Dans cet aperçu, nous souhaitons, après une introduction au sujet, présenter une définition-précision de la carence en fer dans l’ insuffisance cardiaque (IC) et la question «mieux vaut ne pas substituer le fer sous un inhibiteur du SGLT2?» à l’ aide de la littérature récente. Ce sujet est important lors de la prise en charge des patients atteints d’ IC en consultation de médecine générale et de cardiologie.
In this review, after an introduction to the topic, we would like to provide a definition-precision of iron deficiency in heart failure (HF) and the question “is it better not to substitute iron deficiency with an SGLT2 inhibitor?” on the basis of recent literature. This topic is important in the care of HF patients during GP and cardiology consultations.
Key words: Heart failure, iron deficiency, ferritin, transferrin saturation, intravenous iron, SGLT2-Inhibitor and iron
Introduction
La carence en fer est la maladie carentielle la plus fréquente chez l’ homme et la cause la plus fréquente d’ anémie dans le monde. Selon la définition, 20 à 68 % des patients souffrant d’ insuffisance cardiaque chronique (ICC) présentent une carence en fer, souvent sans anémie associée. Le fer est essentiel pour la fonction de: l’ hémoglobine, la myoglobine, les mitochondries, le système immunitaire, les enzymes et les hormones. Une carence en fer aggrave les symptômes de l’ IC, augmente le taux d’ hospitalisation pour IC, détériore la fonction rénale et entraîne une mortalité plus élevée, avec ou sans anémie concomitante. Cette dernière apparaît avec un retard de 6–8 semaines dans 30–50 % des cas.
En plus d’ un hémogramme différentiel à la machine avec Hb, Hct, y compris les indices Ec (MCV, MCH, MCHC), les réticulocytes (RDW = largeur de distribution Ec ), la ferritine sérique et la saturation de la transferrine (TSAT), une CRP et éventuellement un récepteur de la transferrine (sTfR) font partie de l’ examen d’ une éventuelle anémie ferriprive.
Cette anémie hyporégénérative est d’ abord normochrome, normocytaire, puis hypochrome, microcytaire en cas d’ érythropoïèse déficiente. Les réticulocytes sont bas, le MCV et le MCH sont réduits. En outre, on trouve comme expression d’ une érythropoïèse inefficace une anisocytose (RDW↑), une poïkilocytose et des anulocytes, éventuellement pas de fer dans la moelle osseuse. La ferritine sérique est abaissée en cas d’ anémie ferriprive – cf. carence en fer fonctionnelle et absolue.
Pour le diagnostic différentiel d’ une anémie hyporégénérative, d’ autres paramètres de laboratoire sont nécessaires comme: Créatinine, e-GFR, valeurs hépatiques, vit. B12 avec holo-transcobalamine et acide folique (↑MCV, ↑MCH). Si les vitamines sont normales ou élevées, un bilan hématologique s’ impose (syndrome myélodysplasique, atteinte hépatique sévère). Si les indices Ec, la ferritine, la vit. B12 et l’ acide folique sont normaux, le Diagnostic différentiel est important: anémie rénale en cas d’ IRC, anémie en cas de maladie chronique (ACD). (ACD), maladies de la moelle osseuse, leucémie, myélome multiple, lymphome, anémie tumorale, troubles endocriniens, maladies du foie.
Le tab. 1 présente les différents paramètres de laboratoire qui doivent être examinés en premier lieu en cas de troubles du métabolisme du fer. Pour cela, la prise de sang doit être effectuée le matin à jeun, car l’ absorption de nourriture peut augmenter à court terme la saturation de la transferrine (TSAT). Il ne faut pas non plus déterminer ces paramètres pendant une maladie aiguë, car la TSAT pourrait être faussement basse.
Les femmes enceintes, les sportifs de haut niveau et les personnes âgées présentent souvent une carence en fer. Sur le plan anamnestique, les éventuelles hémorragies jouent le rôle le plus important. D’ autres possibilités sont l’ alimentation, certains médicaments, l’ alcoolisme, les infections et différentes maladies chroniques. Cliniquement, une carence en fer entraîne des symptômes multiples tels que fatigue, lassitude, dyspnée, sensibilité aux infections, vertiges, maux de tête, troubles du sommeil, dépression. Une carence en fer a un pronostic défavorable, ceci indépendamment d’ une anémie, et entraîne une mauvaise qualité de vie.
En cas d’ anémie hyperrégénérative avec des réticulocytes élevés (RDW↑), il faut en premier lieu exclure une hémolyse (LDH, bilirubine, indirecte, haptoglobine, CRP) et une anémie hémorragique aiguë. On les retrouve également dans une phase de récupération thérapeutique. L’ anamnèse est ici aussi particulièrement importante.
On distingue une carence en fer fonctionnelle d’ une carence en fer absolue:
Carence fonctionnelle en fer: on la trouve chez les patients souffrant d’ infections, d’ inflammations chroniques, d’ IRC, de maladies du foie, de tumeurs avancées, d’ excès d’ alcool – Anémie en cas de maladies chroniques (ACD). Celle-ci est hypochrome chez une partie des patients, souvent normochrome, normocytaire sans anisocytose (MCV+MCH normal, RDW normal). La cause est multifactorielle et entraîne une diminution de la production d’ érythrocytes, c’ est-à-dire que le nombre de réticulocytes est faible. Les cytokines (interleukine 1, TNF-α, γ-interféron) sont libérées en plus grande quantité dans le cadre de maladies chroniques et entraînent une sensibilité réduite des cellules précurseurs de l’ érythropoïèse à l’ érythropoïétine. Étant donné qu’ il existe une inflammation systémique en cas d’ insuffisance cardiaque (IC), l’ hépcidine est produite en plus grande quantité dans le foie, principalement par l’ interleukine-6. Cela provoque un trouble de l’ absorption du fer dans le duodénum et le jéjunum supérieur par un blocage de la libération des entérocytes et des macrophages réticulo-endothéliaux – «bloc d’ hepcidine» – par exemple du foie et de la rate. Si l’ inflammation peut être atténuée, l’ hepcidine et la ferritine sont à nouveau réduites dans le sérum. Cela entraîne une augmentation du Fe2+ cytosolique bioréactif et une amélioration de la carence fonctionnelle en fer. Il n’ y a pas de résistance à l’ érythropoïétine et une substitution en fer n’ est pas nécessaire. Ce trouble de la répartition du fer provoque une carence en fer au niveau de la cellule précurseur érythropoïétique, malgré un dépôt de fer suffisant.
Ferritine sérique: elle correspond à l’ état de remplissage des réserves de fer de l’ organisme et constitue un bon paramètre en cas d’ anémie ferriprive. La ferritine est une protéine de la phase aiguë et peut être détectée en cas d’ infection ou de maladie aiguë ou chronique. (hsCRP↑), l’ IRC, l’ IC, les maladies du foie, les excès d’ alcool, le cancer, bien que les réserves en fer soient réduites ou vides. En cas de carence en fer avérée: ferritine sérique < 12 µg/l; en cas de surcharge en fer: ferritine sérique > 220 µg/l. Si la CRP est normale alors que le MCV est diminué et la ferritine normale ou élevée, si le RDW est normal, on peut suspecter une thalassémie. En cas de CRP élevée et de sTfR normal, il s’ agit d’ une ACD, si le sTfr est élevé, il y a une carence en fer supplémentaire – voir tab. 1.
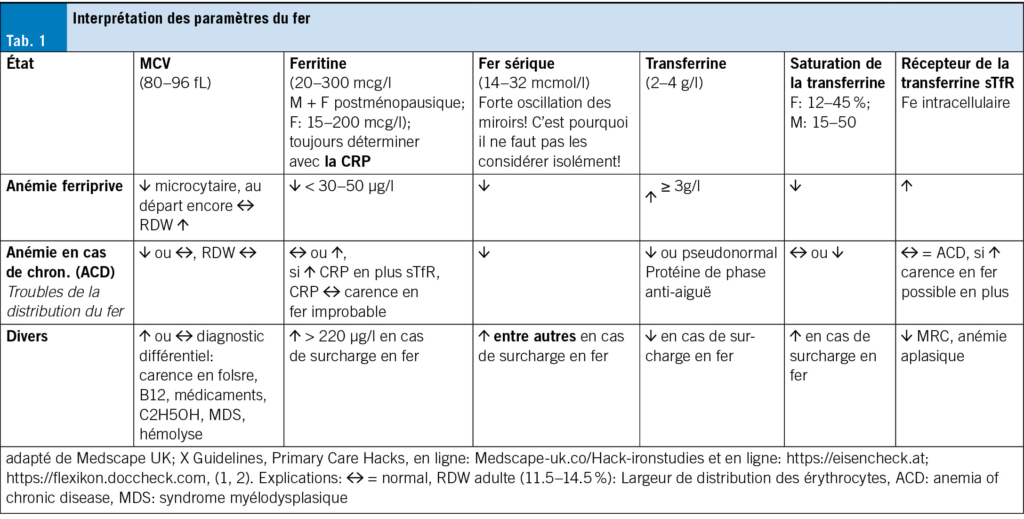
Fer sérique: Le fer sérique est la quantité de fer circulant liée à la transferrine. Le taux de fer sérique est très variable et est influencé par l’ alimentation, les inflammations, les infections et les maladies malignes. Un faible taux de fer sérique isolé n’ est pas très significatif pour le diagnostic d’ une carence en fer. Mesurer le fer sérique seul n’ a que peu d’ intérêt, car ce taux est soumis à des variations horaires et à un rythme circadien. Les valeurs matinales sont, en période de pointe, plus de deux fois supérieures aux valeurs mesurées douze heures plus tard, de sorte qu’ elles ne peuvent pas être utilisées pour représenter la teneur en fer de l’ organisme.
Transferrine: c’ est la principale protéine de transport du fer dans le sérum, qui contrôle le taux de fer libre. Elle transporte par exemple le fer de la cellule intestinale via le sang vers la moelle osseuse pour l’ érythropoïèse. Elle augmente en cas d’ anémie ferriprive afin de maximiser l’ utilisation du fer disponible et de réduire la surcharge en fer. C’ est une protéine de phase anti-aiguë et elle peut être abaissée ou pseudonormale en cas d’ inflammation malgré une carence en fer.
Saturation de la transferrine (TSAT): c’ est la proportion des sites de fixation du fer de la transferrine qui sont occupés par du fer. Le taux de TSAT est le plus significatif lorsque le sang est prélevé le matin à jeun pour l’ analyse en laboratoire. Un TSAT trop bas signifie que le corps ne dispose pas de suffisamment de fer. Cela peut être le cas en cas de taux d’ inflammation élevés, même si les réserves de fer sont bien remplies. La TSAT est une bonne valeur de laboratoire pour déterminer s’ il y a une carence en fer. Un taux élevé de TSAT (> 50 %) est un test sensible et spécifique pour une surcharge en fer (p. ex. hémochromatose, transfusions, administration de fer, hémolyse, etc.); tandis que des valeurs faibles sont très sensibles mais peu spécifiques pour une carence en fer. La grossesse, les contraceptifs oraux combinés et certaines maladies chroniques font baisser le taux de TSAT sans qu’ il y ait de carence en fer. La TSAT est calculée à partir du fer sérique et de la transferrine sérique. C’ est pourquoi un taux de saturation de la transferrine normal (15–45 %) n’ exclut pas toujours une carence en fer.
Récepteur de la transferrine (sTfR): le sTfR soluble est un marqueur moderne du stock de fer intracellulaire. Une augmentation donne l’ indication d’ une carence en fer manifeste ou latente avec une érythropoïèse déficiente en fer. Il s’ agit d’ un marqueur fiable de l’ approvisionnement en fer en cas d’ inflammation chronique, car sa concentration est indépendante des réactions en phase aiguë. En présence d’ une anémie d’ une maladie chronique (ACD) sans carence en fer supplémentaire, le sTfR a une valeur normale. Une diminution du sTfR peut être associée à une érythropoïèse hypoproliférative (par ex. anémie rénale, anémie aplasique). L’ augmentation du sTfR peut être évaluée de manière limitée en cas d’ érythropoïèse hyper-régénérative (réticulocytes) comme une hémolyse, une anémie par hémorragie, une thalassémie hétérozygote ou une polycythémie vraie ou en phase de récupération. Cf. tab. 1.
En cas de suspicion d’ un trouble de la répartition du fer, il est éventuellement nécessaire de procéder à un diagnostic plus approfondi (RDW, Ret-He, Eisenplot selon Thomas, indice de ferritine). En cas d’ inflammation aiguë, un contrôle des paramètres devrait être effectué au cours de quelques semaines, car les valeurs se normalisent généralement après la disparition des symptômes aigus.
Une carence en fer fonctionnelle réagit à une substitution de fer (Fe3+) par voie intraveineuse, mais pas à une substitution orale.
Carence absolue en fer: onla trouve notamment en cas d’ hémorragie digestive occulte sous antiplaquettaires ou anticoagulants; de prise prolongée d’ un inhibiteur de protons/antiacides – l’ absorption du fer est perturbée par l’ augmentation du pH; de consommation chronique élevée de thé noir ou de café – les polyphénols inhibent l’ absorption dans le duodénum; d’ antagonistes du calcium – bloquent les canaux de transport dans les membranes des entérocytes; de carence en fer dans l’ alimentation (pas de viande, beaucoup de soja, etc.); de carence en fer dans les aliments. ) et les néoplasies gastro-intestinales avec suintement (1, 2). L’ hepcidine est régulée à la baisse et le récepteur de la transferrine 1 (protéine de transport transmembranaire de la transferrine) est régulé à la hausse afin de faciliter l’ absorption du fer dans une cellule; parallèlement, la ferritine est dégradée, ce qui libère le fer séquestré des réserves intracellulaires. Une hépcidine et une ferritine basses et des niveaux élevés de transferrine et de récepteur de transferrine 1 (TfR1) avec une faible saturation de transferrine (TSAT) dans le sang circulant sont considérés comme des paramètres fiables pour une carence en fer – voir tab. 1.
En cas de carence absolue en fer, une amélioration peut être obtenue par une substitution orale de Fe2+ ou par une substitution intraveineuse de Fe3+, cette dernière étant nettement plus rapidement efficace. Le taux d’ absorption des sels Fe2+ oraux n’ est que de 10 %. Par voie orale, il est recommandé de prendre ≥ 60 mg/die une fois par jour et tous les 2 jours à jeun, ceci en raison d’ une augmentation/diminution à court terme de l’ hepcidine. La prise simultanée de vitamine C (jus d’ orange) favorise la résorption, celle d’ un comprimé de calcium la retarde. Il ne faut pas non plus prendre en même temps du café, du thé, du lait, des anti-acides, des oxalates et des phosphates. Après 14 jours, l’ effet peut être contrôlé par l’ augmentation des réticulocytes et de l’ hémoglobine. Objectif ferritine > 100µg/l.
Guidelines actuels, études
Selon les directives actuelles de l’ ESC IC 2021/2023, il y a carence en fer en cas d’ IC si la ferritine est < 100 ug/l ou si la ferritine est comprise entre 100 et 299 ug/l et si la saturation de la transferrine est < 20 %. En cas d’ infection avec une CRP élevée, la ferritine est augmentée en tant que protéine de phase aiguë, comme expliqué, et les conclusions concernant la ferritine sont donc limitées. Selon les lignes directrices, les patients atteints d’ IC devraient faire l’ objet d’ un contrôle régulier (tous les 2–3 mois) pour détecter une éventuelle carence en fer et une anémie (IC). En cas d’ IC, ce dépistage devrait également être effectué avant toute intervention non cardiaque – voir tab. 1.
Le diagnostic et le traitement d’ une carence en fer en cas d’ IC sont malheureusement encore rares dans la vie quotidienne. Selon une étude rétrospective réalisée en 2019, sur 10 381 hospitalisations pour IC (HFrEF, HFpEF), seuls 158 patients ont fait l’ objet d’ une évaluation de leur carence en fer: parmi eux, 109x carence en fer selon les directives et finalement 23 patients ont été traités par voie intraveineuse (3). Dans le registre IC suédois, en 2021, sur 21 496 patients, cet examen n’ a été réalisé que chez ¼ des patients, parmi lesquels environ 50 % présentaient une carence en fer; seul 1 sur 5 a reçu une substitution (4).
Depuis 2009, cinq études différentes au total et deux méta-analyses ont été publiées sur le traitement par fer en cas d’ IC. Les études en double aveugle contrôlées par placebo publiées ces dernières années: CONFIRM-HF (5), AFFIRM-AHF (6) et deux méta-analyses en 2018 et 2023 (7, 8) ont révélé que le traitement par voie iv. Le traitement par carboxymaltose ferrique a permis d’ améliorer les résultats chez les patients IC (HFrEF, HFmrEF) souffrant de carence en fer. Dans la grande étude AFFIRM-AHF (RCT) menée après un épisode aigu d’ IC, un tel traitement a permis de réduire le taux d’ hospitalisation pour IC et le décès par cv de 21 % sur 52 semaines, NNT de 7. Si l’ on considère les critères d’ évaluation séparément, il est évident que l’ administration de fer a eu un effet uniquement sur le taux d’ hospitalisation lié à l’ IC, le risque d’ hospitalisation étant significativement plus faible de 26 % sous traitement (RR: 0,74; p=0,013). L’ administration de fer n’ a eu aucune influence sur la mortalité cardiovasculaire par rapport au placebo (6).
La thérapie iv. Selon les 2023 Focused Update ESC IC-Guidelines, le traitement par fer a désormais une indication IA en cas d’ IC symptomatique (FEVG ≤ 50 %) avec carence en fer pour améliorer les symptômes et augmenter la qualité de vie. Un traitement iv.-fer-carboxymaltose (FCM)/fer-derisomaltose (FDI) chez les patients symptomatiques avec une FEVG ≤ 50 % et une carence en fer devrait être envisagé pour réduire l’ hospitalisation pour IC (IIa A) (9). Les données de l’ étude AFFIRM-AHF 2020 ont été déterminantes pour cette nouveauté (6).
Cave: flush en cas de traitement iv. trop rapide. administration de fer, réaction d’ hypersensibilité aiguë de type immédiat (réaction ana-phylactique), prise en charge et suivi (au moins 30 min) du patient; évaluation du rapport risque/bénéfice.
Une substitution orale de fer n’ est pas efficace en cas d’ IC avec une FE VG ≤ 50 % en raison des mécanismes mentionnés et de la carence fonctionnelle en fer selon la très petite étude IRON-HF concernant l’ amélioration des performances. L’ apport de fer par voie intraveineuse est supérieur à l’ amélioration de la capacité fonctionnelle (VO2max). Cependant, la correction de l’ anémie semble être similaire entre l’ administration de fer sous forme de comprimés et l’ administration de fer par voie iv. fer est similaire (10). Dans l’ étude IRONOUT-HF – le seul grand essai contrôlé randomisé chez des patients atteints de HFrEF et de carence en fer – le polysaccharide de fer oral n’ a pas amélioré les performances physiques et, dans cette publication, la majorité des patients n’ a pas atteint la déplétion en fer pendant 16 semaines (11). En cas de carence fonctionnelle en fer, le fer absorbé par voie orale est absorbé très lentement, car il est intercepté par le «bloc d’ hepcidine» avant d’ atteindre les organes cibles.
Autres études actuelles avec utilisation d’ inhibiteurs du SGLT2
Dans une publication de M. Packer dans Circulation mai 2024, la définition actuelle d’ une carence en fer dans les guidelines est maintenant remise en question par des experts internationaux avec la participation de la Charité à Berlin. Les auteurs demandent «d’ abandonner la définition actuelle de la carence en fer chez les patients IC, basée sur la concentration de ferritine, et de la remplacer par une définition basée sur l’ hypofermie (TSAT < 20 %)». La raison en est la carence fonctionnelle en fer mentionnée, due à l’ inflammation systémique et à l’ augmentation de la pression veineuse centrale en cas d’ IC, qui augmentent l’ hepcidine dans le foie et inhibent ainsi la libération de fer. Comme mentionné, la ferritine est synthétisée et libérée en plus grande quantité lors d’ une inflammation; la synthèse des récepteurs de transferrine est inhibée. Ainsi, selon les auteurs, on observe souvent des valeurs de ferritine qui se situent alors dans la norme, entre 20–100–300 ug/l. Ainsi, sans la prise en compte de la TSAT selon la définition actuelle des ESC-IC-Guidelines, aucun traitement à base de fer ne serait alors prescrit à tort. «Les patients hypoferrémiques avec un TSAT < 20 % présentent généralement aussi une carence en fer lors d’ un examen de la moelle osseuse; après une thérapie intraveineuse à base de fer, leur capacité fonctionnelle s’ améliore et le risque d’ événement cv diminue considérablement» (12). Avec un TSAT > 20 % et une ferritine sérique de 20–100 mg/l, le pronostic est bon sans traitement ferrique. Un tel traitement serait alors défavorable – effet pro-inflammatoire, promotion de la croissance Tu.
Dans un autre travail de M. Packer publié dans le JACC de janvier 2023, l’ interaction de l’ administration iv. entre l’ administration de fer (Fe3+) et l’ administration simultanée d’ un inhibiteur du SGLT2 est remise en question de manière critique (13). Deux hypothèses sont discutées dans l’ article: «l’ hypothèse de la carence en fer cytosolique» et «l’ hypothèse de la recharge en fer cytosolique». Dans cette dernière, les SGLT2-I. provoquent, par la voie de signalisation de la sirtuine 1 et par une réduction de l’ inflammation, une baisse de la ferritine, de l’ hepcidine dans les hépatocytes et les macrophages et une augmentation de l’ érythropoïétine et des récepteurs de la transferrine, indépendamment de l’ érythropoïèse. L’ auteur part du principe que les modifications des biomarqueurs du fer sous SGLT2-I. n’ indiquent pas une carence en fer intracellulaire. Selon son raisonnement, le fer 2+ est élevé dans le cytosol, associé à une utilisation accrue, à une érythropoïèse préservée et à une cardioprotection préservée.
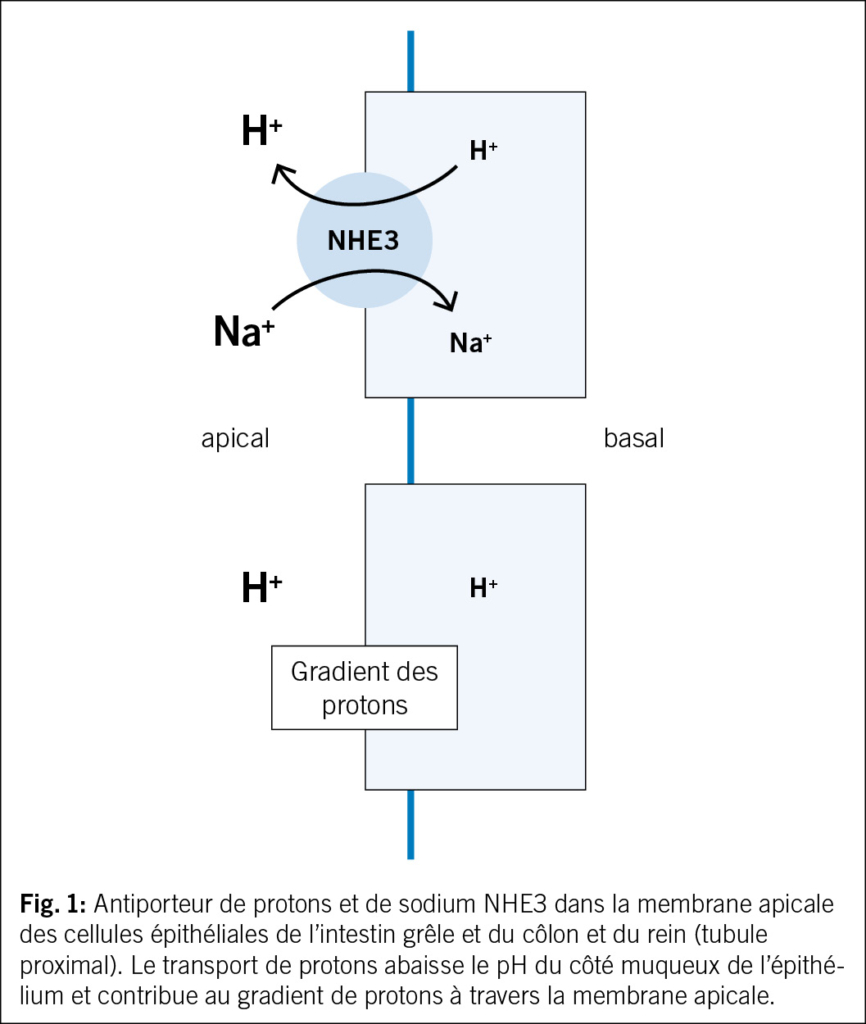
En cas d’ IC, le système sympathique rénal, l’ angiotensine II, la néprilysine et les récepteurs α sont également activés. Cela conduit à l’ expression de NHE3 – NHE3 est un antiporteur 3 Na+/H+, il s’ agit d’ une protéine de transport membranaire présente dans l’ intestin et dans le tubule proximal du rein et qui régule le pH dans les cellules par le transport de protons – cf. fig. 1.
Le SGLT2 est une autre expression de l’ IC. Celle-ci entraîne une rétention de sodium et d’ eau avec une augmentation du volume de l’ interstitium et du plasma. Ceci aggrave à son tour l’ IC. Selon M. Packer, les SGLT2-I. bloquent le système sympathique rénal et l’ expression de NHE3 et de SGLT2 (14).
Les inhibiteurs de SGLT2 réduisent l’ inflammation et la fibrose, diminuent le stress oxydatif; ils sont organoprotecteurs ! Outre l’ érythropoïétine, ils augmentent l’ érythrocytose (Hkt) avec une augmentation de la libération d’ O2, la gluconéogenèse et l’ oxydation des acides gras. Ces mécanismes entraînent une augmentation de la production d’ ATP dans les mitochondries des cardiocytes et des cellules rénales via l’ augmentation de l’ oxygène et la synthèse de corps cétoniques. Diurèse osmotique connue (potentialisation des diurétiques de l’ anse) avec diminution du volume plasmatique et effet cardioprotecteur direct mentionné avec amélioration de la dyspnée; diminution de l’ acide urique (14) – cf. Fig. 2.
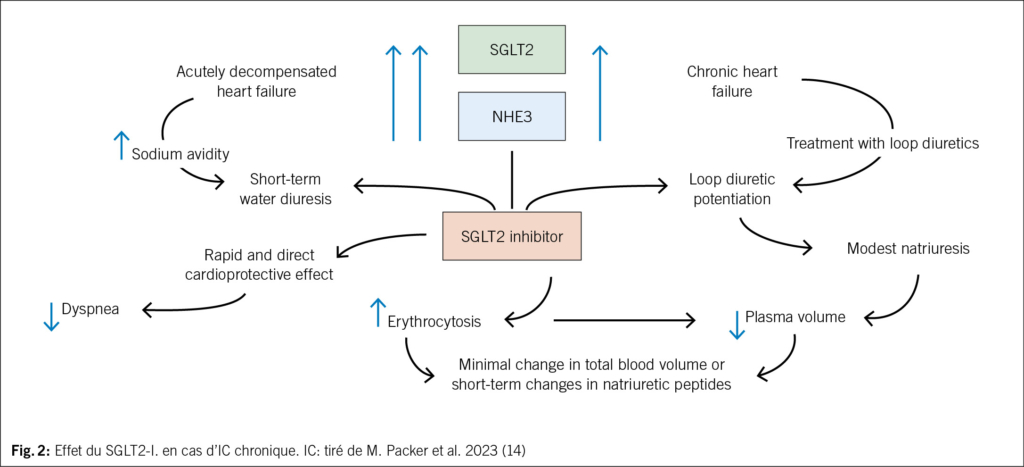
D’ après les données cliniques de la DAPA-HF, cette «hypothèse de remplissage cytosolique en fer» est favorisée. «Le traitement par fer intraveineux pourrait donc être inutile et théoriquement nocif (inflammation/ferroptose) chez les patients IC qui semblent être déficients en fer sous SGLT2-I.». Selon l’ auteur, des études supplémentaires sur cette thérapie combinée sont donc nécessaires avant qu’ elle ne soit largement recommandée (14, 15). Ainsi, dans l’ étude IRONMAN, seuls 3 % des patients présentaient un SGLT2-I; dans la grande étude HEART-FID, dont le critère d’ évaluation primaire était négatif, 7.7 % des patients présentaient un SGLT2-I. Jusqu’ à présent, les données n’ indiquent pas qu’ une carence en fer sous-jacente compromette les bénéfices importants de cette classe de médicaments.
La carence en fer était fréquente chez les DAPA-HF dans une analyse post-hoc (43.7 %) et était associée à de moins bons résultats. La dapagliflozine semblait augmenter la consommation de fer, mais améliorait les résultats, indépendamment du statut du fer au début de l’ étude. La TSAT, la ferritine et l’ hepcidine ont été réduites et la capacité totale de fixation du fer et le récepteur soluble de la transferrine ont été augmentés avec la dapagliflozine par rapport au placebo. L’ effet de la dapagliflozine sur le critère d’ évaluation principal était cohérent chez les patients présentant une carence en fer par rapport aux patients ayant suffisamment de fer (hazard ratio, 0.74). Des résultats similaires ont été observés pour les décès cardiovasculaires, les hospitalisations pour IC et la mortalité totale (15). «La constatation d’ un bénéfice cohérent de la dapagliflozine signifie qu’ une carence en fer absolue préexistante ne devrait pas être considérée comme un obstacle à l’ initiation du traitement par la dapagliflozine ou que le développement d’ une carence en fer absolue pendant le traitement ne devrait pas être considéré comme une raison d’ arrêter le traitement. Ces observations d’ études augmentent le potentiel d’ une synergie thérapeutique entre la recharge en fer et l’ inhibition du SGLT2 chez les patients atteints d’ HFrEF, non seulement pour éviter la carence en fer, mais peut-être aussi pour traiter l’ anémie» (12).
Chez un large éventail de 1137 patients âgés (médiane 73 ans) atteints d’ IC dans l’ étude IRONMAN (16) avec une FEVG ≤ 45 %, une carence en fer (TSAT < 20 %, ferritine sérique < 100ug/l) et une Hb inférieure à la norme de 13g/dl chez les femmes ou de 14g/dl chez les hommes, l’ administration iv. répétée de fer3+–dérisomaltose (FDI) a été associée à une réduction du risque d’ hospitalisation pour IC et à une amélioration des performances pendant 2.7 ans, sans réduction significative du taux de décès cv ou du taux de décès total. Le rapport de risque de décès cardiovasculaire (0.86; IC 95 %, 0.67 à 1.1) était similaire à celui de l’ étude HEART-FID, la plus grande étude sur l’ IDR par voie iv. à ce jour, qui s’ est révélée négative. Chez 3065 patients ambulatoires souffrant d’ IC avec une fraction d’ éjection réduite de ≤ 40 % et une carence en fer (selon les directives) et une hospitalisation pour IC au cours des 12 derniers mois ou un NT-pro-BNP élevé, ce dernier n’ a pas montré de différence apparente entre le fer-carboxymaltose et le placebo en ce qui concerne le critère d’ évaluation primaire: décès, hospitalisation pour IC ou modification du test de marche de 6 minutes. Le TSAT moyen était de 23,9 % (17).
Une méta-analyse récente de: HEART-FID, CONFIRM et AFFIRM-AHF a certes révélé une réduction du risque de 14 % (HR 0,86) en ce qui concerne le décès et l’ hospitalisation cv, mais cela a été entraîné par les hospitalisations, sans effet apparent sur la mortalité. Dans une sous-analyse, un TSAT < 15 % a montré un bénéfice clairement prévisible d’ une substitution en fer par FCM. La réduction du risque de décès ou d’ hospitalisation par cv était ici de 28 %. Effets potentiellement défavorables chez les patients dont le TSAT était ≥ 24 % (18).
Dans une revue intéressante, datant de 2023, sur le traitement de la carence en fer en cas d’ IC avec FE réduite, il est également mentionné que les données d’ études actuelles (FAIR-HF-HpEF, PREVER-HF) pour un traitement de substitution en fer en cas d’ HFpEF font encore défaut (19).
Copyright Aerzteverlag medinfo AG
Zelglistrasse 17
8127 Forch
L’ auteur n’a pas déclaré de conflit d’intérêts en rapport avec cet article
1. Gattermann N. et al., Abklärung von Eisenmangel und Eisenüberladung, Dtsch Ärztebl Int 2021;118:847-56
2. Onkopedia.com: Leitlinien, Hämatologische Erkrankungen: Eisenmangel- und Eisenmangelanämie
3. Mistry R. et al., Iron deficiency in heart failure, an underdiagnosed and undertreated condition during hospitalization, Annals of Hematology 2019;98 (10):2293–2297
4. Becher P.M. et al, Phenotyping heart failure patients for iron deficiency and use of intravenous iron therapy: data from the Swedish Heart Failure Registry, Eur J Heart Fail, 2021 Nov;23(11):1844–1854. doi: 10.1002/ejhf.2338. Epub 2021 Sep 14.
5. Ponikowski P. etal, Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency, CONFIRM, Eur Heart J, Volume 36, Issue 11, 14 March 2015, Pages 657–668
6. Ponikowski P et al. Ferric carboxymaltose for iron deficiency at discharge after acute heart failure: a multicentre, double-blind, randomised, controlled trial, AFFIRM-AHF, The Lancet 2020, DOI: https://doi.org/10.1016/S0140-6736(20)32339-4
7. Anker SD. Et al, Effects of ferric carboxymaltose on hospitalisations and mortality rates in iron-deficient heart failure patients: an individual patient data meta-analysis, Eur J Heart Fail 2018 Jan;20(1):125–133
8. Ponikowski P. et al, Efficacy of ferric carboxymaltose in heart failure with iron deficiency: an individual patient data meta-analysis, European Heart Journal, Volume 44, Issue 48, 21 December 2023, Pages 5077–5091
9. McDonagh T. A. et al.,2023 Focused Update of the 2021 ESC-Guidelines for the diagnosis and treatment of acute and chronic heart failure, ESC Clinical Practice Guidelines, European Heart Journal, Volume 44, Issue 37, 1 October 2023, Pages 3627–3639
10. Beck-da-Silva L. et al., IRON-HF study: a randomized trial to assess the effects of iron in heart failure patients with anemia, Int J Cardiol 2013 Oct 9;168 (4):3439–42
11. Lewis GD. et al, Effect of Oral Iron Repletion on Exercise Capacity in Patients With Heart Failure With Reduced Ejection Fraction and Iron Deficiency: The IRONOUT HF Randomized Clinical Trial, JAMA 2017 May 16;317(19):1958–1966.
12. Packer M. et al., Redefining Iron Deficiency in Patients with Chronic Heart Failure, Circulation 2024; https://doi.org/10.1161/CIRCULATIONAHA.124.068883
13. Packer M., Potential Interactions When Prescribing SGLT2 Inhibitors and Intravenous Iron in Combination in Heart Failure, JACC HF 2023 Vol.11, No.1: 106–114
14. Packer M. et al., Critical Reanalysis of the Mechanisms Underlying the Cardiorenal Benefits of SGLT2 Inhibitors and Reaffirmation of the Nutrient Deprivation Signaling/Autophagy Hypothesis, Circulation 2022;146:1383–1405
15. Docherty K.F. et al., Iron Deficiency in heart failure and effect of dapagliflozin: findings from DAPA-HF. Circulation 2022; 146: 980–994
16. Kalra PR et al., Intravenous ferric derisomaltose in patients with heart failure and iron deficiency in the UK (IRONMAN): an investigator-initiated, prospective, randomised, open-label, blinded-endpoint trial. Lancet 2022; 400:2199–2209
17. Mentz RJ. et al., Ferric Carboxymaltose in Heart Failure with Iron Deficiency, HEART-FID, N Engl J Med 2023;389:975–986
18. Ponikowski P. et al., Efficacy of ferric carboxymaltose in heart failure with iron deficiency: an individual patient data meta-analysis, Eur Heart J. 2023 Dec 21; 44(48): 5077–5091
19. Shamsi A.et al., Treatment of Iron Deficiency in Heart Failure, Current Cardiology Reports 2023; 25:649–661