Einleitung
Die Integrative Onkologie gewinnt immer mehr an Bedeutung; die Nachfrage seitens der Patient/-innen, die Anzahl Fachpersonen in der Schweiz mit Weiterbildung in einer integrativ-onkologischen Kerndisziplin (siehe Artikel Gemeinsamkeiten und Kerndisziplinen der Integrativen Onkologie) und Forschungserkenntnisse nehmen zu (1–5). Beispiele für wachsende belastbare Evidenz (siehe Artikel Forschung) sind die deutschsprachige S3-Leitlinie Komplementärmedizin in der Behandlung onkologischer Patient/-innen (2) und die Leitlinien der Society Integrative Oncology (SIO) zusammen mit der American Society for Clinical Oncology (ASCO) zum Symptommanagement mit Integrativen Interventionen (3–5). Zudem werden komplementäre Interventionen, wie bspw. Akupunktur oder Phytotherapie, zunehmend in allgemeinen onkologischen Supportive Care Guidelines integriert wie diejenigen vom Leitlinienprogramm Onkologie (S3-Guidelines Supportive Care: z. B. bei Tumortherapie-induzierter Nausea und Emesis, Supportive Massnahmen in der Radioonkologie) (6) des US-amerikanischen National Comprehensive Cancer Network (NCCN: Guidelines Supportive Care; https://www.nccn.org/guidelines/category_3; in den Kapiteln Adult Cancer Pain, Cancer-Related Fatigue, Distress Management, Palliative Care und Survivorship,) oder der Multinational Association of Supportive Care in Cancer (7).
Patient/-innen erhoffen sich vor allem den Einbezug ganzheitlicher physischer, emotionaler, sozialer und spiritueller Bedürfnisse (8, 9), und selbst aktiv zu sein im Leben mit Krebs i. S. von Selbstmanagement (10, 11), welche durch das onkologische Therapiekonzept oft nicht ausreichend adressiert werden (1). Es können auch Aspekte der Schulbildung und der sozialen Situation eine Rolle spielen (12).
Als Reaktion auf den steigenden Bedarf offerieren immer mehr zertifizierte Tumorzentren ein integrativ-onkologisches Angebot. Das Angebot variiert, bedingt durch geografische und historisch geprägte Gegebenheiten und die Verfügbarkeit von Fachkräften, stark. Grundsätzlich gibt es in der Schweiz zwei Personengruppen, welche Angebote zu komplementären Verfahren durchführen: medizinisches Fachpersonal (Ärzt/-innen und Gesundheitsfachpersonen) und Therapeut/-innen. Um die sichere Integration komplementärmedizinischer Verfahren in die Tumortherapie zu unterstützen, benötigt es Fort- und Weiterbildung (1, 13). Die Fort- und Weiterbildungslandschaft bezüglich komplementärer Behandlungsansätze ist vielfältig und unterscheidet sich nicht nur im Umfang und in der Tiefe, sondern auch in der Qualität. Zudem sind die Angebote zumeist spezifisch auf einzelne Verfahren, z. B. Phytotherapie oder Akupunktur, ausgerichtet. Immer mehr Ärzt/-innen, Pflegefachpersonen oder auch Therapeut/-innen erkundigen sich daher nach Angeboten, die verschiedene Ansätze verbinden oder eine Basis für weitere Vertiefung bieten (14).
In diesem Artikel erhalten Sie eine Übersicht über eine sichere Praxiseinbindung komplementärer Methoden, Basiskompetenzen für integrativ-onkologische Fachpersonen, aktuell verfügbare Angebote und erste Ideen für künftige Angebote.
Die Lehre in der Integrativen Onkologie (IO): Eine Notwendigkeit für die optimale kompetente Betreuung von Patient/-innen
Die onkologischen Kenntnisse und Erfahrungen von Therapeut/-innen sind sehr unterschiedlich. Einige behandeln regelmässig onkologische Patient/-innen, andere haben keine Routine in der Begleitung krebsbetroffener Menschen oder lehnen diese ab. Die Einschätzung hinsichtlich der onkologisch-fachlichen Kompetenz der Therapeut/
-innen ist sowohl für die Patient/-innen als auch medizinisches Fachpersonal ohne integrativ-medizinisches Wissen schwer möglich. Zudem liegt es häufig an den Patient/
-innen selbst, die Verbindung zwischen konventionell und komplementärmedizinisch tätigen Behandler/-innen herzustellen – obwohl eine patientenzentrierte, interprofessionelle Zusammenarbeit das Ideal wäre (15).
Während ihres gesamten Krankheitsverlaufs werden Patient/-innen mit zahlreichen Ratschlägen und Informationen unterschiedlicher Qualität konfrontiert – von Angehörigen und Bekannten (16), Therapeut/-innen (17), aber auch über das Internet und soziale Netzwerke (18). Insbesondere in Phasen emotionaler Belastung (Disstress) ist es für krebsbetroffene Menschen nicht einfach, zwischen all diesen Informationen zu unterscheiden und herauszufinden, was in ihrer individuellen Situation «richtig» und fachlich korrekt ist (19).
Mitunter wird die Anwendung komplementärer Therapien als «natürlich» verharmlost. Dies gilt sowohl für Patient/-innen als auch für medizinisches Fachpersonal. Doch kann der unreflektierte Einsatz eines Phytotherapeutikums, die unsachgemässe Anwendung einer manuellen Therapie oder eine restriktive Diät bei Krebspatient/-innen schwerwiegende Folgen haben (20). Potenzielle Risiken können so unterschätzt werden.
Oder aber medizinisches Fachpersonal rät aus Vorsicht oder mangels Wissens gänzlich vom Einsatz komplementärer Therapien ab (21). Dies kann dazu führen, dass Patient/-innen komplementäre Verfahren ohne Rücksprache mit dem medizinischen Fachpersonal nutzen – oder im Gegenteil schweren Herzens darauf verzichten. In beiden Fällen ist der geschlossene Dialog eine verpasste Chance, einem vermutlich unerfüllten Bedürfnis (unmet need) der Patient/-innen gerecht zu werden (22).
Die Risikobewertung einer Komplementärtherapie fällt zwischen Patient/-innen, konventionell-medizinischem Fachpersonal (z. B. Onkolog/-innen, Onkologiepflegefachpersonen oder Hausärzt/-innen) und Therapeut/-innen sehr unterschiedlich aus (21). Um die potenziellen Risiken zu bewerten, sind daher folgende Voraussetzungen erforderlich:
a) eine proaktive, gegenseitig wertschätzende, offene Kommunikation über alle diagnostischen und therapeutischen Massnahmen (einschliesslich komplementärmedizinischer Verfahren)
b) Basiskenntnis des konventionell-medizinischen Fachpersonals der wichtigsten integrativ-onkologischen Fachdisziplinen (siehe Artikel Gemeinsamkeiten und Kerndisziplinen der Integrativen Onkologie)
c) Kenntnis und Kontakt zu regionalen Spezialisten für Integrative Onkologie (z. B. via SNIO-Verzeichnis www.integrative-oncology.ch) oder anderen Fachleuten, je nach dem im Zusammenhang mit dem identifizierten Risiko aufgetretenen Problem (z. B. Akupunktur bei Gerinnungsstörungen, Immunschwäche oder Infektionen [23]; Wechselwirkungen und mögliche Nebenwirkungen bei der gleichzeitigen Anwendung von phytotherapeutischen Behandlungen und onkologischen Therapien [24]; Mind-Body-Interventionen für psychisch instabile Patient/-innen oder bei Patient/-innen mit PTBS [20, 25]; Körpertherapien wie rhythmische Massage, Osteopathie und Chiropraktik bei Skelettrisiken aufgrund lokaler Metastasen oder Osteoporose [20, 25]). Die wichtigsten Risiken sind bei den Kerndisziplinen (siehe Artikel) zusammengefasst.
Basiswissen bzgl. Integrativer Onkologie ist daher für medizinisches Fachpersonal im Umfeld von Krebspatient/-innen sowie für die Patient/-innen selbst unerlässlich – sei es, um einen offenen Dialog über den Nutzen komplementärer Verfahren zu fördern (13, 26, 27), Risiken des Fehlgebrauchs zu erkennen (21), Patient/-innen an Fachpersonen der Integrativen Onkologie zu verweisen, auf deren Bedürfnisse einzugehen oder auch, um komplementärtherapeutische, in der supportiven Therapie validierte Optionen im Sinne eines integrativen Ansatzes anzubieten.
Im Sinne einer ganzheitlichen Patientenversorgung müssen zudem «indirekte» Risiken der Nutzung komplementärer Verfahren berücksichtigt werden wie
a) eine Verzögerung der konventionellen Behandlung (21);
b) Fehlinformationen über die onkologische Erkrankung, deren Schweregrad und Behandelbarkeit und Behandlungsoptionen bis zu falschen Heilsversprechungen;
c) isolierter Verweis auf die Patientenpräferenz (die sog. 3. Säule der Evidenz, siehe Artikel Forschung) ohne eine gleichzeitige klinisch-therapeutische und evidenzbasierte Mitverantwortung;
d) zusätzliche finanzielle Belastungen für die Patient/-innen (insbesondere bei kostspieligen Therapien oder Präparaten), die sog. finanzielle Toxizität;
e) ein überladener Terminkalender durch parallele «konventionelle» und «komplementäre» Termine (sog. Zeit-Toxizität);
f) sog. aggressive integrative onkologische Behandlung nahe am Lebensende (siehe Artikel Integrative Palliative und End-of-Life Care in der Onkologie);
g) mangelnde Koordination und Kommunikation zwischen den verschiedenen Akteuren für eine optimale interdisziplinäre, patientenzentrierte Versorgung.
Eine gut strukturierte Integrative Onkologie mit enger, lokal vertrauter Zusammenarbeit ermöglicht eine koordinierte und individualisierte Anwendung der Verfahren, minimiert die Risiken komplementärer Medizin und nutzt deren Potenziale zur Optimierung der Lebensqualität und Symptomkontrolle bei Krebspatient/-innen.
Grundlegende Fähigkeiten und Vorschläge für die Aus-, Fort- und Weiterbildungen in IO
Im Rahmen eines zweiphasigen internationalen Projekts der SIO wurden durch systematische Literaturrecherche und ein interprofessionelles Konsensusverfahren 37 Kernkompetenzen für die Integrative Onkologie identifiziert (13). Diese Kompetenzen, die professionsübergreifend für Ärzt/-innen, Pflegefachpersonal, Psycholog/-innen, andere Gesundheitsberufe und Therapeut/-innen gelten, umfassen Wissen (Knowledge, n = 11), Fähigkeiten (Abilities, n = 17) und Fertigkeiten (Skills, n = 9). Kommunikative Kompetenzen spielen dabei eine wichtige Rolle. Die Kernkompetenzen dienen als Grundlage zur Entwicklung von Fortbildungsprogrammen, um eine sichere, evidenzbasierte und patientenzentrierte Versorgung in der Integrativen Onkologie auch im deutschsprachigen Raum zu gewährleisten (28). Auch Bennardi et al. sehen neben formaler Vermittlung von Wissen das Lernen im Praxisfeld zum Erwerb von Fähigkeiten und zur Entwicklung der Haltung als relevant (29). Integrative Onkologie versteht sich grundsätzlich als ein Ansatz, der unter Einbezug eines multiprofessionellen Teams stattfindet (13, 30). Betrachtet man die Forschungserkenntnisse zu erfolgreicher Zusammenarbeit verschiedener Gesundheitsberufe in der Praxis, zeigt sich, dass interprofessionelle Aus-, Fort- und Weiterbildungen ein Kernelement für das Gelingen darstellen (29). Zudem stärkt ein interprofessioneller Ansatz die Versorgungsstrukturen und verbessert die Outcomes der Patient/-innen (31). Für die Entwicklung neuer Fort- und Weiterbildungsangebote scheinen daher ein multiprofessionelles Dozierendenteam und eine Ausrichtung der Inhalte auf ein multiprofessionelles Zielpublikum zentral (32). Die Interprofessional Education Collaborative (IPEC) formuliert 4 interprofessionelle Kernkompetenzen, die vermittelt werden sollten (33):
1) Werte und Ethik
2) Rollen und Verantwortlichkeiten
3) Kommunikation
4) Team und Teamwork
Der Weg von der onkologisch tätigen hin zur erfahrenen integrativ-onkologischen Fachperson folgt einem Lernprozess, den schon Patricia Benner 1984 beschrieben hat (34). Sie zeigt in ihrem Werk «From Novice to Expert» auf, welche Kompetenzentwicklungsschritte Fachpersonen bei einem Rollenwechsel durchlaufen und wie das Lernen in den einzelnen Stufen bestmöglich unterstützt werden kann (35). Daran angelehnt empfiehlt sich zu Beginn ein strukturiertes Lernen, gestützt auf vorhandenes Wissen, wenn immer möglich dargestellt in regulären Krankheitsverläufen unter Zuhilfenahme von Leitlinien. Im weiteren Verlauf prägen eigene Erfahrungen und die Reflexion den Lernprozess, und das Lernen wird vor allem durch Intervision mit Kolleg/-innen und Besprechung komplexer oder spezifischer Fälle gefördert. Benner bezeichnet dies als Lernen an Paradigmafällen (36).
Dieses Wissen kann die künftige Entwicklung von integrativ-onkologischen Edukationsmaterialien unterstützen.
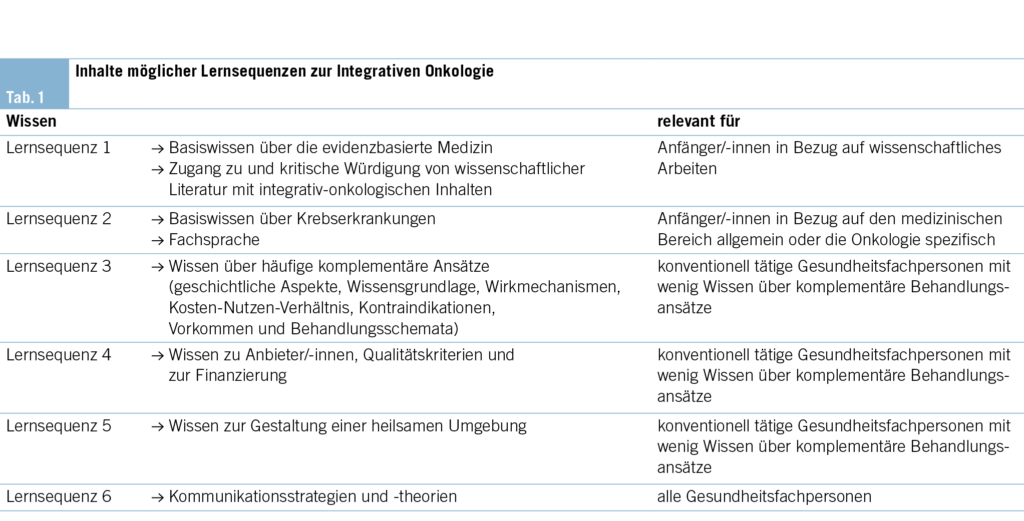
Um rein theoretisches Wissen zu vermitteln, können beispielsweise Podcasts, Webinare oder kurze Schulungssequenzen genutzt werden. Basierend auf den Kernkompetenzen von Witt et al. lassen sich die in Tab. 1 aufgeführten Inhalte ableiten und in Lernmodule einteilen (13).
Um das theoretische Wissen in einem nächsten Schritt effektiv in den Alltag zu integrieren und somit, wie von Benner (35) beschrieben, die Fertigkeiten zu schulen, braucht es zudem gemeinsame Lernsettings (29, 36). In der interprofessionellen Edukation haben sich hier Simulationen oder konkrete Fallarbeit bewährt (36). Teilnehmende verschiedener Professionen lösen hierbei gemeinsam komplexe Behandlungsszenarien und lernen so nicht nur die praktische Anwendung von Inhalten, sondern zudem auch die Zusammenarbeit miteinander besser kennen. Zum Bereich der Fertigkeiten zählt ausserdem das Erlangen praktischer Anwendungskompetenz zu konkreten komplementären Interventionen, wie bspw. Akupunktur oder auch äussere Anwendungen.
Die konkrete Handlungsfähigkeit entsteht in einem weiteren Schritt durch kontinuierliche Reflexion, Intervision oder bspw. Mentoringprogramme (36). Es geht konkret darum, eine offene und empathische Haltung zu entwickeln. Fertigkeiten sind auch, ein Verständnis den verschiedenen komplementären Verfahren gegenüber zu entwickeln und mit fehlender wissenschaftlicher Evidenz in der Kommunikation und Therapie umzugehen (13).
Zusammenfassend lässt sich festhalten, dass ein stufenweises Vorgehen, welches sich an konkreten Kompetenzen orientiert, zielführend für die Entwicklung künftiger Fort- und Weiterbildungsmaterialien zur Integrativen Onkologie ist. Die Angebote sollten interprofessionell für ein multiprofessionelles Zielpublikum entwickelt werden.
Ausbildung und primärqualifizierende Weiterbildung
In der Schweiz sind nur sehr grundlegende integrativ-medizinische Inhalte in der ärztlichen studentischen Ausbildung enthalten (37). Die ärztliche Weiterbildung zum medizinischen Onkologen (SIWF-SGMO) (38) umfasst im Weiterbildungsprogramm vom 1. Juli 2021 keine Inhalte der Integrativen Onkologie, diese fehlen auch im ESMO/ASCO Core Curriculum (39), es werden Ernährung, körperliche Aktivität, Survivorship, Palliative Care und psychosoziale Aspekte erwähnt, aber ohne explizit Themen der Integrativen Onkologie, die in Supportive Care Guidelines erwähnt sind, aufzunehmen.
Auch die Ausbildung zur Pflegefachperson HF sowie der Bachelorstudiengang zur Pflegefachperson FH enthalten nur sehr geringe Anteile an integrativ-medizinischen Inhalten. In der Regel beschränken sich diese auf den Bereich der Palliative Care, der Grundpflege und/oder der Prophylaxe bzw. das allgemeine Symptommanagement und werden je nach Schwerpunkt der Fachhochschulen bzw. der höheren Fachschulen unterschiedlich stark ausgearbeitet.
In den Weiterbildungen zu Fachexpert/-innen Onkologie oder Palliative Care werden insbesondere äussere Anwendungen zum erweiterten Symptommanagement thematisiert.
Weiterbildungsangebote für die Integrative Onkologie in der Schweiz
In der Schweiz existiert bisher keine für Ärzt/-innen SIWF-anerkannte Weiterbildung in Integrativer Onkologie, die Grundlagen der Integrativen Onkologie (z. B. Grundprinzipien, Menschenbild, Diagnostisches Vorgehen) und der einzelnen Kerndisziplinen (Anthroposophisch-erweiterte Medizin, Individualisierte Homöopathie, Medizinische Hypnose, Integrative Pflege, Mind Body Medicine, Phytotherapie, TCM/Akupunktur) beinhaltet. Für einige der ärztlichen Kerndisziplinen können Fähigkeitsausweise (https://www.siwf.ch/weiterbildung/faehigkeitsausweise.cfm) erworben werden (siehe auch SNIO Certification Courses unten).
Eine Übersicht über vom Swiss Network for Integrative Oncology (SNIO) veröffentlichte zertifizierte Weiterbildungen und Kurse finden Sie unter folgendem QR-Code:
https://integrative-oncology.ch/media/education_certification-courses.pdf
Weiterbildungsangebote für die Integrative Onkologie im Ausland
In Deutschland bietet die Arbeitsgemeinschaft Gynäkologische Onkologie bspw. einen Zertifizierungskurs Integrative Medizin in der Onkologie an (40), in den USA gibt es integrativ-onkologische Fellowships (41).
Fortbildungen
Im Bereich Fortbildungen besteht ein langsam wachsendes Angebot, auch mit Inhalten aus verschiedenen Kerndisziplinen der Integrativen Onkologie und Akkreditierung durch verschiedene Fachgesellschaften, wie z. B. wissenschaftliche Session des SNIO am SOHC (Schweizer Hämatologie Onkologie Kongress).
In Zukunft wird das SNIO auch einen Kalender mit den in der Schweiz verfügbaren Fortbildungen veröffentlichen.
Herausforderungen der aktuellen Aus-, Fort- und Weiterbildungen
Eine wesentliche Einschränkung bei den meisten Schweizer Aus-, Fort- und Weiterbildungen besteht darin, dass sie nicht speziell auf den onkologischen Kontext zugeschnitten sind. Das bedeutet, dass sie weder die spezifischen Risiken noch die evidenzbasierten Indikationen komplementärer Therapien (siehe Artikel Kerndisziplinen) bei Krebspatient/-innen vermitteln. Darüber hinaus werden in vielen Fort- oder Weiterbildungen wichtige Aspekte der Lebensstilmedizin im onkologischen Kontext – wie Bewegung, Ernährung, Schlafhygiene, Stressbewältigung und psychische Gesundheit – sowie die Beurteilung von Nahrungsergänzungsmitteln oder pflanzlichen Präparaten nicht adäquat thematisiert.
In den kommenden Jahren beabsichtigt das SNIO, die Fort- und Weiterbildungsmöglichkeiten in Integrativer Onkologie zunächst für Onkolog/-innen und onkologische Pflegefachpersonen auszubauen, in einem zweiten Schritt dann auch für Patient/-innen und Komplementärtherapeut/-innen. Ein Anliegen von SNIO ist es, Gesundheitsfachpersonen, die Krebspatient/-innen behandeln, grundlegende Kenntnisse zu vermitteln und sie somit bei ihrer Befähigung zu unterstützen.
Durch den folgenden QR-Code erhalten Sie eine Auswahl an Informationsquellen, die von der medizinischen Fachgemeinschaft im Bereich der Integrativen Onkologie als zuverlässig eingestuft werden, sowie eine Sammlung von praktischen Werkzeugen (27, 42).
https://integrative-oncology.ch/media/education_resources.pdf
Mithilfe dieser evidenzbasierten Informationen kann jedes komplementärmedizinische Verfahren mit den Patient/-innen im eigenen Kontext und auf der Grundlage des Nutzen-Risiko- oder Wirksamkeit-Sicherheits-Verhältnisses besprochen werden, wie es in den SIO-Empfehlungen und den Modellen von Cohen und Eisenberg vorgeschlagen wird (20, 43, 44).
Schlussfolgerung
Integrative Onkologie ist ein zentraler Bestandteil moderner onkologischer Behandlung. Um ihr Potenzial sicher und wirksam zu nutzen, braucht es gezielte, interprofessionelle Fort- und Weiterbildungen, die den onkologischen Kontext berücksichtigen. Der Aufbau entsprechender Bildungsangebote in der Schweiz ist ein wichtiger nächster Schritt, um Patient/-innen ganzheitlich, evidenzbasiert und bedürfnisorientiert begleiten zu können.
Gisèle Montavon 1, Sara Kohler 2, Theresia Knittel 3, Claudia M. Witt 4
1 Service d‘oncologie, HFR Fribourg – Hôpital Cantonal, Fribourg ;
Service d‘oncologie médicale, Centre Hospitalier Universitaire Vaudois (CHUV), Lausanne
2 Institut für Pflege, Zürcher Hochschule für Angewandte Wissenschaften (ZHAW), Winterthur
3 Klinik für Onkologie, Hämatologie und Transfusionsmedizin, Kantonsspital Aarau, Aarau
4 Lehrstuhl für Komplementär- und integrative Medizin, Universität Zürich, Zürich
Zürcher Hochschule für Angewandte Wissenschaften (ZHAW)
Departement Gesundheit; Institut für Pflege
Katharina-Sulzer-Platz 9
8400 Winterthur
sara.kohler@zhaw.ch
Gisèle Montavon ist Board Member des Swiss Network for Integrative Oncology. Claudia M. Witt ist Präsidentin des Schweizer Fachverbandes Mind Body Medicine und erhält Honorare für wissenschaftliche Vorträge zur Integrativen Onkologie und Entwicklung von Behandlungspfaden und Curricula von Schweizer und Deutschen Spitälern.
Die weiteren Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Mao JJ, Pillai GG, Andrade CJ, Ligibel JA, Basu P, Cohen L, et al. Integrative oncology: Addressing the global challenges of cancer prevention and treatment. CA Cancer J Clin. 2022;72(2):144-64.
2. Onkologie L. S3-Leitlinie Komplementärmedizin in der Behandlung onkologischer PatientInnen 2024 [Available from: https://www.leitlinienprogramm-onkologie.de/leitlinien/komplementaermedizin.
3. Bower JE, Lacchetti C, Alici Y, Barton DL, Bruner D, Canin BE, et al. Management of Fatigue in Adult Survivors of Cancer: ASCO-Society for Integrative Oncology Guideline Update. J Clin Oncol. 2024;42(20):2456-87.
4. Carlson LE, Ismaila N, Addington EL, Asher GN, Bradt J, Mehta A, et al. Integrative Oncology Care of Symptoms of Anxiety and Depression in Adults With Cancer: SIO-ASCO Guideline Summary and Q&A. JCO Oncol Pract. 2023;19(10):847-51.
5. Mao JJ, Ismaila N, Bao T, Barton D, Ben-Arye E, Garland EL, et al. Integrative Medicine for Pain Management in Oncology: Society for Integrative Oncology-ASCO Guideline. J Clin Oncol. 2022;40(34):3998-4024.
6. Onkologie L. S3-Leitlinie Supportive Therapie bei onkologischen PatientInnen [Available from: https://www.leitlinienprogramm-onkologie.de/leitlinien/supportive-therapie.
7. Molassiotis A, Affronti ML, Fleury M, Olver I, Giusti R, Scotte F. 2023 MASCC/ESMO consensus antiemetic guidelines related to integrative and non-pharmacological therapies. Support Care Cancer. 2023;32(1):30.
8. Wode K, Henriksson R, Sharp L, Stoltenberg A, Hök Nordberg J. Cancer patients‘ use of complementary and alternative medicine in Sweden: a cross-sectional study. BMC Complement Altern Med. 2019;19(1):62.
9. Paterson C, Toohey K, Bacon R, Kavanagh PS, Roberts C. What Are the Unmet Supportive Care Needs of People Affected by Cancer: An Umbrella Systematic Review. Semin Oncol Nurs. 2023;39(3):151353.
10. Shneerson C, Taskila T, Holder R, Greenfield S, Tolosa I, Damery S, et al. Patterns of self-management practices undertaken by cancer survivors: variations in demographic factors. Eur J Cancer Care (Engl). 2015;24(5):683-94.
11. Boland L, Bennett K, Connolly D. Self-management interventions for cancer survivors: a systematic review. Support Care Cancer. 2018;26(5):1585-95.
12. Kemppainen LM, Kemppainen TT, Reippainen JA, Salmenniemi ST, Vuolanto PH. Use of complementary and alternative medicine in Europe: Health-related and sociodemographic determinants. Scand J Public Health. 2018;46(4):448-55.
13. Witt CM, Helmer SM, Schofield P, Wastell M, Canella C, Thomae AV, et al. Training oncology physicians to advise their patients on complementary and integrative medicine: An implementation study for a manual-guided consultation. Cancer. 2020;126(13):3031-41.
14. Ng JY, Kochhar J, Cramer H. Oncology researchers‘ and clinicians‘ perceptions of complementary, alternative, and integrative medicine: an international, cross-sectional survey. Support Care Cancer. 2024;32(9):615.
15. Mentink M, Jansen J, Noordman J, van Vliet L, Busch M, van Dulmen S. Interprofessional contact with conventional healthcare providers in oncology: a survey among complementary medicine practitioners. BMC Complement Med Ther. 2024;24(1):285.
16. Renet S, de Chevigny A, Hoacoglu S, Belkarfa AL, Jardin-Szucs M, Bezie Y, et al. Risk evaluation of the use of complementary and alternative medicines in cancer. Ann Pharm Fr. 2021;79(1):44-52.
17. Keinki C, Ahmadi E, Kastrati K, Zomorodbakhsch B, Hubner J, Working Group P, et al. Cancer Patient Motives and Expectations on Non-medical Practitioners. In Vivo. 2022;36(5):2505-13.
18. Mazzocut M, Truccolo I, Antonini M, Rinaldi F, Omero P, Ferrarin E, et al. Web Conversations About Complementary and Alternative Medicines and Cancer: Content and Sentiment Analysis. J Med Internet Res. 2016;18(6):e120.
19. Bender JL, Hueniken K, Eng L, Brown MC, Kassirian S, Geist I, et al. Internet and social media use in cancer patients: association with distress and perceived benefits and limitations. Support Care Cancer. 2021;29(9):5273-81.
20. Deng GE, Frenkel M, Cohen L, Cassileth BR, Abrams DI, Capodice JL, et al. Evidence-based clinical practice guidelines for integrative oncology: complementary therapies and botanicals. J Soc Integr Oncol. 2009;7(3):85-120.
21. Stub T, Quandt SA, Arcury TA, Sandberg JC, Kristoffersen AE. Attitudes and knowledge about direct and indirect risks among conventional and complementary health care providers in cancer care. BMC Complement Altern Med. 2018;18(1):44.
22. Bonacchi A, Toccafondi A, Mambrini A, Cantore M, Muraca MG, Focardi F, et al. Complementary needs behind complementary therapies in cancer patients. Psychooncology. 2015;24(9):1124-30.
23. de Valois B, Young T, Zollman C, Appleyard I, Ben-Arye E, Cummings M, et al. Acupuncture in cancer care: recommendations for safe practice (peer-reviewed expert opinion). Support Care Cancer. 2024;32(4):229.
24. Wolf C, Rachow T, Ernst T, Hochhaus A, Zomorodbakhsch B, Foller S, et al. Complementary and alternative medicine (CAM) supplements in cancer outpatients: analyses of usage and of interaction risks with cancer treatment. J Cancer Res Clin Oncol. 2022;148(5):1123-35.
25. Latte-Naor S, Mao JJ. Putting Integrative Oncology Into Practice: Concepts and Approaches. J Oncol Pract. 2019;15(1):7-14.
26. Salamonsen A. Doctor-patient communication and cancer patients‘ choice of alternative therapies as supplement or alternative to conventional care. Scand J Caring Sci. 2013;27(1):70-6.
27. Akeeb AA, King SM, Olaku O, White JD. Communication Between Cancer Patients and Physicians About Complementary and Alternative Medicine: A Systematic Review. J Integr Complement Med. 2023;29(2):80-98.
28. Rogge AA, Witt CM. Education Competencies for Integrative Oncology in Germany: Results of a Stakeholder Engagement Survey Study. Complement Med Res. 2022;29(6):446-52.
29. Bennardi M, Diviani N, Saletti P, Gamondi C, Stussi G, Cinesi I, et al. A qualitative analysis of educational, professional and socio-cultural issues affecting interprofessional collaboration in oncology palliative care. Patient Educ Couns. 2022;105(9):2976-83.
30. Sulosaari V, Dodlek N, Brandl A, De Munter J, Eriksen JG, McInally W, et al. Interprofessional education in cancer care – a scoping review. BMC Med Educ. 2024;24(1):767.
31. [WHO] WHO. Framework for Action on Interprofessional Education Collaborative Practice 2010 [Available from: https://www.who.int/publications/i/item/framework-for-action-on-interprofessional-education-collaborative-practice.
32. Maani-Fogelmann P, Bakitas M. Hospital-Based Palliative Care. Oxford textbook of palliative nursing 4th Edition. 2015:30.
33. IPEC Core Competencies for Interprofessional Collaborative Practice. 3 ed2023.
34. Benner P. FROM NOVICE TO EXPERT EXCELLENCE AND POWER IN CLINICAL NURSING PRACTICE. AJN The American Journal of Nursing. 1984;84(12):1479.
35. Benner P. Stufen zur Pflegekompetenz – From Novice to Expert: Huber; 2012.
36. Kirkpatrick AJ, Donesky D, Kitko LA. A Systematic Review of Interprofessional Palliative Care Education Programs. J Pain Symptom Manage. 2023;65(5):e439-e66.
37. Principal Relevant Objectives and a Framework for Integrative Learning and Education in Switzerland [Available from: https://www.profilesmed.ch/.
38. SIWF/ISFM FMH Weiterbildung in Medizinische Onkologie [Available from: https://www.siwf.ch/weiterbildung/facharzttitel-und-schwerpunkte/medizinische-onkologie.cfm.
39. Cufer T, Kosty MP. ESMO/ASCO Recommendations for a Global Curriculum in Medical Oncology Edition 2023. JCO Glob Oncol. 2023;9:e2300277.
40. Essen UD. Integrative Medizin in der Onkologie [Available from: https://www.nhk-fortbildungen.de/fortbildung/integrative-medizin-in-der-onkologie.
41. Larsen A, Crudup T, Huston A, Sharman R, Babakhanlou R, Miu R, et al. Integrative Oncology Fellowship Training in the United States: Uniting Requirements and Core Competencies. J Cancer Educ. 2025.
42. Swiss Network for Integrative Oncology [Available from: https://integrative-oncology.ch/.
43. Cohen MH, Eisenberg DM. Potential physician malpractice liability associated with complementary and integrative medical therapies. Ann Intern Med. 2002;136(8):596-603.
44. Deng GE, Cassileth BR, Cohen L, Gubili J, Johnstone PA, Kumar N, et al. Integrative Oncology Practice Guidelines. J Soc Integr Oncol. 2007;5(2):65-84.