Prävalenz der Demenz
Die Prävalenz der Demenz nimmt mit dem Alter zu. Bei 65 bis 69-Jährigen beträgt sie 3%, bei 70 bis 79-Jährigen 9% und bei 80 bis 84-Jährigen 18% wie Prof. Dr. med. Andreas Schönenberger, Chefarzt Medizinische Klinik Kantonsspital Münsterlingen, feststellte. Die Diagnosekriterien sind auch mit den neuen ICD-11 Code nach wie vor gleichgeblieben. Wichtigstes Kriterium ist die Gedächtnisstörung, die zwingend vorhanden sein muss. Zusätzlich muss mindestens eine weitere kognitive Störung vorhanden sein, z.B. Aphasie, Apraxie, Agnosie oder eine Störung der Exekutivfunktion. Weitere wichtige Kriterien sind Alltagsrelevanz, Verschlechterung über Zeit, kein Delir oder andere Störung. Gemäss ICD-11 zusätzlich: Dauer mindestens 6 Monate.
Grundprinzipien der Testung
- Domäne (Kurzzeit-)Gedächtnis: Wortliste zum Merken, Aufgabe zum Ablenken, Abrufen der Wortliste.
- Domäne Aufmerksamkeit: Von 20 rückwärts zählen, Monate rückwärts aufsagen, von 100 in 7er-Schritte rückwärts zählen.
- Domäne Orientierung: Zeit, Ort, Person.
- Domäne Visuokonstruktion, Exekutivfunktionen. Würfel zeichnen, Uhr zeichnen, Pentaeder zeichnen.
Standardtests
Minimental Status
- Vorteile: Gedächtnis, Orientierung, Aufmerksamkeit, Sprache abgedeckt. Limitatio für Acetylcholinesterase-Inhibitoren (AChEI)/Memantin basierend auf MMSE
- Nachteile: Exekutivfunktionen/Visuokonstruktion untergewichtet, Aufmerksamkeitstestung bildungsabhängig, einfach / langweilig, geschützt. Zeitbedarf 8-10 Minuten.
Montreal Cognitive Assessment (MOCA)
- Vorteile: Schwieriger/unterhaltsamer als MMSE. Exekutivfunktionen / Visuokonstruktion abgedeckt, Aufmerksamkeit ausführlicher und weniger bildungsabhängig als im MMSE, nicht geschützt
- Nachteile: Noch nicht akzeptiert als Limitatio für AChEI
- Zeitbedarf 8-10 Minuten
Mini Cog
- Vorteile: Gedächtnis und Visuokonstruktion abgedeckt, rasch durchführbar
- Nachteile: Keine weiteren Domänen (z.B. Orientierung, Aufmerksamkeit)
- Zeitbedarf 2-3 Minuten
Von der Testung zur Diagnose
- Testung und (Fremd-)Anamnese
- Prüfung der Testkriterien, Ausschluss von Differentialdiagnosen
- Ätiologische Zuordnung der Demenz, Einschätzung des Schweregrades
(Fremd-)Anamnese unter Einbezug von Angehörigen oder Betreuern
Beginn und zeitlicher Verlauf und deren Auswirkungen im Alltag, die Schulbildung, nicht-kognitive Symptome der Gedächtnisschwierigkeiten sollen erfragt werden, sowie Fragen nach Schlaf (Tag-Nacht-Umkehr), Familienanamnese bezüglich Demenz und Parkinsonsymptome und Fragen nach autonomen Symptomen
(Inkontinenz, Orthostase).
(Fremd-)Anamnese: auch nicht kognitive Symptom abfragen
Gemäss einer Studie aus dem Jahre 2002, die im JAMA publiziert wurde, wurde Aggressivität in 30.3%, Depression in 20.1%, Wahn in 18.0%, Apathie in 14.7%, Reizbarkeit in 14.7%, Schlafstörung in 13.8%, Halluzinationen in 10.5% Essstörung in 10.4%, Angst in 9.9% und Enthemmung in 3.1% gefunden. (Laketsos CG et al. JAMA. 2002;288(12):1475-1483).
Ausschluss von Differentialdiagnosen
Diagnosekriterien Delir: Akuter Beginn, flukturierender Verlauf, Aufmerksamkeitsstörung prädominant, aber auch andere kognitive
Domänen gestört (z.B. Orientierung, Gedächtnis), verändertes
Bewusstsein (hypo- oder hyperalert).
Ausschluss von Differentialdiagnosen (weitere DDs)
- Depression, andere psychiatrische Leiden
- Metabolische/endokrine Störungen: B12-Mangel, Folsäuremangel, Hypo-/Hyperkalzämie, Hypo-/Hypernatriämie, Hypo-/Hyperthyreose
- Hirnorganische Veränderungen: Hydrocephalus (inkl. Normaldruckhydrocephalus), Tumoren, Subduralhämatom)
- Infektionen: HIV, JC Virus, Lues, Enzephalitis
Polypharmazie-Check: Medikamente, die kognitive Störungen verursachen können
- Trizyklische Antidepressiva (z.B. Amitriptylin, Trimipramin)
- Neuroleptika mit starker anticholinerger Wirkung (z.B. Levomepropazin, Clozapin)
- Alte Antiparkinsonika mit starker anticholinerger Wirkung (z.B. Benzatropin)
- Alle Antihistaminika (z.B. Hydroxyzin)
- Alte Uro-Spasmolytika mit systemischer anticholinerger Wirkung (z.B. Trospiumchlorid)
- Antikonvulsiva mit sedierender Wirkung (z.B. Phenytoin, Levetiracetam, Carbamazepin)
- Sedativa / Benzodiazepine
- Opiate (insbeso. Pethidin)
- Antibiotika (insbesondere Cephalosporine, Chinolone, Makrolide, Penicilline)
- Antiarrhythmika (z.B. Amiodaron, Betablocker)
Diagnosestellung
Diagnosekriterien prüfen, wobei das wichtigste Kriterium das Vorliegen einer Gedächtnisstörung ist (muss zwingend vorhanden sein). Zusätzlich muss mindestens eine weitere kognitive Störung existieren, z.B. Aphasie, Apraxie, Agnosie, Störung Exekutivfunktion. Weitere wichtige Kriterien sind die Alltagsrelevanz, eine Verschlechterung über Zeit, kein Delir oder andere Störung. Gemäss ICD-11 zusätzlich: Dauer mind. 6 Monate.

Nach der Diagnosestellung
Ätiologische Zuordnung
Alzheimer-Demenz 60%, Lewy-Body-Demenz 15%, Vaskuläre Demenz 15, Frontotemporale Demenz 5%, andere Demenzen 5%.
Primärprävention
Antihypertensive Therapie. «Eine Heilung des Gedächtnisschwunds ist noch immer nicht in Sicht, aber das Demenzrisiko lässt sich halbieren», so der Referent.
Nicht-pharmakologische Therapie
- Organisation eines sozialen Netzwerks
- Stärkung vorhandener Ressourcen
- Organisation einer Tagesstruktur
- Anpassung der räumlichen Umgebung
Milieutherapie: Organisation einer Tagesstruktur
- Tagesklinik
- Stärkung vorhandener Ressourcen
- Kognitives Training und körperliche Aktivität Gewisse Evidenz aus Studien ist vorhanden, dass durch kognitives Training und körperliche Aktivität der kognitive Abbau gebremst werden kann.
Pharmakologische Therapie: Aducanumab
In den Phase III-Studien ENGAGE und EMERGE wurden Patienten mit MCI oder früher Alzheimer-Demenz der monoklonale Antikörper Aducanumab monatlich i.v. appliziert. Beide Studien wurden vorzeitig gestoppt da kein Nutzen erkennbar war. Nur in der EMERGE-Studie wurde nach 1.5 Jahren in der Gruppe mit hoher Dosis wurde eine leichte klinische Verbesserung festgestellt (MMSE Score +0.6 Punkte). Die Behandlungskosten beliefen sich auf ca. 50’000 US$ pro Jahr. Der Wirkstoff von Biogen ist der erste, er den Krankheitsverlauf bei Alzheimer abbremsen soll. Mit seiner Zulassung setzte die FDA sich über die Empfehlung ihrer externen Beratungskommission hinweg. Die FDA knüpft die Zulassung an die Durchführung einer Phase-4-Studie. Sie muss in den nächsten Jahren den Beweis erbringen, dass das Mittel auch den klinischen Zustand der Patienten verbessert
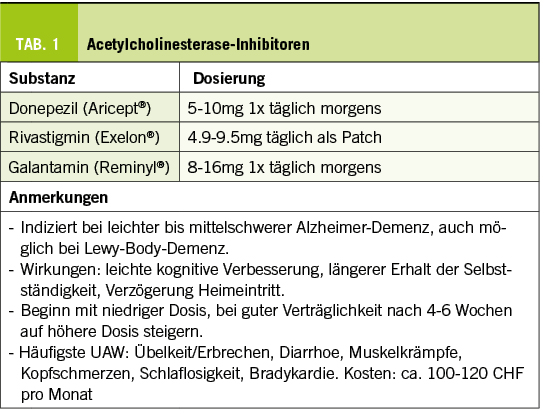

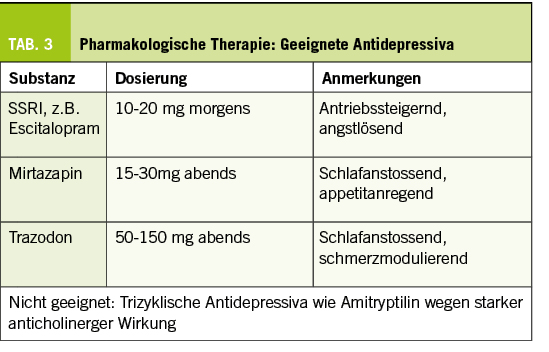
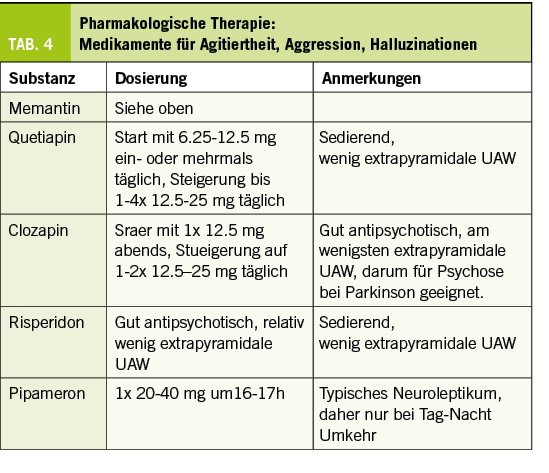
Memory Clinic
Der Referent erwähnte zum Schluss die Bedeutung der Memory Clinic. Sie wird eingesetzt zur sicheren Diagnosestellung bei Unklarheit/Unsicherheit, zur ätiologischen Klärung der Demenzdiagnose, sowie zur Indikationsstellung einer medikamentösen Therapie.










