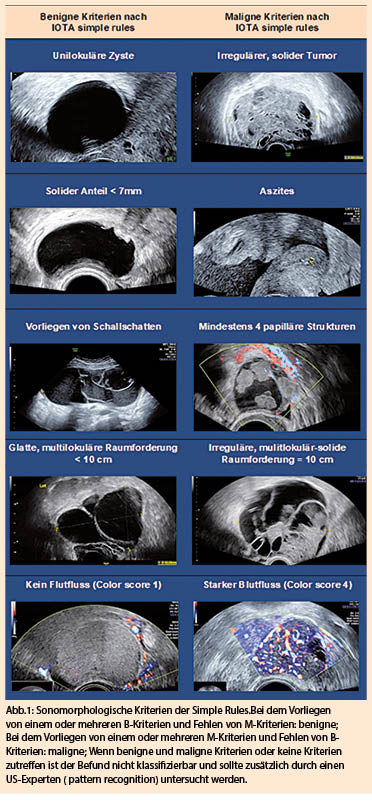
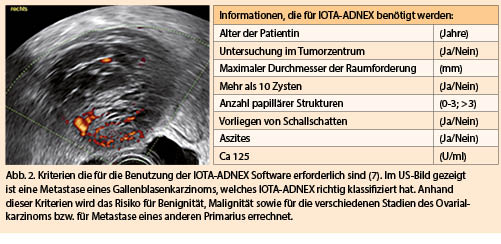
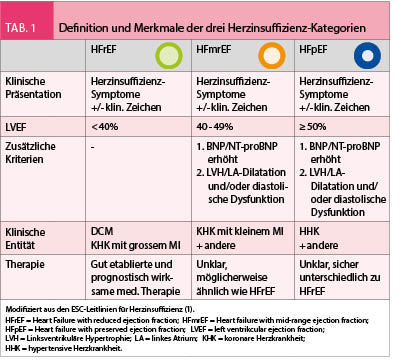
Interaktionen von Nahrungsaufnahme mit Medikamenten treten auf wegen der Nahrungsaufnahme per se, wegen spezifischer Komponenten in der Nahrung, aber auch wegen der galenischen Form der verabreichten Medikamente. In diesem Artikel werde ich mich mit der Wahl der galenischen Formulierung in Bezug auf Nahrungsaufnahme sowie mit Interaktionen von Arzneistoffen mit Nahrungsaufnahme und Nahrungsbestandteilen befassen.
Abstract: WInteractions of food intake with drugs occur because of food intake per se, because of specific components in food, but also because of the galenic form of the administered drugs. In this article I will deal with the choice of galenic formulation in relation to food intake as well as with the effect of food intake and food ingredients on the absorption of drugs.
Key Words: gastric emptying, gastric and duodenal pH, drug absorption, food-drug interactions
Zwischen der oralen Einnahme eines Medikamentes und des Erscheinens des Arzneistoffes im systemischen Kreislauf gibt es verschiedene Möglichkeiten, welche zu unerwünschten oder unerwarteten Wirkungen des eingenommenen Medikamentes führen können. Dazu zählen unter anderem die Einnahme ungünstiger galenischer Formulierungen auf den vollen Magen, Interaktionen von Arzneistoffen untereinander oder mit Nahrungsbestandteilen, verminderte intestinale Aufnahme von Arzneistoffen wegen Induktion von exkretorischen Arzneistofftransportern (z.B. P-Glykoprotein) oder intestinalen Zytochromen sowie eingeschränkte hepatische Aufnahme von Arzneistoffen durch verminderte Aktivität von Importproteinen und erhöhter hepatischer Abbau durch Induktion von Zytochromen in der Leber.
Wahl der galenischen Formulierung in Bezug auf Nahrungsaufnahme
Die Interaktion zwischen Nahrungsmittelaufnahme und galenischer Formulierung ist in einem vor 20 Jahren erschienenen Artikel sehr gut abgehandelt worden (1); die Prinzipien zum Verstehen dieser Interaktion und zur Vermeidung von Komplikationen haben sich in der Zwischenzeit nicht verändert.
Die meisten Arzneistoffe werden im Dünndarm absorbiert, müssen also den Magen passieren, bevor sie aufgenommen werden können. Faktoren, welche den Transport eines Arzneistoffes in den Dünndarm beeinflussen, sind die Freisetzung aus der galenischen Form, die Löslichkeit und Stabilität des Arzneistoffs im Magen sowie der Transport durch den Magen. Für den Transport von Arzneistoffen durch den Magen spielt v.a. die Motorik im distalen Teil des Magens eine wesentliche Rolle. Festes Material, wie z.B. nicht dispergierte Tabletten, müssen via Magenmotorik durch den Pylorus transportiert werden. Im distalen Magen existieren im Wesentlichen 2 Motilitätsmuster, eine Nüchtern- und eine digestive Motilität. Im nüchternen Zustand (keine Nahrungsbestandteile im Magen) bewirken alle 1 bis 2 Stunden vorkommende peristaltische Wellen (Phase-3 Kontraktionen) den Transport von festem Material durch den Pylorus. Der Pylorus ist offen und grössere Nahrungsbestandteile (>0.5 cm) können durch den Pylorus transportiert werden. Nach der Einnahme von flüssiger oder fester Nahrung wechselt die Motorik des distalen Magens auf die digestive Form, solange Nahrungsreste im Magen vorhanden sind. Der Pylorus schliesst sich bis auf einen Durchmesser von wenigen Millimetern und lässt also nur noch Flüssigkeit und kleine (<0.5 cm), feste Bestandteile passieren. Die Magenkontraktionen haben zum Ziel, den Mageninhalt so zu zerkleinern, dass er den fast geschlossenen Pylorus passieren kann. Nicht dispergierte Tabletten (z.B. magensaftresistente, nicht zerfallende Tabletten), verbleiben im Magen, je nach Nahrungsmenge für einige Stunden. Während also flüssige und im Magensaft zerfallende Arzneimittel den Magen unabhängig von gleichzeitiger Nahrungsaufnahme passieren können, gilt dies nicht für magensaftresistente, nicht zerfallende Tabletten. Für einen schnellen oder nicht verzögerten Wirkeintritt sollten solche Präparate also mit Wasser (nicht mit kalorienhaltigen Getränken) nüchtern eingenommen werden. Dieser Sachverhalt sollte für die Zulassung solcher Medikamente geprüft worden und entsprechend in der Fachinformation vermerkt sein.
Unspezifische Effekte der Nahrungsaufnahme auf die Pharmakokinetik von Arzneistoffen
Über dieses Thema ist kürzlich ein guter Reviewartikel publiziert worden (2). Die Interaktion von Arzneistoffen mit der Nahrung muss sowohl von der FDA wie auch der EMA aus für alle Medikamente geprüft werden, welche neu auf den Markt kommen. Die entsprechenden Studien werden in der Fachinformation erwähnt (meist eine Crossoverstudie einer Einzeldosis im nüchternen Zustand versus nach Einnahme einer fettreichen Mahlzeit) und darauf beruhen die Dosisempfehlungen. Bei einem relevanten Einfluss der Nahrungsaufnahme auf die Pharmakokinetik ist es essenziell, die Patienten darauf hinzuweisen, dass sie allenfalls auf die Einnahme bestimmter Nahrungsmittel verzichten, oder das Medikament stets zum gleichen Zeitpunkt in Bezug auf Nahrungseinnahme zu sich nehmen sollen.
Die pharmakokinetischen Parameter, welche durch Nahrungsaufnahme beeinflusst werden, sind vor allem die Zeit bis zum Erreichen der maximalen Konzentration (Tmax), die maximale Konzentration (Cmax) und die Exposition (Fläche unter der Plasmakonzentration-Zeitkurve, AUC).
Die wichtigsten Mechanismen, welche zu einer Interaktion der Nahrungsaufnahme mit Arzneistoffen führen, sind in Tabelle 1 aufgelistet. Fettreiche Nahrung hemmt die Magenentleerung, was in den meisten Fällen zu einer Erhöhung der Tmax führt, die Exposition aber nicht beeinträchtigt. Die Exposition kann sich v.a. für sehr lipophile Arzneistoffe erhöhen, einerseits wegen verbesserter Löslichkeit und dann auch wegen möglicher Absorption via Lymphe. Fettreiche Ernährung führt auch zu einer Sekretion von Gallensäuren in das Duodenum, was die Dünndarmepithelien für die Penetration von Arzneistoffen durchlässiger macht. Auf der anderen Seite kommt es zur Bildung von Mizellen, was die freie Konzentration von Arzneistoffen und damit die intestinale Aufnahme senken kann. Generell kann davon ausgegangen werden, dass der Effekt der Nahrungsaufnahme bezüglich Zunahme der Exposition für schlecht wasserlösliche, aber gut penetrierbare Arzneistoffe am Ausgeprägtesten ist, da die Löslichkeit verbessert werden kann (3).
Eine proteinreiche Ernährung kann zu verminderter Aufnahme von peptidähnlichen Arzneistoffen führen, da die beim Abbau der Proteine entstehenden Peptide oder Aminosäuren mit dem aktiven Transport von Arzneistoffen konkurrenzieren können. Das könnte zum Beispiel für Angiotensinrezeptorblocker oder auch für DOPA der Fall sein. Absorbierte Aminosäuren können auch an der Blut-Hirnschranke mit der Aufnahme von L-DOPA konkurrieren, was zeigt, dass Nahrungsmittel-Arzneistoffinteraktionen nicht nur im Gastrointestinaltrakt vorkommen müssen.
Zudem können Arzneistoffe unspezifisch von Nahrungsfasern adsorbiert werden, was die Exposition solcher Arzneistoffe senkt.
Ein unspezifischer Effekt der Nahrungsaufnahme ist auch das Anheben des pH im Magen (von ca. 2 im nüchternen Zustand auf ca. 5 nach dem Essen). Der Effekt betrifft v.a. die Stabilität der Arzneistoffe; z.B. ist Leukovorin instabil bei pH<3 und sollte deshalb nicht auf nüchternen Magen eingenommen werden. Zudem kann sich mit steigendem pH die Löslichkeit vermindern, was unter anderem für den Tyrosinkinasenhemmer Elrotinib der Fall ist.
Spezifische Nahrungsmittel-Arzneistoffinteraktionen
Eine der wichtigsten, spezifischen Interaktion mit Nahrungsmittel-Arzneistoffinteraktion ist diejenige mit Grapefruit und, etwas weniger ausgeprägt, auch mit Pomelo. Grapefruit und Pomelo enthalten die Furanocoumarine Bergamottin und 6’,7’-Dihydroxybergamottin, welche das Zytochrom P450 (CYP) 3A4 im Darm (aber nicht in der Leber) irreversibel hemmen (4). Das gehemmte intestinale CYP3A4 muss neu synthetisiert werden, um die intestinale CYP3A4 Aktivität wieder herzustellen, was ca. 24 Stunden dauert. CYP3A4 Substrate (z.B. Arzneistoffe), welche im Darm relevant abgebaut werden, erreichen deshalb nach der Einnahme von Grapefruitsaft höhere systemische Konzentrationen wegen Steigerung der Bioverfügbarkeit. Dies betrifft unter anderem die meisten Calciumantagonisten, Triazolam und Midazolam, Cyclosporin und Tacrolimus, Amiodaron, Apixaban und Rivaroxaban, Oxycodon sowie Simvastatin und Atorvastatin. Eine vollständigere Liste der Arzneistoffinteraktionen mit Grapefuitsaft findet sich bei Mouly et al. (5).
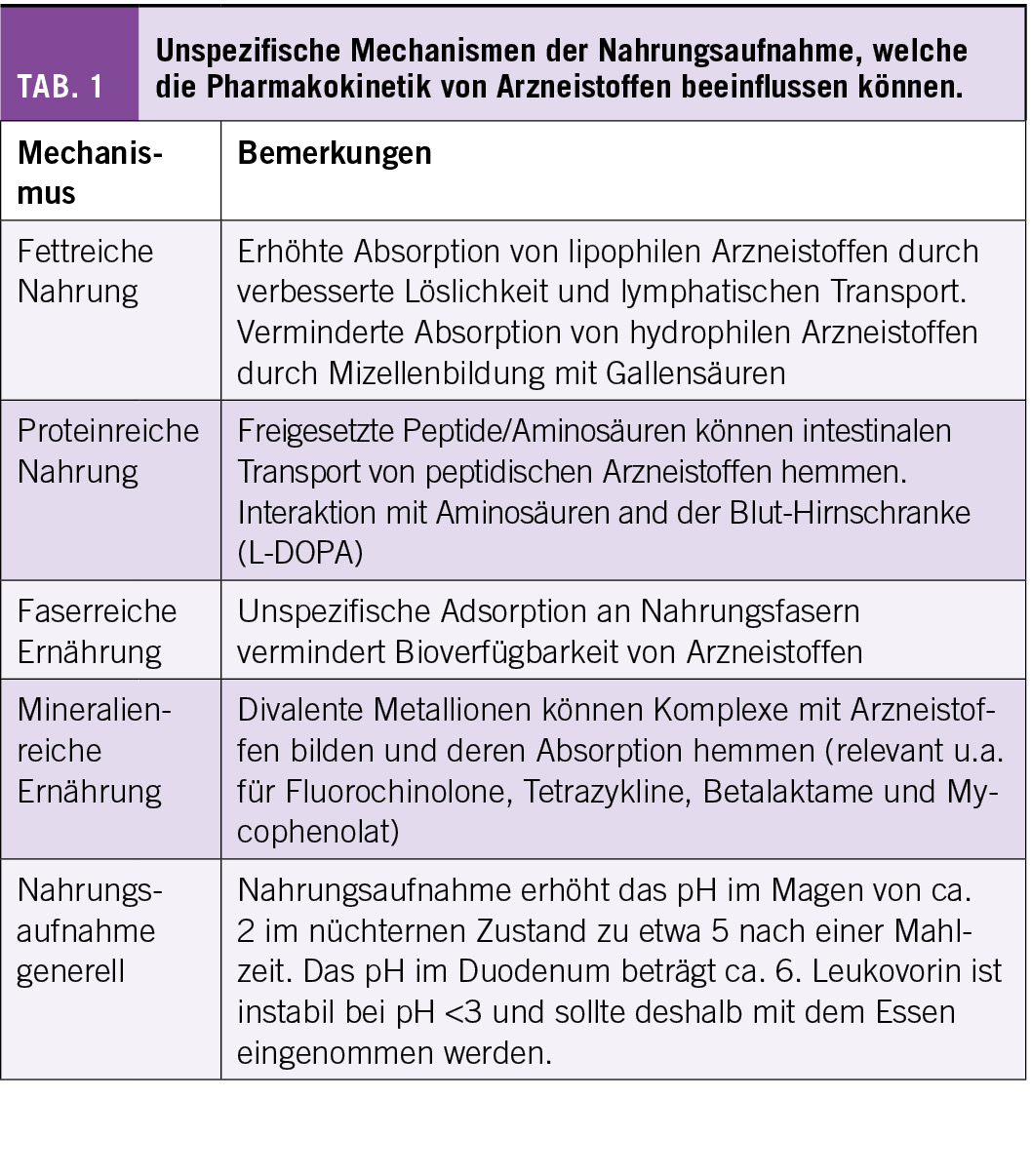
Die Interaktion von Grapefruitsaft mit Midazolam ist in der Abb. 1 illustriert. Gesunde Probanden wurden mit 250 mL Grapefruitsaft oder Wasser vorbehandelt und der Effekt auf die Pharmakokinetik von oral oder intravenös verabreichtes Midazolam untersucht. Ein Effekt von Grapefruit war nur nach oraler Gabe von Midazolam sichtbar, was beweist, dass Grapefruit auf das CYP3A4 im Darm, nicht aber in der Leber, wirkt. Nach oraler Gabe von Midazolam kam es durch Grapefruit ungefähr zu einem 30%-igen Anstieg der Bioverfügbarkeit, was die Sedation der Probanden verstärkte (4).
Eine weitere, spezifische Interaktion mit Nahrungsbestandteilen ist die Komplexbildung mit bivalenten Metallionen (insbesondere Fe2+, Mg2+ und Ca2+). Dies muss v.a. bei der Einnahme von Milch und gewissen Milchprodukten, stark mineralhaltigem Mineralwasser und von Nahrungsmittelzusätzen, welche Mineralien enthalten, beachtet werden. Betroffene Arzneistoffe sind u.a. Mycophenolat, Fluorochinolone oder auch Thyroxin (2).
Klinisch relevante Nahrungsmittel-Arzneistoffinteraktionen
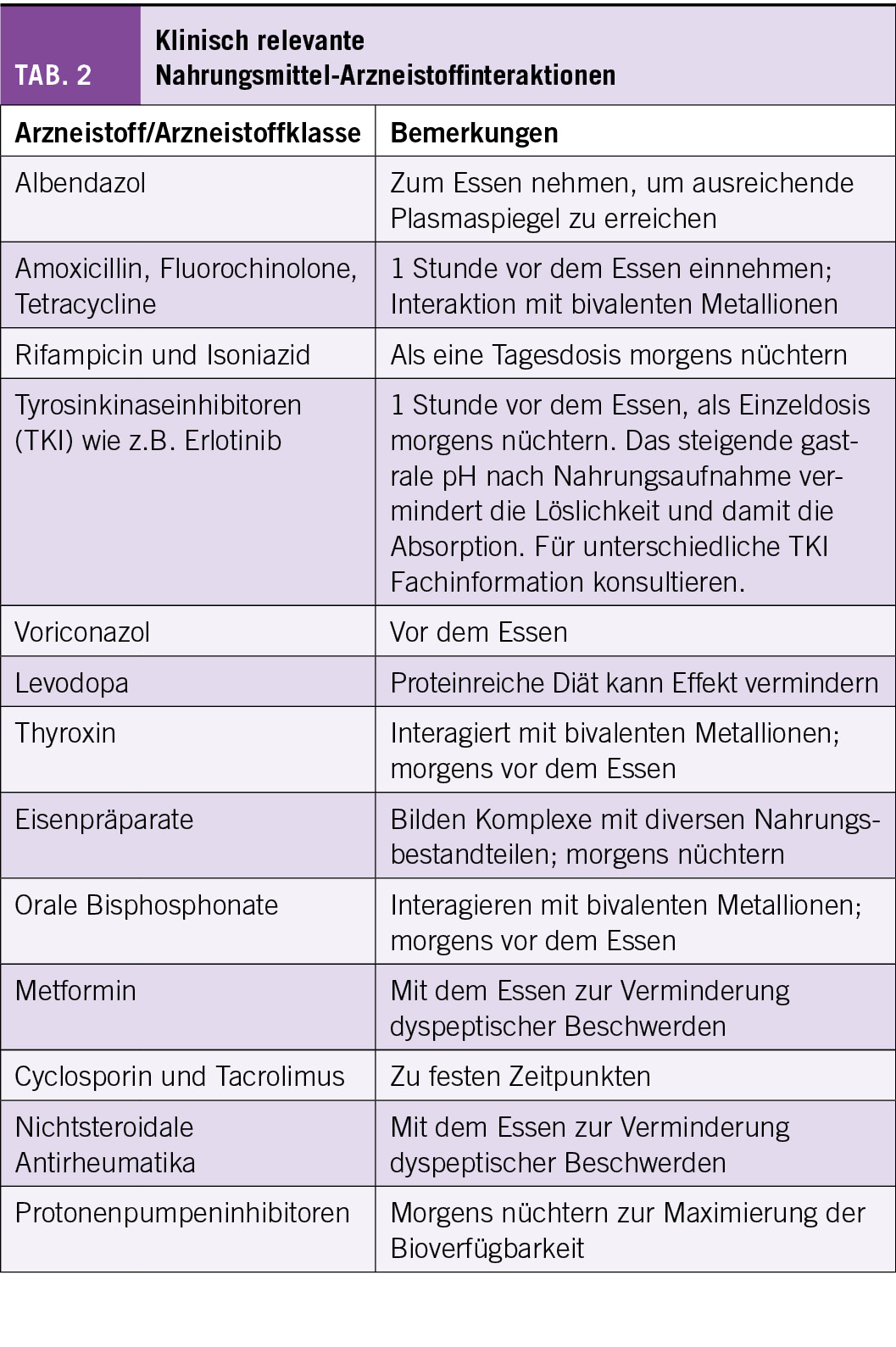
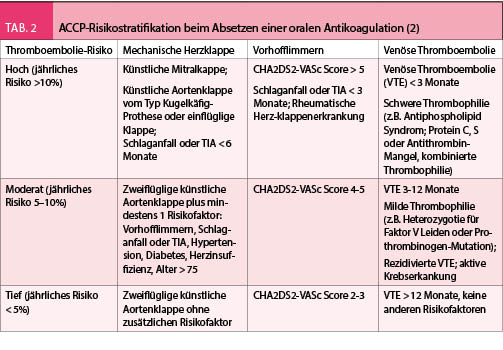
Tabelle 2 enthält eine Liste von klinisch relevanten Nahrungsmittel-Arzneistoffinteraktionen. Die Liste ist nicht vollständig; wie weiter oben ausgeführt, sollten die Empfehlungen der entsprechenden Fachinformation befolgt werden, welche auf den durch die Firmen durchgeführten Studien basieren.
Copyright bei Aerzteverlag medinfo AG
Klinische Pharmakologie & Toxikologie
Universitätsspital
4031 Basel
stephan.kraehenbuehl@usb.ch
Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Walter-Sack I, Haefeli WE. [Consideration of drug absorption in customizing drug therapy]. Therapeutische Umschau Revue therapeutique. 2000;57(9):557-62.
2. Deng J, Zhu X, Chen Z, Fan CH, Kwan HS, Wong CH, et al. A Review of Food-Drug Interactions on Oral Drug Absorption. Drugs. 2017;77(17):1833-55.
3. Wu CY, Benet LZ. Predicting drug disposition via application of BCS: transport/absorption/ elimination interplay and development of a biopharmaceutics drug disposition classification system. Pharmaceutical research. 2005;22(1):11-23.
4. Kupferschmidt HH, Ha HR, Ziegler WH, Meier PJ, Krähenbühl S. Interaction between grapefruit juice and midazolam in humans. Clinical pharmacology and therapeutics. 1995;58(1):20-8.
5. Mouly S, Lloret-Linares C, Sellier PO, Sene D, Bergmann JF. Is the clinical relevance of drug-food and drug-herb interactions limited to grapefruit juice and Saint-John’s Wort? Pharmacological research. 2017;118:82-92.