Der Trikuspidalklappeninsuffizienz und ihrer Behandlung wurde lange Zeit eine geringe klinische Bedeutung beigemessen, da in der Vergangenheit nur chirurgische Verfahren zur Verfügung standen, die mit einer hohen Sterblichkeitsrate verbunden waren. Grundlage der Therapie einer schweren Trikuspidalklappeninsuffizienz bleibt die optimale medikamentöse Behandlung mit Diuretika. Bei anhaltender schwerer Trikuspidalklappeninsuffizienz stehen eine Reihe neuartiger minimalinvasiver Reparaturverfahren sowie die perkutane Trikuspidalklappenimplantation zur Verfügung.
In the past, tricuspid valve regurgitation was considered of little clinical importance as only surgical procedures associated with high mortality rates were available. Cornerstone therapy for severe tricuspid valve insufficiency remained optimal medical treatment with diuretics. However, with advanced interventional techniques and new minimally invasive repair procedures including percutaneous tricuspid valve implantation, an updated assessment of treatment options is essential.
Key Words: Tricuspid valve insufficiency, transcatheter therapy, valve reconstruction, valve replacement
Einführung
Die Prävalenz einer signifikanten, mässigen oder schweren Trikuspidalinsuffizienz (TI) beträgt ca. 0,6% in der Allgemeinbevölkerung und bis zu 3% nach dem 75. Lebensjahr, ähnlich wie bei der Aorten-stenose. Epidemiologische Studien deuten darauf hin, dass eine signifikante TI mit einer fast doppelt so hohen Sterblichkeit verbunden ist. Trotz der hohen Prävalenz und der schlechten Prognose wird sie nur selten operativ behandelt (1). Der Outcome bei operativer Sanierung hängt direkt mit der Funktion des linken (LV) und rechten Ventrikels (RV) und des Pulmonalarteriendrucks ab (2-4).
In der Vergangenheit wurde die Funktion der Trikuspidalklappe (TK) von der medizinischen Fachwelt als deutlich weniger wichtig erachtet als die Funktion der Aorten- und Mitralklappe. Ausserdem ging man davon aus, dass eine schwere TI mit alleiniger medikamentöser Therapie gut toleriert und kontrolliert werden kann. Die derzeitige Auffassung über die TK hat sich jedoch erheblich geändert.
Angesichts des hohen Risikos einer Trikuspidalklappenoperation (5, 6) und der schlechten Ergebnisse der konservativen Therapie (7) hat sich die kathetergestützte Trikuspidalintervention in jüngster Zeit als praktikable Alternative zur Chirurgie entwickelt. Zudem zeigten jüngste Studien, dass die Sterblichkeit im Spital, periprozedurale Komplikationen, sowie Dauer des Krankenhausaufenthalts und die medizinischen Kosten bei interventionellem Trikuspidalrepair im Vergleich zu den chirurgischen Methoden tiefer waren (8).
Im Folgenden werden die aktuell gängigen kathetergestützten Verfahren, die für die Reparatur oder den Ersatz der TK zur Verfügung stehen, sowie die damit verbundenen klinisch relevanten Studien erörtert.
Anatomie, Ätiologie und Symptome der Trikuspidalinsuffizienz
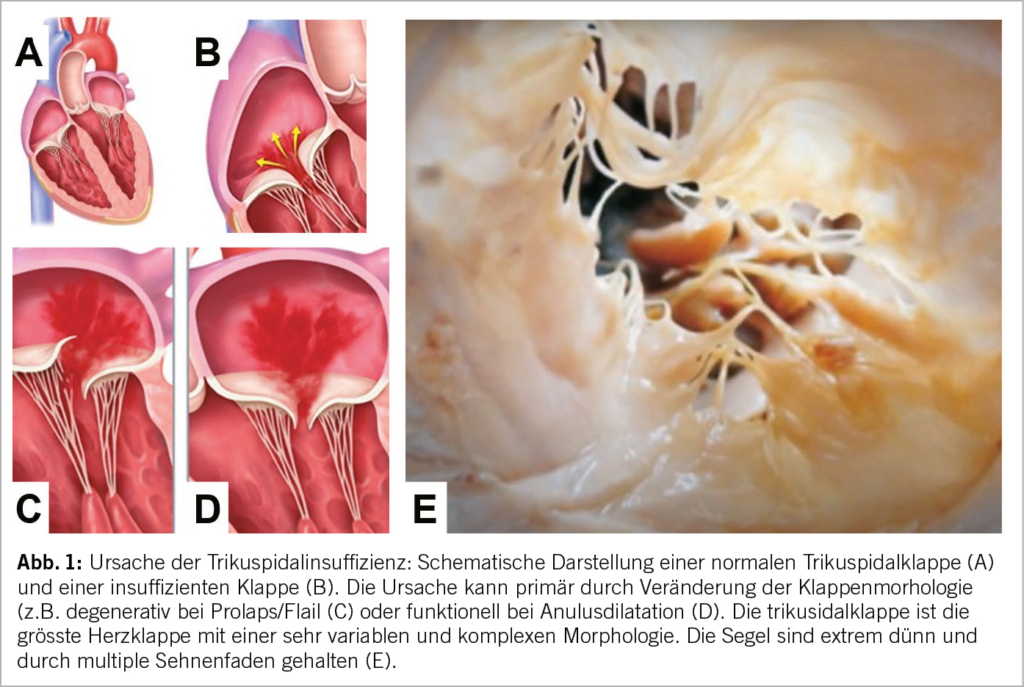
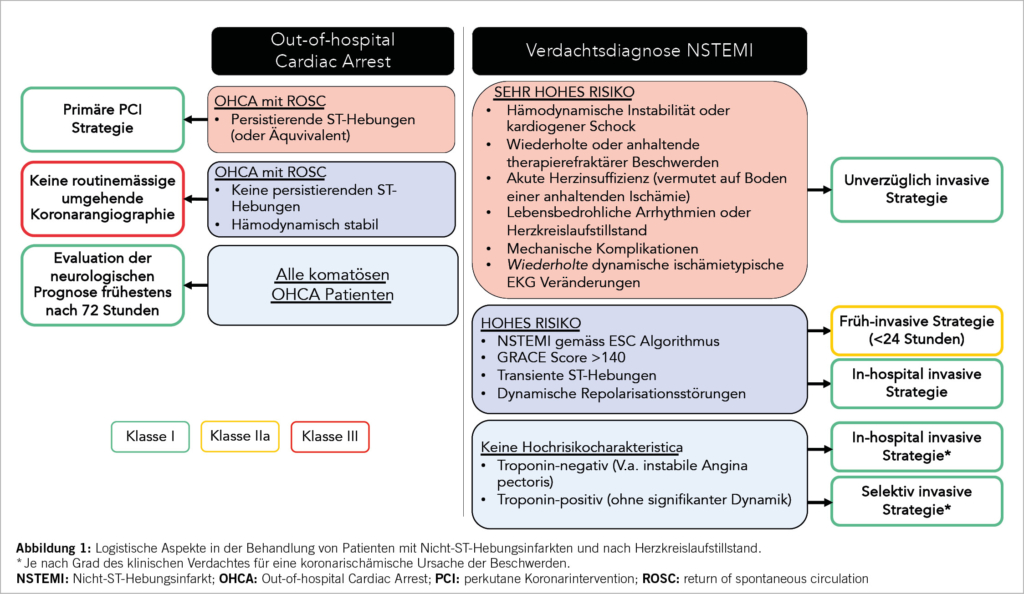
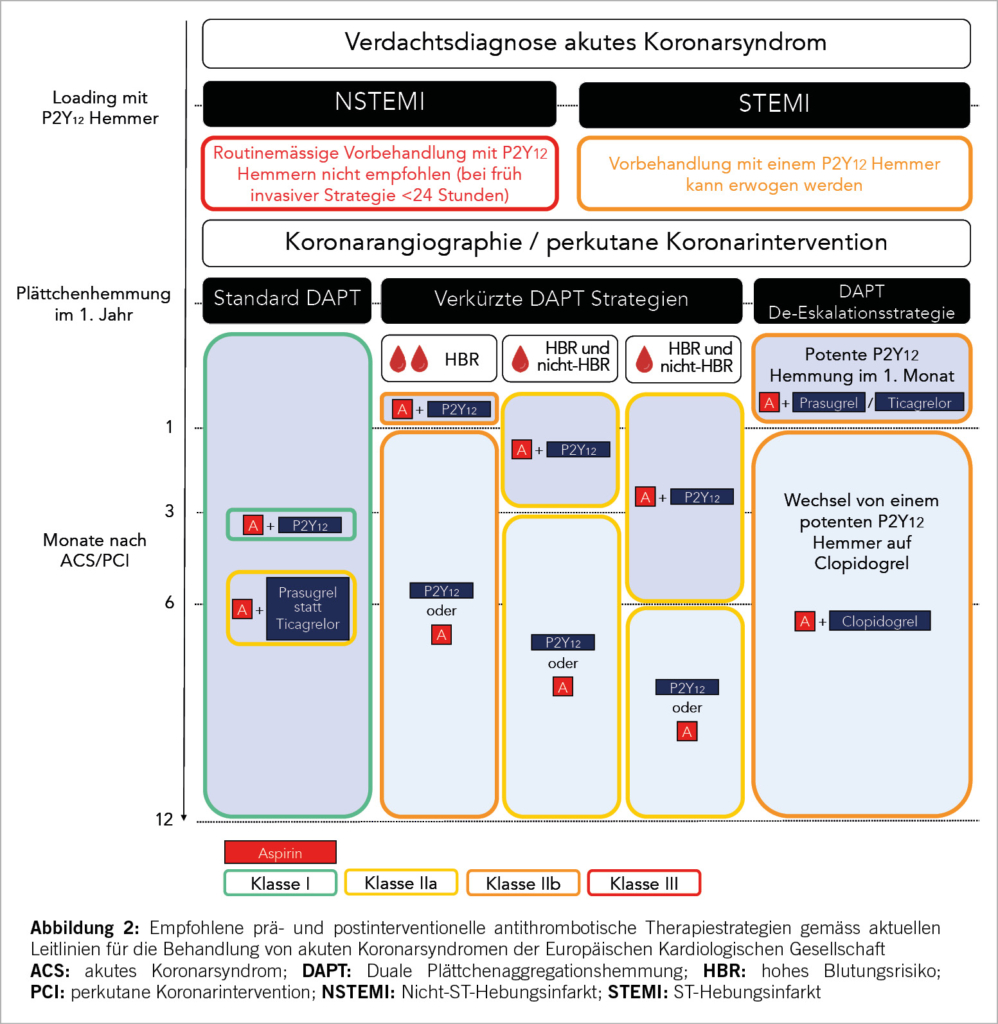
Die TK ist die grösste aller Herzklappen und in ihrer Morphologie sehr variabel. Der normale Trikuspidalanulus weist eine unebene D-förmige Struktur auf (9). Das vordere Segel, das eine viereckige Form hat, ist das grösste Segel und weist die grösste Bewegung auf, das hintere Segel, das eine dreieckige Form aufweist, ist das kürzeste. Das septale Segel, das halbkreisförmig ist und Einbuchtungen aufweist, ist das am wenigsten bewegliche Segel und ist direkt über dem interventrikulären Septum am Trikuspidalanulus befestigt (10). Eine kürzlich eingeführte neue Nomenklatur wird der Variabilität gerecht und berücksichtigt auch bikuspide, quadrikuspide und quindikuspide Konfigurationen in 5%, 39%, respektive 2% (11). Zusätzlich wurde die TI auch neu in 5 Schweregrade eingeteilt: reissend («torrential»), sehr schwer («massive»), schwer («severe»), mittelschwer («moderate») und leicht («mild») (12). Die TI ist in hohem Masse vom Ausmass der Dilatation des Klappenanulus abhängig (Abb. 1).
In ca. 90% der Fälle liegt eine sekundäre Genese vor, die Prävalenz nimmt dabei mit dem Alter zu (3, 9, 13, 14). Diese ist zumeist durch eine ischämische Herzkrankheit, Vorhofflimmern, Aorten- oder Mitralklappenerkrankungen, Kardiomyopathien oder pulmonale Erkrankungen verursacht. Eine wichtige Ursache ist auch die durch Schrittmacher- oder ICD-Elektroden induzierte TI. Ähnlich wie bei der Mitralklappe wird auch bei der TK zwischen der atriogenen und ventrikulogenen funktionellen TI unterschieden. Nur bei rund 10% der Patienten liegt eine primäre Aetiologie vor. Ursächlich dafür sind meist degenerative Veränderungen wie myxomatöse Degeneration (Prolaps), Endokarditis, Karzinoid-Syndrom, rheumatische Herzerkrankung oder Bestrahlung des Thorax, seltener kongenitale Ursachen wie eine Ebstein-Anomalie (13).
Zu den typischen Symptomen der TI gehören Müdigkeit und Leistungsreduktion, Atemnot, Appetitlosigkeit, Aszites und periphere Ödeme (13). Zur Verbesserung dieser Symptome werden in erster Linie Diuretika eingesetzt. Eine langjährige, hochdosierte Behandlung mit Diuretika zusammen mit der chronischen Rechtsherzinsuffizienz kann zu einer Verschlechterung der Nierenfunktion (kardio-renales Syndrom), Leberfunktion und letztlich zu einem Nierenversagen und Leberzirrhose führen.
Behandlung der TI
Die Behandlung der TI ist komplex und sollte deshalb interdisziplinär im Heart Team evaluiert werden, um die optimale Lösung für jeden Patienten individuell definieren zu können. In vielen Fällen kann die defekte Herzklappe chirurgisch rekonstruiert werden. Dieser Eingriff wird meistens minimalinvasiv unter Verwendung der Herzlungenmaschine (HLM) vorgenommen und gilt heute als «Goldstandard». Bei einigen Patienten kommt eine chirurgische Lösung allerdings nicht in Frage, da die rechtsventrikuläre Funktion oder das operative Risiko prohibitiv sind. Für solche Fälle wurden wenig invasive Verfahren entwickelt, die am schlagenden Herzen angewandt werden.
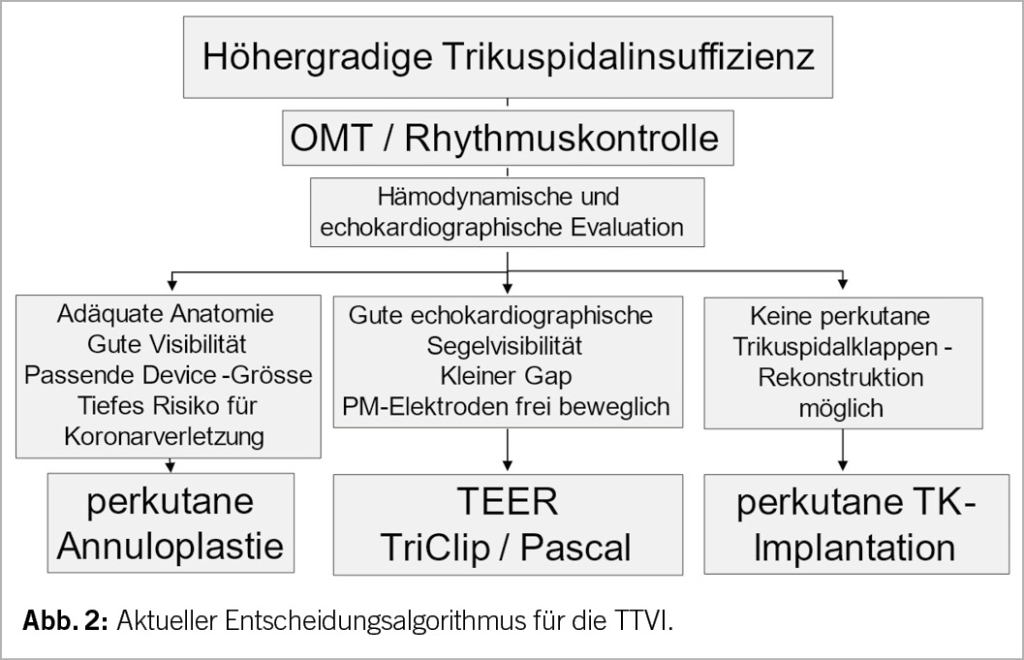
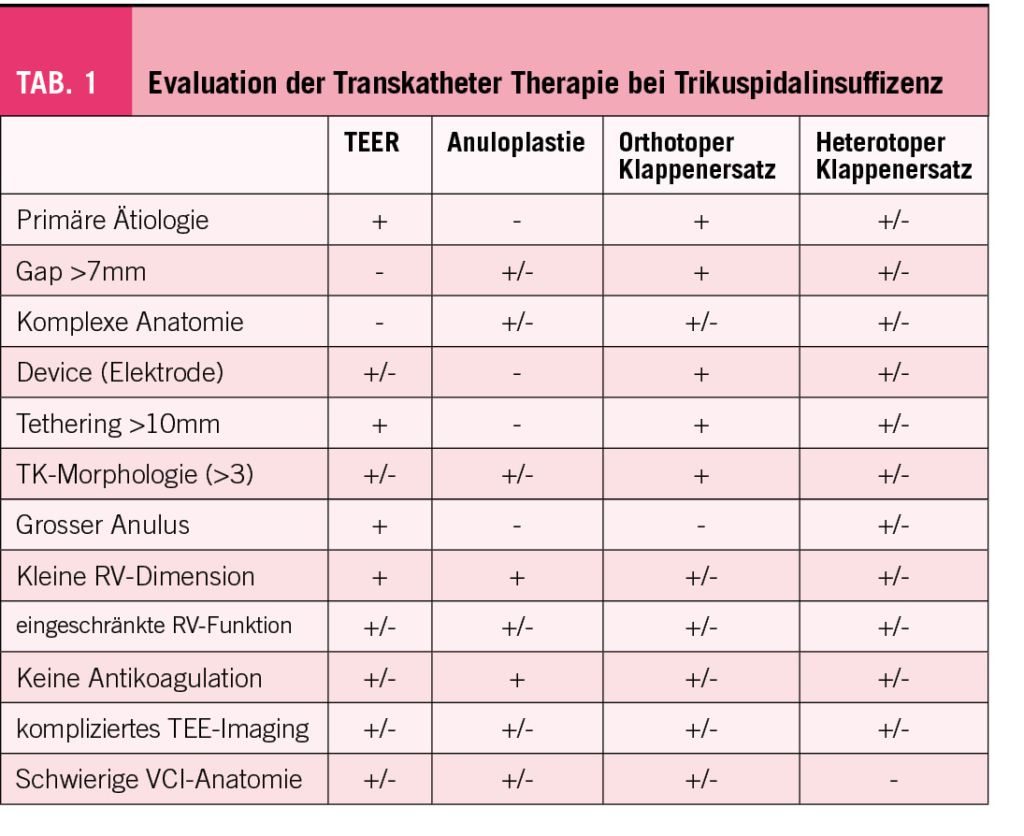
Die Wahl der alternativen, katheterbasierten TK-Intervention (TTVI) ist ebenfalls komplex (Abb. 2). Neben den anatomischen Gegebenheiten ist auch ein umfassendes Verständnis der physiologischen und hämodynamischen Bedingungen wichtig für den Erfolg der Klappenintervention (Tab. 1) (15). Eine multimodale Evaluation, welche nicht-invasive und invasive Untersuchungen kombiniert, ist zentral und sollte idealerweise in einem euvolämen Patientenzustand durchgeführt werden. Dabei sind die zu erwartenden hämodynamischen Auswirkungen einer TTVI zu beachten: Eine Reduktion der TI erhöht akut die Nachlast des RV, was zu einer Verschlechterung der RV-Funktion führen kann. Langfristig zeigen sich aber auch eine Reduktion des RV-Volumens und Verbesserung der RV-Kontraktilität durch Reduktion der Volumenbelastung. Aktuelle Studien konnten trotz initial echokardiographischer Verschlechterung der RV-Funktion eine Verbesserung von Schlagvolumen und Herzminutenvolumen nach TTVI dokumentieren (16, 17).
Das Outcome nach TTVI hängt auch direkt von der Funktion anderer Organsysteme ab, insbesondere der Leber- und Nierenfunktion. Ein vorbestehendes hepato-kardiales Syndrom zeigte ein signifikant schlechteres Outcome nach TTVI hinsichtlich Mortalität und Re-Hospitalisationen wegen Herzinsuffizenz (18).
Transkatheter Trikuspidalklappen Interventionen (TTVI)
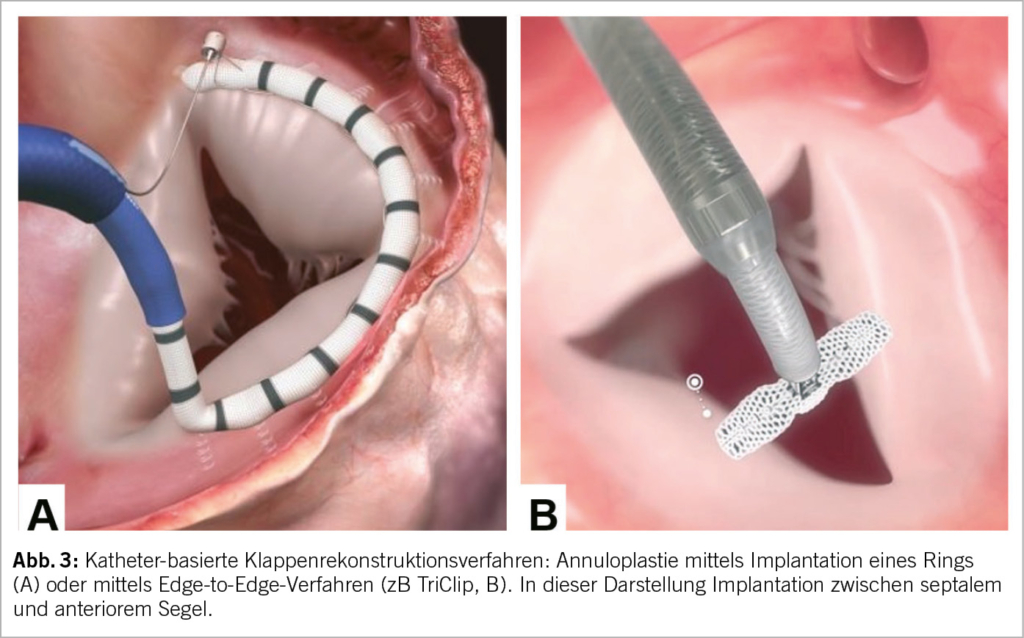
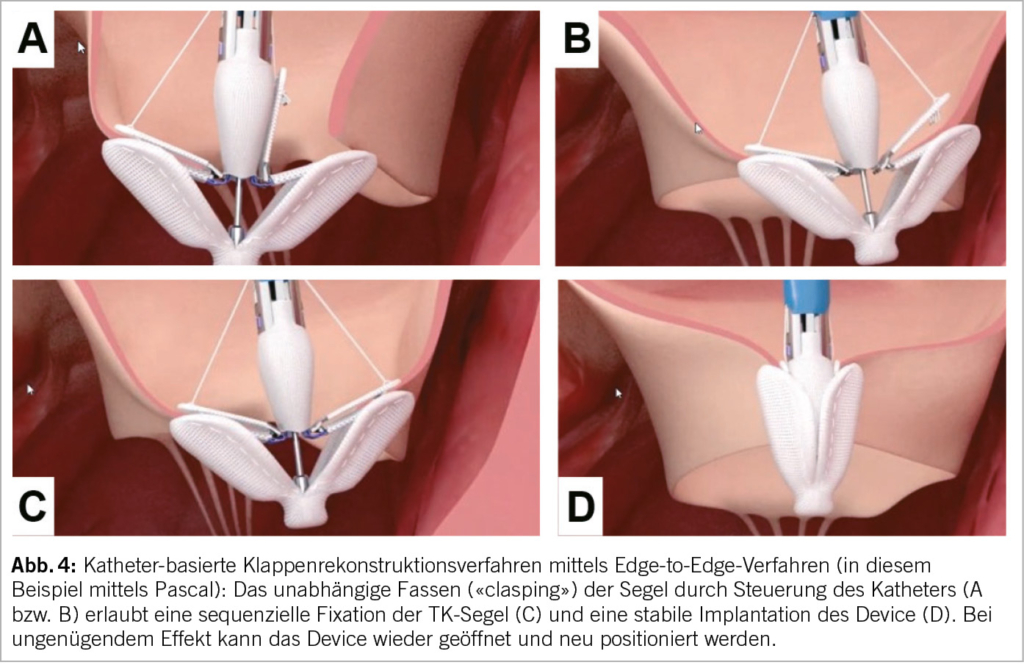
Unter katheterbasierte Verfahren fallen (in Analogie zu den Mitralklappenbehandlungen) Rekonstruktionsverfahren wie Implantation von Anuloplastie-Devices (Abb. 3), edge-to-edge repair (TEER, Abb. 3B und Abb. 4) und der interventionelle TK-Ersatz (Abb. 5). Abhängig von der zugrundliegenden valvulären Pathologie bieten sich auch kombinierte Eingriffe an, wie z.B. die direkte Ringanuloplastie mit anschliessender «edge-to-edge-repair». In kürzlich publizierten Studien haben TEER-Devices den echokardiografisch gemessenen Schweregrad der TI in 80-85% der Patienten von schwer auf moderat und davon in 30-50% der Fälle auf leicht reduziert. Gleichzeitig wurden eine signifikante klinische Besserung sowie eine Verbesserung der Lebensqualität dokumentiert (19, 20). Am effizientesten zeigte sich der orthotope Trikuspidalklappen-Ersatz, der bei 90% der Fälle den Schweregrad der TI auf mild oder weniger reduzieren konnte (21).
Transcatheter edge-to-edge valve repair (TEER)
Trikuspid-TEER ist aktuell das häufigste perkutane Verfahren für die Behandlung der TI. Weltweit sind hierfür zwei Implantate kommerziell erhältlich und in Europa für die Behandlung der Trikuspidalklappe zugelassen (CE Marktzulassung): TriClip (Abbott Vascular) und PASCAL (Edwards Lifesciences). Beide Devices folgen dem Prinzip des chirurgischen Alfieri-Stitch (edge-to-edge) und reduzieren die TI durch Koaptation der TK-Segel. In der Handhabung sind sie ähnlich: Der Zugang erfolgt über die Punktion der rechten Femoralvene und das Implantat wird über eine steuerbare Schleuse bis in den rechten Vorhof vorgeschoben. Das lenkbare Kathetersystem wird unter echokardiographischer und fluoroskopischer Kontrolle bis zur TK gesteuert. Die Orientierung und Zahl von implantierten Devices richtet sich nach der Art, Schweregrad und Anatomie der funktionellen und strukturellen Läsion. Am häufigsten werden die Implantate zwischen dem anterioren und septalen Segeln, seltener zwischen posterioren und septalen Segel platziert. Die Echokardiographie spielt eine entscheidende Rolle zur Auswahl anatomisch geeigneter Patienten, sowie intraprozedural zur Anleitung des Eingriffs (mittels TEE). Als geeignete Anatomien für eine TK-TEER gelten v.a. zentrale Jets zwischen dem anterioren und septalen Segel, ein Koaptations-Gap <7mm, ein umschriebener Prolaps oder Flail und eine trikuspide Klappenmorphologie (Tabelle 1). Eher ungeeignet sind Koaptations-Gaps >9mm, schwer verdickte oder verkalkte Segel, die anteroposteriore oder septoposteriore Hauptlokalisation des Jets, quadriskupide oder quindiskuspide Klappenmorphologien, sowie das Vorhandensein einer adhesiven Schrittmacher-Elektrode.
Der TriClip™ (Abbott Vascular) stellt eine modifizierte Form des seit 2008 in der Schweiz eingeführten MitraClip™ Systems dar und ist das erste Device, das eine breite klinische Anwendung erlangte. Um unterschiedlichen Patientenanatomien gerecht zu werden, gibt es TriClip™ in zwei verschiedenen Grössen. Da diese Prozedur am schlagenden Herz durchgeführt wird, kann der Interventionserfolg schon während dem Eingriff mittels TEE beurteilt werden. Die TRILUMINATE-Studie ist die erste randomisierte Studie, in welcher die TTVI mittels TriClip™ mit einer medikamentösen Therapie bei 350 Patienten mit schwerer TI verglichen wurde (20). Die TTVI führte zu einer deutlichen Reduktion der TI (leicht oder mittelschwer in 87% der Patienten). Zwar gab es keine Unterschiede bzgl. Gesamt-Mortalität oder Re-Hospitalisationen zwischen den beiden Gruppen, die Studie war allerdings nicht dafür gepowert. Die Resultate des vordefinierten primären hierarchischen Composite-Endpunktes fielen zugunsten der Device-Gruppe aus, wobei ausschlaggebend hierfür eine Verbesserung der Lebensqualität (gemäss Kansas City Cardiomyopathy Questionnaire) in der Device Gruppe war. Zudem fand sich ein gradueller Zusammenhang zwischen Verbesserung der TI und subjektiver Besserung: Die besten subjektiven Resultate wurden in der Gruppe erzielt, in welcher die TTVI zu einer Abnahme der TI um 2 oder mehr Grade führte.
Das PASCAL-Reparatursystem (Edwards Lifesciences) ist in zwei Grössen erhältlich. Das PASCAL P10 Device verfügt über einen zentralen Spacer und zwei breitere Klammerarme, während das PASCAL Ace System über dünnere Klammerarme und einen schlankeren Spacer verfügt. Für den Einsatz in der Triksupidalklappe kommt aufgrund der anatomischen Komplexität und Fragilität der Trikuspidalklappe fast ausschliessen das PASCAL Ace System in Frage (22). Vorläufige Resultate der aktuell laufenden Studien (CLASP TR und TRICLASP) bei Patienten mit schwerer TI zeigten nach 30 Tagen eine Abnahme der TI auf lediglich leicht bis mittelschwer bei 86% bis 90% (23, 24). Der enddiastolische RV-Durchmesser wurde signifikant reduziert, während das LV-Schlagvolumen sowie der funktionelle Status, die körperliche Leistungsfähigkeit und Lebensqualität signifikant verbessert werden konnten. Weitere prospektive, randomisierte Studien, die den TriClip und das Pascal-Device mit optimaler medikamentöser Therapie und alternativen Methoden vergleichen, sind geplant.
Annuloplastie: Cardioband (Edwards Lifesciences)
Die Annuloplastie ist heutzutage ein Standardverfahren in der herzchirurgischen Behandlung der TK-Rekonstruktion. Als Transkatheter-Therapie muss sich die Annuloplastie noch etablieren. Da es sich um eine annuläre Behandlung handelt, zielt sie prinzipiell eher auf die Pathologie assoziiert mit annulärer Dilatation ab. Katheter-basierte Annuloplastie-Systeme lassen sich in Ring- (direkt oder indirekt), nahtbasierte und nicht nahtbasierte Systeme unterteilen. Präinterventionell sind gefährdete Strukturen im Interventionsgebiet mit Bildgebung und Herzkatheter zu beurteilen; die rechte Koronararterie (RCA), das Erregungsleitungssystem (AV-Knoten und rechtes His-Bündel), sowie das Ostium des Koronarsinus. Das Cardioband besteht aus einem adaptierbaren Dacronband, die Grösse des Bandes wird anhand von CT-Messungen bestimmt. Dieses wird vorhofseitig am anterioren Anulus mittels multipler Anker fixiert. Zur Sicherheit wird ein Führungsdraht in die RCA platziert, um eine Verletzung zu vermeiden. Sobald alle Anker eingesetzt sind, wird das System vom Band gelöst und entfernt (22). Unter Studienbedingungen lag das Risiko für eine RCA-Perforation oder einer Komplikation, die eine Stentimplantation erforderte bei 15 % (25, 26).
Transkatheter Trikuspidalklappen-Implantation
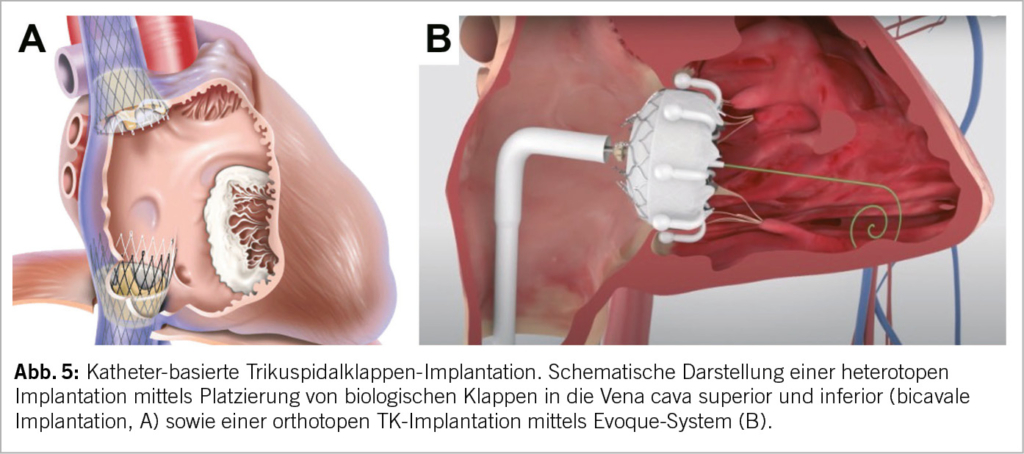
Die Transkatheter-TK-Implantation (Abb. 5) ermöglicht die Implantation einer biologischen Klappenprothese in TK-Position ohne den Einsatz einer HLM (Herz-Lungen-Maschine) und ohne chirurgischen Zugang (Sternotomie oder Thorakotomie). Grundsätzlich muss zwischen bereits operierten TK (nach Anuloplastie oder chirurgischem Trikuspidalklappenersatz) und nativen Klappen unterschieden werden: Valve-in-Valve-Eingriffe werden heute idR. mit Ballon-expandierbaren TAVI-Prothesen durchgeführt, welche ähnlich wie bei der Mitraklappe auch für die TK «zweckentfremdet» werden. Valve-in-Ring-Eingriffe sind allerdings bei der TK meist problematisch, da die implantierten chirurgischen Anuloplastie-Ringe idR nicht-geschlossen und uneben sind und daher kein gutes Widerlager für eine Katheter-gesteuerte Prothese darstellen.
Anspruchsvoller ist der orthotope Katheter-basierte Klappenersatz (Abb. 5B) bei der nativen TK. Die Verankerung der Prothese im Annulus ohne Beeinträchtigung der benachbarten anatomischen Strukturen (AV-Reizleitungs-System, RCA, Ostium des S. coronarius, etc.) bildet dabei die grösste Herausforderung. Unterschiedliche Modelle wurden in den letzten Jahren getestet. Aktuell am weitesten fortgeschritten ist das EVOQUE-System (Edwards Lifesciences). Diese selbst-expandierbare Bioprothese steht in verschiedenen Grössen zu Verfügung (44-52mm) und besteht aus Rinderperikard. Der Zugang erfolgt femoral-venös mittels Führungsdraht. Dieses Device weist eine geringe Radialkraft auf um schwere Reizleitungsstörungen oder RCA-Impingement zu vermeiden. Erste Resultate zeigen eine eindrückliche Reduktion der TI, in ca. 90% der Fälle auf leicht und weniger und eine erstaunlich tiefe 1-Jahres-Mortalität von 7-10% (21, 27).
Die EVOQUE ist die erste perkutan orthotop implantierbare Klappe, welche eine CE Zertifizierung für die Behandlung der TI bekommen hat (Oktober 2023).
Ein heterotoper Klappenersatz (Abb. 5A) ist bei schwer symptomatischen Patienten als palliativer Eingriff indiziert, bei denen alle anderen Verfahren ungeeignet oder mit zu hohem Risiko verbunden sind. Dabei erfolgt die Implantation der biologischen Klappen in die untere und/oder obere Hohlvene (uni- oder bikaval) ohne die TK selbst einzubeziehen. Der heterotope bikavale Trikuspidalklappen-Ersatz mittels TricValve (transcatheter bicaval valves system) führt zu einer akuten Reduktion der venösen Druckwerte und damit einer «Entstauung» im Systemkreislauf. Mittelfristig beobachtet man eine Verbesserung der Leistungsfähigkeit, der 6-min-Gehstrecke sowie ein rechtsventrikuläres Remodelling (28). Die TricValve ist ein seit Mai 2021 CE-zertifiziertes Medizinprodukt. Von Vorteil ist, dass diese unabhängig von der Morphologie der Trikuspidalklappe bzw. des Annulus oder des RV implantiert werden können. In der Tricus EURO-Studie konnte bei 35 Patienten eine 94%ige Erfolgsrate mit signifikanter Besserung der echokardiographischen Parameter, Verringerung des Lebervenenrückflusses und funktioneller Besserung gezeigt werden (28).
Bei hoher Gefahr einer Klappenthrombose infolge tiefer Druck- und Flussverhältnisse im rechten Herz ist nach Trikuspidalklappen-Implantation eine Antikoagulation indiziert (22).
Abkürzungen:
TI Trikuspidalinsuffizenz; LV Linker Ventrikel; RV Rechter Ventrikel; TK Trikuspidalklappe; ICD implantierbarer Kardioverter/Defibrillator; TTVI Transkatheter-Trikuspidalklappen-Eingriffe; TEER Transcatheter edge-to-edge valve repair; HLM Herz-Lungen-Maschine; TAVI Transkatheter-Aortenklappen-Implantation; TEE transösophageale Echokardiographie
Copyright bei Aerzteverlag medinfo AG
Herzklinik Hirslanden
Witellikerstrasse 40
8032 Zürich
HerzKlinik Hirslanden
Witellikerstrasse 40
8032 Zürich
HerzKlinik Hirslanden
Witellikerstrasse 40
8032 Zürich
Oliver.Gaemperli@hirslanden.ch
Die HerzKlinik Hirslanden wurde als erste Klinik in Europa als center of excellence für HeartTeam anerkannt und bietet entsprechende Workshops für nationale und internationale Herzklappenzentren.
Die Autoren erklären, dass dieser kurze Review unabhängig von kommerziellen oder finanziellen Beziehungen, die als potenzieller Interessenkonflikt ausgelegt werden könnten, durchgeführt wurde.
1. Topilsky Y, Maltais S, Medina Inojosa J, Oguz D, Michelena H, Maalouf J, et al. Burden of Tricuspid Regurgitation in Patients Diagnosed in the Community Setting. JACC Cardiovasc Imaging. 2019;12(3):433-42.
2. Wang N, Fulcher J, Abeysuriya N, McGrady M, Wilcox I, Celermajer D, Lal S. Tricuspid regurgitation is associated with increased mortality independent of pulmonary pressures and right heart failure: a systematic review and meta-analysis. Eur Heart J. 2019;40(5):476-84.
3. Henning RJ. Tricuspid valve regurgitation: current diagnosis and treatment. Am J Cardiovasc Dis. 2022;12(1):1-18.
4. Chorin E, Rozenbaum Z, Topilsky Y, Konigstein M, Ziv-Baran T, Richert E, et al. Tricuspid regurgitation and long-term clinical outcomes. Eur Heart J Cardiovasc Imaging. 2020;21(2):157-65.
5. Dreyfus J, Flagiello M, Bazire B, Eggenspieler F, Viau F, Riant E, et al. Isolated tricuspid valve surgery: impact of aetiology and clinical presentation on outcomes. Eur Heart J. 2020;41(45):4304-17.
6. Scotti A, Sturla M, Granada JF, Kodali SK, Coisne A, Mangieri A, et al. Outcomes of isolated tricuspid valve replacement: a systematic review and meta-analysis of 5,316 patients from 35 studies. EuroIntervention. 2022;18(10):840-51.
7. Taramasso M, Benfari G, van der Bijl P, Alessandrini H, Attinger-Toller A, Biasco L, et al. Transcatheter Versus Medical Treatment of Patients With Symptomatic Severe Tricuspid Regurgitation. J Am Coll Cardiol. 2019;74(24):2998-3008.
8. Wang X, Ma Y, Liu Z, Fan X, Guan G, Pan S, et al. Comparison of outcomes between transcatheter tricuspid valve repair and surgical tricuspid valve replacement or repair in patients with tricuspid insufficiency. J Cardiothorac Surg. 2023;18(1):170.
9. Dahou A, Levin D, Reisman M, Hahn RT. Anatomy and Physiology of the Tricuspid Valve. JACC Cardiovasc Imaging. 2019;12(3):458-68.
10. Yucel E, Bertrand PB, Churchill JL, Namasivayam M. The tricuspid valve in review: anatomy, pathophysiology and echocardiographic assessment with focus on functional tricuspid regurgitation. J Thorac Dis. 2020;12(5):2945-54.
11. Hahn RT, Weckbach LT, Noack T, Hamid N, Kitamura M, Bae R, et al. Proposal for a Standard Echocardiographic Tricuspid Valve Nomenclature. JACC Cardiovasc Imaging. 2021;14(7):1299-305.
12. Hahn RT, Zamorano JL. The need for a new tricuspid regurgitation grading scheme. Eur Heart J Cardiovasc Imaging. 2017;18(12):1342-3.
13. Hahn RT. Tricuspid Regurgitation. N Engl J Med. 2023;388(20):1876-91.
14. Rogers JH, Bolling SF. The tricuspid valve: current perspective and evolving management of tricuspid regurgitation. Circulation. 2009;119(20):2718-25.
15. Praz F, Muraru D, Kreidel F, Lurz P, Hahn RT, Delgado V, et al. Transcatheter treatment for tricuspid valve disease. EuroIntervention. 2021;17(10):791-808.
16. van den Enden AJM, Bastos MB, Schreuder JJ, Daemen J, Van Mieghem NM. Invasive Cardiomechanics During Transcatheter Edge-to-Edge Repair for Massive Tricuspid Regurgitation Using Biventricular Pressure-Volume Loop Monitoring. JACC Case Rep. 2021;3(18):1883-7.
17. Sannino A, Ilardi F, Hahn RT, Lancellotti P, Lurz P, Smith RL, et al. Clinical and Echocardiographic Outcomes of Transcatheter Tricuspid Valve Interventions: A Systematic Review and Meta-Analysis. Front Cardiovasc Med. 2022;9:919395.
18. Stolz L, Orban M, Besler C, Kresoja KP, Braun D, Doldi P, et al. Cardiohepatic Syndrome Is Associated With Poor Prognosis in Patients Undergoing Tricuspid Transcatheter Edge-to-Edge Valve Repair. JACC Cardiovasc Interv. 2022;15(2):179-89.
19. Mehr M, Taramasso M, Besler C, Ruf T, Connelly KA, Weber M, et al. 1-Year Outcomes After Edge-to-Edge Valve Repair for Symptomatic Tricuspid Regurgitation: Results From the TriValve Registry. JACC Cardiovasc Interv. 2019;12(15):1451-61.
20. Sorajja P, Whisenant B, Hamid N, Naik H, Makkar R, Tadros P, et al. Transcatheter Repair for Patients with Tricuspid Regurgitation. N Engl J Med. 2023;388(20):1833-42.
21. Webb JG, Chuang AM, Meier D, von Bardeleben RS, Kodali SK, Smith RL, et al. Transcatheter Tricuspid Valve Replacement With the EVOQUE System: 1-Year Outcomes of a Multicenter, First-in-Human Experience. JACC Cardiovasc Interv. 2022;15(5):481-91.
22. Blusztein DI, Hahn RT. New therapeutic approach for tricuspid regurgitation: Transcatheter tricuspid valve replacement or repair. Front Cardiovasc Med. 2023;10:1080101.
23. Kodali SK, Hahn RT, Davidson CJ, Narang A, Greenbaum A, Gleason P, et al. 1-Year Outcomes of Transcatheter Tricuspid Valve Repair. J Am Coll Cardiol. 2023;81(18):1766-76.
24. Baldus S, Schofer N, Hausleiter J, Friedrichs K, Lurz P, Luedike P, et al. Transcatheter valve repair of tricuspid regurgitation with the PASCAL system: TriCLASP study 30-day results. Catheter Cardiovasc Interv. 2022;100(7):1291-9.
25. van Rosendael PJ, Kamperidis V, Kong WK, van Rosendael AR, van der Kley F, Ajmone Marsan N, et al. Computed tomography for planning transcatheter tricuspid valve therapy. Eur Heart J. 2017;38(9):665-74.
26. Korber MI, Landendinger M, Gercek M, Beuthner BE, Friedrichs KP, Puls M, et al. Transcatheter Treatment of Secondary Tricuspid Regurgitation With Direct Annuloplasty: Results From a Multicenter Real-World Experience. Circ Cardiovasc Interv. 2021;14(8):e010019.
27. Kodali S, Hahn RT, George I, Davidson CJ, Narang A, Zahr F, et al. Transfemoral Tricuspid Valve Replacement in Patients With Tricuspid Regurgitation: TRISCEND Study 30-Day Results. JACC Cardiovasc Interv. 2022;15(5):471-80.
28. Estevez-Loureiro R, Sanchez-Recalde A, Amat-Santos IJ, Cruz-Gonzalez I, Baz JA, Pascual I, et al. 6-Month Outcomes of the TricValve System in Patients With Tricuspid Regurgitation: The TRICUS EURO Study. JACC Cardiovasc Interv. 2022;15(13):1366-77