Mit Inhalativa lassen sich Erkrankungen der Atemwege, v.a. Asthma und COPD, direkt erreichen. Durch die lokale Gabe werden systemische Nebenwirkungen der eingesetzten Medikamente drastisch reduziert. Es existieren ganz verschiedene Inhalationsformen, die in Abhängigkeit von den Bedürfnissen des Patienten und physikalischen Gegebenheiten ausgewählt werden müssen. Die Medikation richtet sich nach dem Krankheitsbild. Hier haben die Guidelines für Asthma (GINA) und die COPD (GOLD) in den letzten Jahren relevante Neuerungen vorgesehen, die jedem Hausarzt bewusst sein sollten. Ein wichtiger Faktor, der selbstdispensierenden Ärzten eine gewisse Begrenzung in der Wahl der Inhaler auferlegt, ist die Notwendigkeit, dass sich eine Praxis-Apotheke auf wenige Medikamente für ein Krankheitsbild beschränken muss.
Inhalatives can be used to directly treat respiratory diseases, especially asthma and COPD. Local administration drastically reduces the systemic side effects of the drugs used.There are various forms of inhalation, which must be selected depending on the needs of the patient and physical conditions. The medication depends on the clinical picture. Here the guidelines for asthma (GINA) and COPD (GOLD) have provided relevant innovations in recent years, which every family doctor should be aware of. An important factor that imposes a certain limitation on self-dispensing physicians in the choice of inhalers is the need for a practice pharmacy to limit itself to a few medications for one clinical picture.
Key Words: respiratory diseases, inhalation, asthma, COPD
Wie erreichen die Medikamente den Ort des Krankheitsgeschehens
Mit einer Schale heissen Kamillentees, über den der Kopf gehalten wurde, wurden früher Erkältungen der oberen Atemwege behandelt. Mit dem Verdampfen entstehen grosse Tröpfchen, die direkt nach dem Eindringen in die oberen Atemwege dort durch Impaktation deponiert werden. Ein modernes Inhalationssystem kann dagegen sehr feine Tröpfchen der Grösse von 1 bis 5 μm erzeugen. Beim Feuchtvernebler (z.B. Typ Pari Boy®) geschieht dies durch den Verneblungsdruck. Kleinste Tröpfchen/Partikel sind in der Lage, die peripheren Atemwege zu erreichen und werden dort teilweise sedimentiert. Dies erfordert Zeit, weshalb der Atem nach erfolgter tiefer Inspiration angehalten werden muss.
Die intrabronchiale Deposition hängt neben der Partikelgrösse auch von der inspiratorischen Stromstärke ab. Wird schnell und kräftig eingeatmet, was bei einem Pulverinhalator (PI) notwendig ist, damit feine Partikel entstehen können, ist der Anteil zentraler Deposition höher als bei einem modernen «in Lösung» Dosieraerosol (DA) oder einem soft-mist Inhaler (Typ Respimat®). Bei diesen wird die Vernebelung manuell aktiviert, nicht durch die Einatmung. Dies erlaubt eine sehr langsame Inhalation mit besserer peripherer Deposition.
Pro und Contra der verschiedenen Inhalationssysteme
Am Markt sind verschiedene Inhalationsformen vertreten, Pulverinhalatoren (PI), Dosieraerosole (DA), der soft-mist Inhaler Respimat® und Flüssigkeitsvernebler. Hier unterscheidet man konventionelle Feuchtvernebler von MeshVerneblern (Pari Velox®, Philips Innospire Go®).
Verschiedene Faktoren bewirken, dass beim einzelnen Patienten die eine oder die andere Inhalationsform zu favorisieren ist. Dies sind die auch altersabhängige Fähigkeit zur Kooperation bei der Inhalation, die inspiratorische Kraft, die Praktikabilität (Mitnahme im Alltag) und die Resistenz gegen Umwelteinflüsse (Hitze, Kälte).
Dosieraerosole existieren seit den 50er-Jahren des letzten Jahrhunderts, d.h. sind altbewährt, kostengünstig und relativ einfach zum Einnehmen. Neue DA mit dem Medikament in Lösung im Treibgas HFA (z.B. Alvesco®, Foster®) erzeugen sehr kleine Partikel mit guter Deposition in den kleinsten Atemwegen, was v.a. beim Asthma ein Vorteil sein kann. Entsprechend ist die laryngeale Deposition gering, so dass topische Kortikosteroide (ICS) in dieser Form seltener zu Mundsoor bzw. Heiserkeit führen. Bei konventionellen DA liegt eine Dispersion vor, d.h. vor dem Inhalieren muss das DA geschüttelt werden, damit das Medikament in Pulverform sich kurzzeitig gleichmässig im HFA verteilt. Ohne Schütteln würde nur das Treibgas vernebelt werden. Leider verstärkt HFA den Treibhauseffekt um ein Vielfaches mehr als CO2, so dass der Einsatz von DA aus diesen Gründen reduziert werden sollte. DA sind sehr kälteempfindlich. Schon bei Temperaturen <50, z.B. beim Wintersport, kann die Wirkung von DA ausbleiben (1).
Bei konventionellen DA sollte eine Vorschaltkammer vom Typ Aerochamber® blau mit Mundstück (bei Kindern >5 Jahre und Erwachsenen) zur Hilfe genommen werden. Damit lässt sich die sonst hohe laryngeale Deposition massiv reduzieren. Bei den «in Lösung» DA ist die Vorschaltkammer entbehrlich, ausser die Pa-tienten haben Probleme, die Auslösung des DA mit dem Beginn der Einatmung zu koordinieren. Bei einem Koordinationsproblem kann sogar ein soft mist Inhaler vom Typ Respimat® mit einer Aerochamber® versehen werden (2).
Pulverinhalatoren wurden vor ca. 60 Jahren eingeführt, zuerst monodose, später auch multidose Inhaler. Sie sind meist einfach zum Ein- und zum Mitnehmen. Bei Patienten, die ICS erhalten und beruflich auf die Stimme angewiesen sind, kann eine persistierende Heiserkeit aber limitierend sein. Bei PI ist zur Erzeugung feiner Partikel eine kräftige Inspiration nötig. Es existieren von manchen Herstellern dummies der PI (z.B. roter Turbuhaler®), mit dem beim individuellen Patienten geprüft werden kann, ob die inspiratorische Stromstärke für den jeweiligen Inhaler ausreichend ist. In der Exazerbation nimmt die Atemkraft oft ab, so dass aber bei Patienten mit bekannten Krisen schwerster Obstruktion für den Notfall ein DA, das auch einen schnell wirkenden Betastimulator enthält, zur Verfügung stehen sollte.
Der soft-mist Inhaler Respimat® ist mit flüssigem Medikament gefüllt. Durch eine halbe Drehung wird eine Feder gespannt. Bei der Freigabe der Feder durch Knopfdruck presst sie eine bemessene Dosis durch feinste Kanäle. Beim Wiederaustreten der Flüssigkeit entsteht eine sehr feine Aerosolwolke, die wie beim DA langsam eingeatmet werden kann. Da dem Medikament Reservepatronen beiliegen und kein HFA nötig ist, stellt dieses System auch im Hinblick auf den Umweltschutz ein Novum dar. Leider wurde bisher in der Schweiz keine Zulassung des Respimat® mit kurzwirkende Betastimulatoren bzw. ICS beantragt.
Feuchtvernebler haben in der Schweiz stark an Bedeutung verloren. Wichtige Medikamente existieren nicht in flüssiger Form. Die Inhalationszeiten sind lang, bei den MeshVerneblern allerdings etwas kürzer als bei Flüssigverneblern. Der Einsatz macht vor allem noch bei Kindern mit Asthma und bei cF-Patienten jeden Alters Sinn. Für die letzteren stehen Antibiotika (z.B Colistin und Tobramycin) zur Verfügung, die zur Exazerbationsprophylaxe bei einer Kolonisation der Atemwege mit Pseudomonas regelmässig inhaliert werden müssen.
Das Inhalationssystem bestimmt die Inhalationstechnik
Für jede korrekte Inhalation gilt, dass zuvor ausgeatmet wird, anschliessend tiefe Inspiration mit nachfolgendem Atemanhalten über 10 Sekunden. Mit Beginn des Inspirationsmanövers müssen DA bzw. soft-mist Inhaler zeitgleich aktiviert werden. Bei PI führt die Inspiration automatisch zur Freisetzung der Partikel. Vorteil davon ist, dass die Koordination von Aktivierung und Beginn der Inspiration entfällt. Auf der anderen Seite bedarf die Inhalation aus einem PI einen hohen Atemfluss mit teilweiser Deposition im Larynxbereich, und es besteht die Gefahr, dass bei akuter Obstruktion die Inspirationskraft reduziert ist, sodass das Pulver ungenügend freigesetzt wird.
Die korrekte Inhalation muss bei jedem Patienten instruiert und geübt werden. Es ist sinnvoll, wenn dafür Praxispersonal ausgebildet wird. Dem Patienten muss bewusst gemacht werden, dass die Inhalation mit dem PI kräftig und schnell erfolgen soll. Bei einem DA und soft mist Inhaler ist es dagegen wichtig, dass ganz langsam inspiriert wird. Insofern macht es Sinn, dass bei der Verordnung von mehr als einem Inhalativum eher ein Kombinationspräparat gewählt wird, möglichst nicht 2 Systeme, die eine unterschiedliche Inhalationstechnik erfordern.
Die einmalige Instruktion der Inhalationstechnik hat sich in der Praxis als ungenügend erwiesen. Bei wiederholten Konsultationen ist es deshalb wünschenswert, wenn die Patienten ihren Inhaler mitbringen und die Inhalation dem geschulten Personal demonstrieren. Die spezifische Inhalationstechnik für jedes hier erhältliche System lässt sich auf der Homepage der Lungenliga Schweiz (3) in Form von Videoclips anschauen und auch dem Patienten zeigen.
Wahl der Medikamente für den spezifischen Patienten
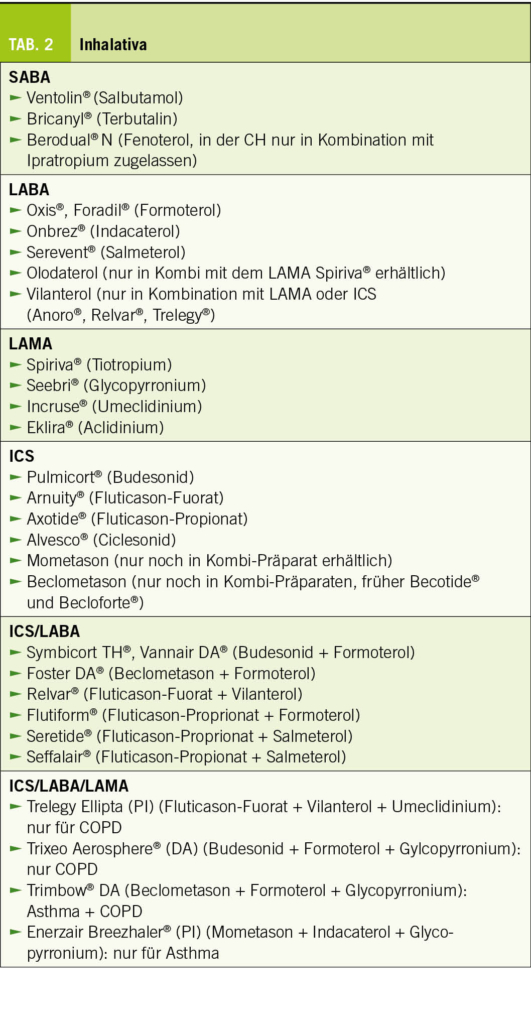
Da nicht alle Medikamente in den 4 möglichen Inhalationsformen zur Verfügung stehen, muss vor der Verordnung überlegt werden, was der am besten geeignete Inhaler für den Patienten sein könnte. Dann wird aufgrund des Krankheitsbildes und Schweregrades die richtige Substanz bzw. Kombination ausgewählt und geschaut, ob der gewünschte Inhaler überhaupt mit dem gewählten Medikament erhältlich ist. Anderenfalls ist ein Kompromiss unumgänglich.
Die Medikamente lassen sich in ICS, Betastimulatoren mit kurzer (SABA) bzw. langer Wirkungsdauer (LABA) und in die Anticholinergika (LAMA) unterteilen. Bei den LABA ist noch von Bedeutung, dass nur Formoterol einen ähnlich schnellen Wirkungseintritt wie Ventolin®, Bricanyl® oder Berotec® besitzt. Dies hat praktische Konsequenzen:
Die aktuellen Asthma-GINA-Guidelines (4) sehen neu in erster Linie bei allen 5 Schweregradstufen des Asthmas vor, dass der Notfall-Inhaler nicht mehr ein SABA ist, sondern ein Kombinationspräparat aus ICS/Formoterol (LABA), da SABA beim Asthma die Asthmakontrolle verschlechtern kann. Nur die folgenden beiden Kombinationspräparate wurden in Studien dafür getestet: Symbicort TH® (5) und Foster DA® (6). Bei leichtem Asthma wird diese Kombination in stabilen Phasen nur bei Bedarf eingesetzt. Beim mittelschweren und schweren Asthma kann das Medikament sowohl als Basis wie auch als Bedarfsmedikation verordnet werden. Der grosse Vorteil von Formoterol ist auch, dass es eine grosse therapeutische Breite besitzt. Die normale Menge Formoterol in einem Hub Symbicort TH® 200/6 beträgt 6μg. Kurzfristig darf jedoch die Tagesdosis auf maximal 72μg erhöht werden, d.h. auf 12 Hübe. Diese Therapieform trägt den Namen MART (maintenance and rescue therapy). ICS in Kombination mit dem schnell wirkenden Formoterol als MART haben auch einen weiteren Vorteil. Die Patienten dürfen ihrem natürlichen Bedürfnis entsprechen, in stabilen Phasen weniger zu inhalieren, merken aber bei massiver Dosiserhöhung im Rahmen des häufigeren Bedarfseinsatzes eine rasche Verbesserung einer beginnenden Exazerbation. Dies zeigt ihnen eine Selbstwirksamkeit ihres Handelns, was wiederum die langfristige Adhärenz verbessert.
Bei schwerem Asthma macht die Zugabe eines LAMA Sinn.
Auch im COPD GOLD-Update (7) hat es eine wichtige Veränderung gegeben. Über Jahre war von der Gabe von ICS bei COPD abgeraten worden, da diese die Pneumonie-Rate erhöhen können. In den letzten Jahren wurde jedoch viel Evidenz publik, dass die fürs Asthma typische eosinophile Entzündung auch bei COPD auftreten im Sinne einer Asthma-COPD Koexistenz (8). Neue Studien (9) zeigten dann auch klar, dass sich bei Patienten mit einer Bluteosinophilie von > 0.3 G/L mit einer alleinigen LAMA/LABA-Therapie das Exazerbationsrisiko erhöht. In dieser Situation stellten Pneumonien unter den ICS kein Problem dar. Das Pneumonie-Risiko steigt jedoch eindeutig, wenn man ICS bei Eosinophilenwerten < 0.1 G/L verordnet (10). In der gelben Zone mit Eosinophilen > 0.1 und < 0.3 G/L kann bei gehäuften Exazerbationen ein Therapieversuch unternommen werden.
Die Chance, eine Eosinophilie zu finden, ist in der Exazerbation, noch vor Gabe oraler Kortikosteroide, am höchsten. Da die meisten Praxis-Coulter die Eosinophilen nicht getrennt zählen, müssen diese Blutbilder separat in externe Labors gesandt werden.
Copyright bei Aerzteverlag medinfo AG
Chefarzt Pneumologie a.i.
Kantonsspital Graubünden
7000 Chur
thomas.rothe@ksgr.ch
Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Rothe T, Fronkova A, Pein T, Latshang TD. Physikalische und klinische Aspekte der Inhalations-therapie bei Asthma und COPD. PRAXIS 2020; 109: 1-6
2. Wachtel H, Nagel M, Engel M et al. In vitro and clinical characterization of the valved holding chamber AeroChamber Plus for administering tiotropium Respimat® in 1-5-year-old children with persistent asthmatic symptoms. Resp Med 2018; 137: 181-90
3. https://www.lungenliga.ch/de/krankheiten-ihre-folgen/asthma/richtig-inhalieren.html
4. www.ginasthma.org
5. Bateman E, Reddel H, O’Byrne et al. As needed budesonide-formoterol versus maintenance budesonide in mild asthma. N Engl J Med 2018; 378: 1877-87
6. Papi A, Corradi M, Pigeon-Francisco M et al. Beclometasone-formoterol as
maintenance and reliever therapy in patients with asthma: a double-blind,
randomised controlled trial. Lancet Respir Med. 2013; 1: 23-31
7. www.copdgold.org
8. Miratvitlles M, Alvarez-Guitierrez F, Calle M et al. Algorithm for identification of asthma COPD overlap. Eur Respir J 2017; 49: 1700068 [https://doi.org/10.1183/13993003.00068-2017]
9. Lipson DA et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. NEJM 2018; 3: 1671-80
10. Martinez-Garcia MA et al. Inhaled Steroids, Circulating Eosinophils, Chronic
Airway Infection, and Pneumonia Risk in Chronic Obstructive Pulmonary Disease. A Network Analysis. J Respir Crit Care Med 2020; 201: 1078-85