Die chronische Pankreatitis ist mit einer erheblichen Beeinträchtigung der Lebensqualität verbunden. Männer sind häufiger betroffen als Frauen, und der Höhepunkt liegt zwischen 45 und 72 Jahren. Alkohol und Tabak sind die wichtigsten modifizierbaren Risikofaktoren. Das Leitsymptom ist der chronische, rezidivierende, postprandiale Oberbauchschmerz. Das komplexe Krankheitsbild rechtfertigt eine jährliche oder noch engmaschigere Überwachung. Im vorliegenden Artikel wird auf die Klinik, die Diagnostik und das Management der chronischen Pankreatitis eingegangen.
Chronic pancreatitis is associated with significant impairment of quality of life. Men are more commonly affected than women, and the peak age is between 45 and 72 years. Alcohol and tobacco are the main modifiable risk factors. The leading symptom is chronic, recurrent, postprandial upper abdominal pain. The complex clinical picture warrants annual or even closer monitoring. In this article, we review the clinic, diagnosis, and management of chronic pancreatitis.
Key Words: Chronic pancreatitis, gastroenterology, upper abdominal pain
Die chronische Pankreatitis ist ein relevantes Krankheitsbild sowohl für die hausärztliche als auch die gastroenterologische Praxis und geht mit einer deutlichen Reduktion der Lebensqualität und -erwartung einher. Männer sind häufiger betroffen als Frauen und der Höhepunkt liegt zwischen dem 45.-72. Lebensjahr (1). Die chronische Pankreatitis sollte von der akuten wie auch von der rezidivierenden akuten Pankreatitis unterschieden werden, bei welchen definitionsgemäss keine Zeichen der chronischen Pankreatitis vorliegen.
Ätiologie und Pathogenese
Der Begriff der chronischen Pankreatitis beschreibt einen langsamen irreversiblen Schaden des Pankreasparenchyms infolge eines anhaltenden oder schrittweise, irreversiblen fibroinflammatorischen Prozesses mit typischen klinischen und morphologischen Mustern. Alkohol und Tabak sind die wichtigsten beeinflussbaren Risikofaktoren, sehr wahrscheinlich sind weitere prädisponierende Genetik- und Umweltfaktoren mitverantwortlich (2). Seltenere Ursachen sind unter anderem die Autoimmunpankreatitis, der primäre Hyperparathyroidismus, die zystische Fibrose oder ein frühes Malignom. Die biliäre Genese, also Choledocholithiasis oder Sludge, konnte als Ursache für die chronische Pankreatitis nicht belegt werden. In 9 bis zu 60% aller Fälle kann keine Ursache identifiziert werden (3).
In 21% der Fälle kommt es nach dem ersten Schub einer akuten Pankreatitis zu erneuten akuten Schüben und darauffolgend in 36% zur chronischen Pankreatitis (1).
Klinik
Sobald die typische Klinik und Noxen erkennbar sind, sollte eine chronische Pankreatitis in Erwägung gezogen werden. Das Leitsymptom sind chronische, rezidivierende, postprandiale, typische gürtelförmige Oberbauchschmerzen (2).
Ein wichtiges Problem ist die Malnutrition und der Gewichtsverlust, welche oft Ausdruck der exokrinen Pankreainsuffizienz sind. Klinische Merkmale sind Zeichen der Mangelernährung, Gewichtsverlust und Steatorrhö. Ein weiterer Co-Faktor der Malnutrition ist oft auch der Lebensstil mit schlechten Ernährungsgewohnheiten kombiniert mit Alkohol- und Nikotinkonsum.
Die endokrine Insuffizienz hingegen zeigt sich als pankreopriven Diabetes mellitus.
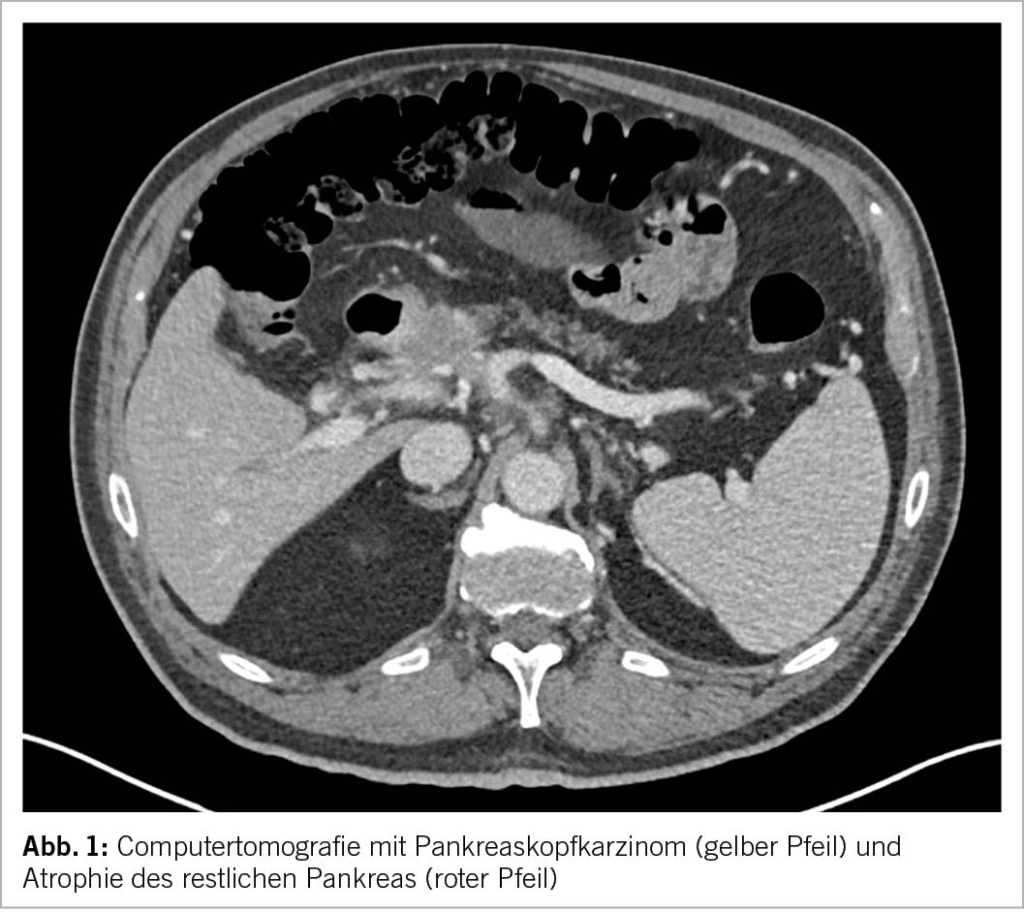
Das Risiko für ein Adenokarzinom des Pankreas (Abb. 1) als schwerwiegendste Komplikation und Differentialdiagnose ist deutlich erhöht (4). Beispielsweise fünf Jahre nach Diagnosestellung der chronischen Pankreatitis ist das Karzinomrisiko achtfach erhöht (5). Ein Pankreaskarzinom Screening ist ausser bei der hereditären chronischen Pankreatitis oder positiven Familienanamnese für Pankreaskarzinom jedoch nicht empfohlen (6). Treten B-Symptome, Ikterus oder eine neue exo- oder endokrine Insuffizienz auf, sollte aktiv mittels Schichtbildgebung ein Karzinom gesucht werden.
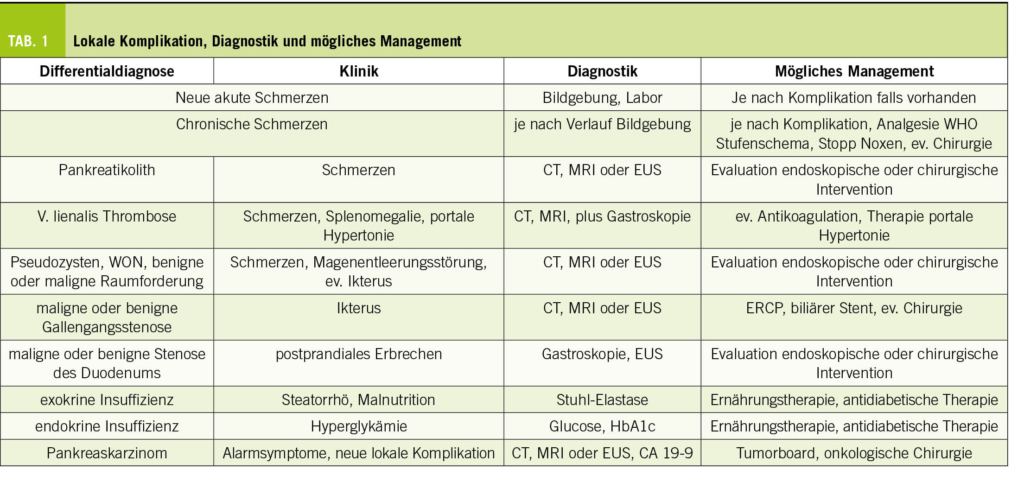
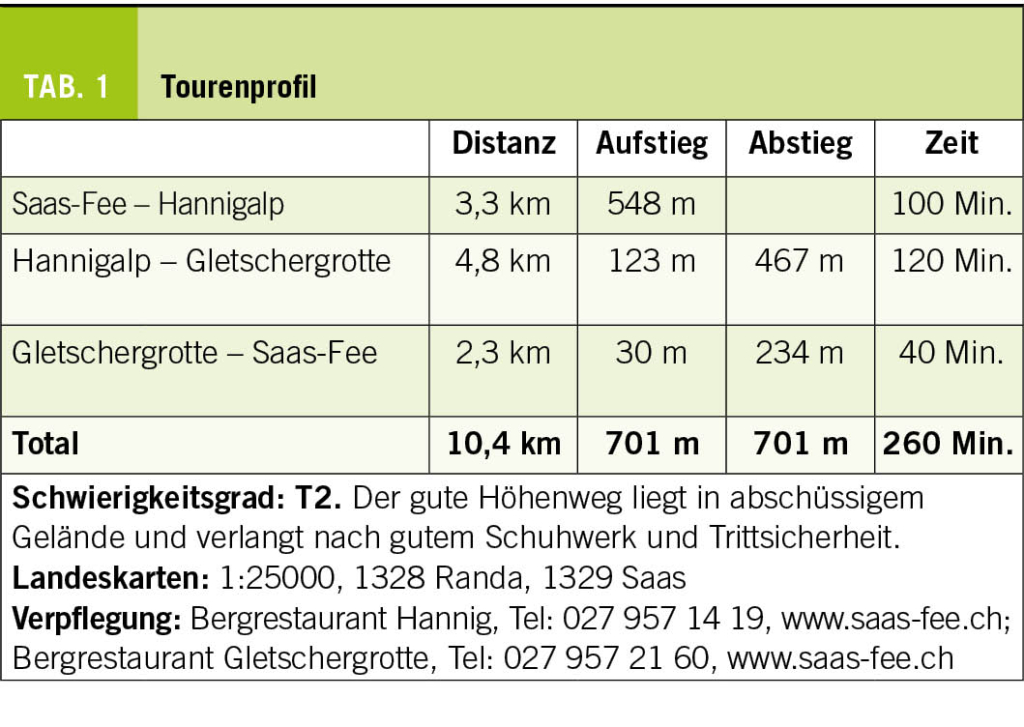
Weitere wichtige lokale Komplikationen sind in der Tabelle 1 zusammengefasst.
Diagnostik
Bei der Anamnese sollten die pankreastypischen Beschwerden gezielt gefragt werden und eine Quantifizierung der Noxen sowie des Gewichtsverlaufes erfolgen. Weiter sind Voroperationen wie z.B. Cholezytektomie, eine stattgehabte Pankreatitis und die Familienanamnese interessant. In der klinischen Untersuchung sollte auf einen Ikterus und die Malnutrition geachtet werden, palpatorisch wird eine Raumforderung der Pankreasloge, die Splenomegalie oder Umgehungskreisläufe gesucht.
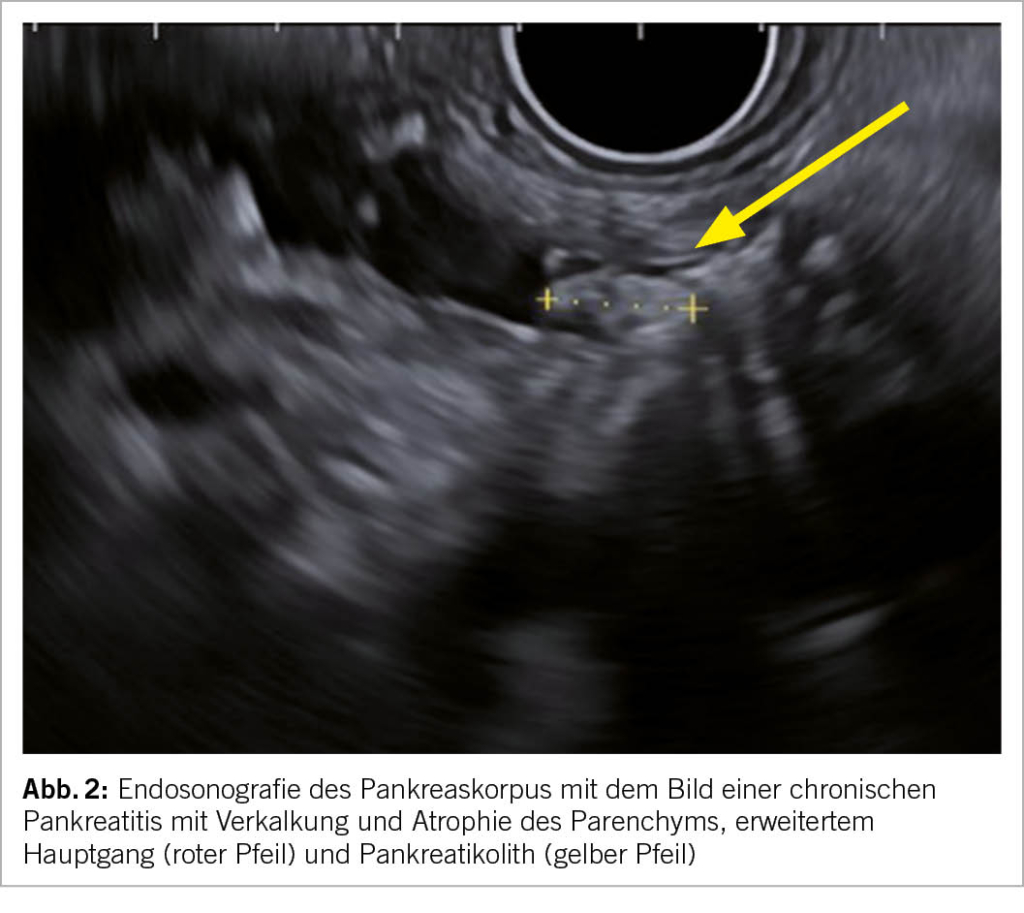
Die Bildgebung ist eine der wichtigsten Bestandteile der Diagnostik. Die Verfahren der Wahl mit hoher Spezifizität und Sensitivität sind die Endosonografie (Endoskopischer Ultraschall, Abk. EUS, Bild 2), die Computertomografie (Abk. CT, Abb. 3) und die Magnetresonanztomografie (Abk. MRI). Die transabdominale Sonografie kann das Pankreas leider häufig nur ungenügend darstellen, dient aber als kostengünstige und breit verfügbare initiale Untersuchung. Die Zeichen der chronischen Pankreatitis bestehen u.a.
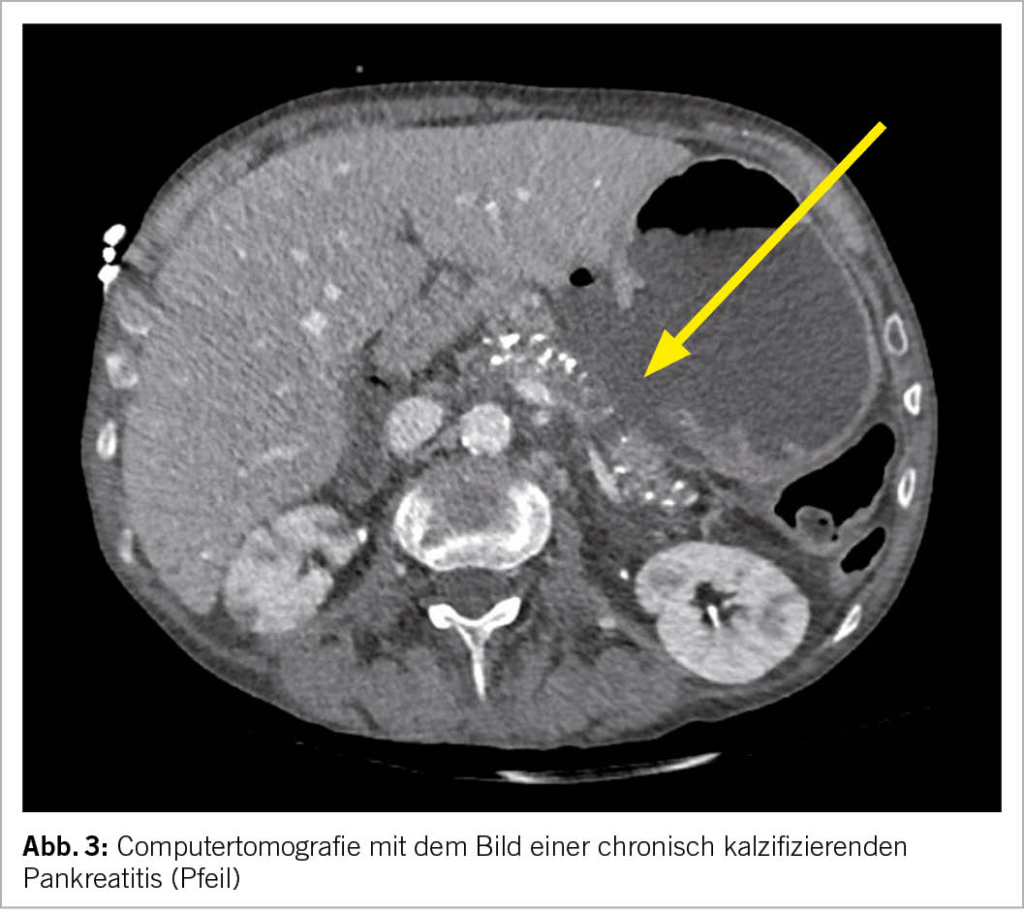
aus einem erweiterten, irregulären Hauptgang, Pankreatikolithen (Abb. 2), Verkalkungen (Abb. 3), hyperechogene Foci und Septen, lobuliertes Parenchym, Atrophie (Abb. 3) und ev. lokale Komplikationen (Tab. 1).
Alle bildgebenden Methoden haben ihre Vor- und Nachteile und sollten idealerweise mit einer Fachperson je nach Fragestellung vorbesprochen werden, um Doppeluntersuchungen zu vermeiden. Die EUS eignet sich v.a. zur Detektion früher Stadien der chronischen Pankreatitis. Suspekte Befunde können diagnostisch punktiert werden und lokale Komplikationen wie Pseudozysten oder Walled-off Nekrosen können endoskopisch behandelt werden. Die CT stellt Kalk (Abb. 3) äusserst zuverlässig dar. Falls der Verdacht auf Pankreaskarzinom besteht, sollte zwecks Beurteilung der Resektabilität ein spezifisches Pankreasprotokoll sowie eine Thorax-CT angemeldet werden. Das MR empfiehlt sich mit dem MRCP Zusatzprotokoll, um den Gallen- und Pankreasgang darzustellen.
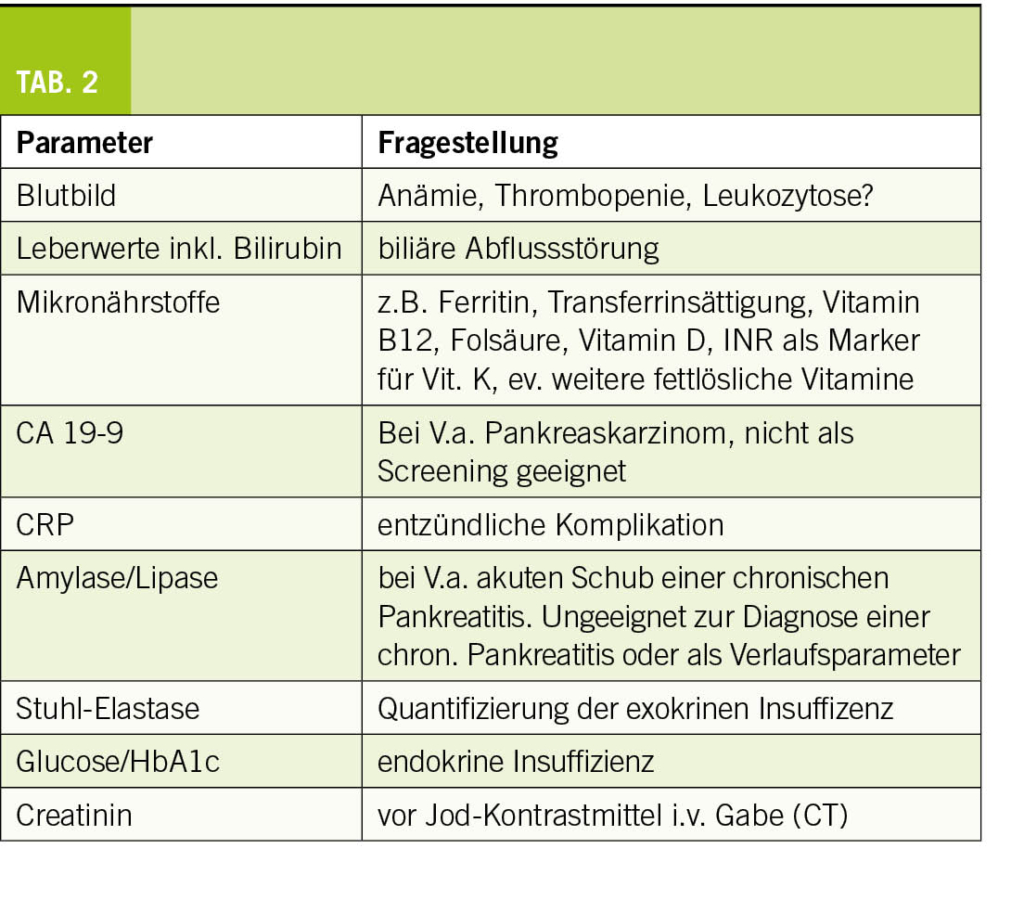
Bitte beachten Sie die Tabelle 2 mit den möglichen Laborparametern für eine Kontrolluntersuchung in der Praxis.
Management
- Die anhaltende Abstinenz von Alkohol und Tabak stehen an erster Stelle, um die Prognose und die Schmerzen günstig zu beeinflussen und die Patienten sollten niederschwellig in einem professionellen Rahmen suchtmedizinisch oder psychiatrisch begleitet werden. Die Substitution von Enzymen beeinflusst die Schmerzen nicht direkt (2) und sollte im Allgemeinen nicht primär zur Schmerztherapie eingesetzt werden. Dies gilt nicht, falls die Schmerzen im Zusammenhang mit der Malabsorption stehen (3).
- Zur Schmerztherapie kann das WHO-Stufenschema angewendet werden. Falls opiatbedürftige Schmerzen ohne erklärende neue lokale Komplikation entstehen, sollte nach neueren Daten innert weniger Monaten nach Beginn der Opiattherapie eine chirurgische Therapie diskutiert werden, um die Schmerzen längerfristig positiv zu beeinflussen (7). Auch im Falle einer fehlenden Besserung nach endoskopischer Therapie sollte eine chirurgische Therapie in Betracht gezogen werden. Ein invasives Verfahren sollte bei lokalen Komplikationen meistens nur gewählt werden, wenn dies Beschwerden verursacht. So besteht beispielsweise bei einem erweiterten Pankreashauptgang mit Pankreatikolithen ohne Schmerzen oder weitere Komplikationen keine Indikation zur invasiven Therapie (3).
- Die Beurteilung und das Management von relevanten Komplikationen sollten in einem Zentrumsspital interdisziplinär mit einer interventionellen Endoskopie, Pankreaschirurgie und interventionellen Radiologie beurteilt werden. Je nach Problem ist teils auch ein direktes chirurgisches Verfahren geeignet. Ein Pankreaskarzinom wird gemäss den üblichen onkologischen Richtlinien behandelt.
- Falls eine exokrine Insuffizienz mittels Zeichen der Malnutrition, Steatorrhö und erniedrigter Stuhl-Elastase objektiviert werden kann, ist die Indikation zur Ernährungstherapie und Pankreas-Enzym-Substitution gestellt (8). Gemäss Spezialitätenliste (9) des Bundesamtes für Gesundheit der in der Schweiz häufig eingesetzten Präparate Creon© oder Panzytrat© wird als Limitatio die «Nachgewiesene, schwere exokrine Pankreasinsuffizienz» gefordert. Dies geschieht in der Praxis üblicherweise über den Nachweis einer pathologisch tiefen Stuhlelastase. Die Anfangsdosis sollte ca 50’000 Einheiten pro Hauptmahlzeit und die Hälfte zu kleineren Mahlzeiten betragen. Die erste Kapsel soll mit dem ersten Biss eingenommen werden, eine allfällige zweite Kapsel in der Hälfte der Mahlzeit. Der Erfolg und die Dosierung dieser Therapie wird überwacht anhand Gewichtsverlauf, Ernährungszustand, Steatorrhö, Maldigestion-bedingten Schmerzen und der Mikronährstoffe. Bei ungenügender Wirkung sollte die korrekte Einnahme sichergestellt werden und die Dosis verdoppelt werden, ggf. Protonenpumpenblocker hinzugefügt werden (3). Trotz Einsatz einer Enzymsubstitution sollte ein Defizit an Mikronährstoffen gezielt substituiert werden. Im Falle einer exokrinen Insuffizenz ist eine Osteodensitometrie grosszügig empfohlen.
- Dieses komplexe Krankheitsbild rechtfertigt eine jährliche oder noch engere Kontrolle (2) mit:
– Quantifzierung, Beratung und Therapie hinsichtlich Noxen
– Symptome, Ernährungszustand, Ernährungsweise
– je nach Klinik Laborkontrolle (Tab. 2)
– exokrine und endokrine Insuffizienz
Falls eine neue Komplikation oder eine relevante Verschlechterung der Klinik auftreten, sollte grosszügig eine neue Bildgebung evaluiert werden.
Copyright bei Aerzteverlag medinfo AG
Kantonsspital St. Gallen
Klinik für Gastroenterologie und Hepatologie
9007 St. Gallen
Klinik für Gastroenterologie/Hepatologie
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Petrov MS. Global epidemiology and holistic prevention of pancreatitis. Nat Rev Gastroenterol Hepatol 2019;16(3):175–184
2. Beyer G. Chronic Pancreatitis. Lancet 2020;396(10249):499-512
3. Beyer G. S3-Leitlinie Pankreatitis. Z Gastroenterol 2022;60:419-521
4. Lowenfels AB. Pancreatitis and the risk of pancreatic cancer. International Pancreatitis Study Group. NEJM 1993, 328 (20):1433-1437
5. Kirkegard J. Chronic Pancreatitis and Pancreatic Cancer Risk: A Systematic Review and Meta-analysis. American Journal of Gastroenterology 2017;112 (9):1366-1372
6. Goggins. Management of patients with increased risk for familial pancreatic cancer: updated recommendations from the International Cancer of the Pancreas Screening (CAPS) Consortium. Gut. 2020; 69: 7–17
7. Issa Y. Effect of Early Surgery vs Endoscopy-First Approach on Pain in Patients With Chronic Pancreatitis: The ESCAPE Randomized Clinical Trial. JAMA 2020; 232 (3):237-247
8. Löhr M. United European Gastroenterology evidence-based guidelines for the diagnosis and therapy of chronic pancreatitis. United European Gastroenterol J. 2017; 5(2):153-199
9. https://www.spezialitätenliste.ch/ShowPreparations.aspx, abgerufen am 14.4.2023