La prévalence de l’ hypothyroïdie augmente avec l’ âge. Chez la personne âgée, la présentation clinique peut être trompeuse en raison de manifestations non spécifiques, de comorbidités, ainsi que d’ effets indésirables et interactions de certains médicaments. L’ hypothyroïdie manifeste nécessite un traitement par lévothyroxine, notamment en raison de son impact sur les systèmes cardiovasculaire et neurologique, et sur le métabolisme intermédiaire et osseux. Il existe toutefois une controverse persistante si le traitement de l’ hypothyroïdie subclinique est bénéfique.
The prevalence of hypothyroidism increases with age. In older adults, the clinical presentation can be deceptive because of nonspecific manifestations, comorbidities, as well as adverse effects and interactions of certain medications. Overt hypothyroidism requires therapy with levothyroxine, in particular because of the impact on the cardiovascular and neurological systems, and intermediary and bone metabolism. There is ongoing controversy whether the treatment of subclinical hypothyroidism is beneficial.
Key Words: hypothyroidism, older, amiodarone, levothyroxine
Les dysfonctions thyroïdiennes sont fréquentes avec une augmentation de la prévalence de l’ hypothyroïdie chez les individus de >65 ans (1,2). La prévalence de l’ hypothyroïdie en Europe, tout âge confondu, est d’ environ 3 %, avec une proportion plus élevée chez les femmes et une majorité d’ atteinte subclinique (3). Les patients avec une hypothyroïdie subclinique sont à risque de développer une hypothyroïdie manifeste avec une progression annuelle moyenne de 2 à 4 %. Ce risque est accru pour certains patients : les femmes, les patients avec anticorps anti-thyroperoxydase (TPO) positifs, et plus le taux de TSH est élevé (1).
En raison du vieillissement de la population, il est essentiel de connaître les changements physiologiques de la glande thyroïde, les étiologies principales, ainsi que la prise en charge chez la personne âgée.
Physiologie de la thyroïde
Les hormones thyroïdiennes sont essentielles pour le développement, la croissance ainsi que le métabolisme basal. Durant le vieillissement, des changements anatomiques et hormonaux sont subis par la thyroïde. Sur le plan anatomique, on constate une atrophie de la glande, une diminution de la taille des follicules et du contenu en colloïde, ainsi qu’ une augmentation de la fibrose (4). Une augmentation en taille de la glande est également possible, en raison de l’ incidence plus élevée de maladie thyroïdienne nodulaire chez la personne âgée (5). Sur le plan hormonal, la TSH augmente avec l’ âge (6,7). Le taux de T4 libre (T4l) tend à rester dans la norme. Le taux de T3 libre (T3l) quant à lui présente un déclin avec le vieillissement (8).
Diagnostic et dépistage chez la personne âgée
Le diagnostic repose sur le dosage des paramètres thyroïdiens dans le sérum. L’ hypothyroïdie primaire se traduit par une augmentation de la TSH avec une T4l abaissée (hypothyroïdie manifeste) ou dans la norme (hypothyroïdie subclinique). L’ hypothyroïdie subclinique peut être classifiée en deux catégories : modérée avec TSH entre 4 et 10 mU/l et sévère avec TSH >10 mU/l. Le dosage des anticorps anti-TPO et anti-thyroglobuline permet d’ identifier les patients atteints de thyroïdite auto-immune. Les recommandations de dépistage de dysfonction thyroïdienne chez la personne âgée de la Société Française d’ Endocrinologie (9) sont résumées dans le Tableau 1.
Étiologies
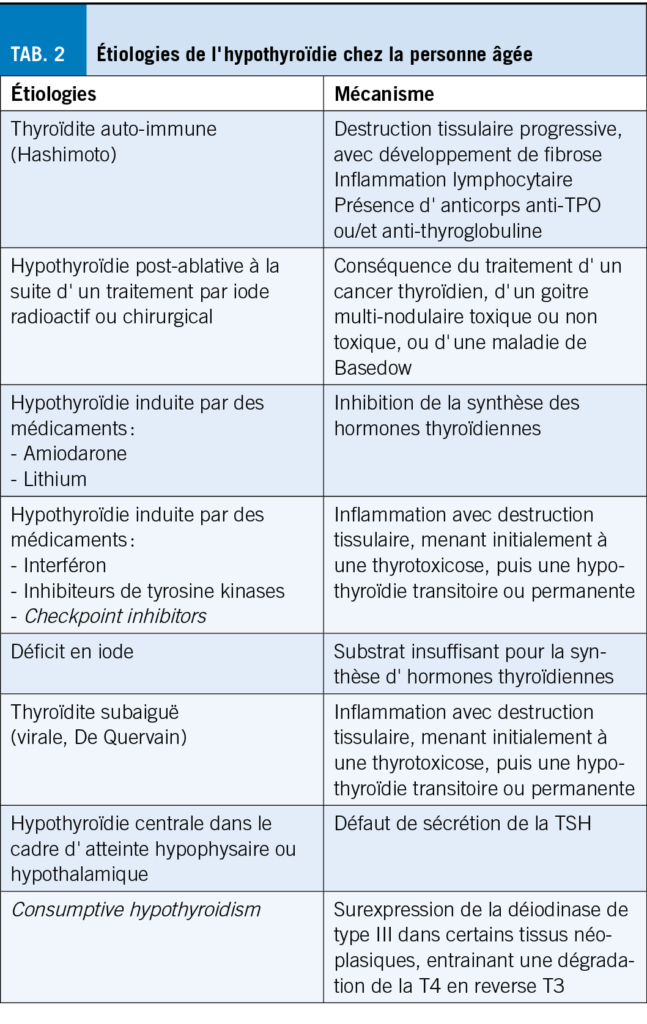
Les étiologies principales sont résumées dans le Tableau 2. La thyroïdite auto-immune (thyroïdite de Hashimoto) est la cause la plus fréquente d’ hypothyroïdie primaire (10,11). Les causes transitoires d’ hypothyroïdie sont essentielles à identifier afin de ne pas surtraiter les patients. Il est important de savoir que les inhibiteurs de tyrosine kinases ainsi que les checkpoint inhibitors (inhibiteurs de points de contrôle immunitaire) peuvent entraîner un dysfonctionnement thyroïdien, généralement avec une thyrotoxicose initiale due à une thyroïdite destructrice, suivie d’ une hypothyroïdie.
Dysfonctionnements thyroïdiens secondaire à un traitement par amiodarone
L’ amiodarone est un anti-arythmique de classe III utilisé pour le traitement d’ arythmies cardiaques, dont la fibrillation auriculaire (12,13,14). L’ amiodarone contient deux atomes d’ iode par molécule et 200 mg d’ amiodarone contiennent 75 mg d’ iode total. Le métabolisme hépatique libère environ 6 mg de ces 75 mg dans la circulation (près de 40 fois plus que les besoins quotidiens de 150 µg). Dans des conditions d’ apport nutritionnel adéquat en iode, jusqu’ à 20 % des patients traités par l’ amiodarone peuvent développer une hypothyroïdie et environ 3 % une hyperthyroïdie (15).
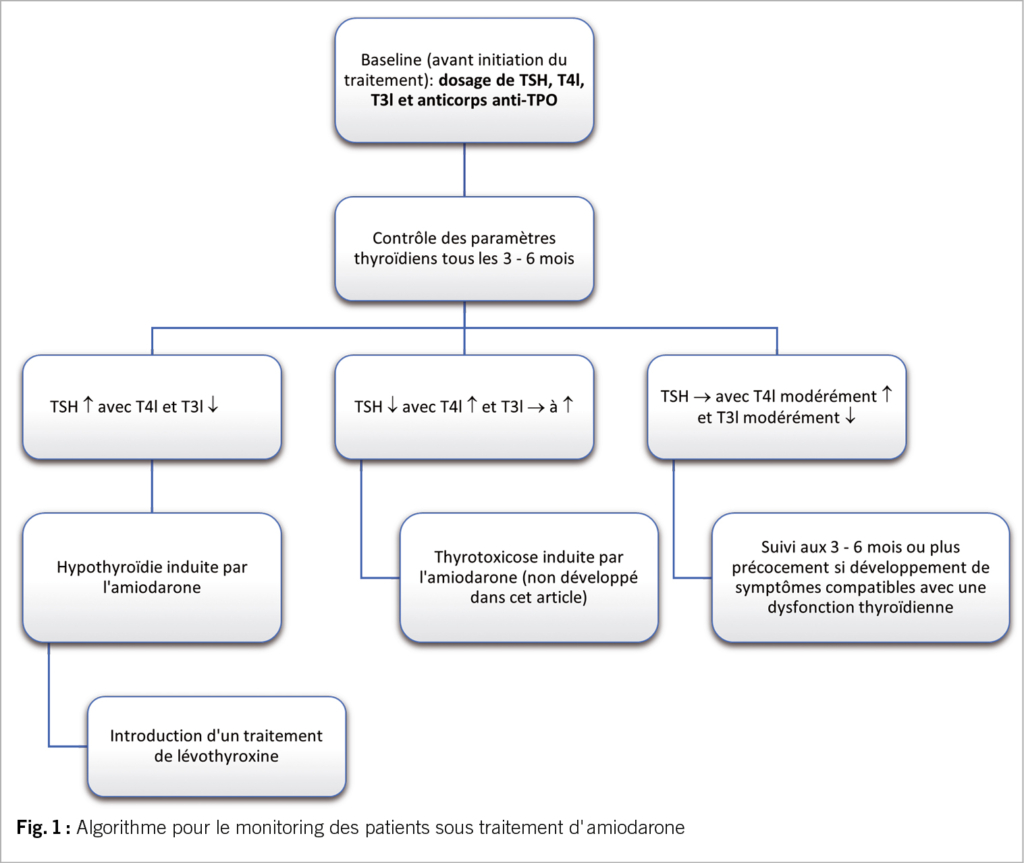
L’ amiodarone cause des altérations du bilan thyroïdien, avec augmentation modérée de la T4l, diminution de la T3l, et légère élévation de la TSH au début de la thérapie qui revient généralement aux valeurs de base. Ces changements sont causés, au moins en partie, par une inhibition de l’ activité des déiodinases de type I et II qui catalysent la conversion de T4l en T3l dans les tissus périphériques et au niveau hypophysaire. De plus, en raison de l’ apport excessif en iode par l’ amiodarone, un phénomène de protection, nommé effet Wolff-Chaikoff, se met en place avec pour but de réduire transitoirement la synthèse d’ hormones thyroïdiennes par inhibition de l’ organification de l’ iode intra-thyroïdien. L’ hypothyroïdie sur amiodarone est la conséquence d’ un défaut d’ adaptation à ce mécanisme d’ autorégulation, ce qui va amener à une suppression persistante de la synthèse hormonale. Ce risque est augmenté si une atteinte auto-immune est présente. Le profil thyroïdien est alors typiquement le suivant : TSH ↑, T4l ↓, T3l ↓. Le développement d’ une hypothyroïdie n’ est pas une contre-indication à la poursuite du traitement par amiodarone et une substitution par lévothyroxine doit être introduite (12,13,14,15). La Figure 1 propose un algorithme pour le monitoring des patients sous amiodarone. La thyrotoxciose associée à une thérapie avec amiodarone n’est pas discutée dans cet article.
Syndrome de T3 basse / Non-Thyroidal Illness Syndrome (NTIS)
Les personnes âgées ont fréquemment des comorbidités, avec un risque de NTIS (16), également appelé syndrome de T3 basse ou euthyroid sick syndrome, fréquemment retrouvé dans le cadre de maladie aiguë sévère. Il se caractérise par les modifications biologiques suivantes : T3 totale ↓, T3l ↓, reverse T3 ↑, TSH → ou anormalement ↓, T4 totale → à ↓, T4l → à ↓, selon la durée de la pathologie. Une diminution à la fois de T4 et de T3 est un marqueur prédictif d’ un risque accru de mortalité (17). Ces changements ne sont pas en lien avec une maladie thyroïdienne primaire mais en relation avec la maladie sous-jacente et l’ état nutritionnel. Il s’ agit d’ une réponse adaptative/protectrice dont la physiopathologie reste mal élucidée (18). Les valeurs biologiques lors d’ un dépistage sont donc à interpréter en tenant compte des comorbidités et de l’ état nutritionnel.
Manifestations cliniques
Les manifestations cliniques d’ hypothyroïdie chez la personne âgée sont souvent non spécifiques, voire absentes, ce qui peut retarder le diagnostic. Les symptômes les plus fréquemment rencontrés sont une asthénie et une faiblesse. De plus, ces patients peuvent souffrir de constipation, d’ inappétence et d’ intolérance au froid. Les manifestations cliniques classiques comprennent la bradycardie, l’ hypertension diastolique, un retard de la phase de relaxation des réflexes périphériques, des œdèmes, une peau sèche et rêche, et une perte de cheveux accrue.
Impact de l’ hypothyroïdie chez la personne âgée
Système cardio-vasculaire
L’ hypothyroïdie manifeste a un impact sur le système cardio-vasculaire avec diminution de l’ output cardiaque, augmentation de la résistance vasculaire et risque de dyslipidémie avec développement d’ athérosclérose. Il y a également un risque accru d’ insuffisance cardiaque (19) et de mortalité cardio-vasculaire (20). L’ implication de l’ hypothyroïdie subclinique dans le développement d’ une insuffisance cardiaque est incertaine. The Cardiovascular Health Study, une étude prospective incluant 4200 patients euthyroïdiens et 680 patients avec hypothyroïdie subclinique, âgés de > 65 ans, n’ a pas montré d’ association entre l’ hypothyroïdie subclinique et l’ insuffisance cardiaque durant un suivi de 10 ans, quel que soit le taux de TSH (21). Cependant, d’ autres études retrouvent une augmentation du risque d’ insuffisance cardiaque, âge-dépendante, avec une TSH >10 mU/l (22).
Système neuropsychiatrique
L’ hypothyroïdie manifeste impacte l’ humeur (ralentissement de la pensée, diminution de l’ attention, apathie, dépression), ainsi que la cognition (mémoire, langage, fonction psychomotrice, fonction exécutive) (23). Le rôle de l’ hypothyroïdie subclinique est moins clair et les données ne sont pas concluantes.
Système musculo-squelettique
Plusieurs études ont démontré une incidence plus élevée de fractures dans le cadre d’ hypothyroïdie manifeste (24, 25). Cependant, d’ autres études (HUNT2) n’ ont pas confirmé ces observations (26). L’ hypothyroïdie peut être associée à une capsulite rétractile, un syndrome du tunnel carpien, une contracture de Dupuytren ou une fibromyalgie (27), ainsi que des symptômes neuromusculaires tel que myalgies, crampes et faiblesse (28).
Thérapie
L’ indication à l’ initiation d’ un traitement pour une hypothyroïdie manifeste est acceptée à l’ unanimité en raison de son impact sur les systèmes cardiovasculaire, neurologique et osseux. Les recommandations de l’ American Thyroid Association (29) sont résumées dans le Tableau 3. La cible de TSH se situe dans la limite supérieure de la norme chez la personne âgée.
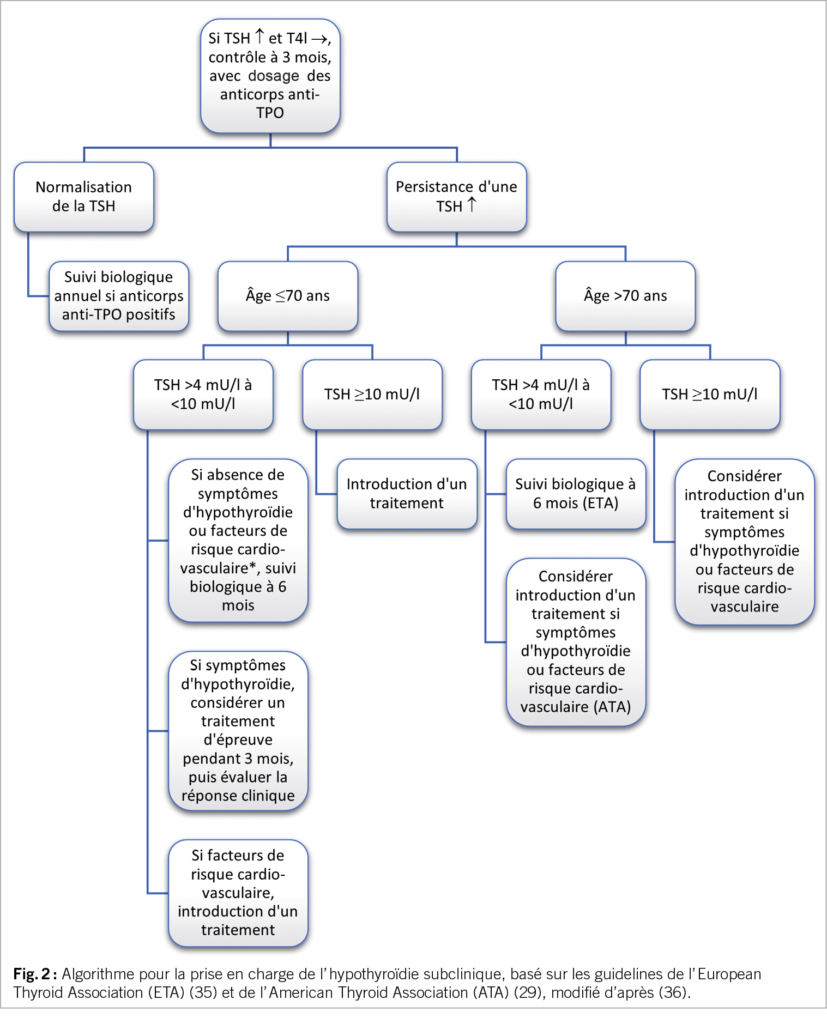
En revanche, l’ introduction d’ un traitement substitutif dans le cadre d’ une hypothyroïdie subclinique reste débattue (30). En premier lieu, il est important de s’ assurer que l’ hypothyroïdie subclinique est persistante et non transitoire (31).
L’ étude TRUST, une étude randomisée contrôlée en double aveugle, de 737 adultes de >65 ans avec une hypothyroïdie subclinique persistante, n’ a pas montré d’ effet bénéfique de l’ introduction d’ une substitution en termes de symptômes d’ hypothyroïdie, force de préhension, tension artérielle, et indice de masse corporelle, entre autres (32). De plus, la Leiden 85+ Study a démontré que les individus de >85 ans, avec une TSH élevée, n’ avaient pas d’ augmentation de symptômes dépressifs, de troubles cognitifs ou d’ incapacité dans la vie quotidienne (33). Remarquablement, des taux élevés de TSH étaient associés à une diminution de la mortalité. En outre, l’ augmentation de la TSH a été suggéré comme un marqueur de longévité dans certaines populations (34). L’ utilité de l’ introduction d’ une substitution chez les patients très âgés (>80-85 ans) reste à déterminer. Une approche pour la prise en charge de l’ hypothyroïdie subclinique, en se basant sur les recommandations des sociétés européennes et américaines, est résumée dans la Figure 2.
Conclusion
La prise en charge des dysfonctions thyroïdiennes chez la personne âgée doit tenir compte de nombreux facteurs tels que la fragilité de la population, les comorbidités, les interactions médicamenteuses ou encore les changements physiologiques de la thyroïde durant le vieillissement. Une modification des valeurs biologiques est fréquemment rencontrée chez la personne âgée et n’ est pas toujours considérée comme pathologique mais peut être propre au vieillissement.
L’ initiation d’ un traitement substitutif dans le cadre d’ une hypothyroïdie manifeste est indiquée en raison de son impact sur de multiples organes. Cependant, le défi se trouve dans les situations d’ hypothyroïdie subclinique, pour lesquelles la nécessité de traitement chez la personne âgée reste débattue et doit être personnalisé en fonction de plusieurs facteurs, tels que le taux de TSH, l’ âge du patient et les comorbidités.
Copyright Aerzteverlag medinfo AG
Service d’ endocrinologie, diabétologie et métabolisme
CHUV | Centre hospitalier universitaire vaudois
Université de Lausanne, Hôtel des patients
Avenue de la Sallaz 08
1011 Lausanne
elisa.gijs@chuv.ch
Service d’ endocrinologie, diabétologie et métabolisme
CHUV | Centre hospitalier universitaire vaudois
Université de Lausanne, Hôtel des patients
Avenue de la Sallaz 08
1011 Lausanne
peter.kopp@chuv.ch
Les auteurs n’ont pas déclaré de conflits d’ intérêts en rapport avec cet article.