In den letzten Jahren hat es eine historische Veränderung in der Behandlung von Typ-2-Diabetespatienten mit albuminurischer diabetischer Nephropathie gegeben. Tatsächlich wurden zwischen 2019 und 2022 qualitativ hochwertige randomisierte kontrollierte Studien veröffentlicht, die den Behandlungsalgorithmus verändert haben (1,2). Ziel dieses Artikels ist es, den aktuellen Stand in Bezug auf die diabetische Nephropathie erneut darzustellen.
In recent years, there has been a historic shift in the treatment of type 2 diabetes patients with albuminuria and diabetic nephropathy. In fact, high-quality randomised controlled trials have been published between 2019 and 2022 that have changed the treatment algorithm (1,2). The aim of this article is to reevaluate the current status with regard to diabetic nephropathy.
Key Words: albuminuria, diabetic nephropathy, type 2 diabetes
Epidemiologie und Screening
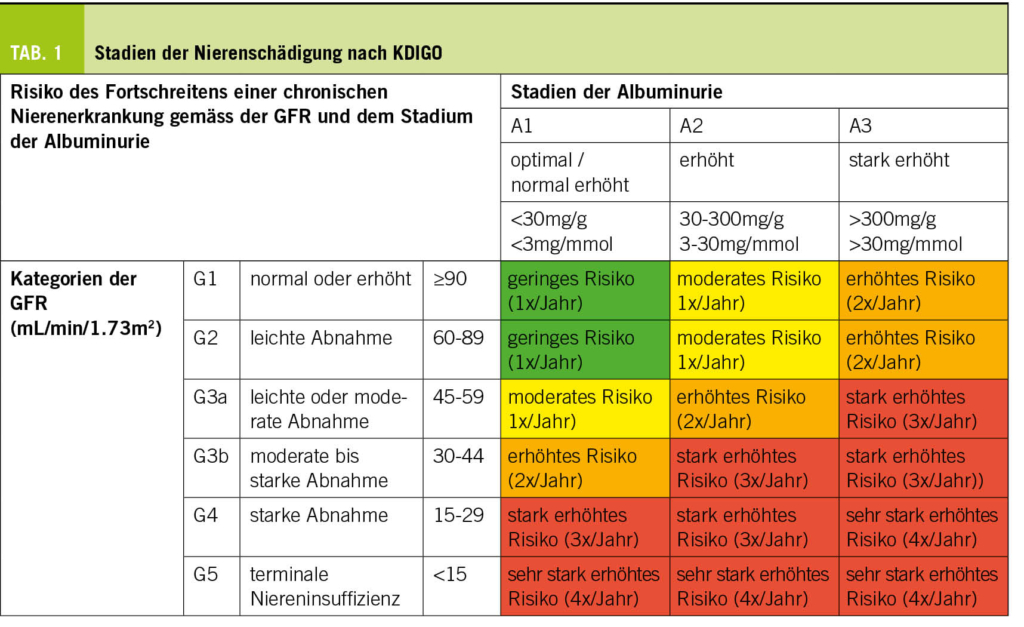
Die Prävalenz der diabetischen Nephropathie nimmt aufgrund der Alterung der Bevölkerung und der steigenden Prävalenz von Typ-2-Diabetes zu. Der Hausarzt und der Diabetologe stehen beim Screening auf diabetische Nephropathie weiterhin an vorderster Front. Eine jährliche Beurteilung mit einer Schätzung der glomerulären Filtrationsrate (eGFR nach CKD-EPI basierend auf Kreatinin) und einem Albumin/Kreatinin-Verhältnis im Urin auf einem Spot wird bei allen erwachsenen Diabetikern empfohlen. Ein Stix oder Urinsediment wird zur Vervollständigung dieser Untersuchung durchgeführt und bei pathologischem Sediment wird nach anderen Ursachen für eine Nierenschädigung gesucht. Die Häufigkeit der Kontrollen wird bei Personen, die bereits eine Nephropathie haben, erhöht (Tab.1). Von einer chronischen Nierenerkrankung spricht man bei einer eGFR < 60ml/min/Jahr und/oder bei einer Albuminurie im Stadium A2-A3. Je nach Alter kann diese Einteilung jedoch verfeinert werden (wenn Alter <40 Jahre <75ml/min/1.73 m2, wenn Alter >65 Jahre <45ml/min/1.73 m2). Letztendlich weist jeder Patient mit einer Albuminurie im Stadium A3 eine beschleunigte Abnahme der Nierenfunktion auf und benötigt eine intensive multifaktorielle Betreuung (Kontrolle des Blutzuckers, des Blutdrucks, der Lipide, des Gewichts, des Tabakkonsums, der Therapietreue …).
Algorithmus für die Behandlung
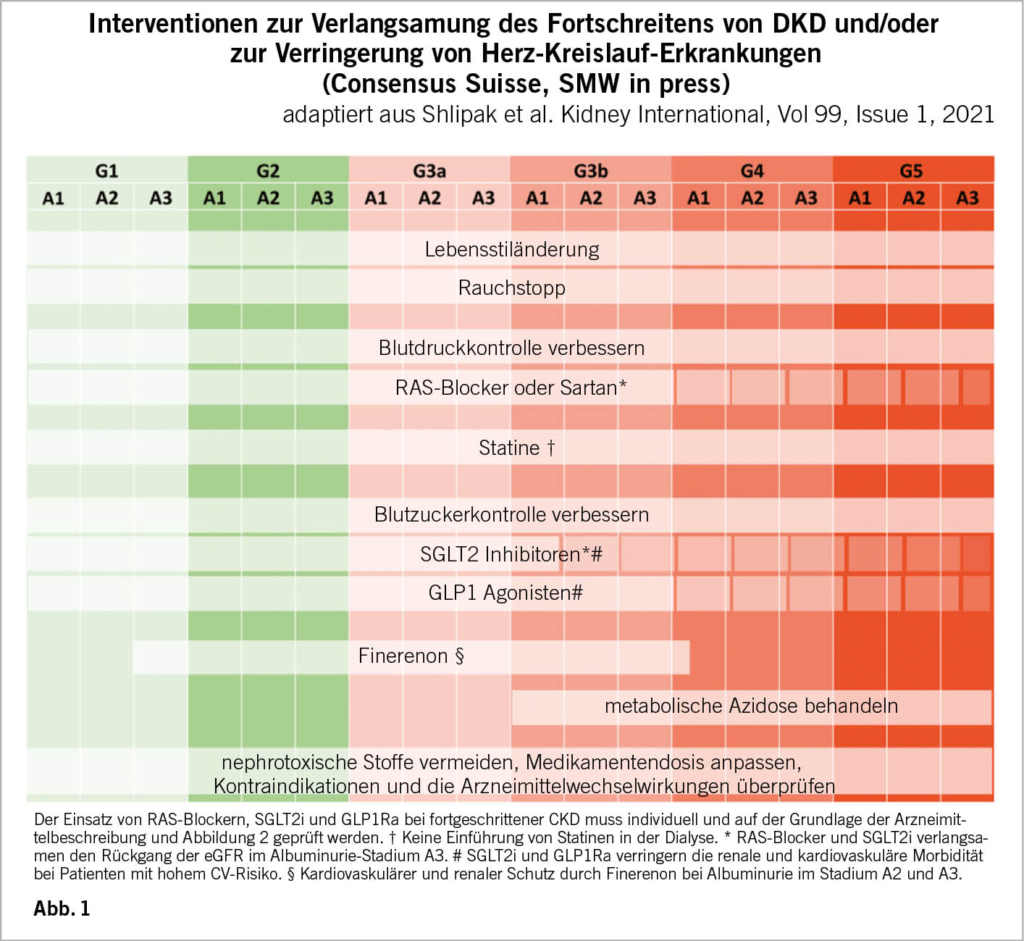
Die Behandlung von Patienten mit diabetischer Nephropathie ist vielfältig und komplex. Ein Schweizer Konsensus zur diabetischen Nephropathie fasst das aktuelle Wissen und das therapeutische Management detailliert zusammen (Abb.1) (2). Es gibt einfache Messwerte (Blutzucker, Blutdruck, Lipide) sowie Ziele für den Nierenschutz (ACE-Hemmer oder Sartan, SGLT2i, Finerenon). Wichtig ist, andere Ursachen für eine Nierenschädigung auszuschliessen und den Patienten im Zweifelsfall an einen Nephrologen zu überweisen. Das Behandlungsziel besteht darin, die Lebensqualität zu verbessern und gleichzeitig den Rückgang der Nierenfunktion zu verlangsamen und das kardiovaskuläre Risiko zu senken. Die überwiegende Mehrheit der Diabetespatienten mit Nephropathie wird an kardiovaskulären Erkrankungen sterben, bevor sie eine terminale Niereninsuffizienz erreichen. Manchmal ist ein multidisziplinäres Management erforderlich, das eine medizinische, pflegerische, diätetische, pharmakologische und podologische Betreuung umfasst. Die Verbesserung der Selbstversorgung und die Einhaltung der Behandlung sind ebenfalls Faktoren, die sich positiv auf die Prognose auswirken können.
Nephroprotektive Medikamente
ACE-Hemmer/Sartane: Die Blockade des Renin-Angiotensin-Systems durch ACE-Hemmer oder Sartane steht bei der Albuminurie-Nephropathie an erster Stelle. Studien, die über 20 Jahre zurückreichen, zeigen eine Verringerung der renalen Ereignisse. Ihre Kombination (ACE-Hemmer, Sartan, Reninhemmer) wird jedoch nicht vorgeschlagen, da die Studien eine Zunahme der Nebenwirkungen gezeigt haben. Eine Bestimmung von Kreatinin und Kaliämie wird 1-2 Wochen nach Beginn der Behandlung vorgeschlagen und bei einem Kreatininanstieg von mehr als 30% ausgesetzt. Ein erhöhter Kaliumwert macht die Suche nach anderen begünstigenden Ursachen wie NSAR, metabolische Azidose und kaliumreiche Ernährung nötig.
SGLT2-Inhibitoren (SGLT2i) (3-6): SGLTi induzieren eine Glukosurie, indem sie die renale Glukose-/Natrium-Rückresorption hemmen. Diese Medikamente verbessern die glykämische Kontrolle bei einer eGFR >45ml/min/1.72m2, verringern das Risiko einer Hospitalisierung wegen Herzinsuffizienz (bei einer eGFR >20ml/min/1.73m2) und verlangsamen den Rückgang der Nierenfunktion und der Albuminurie (bei einer eGFR >25ml/min/1.73m2). Die Einführung eines SGLT2i ab einem KDIGO G2A3-Stadium der Albuminurie kann das Auftreten einer terminalen Niereninsuffizienz um mehr als 10 Jahre verzögern. Diese mittelpreisigen Medikamente werden einmal täglich oral eingenommen. Die Verträglichkeit ist in den meisten Fällen gut. Dennoch ist es wichtig, den Patienten über die Nebenwirkungen aufzuklären, insbesondere über das Risiko einer Genitalmykose (5-10% Risiko) und die Bedeutung einer guten Hydratation. Ihre Anwendung ist bei Typ-1-Diabetikern aufgrund des Risikos einer Ketoazidose derzeit kontraindiziert. Bei Typ-2-Diabetikern ist dieses Risiko gering, sollte aber bei Bauchschmerzen/Übelkeit gesucht werden. Schließlich wird, wie bei Blockern des Renin-Angiotensin-Systems, eine Kontrolle des Kreatinin-/Kaliumspiegels 1-2 Wochen nach Einführung eines SGLT2i bei Personen mit Nierenschäden oder akutem Nierenversagen in der Vorgeschichte empfohlen. Es ist anzumerken, dass neuere Analysen eine Verringerung des Risikos für akutes Nierenversagen und Hyperkaliämie unter SGLT2i zeigen.
Finerenon (7-9): Finerenon ist ein nichtsteroidaler Mineralokortikoid-Rezeptor-Antagonist (MRA). Es unterscheidet sich von den steroidalen MRAs (Aldacton, Eplerenon) dadurch, dass es keine sexuellen Nebenwirkungen hat. Es ist der erste MRA mit nachgewiesener Nephro- und Kardioprotektion bei Typ-2-Diabetespatienten mit albuminöser Nephropathie. Das Risiko einer Hyperkaliämie ist hingegen ein limitierender Faktor, diese Behandlung kann bei einem Kaliumwert ≤4.8mmol/l nicht eingeführt werden und erfordert ein häufiges Monitoring mit Rücknahme bei einem Kaliumwert über 5.5mmol/l. Seine Verwendung bei Diabetespatienten mit Nierenschäden (bis zu 25ml/min/1.73m2) ist von Swissmedic anerkannt, über den Preis wird jedoch noch verhandelt. Aufgrund der Fülle an positiven Studien mit SGLT2i wird Finerenon als zweite Wahl nach der Einführung von SGLT2i eingesetzt werden. Auch wenn es an Studien mangelt, könnte ihre Kombination mit synergistischen Effekten und einer Verringerung des Hyperkaliämie-Risikos interessant sein.
Therapeutische Zielvorgaben
Blutzuckerkontrolle: Zur Primärprävention der diabetischen Nephropathie wird ein Zielwert von HbA1c <6,5-7% empfohlen. Ab einer eGFR<60ml/min können die Zielwerte gelockert werden, da das Hypoglykämierisiko bei Nierenschäden und einer Behandlung mit Insulin, Sulfonylharnstoffen oder Gliniden steigt. Ein älterer Dialysepatient mit einer begrenzten Lebenserwartung wird einen Zielwert von <8,5% haben. Bei Personen mit einer Albuminurie-Nephropathie werden zwar vorrangig SGLT2i gewählt, aber diese Behandlung wird nicht immer ausreichen, um eine gute Blutzuckerkontrolle zu erreichen. Bei einem BMI von über 28 kg/m2 werden GLP1a vorgeschlagen, da es einen kardiovaskulären Schutz bietet und das Fortschreiten der Albuminurie verlangsamt. Die Kombination von GLP1a und SGLT2i erfordert jedoch eine vorherige Genehmigung der Krankenversicherung.
Blutdruckkontrolle: Bei Diabetikern im Alter von 18-64 Jahren ist das Ziel ein systolischer Blutdruck von 130mmHg in der Praxis oder niedriger, wenn dies toleriert wird. Bei Personen ab 65 Jahren ist der Zielwert ein systolischer Blutdruck von 130-139mmHg. Bei einer Nierenschädigung liegt der Zielwert bei 130-139mmHg, wenn toleriert, mit einem Zielwert für den diastolischen Blutdruck von 70-79mmHg.
Lipidkontrolle: Bei Diabetes und Nierenschädigung (nicht dialysiert, nach KDIGO >G3b oder G3aA2 oder A3) wird das kardiovaskuläre Risiko als sehr hoch eingestuft. In diesem Fall ist das erste Ziel ein LDL-Cholesterin <1,8mmol/L mit 50% Reduktion. In einem zweiten Schritt wird ein Zielwert <1,4mmol/L vorgeschlagen, vor allem bei nachgewiesener kardiovaskulärer Erkrankung. Statine bleiben die erste Wahl bei diabetischer Nephropathie.
Bilanz der Komplikationen
Sobald eine signifikante Nierenschädigung vorliegt, wird eine umfangreichere Bilanzierung von Komplikationen vorgeschlagen, die auch die Bilanzierung von Anämie, metabolischer Azidose und Phosphor-Kalzium-Bilanz umfasst. Bei Veränderungen ist eine enge Zusammenarbeit mit dem Nephrologen angezeigt.
Schlussfolgerungen
Es gibt mittlerweile neue Therapien, die bei der albuminurischen diabetischen Nephropathie wirksam sind, wie SGLT2i und Finerenon. Diese neuen Therapien senken das Nieren- und Herzrisiko bei diesen Hochrisikopatienten. Die Behandlung dieser Patienten ist komplex, muss multifaktoriell und multidisziplinär sein und eine therapeutische Begleitung beinhalten, um die Therapietreue zu verbessern.
Übersetzung aus «la gazette médicale» 02-2023
Copyright bei Aerzteverlag medinfo AG
Abteilung für Endokrinologie, Diabetologie und Stoffwechsel
Abteilung für Nephrologie, Centre hospitalier universitaire vaudois (CHUV)
Rue du Bugnon 17
1011 Lausanne
Die Autorin hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. ElSayed NA, Aleppo G, Aroda VR, Bannuru RR, Brown FM, Bruemmer D,
Collins BS, Hilliard ME, Isaacs D, Johnson EL, et al. 11. Chronic Kidney Disease and Risk Management: Standards of Care in Diabetes-2023. Diabetes Care. 2023;46:S191-S202.
2. Zanchi A, Jehle AW, Lamine F, Vogt B, Czerlau C, Bilz S, Seeger H and de Seigneux S. Diabetic kidney disease in type 2 diabetes: a consensus statement from the Swiss Societies of Diabetes and Nephrology. Swiss Med Wkly. 2023;153:40004.
3. Perkovic V, Jardine MJ, Neal B, Bompoint S, Heerspink HJL, Charytan DM, Edwards R, Agarwal R, Bakris G, Bull S, et al. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med. 2019.
4. Heerspink HJL, Stefansson BV, Correa-Rotter R, Chertow GM, Greene T, Hou FF, Mann JFE, McMurray JJV, Lindberg M, Rossing P, et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2020;383:1436-1446.
5. The E-KCG, Herrington WG, Staplin N, Wanner C, Green JB, Hauske SJ, Emberson JR, Preiss D, Judge P, Mayne KJ, et al. Empagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2023;388:117-127.
6. Nuffield Department of Population Health Renal Studies G and Consortium SiM-AC-RT. Impact of diabetes on the effects of sodium glucose co-transporter-2 inhibitors on kidney outcomes: collaborative meta-analysis of large placebo-controlled trials. Lancet. 2022;400:1788-1801.
7. Bakris GL, Agarwal R, Anker SD, Pitt B, Ruilope LM, Rossing P, Kolkhof P, Nowack C, Schloemer P, Joseph A, et al. Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes. N Engl J Med. 2020;383:2219-2229.
8. Rossing P, Filippatos G, Agarwal R, Anker SD, Pitt B, Ruilope LM, Chan JCN, Kooy A, McCafferty K, Schernthaner G, et al. Finerenone in Predominantly Advanced CKD and Type 2 Diabetes With or Without Sodium-Glucose Cotransporter-2 Inhibitor Therapy. Kidney Int Rep. 2022;7:36-45.
9. Pitt B, Filippatos G, Agarwal R, Anker SD, Bakris GL, Rossing P, Joseph A, Kolkhof P, Nowack C, Schloemer P, et al. Cardiovascular Events with Finerenone in Kidney Disease and Type 2 Diabetes. N Engl J Med. 2021;385:2252-2263.