Die Sarkoidose ist eine akut oder chronisch verlaufende entzündliche Multisystemerkrankung unklarer Ätiologie. Bei über 80% der Patienten kommt es zu einer intrathorakalen Manifestation. Die Diagnosestellung basiert auf dem Nachweis von epitheloidzelligen Granulomen, dem Ausschluss anderer Granulomatosen und dem klinischen Erscheinungsbild – kann aber nicht selten herausfordernd sein. Nach einem Screening für einen möglichen Befall weiterer Organe empfiehlt sich eine interdisziplinäre Festlegung der Therapie und des Nachsorgeschemas. Eine Systemtherapie ist bei symptomatischen Patienten mit relevanten Organmanifestationen bzw. -funktionsstörungen indiziert. Neben Kortikosteroiden stehen weitere immunsuppressive Medikamente zur Verfügung. Unter anderen haben die TNF-α-Inhibitoren – insbesondere Infliximab oder Adalimumab – eine günstige Wirkung auf die Sardoidose-assoziierte Entzündung und Granulombildung; sie sind aber nicht für diese Indikation zugelassen. Der Krankheitsverlauf ist in den meisten Fällen günstig. Schwere Verläufe sind möglich, insbesondere bei Herz-/ZNS-Befall, pulmonaler Hypertonie, progredienter Fibrosierung der Lunge und/oder komplikativen Aspergillomen. Ein schwer zu beeinflussendes Problem kann auch ein – gelegentlich invalidisierendes – Sarkoidose-assoziiertes Chronic Fatigue Syndrome darstellen.
Sarcoidosis is an acute or chronic inflammatory multisystem disease with an unclear etiology. Intrathoracic manifestations occur in over 80% of patients. When a diagnosis of sarcoidosis is made, the therapy is focused on suppressing the overly inflammatory response. Therapy is indicated only for symptomatic patients with severe organ manifestations or dysfunction. Treatment and monitoring options are ideally discussed at a dedicated interdisciplinary decision board. In addition to corticosteroids, various immunosuppressive drugs are available. Among others, TNF-α inhibitors – especially infliximab or adalimumab – have a beneficial effect on inflammation, but consist of an off-label therapy. In most cases, the course of the disease is moderate to mild. A severe course of disease is possible in case of heart/CNS involvement, pulmonary hypertension, progressive pulmonary fibrosis and/or aspergilloma. A difficult to manage situation includes the occurrence of a sarcoidosis-associated chronic fatigue syndrome.
Key Words: Sarcoidosis, therapy options, corticosteroidc, TNF-α inhibitors, fatigue
Definition
Sarkoidose ist eine lokale oder systemisch-entzündliche Erkrankung mit bisher unbekannter Ätiologie, die sich durch das Auftreten charakteristischer Gewebeveränderungen in Form von epitheloid-zelligen Granulomen in Lymphknoten, Lunge, Augen, Leber, Herz und Haut manifestiert.
Epidemiologie
Sarkoidose hat eine Inzidenz und Prävalenz, die weltweit je nach geografischer Region, Alter, Geschlecht und ethnischer Zugehörigkeit variiert. Die höchste Inzidenz findet sich in skandinavischen Ländern (11–24 Fälle pro 100’000 Personen pro Jahr) und bei Afroamerikanern (18–71 Fälle pro 100’000 Personen pro Jahr). Die niedrigste Inzidenz wurde in asiatischen Ländern festgestellt (1 Fall pro 100’000 Personen pro Jahr) (1). Die Inzidenz in der Schweiz wurde mit 7 pro 100’000 Personen pro Jahr angegeben (2). Meist tritt die Erkrankung im jüngeren Erwachsenenalter auf. Die Erstmanifestation einer Sarkoidose tritt selten bei Kindern und älteren Menschen auf.
Klinik
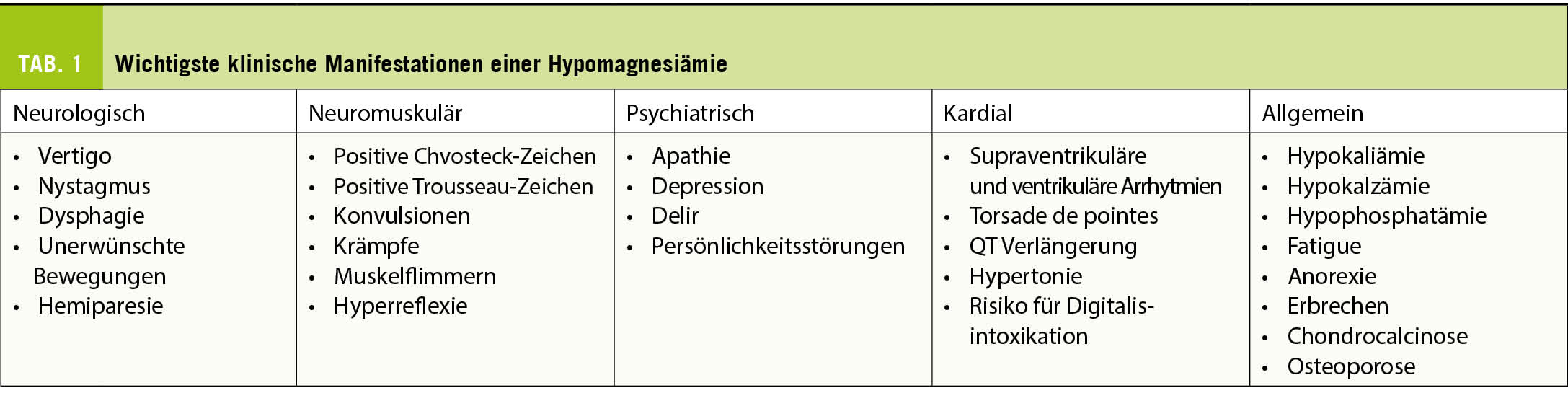
Die Sarkoidose als Multisystemerkrankung kann sich je nach Muster des Organbefalls mit diversen Symptomen manifestieren. Sie wird je nach Krankheitsbeginn (akut oder schleichend), Krankheitsverlauf (selbstlimitierend, chronisch-stabil oder chronisch-progressiv) und grössere Organbeteiligung charakterisiert (1). Zu den schwersten und potenziell lebensbedrohlichen Organmanifestationen zählen die pulmonale, kardiale und CNS-Sarkoidose.
Eine typische Verlaufsform einer akuten Sarkoidose ist das Löfgren-Syndrom. Dieses zeichnet sich durch ein gleichzeitiges akutes Auftreten von Fieber, Erythema nodosum mit schmerzhaften, knotigen Schwellungen der Unterschenkel, einer meist die OSG-betreffenden Oligoarthritis und einer symmetrischen bihilären Lymphadenopathie aus. In den meisten Fällen liegt allerdings eine chronische Verlaufsform vor. Etwa 85% der Patienten haben einen intrathorakalen Befall – Lymphadenopathie mit oder ohne Befall des Lungenparenchyms. Die klinische Präsentation umfasst Husten, Dyspnoe und Thoraxschmerzen, die von Müdigkeit, Gewichtsverlust, Fieber und Unwohlsein begleitet sein können. Extrapulmonale Manifestationen treten bei der chronischen Form der Sarkoidose in bis zu 30% der Patienten auf (3). Grundsätzlich können alle Organe betroffen sein.
Diagnostik
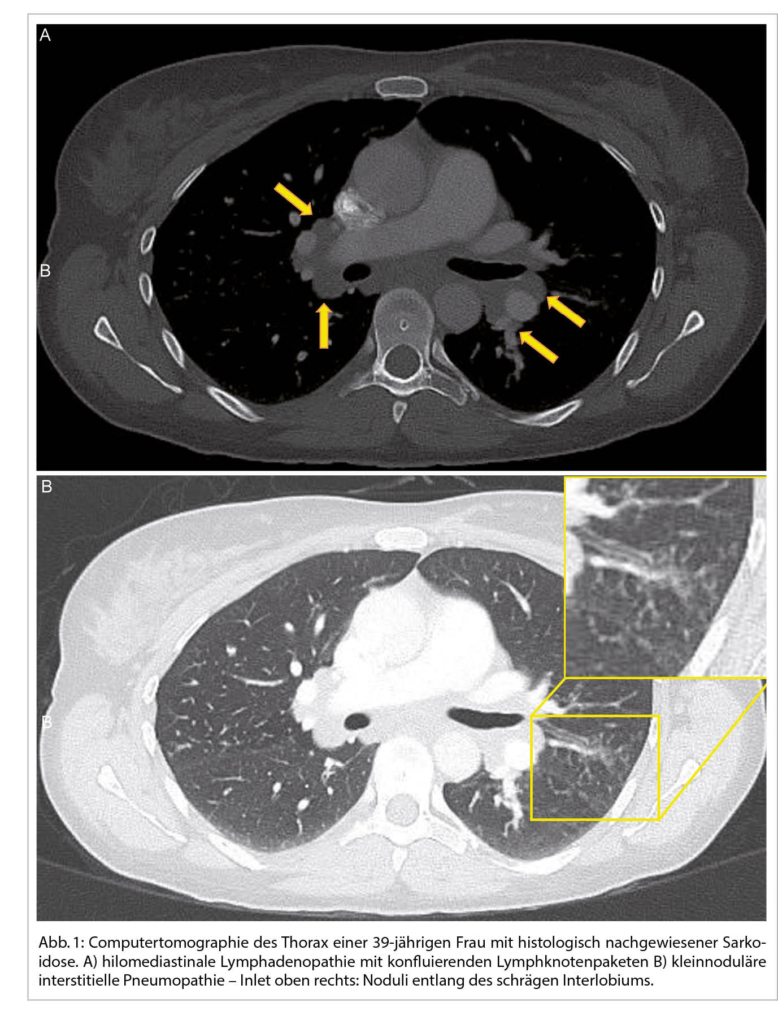
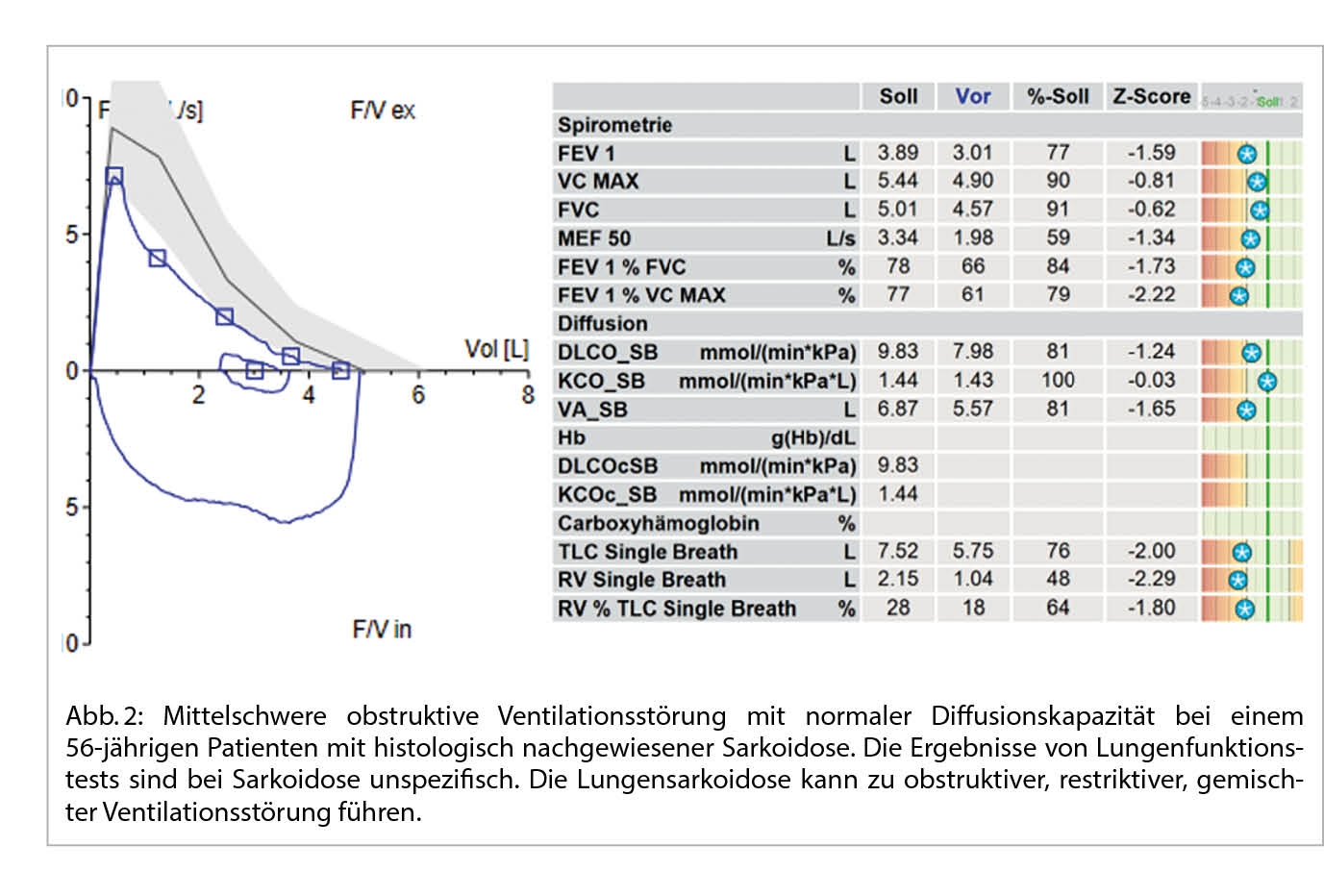
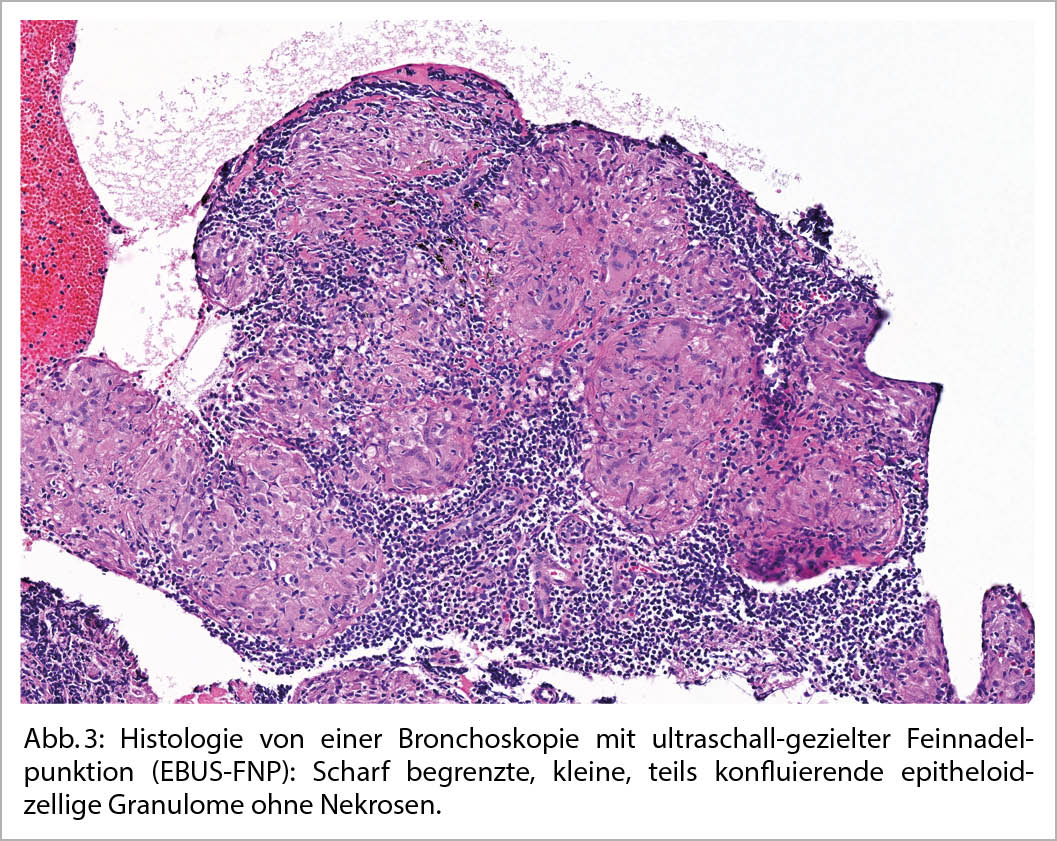
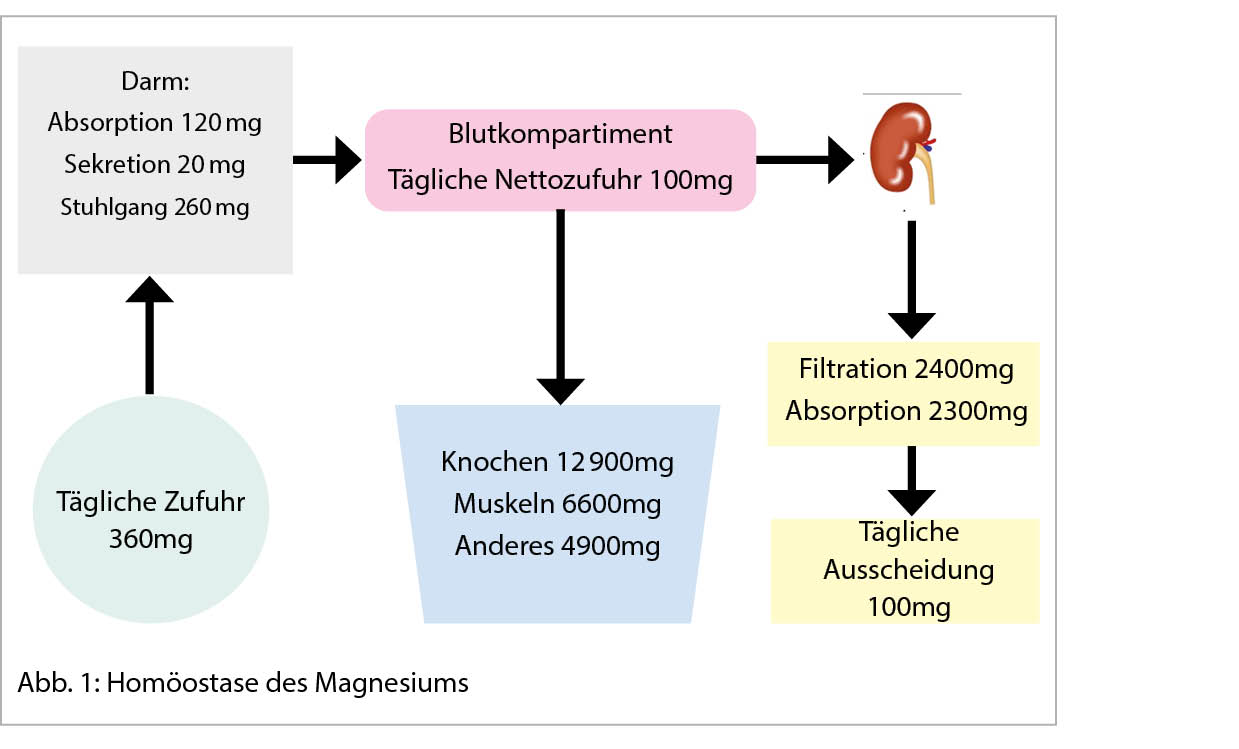
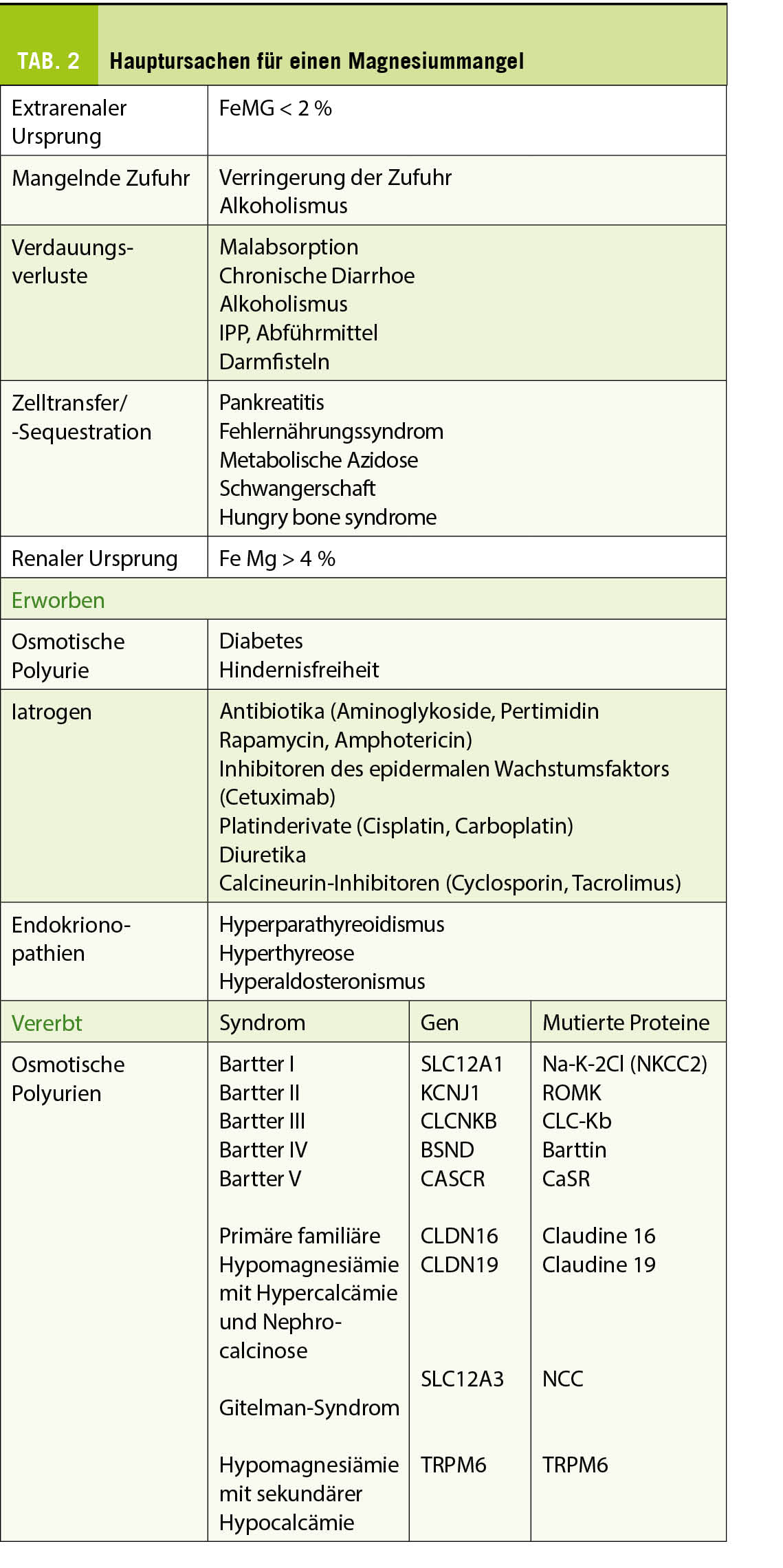
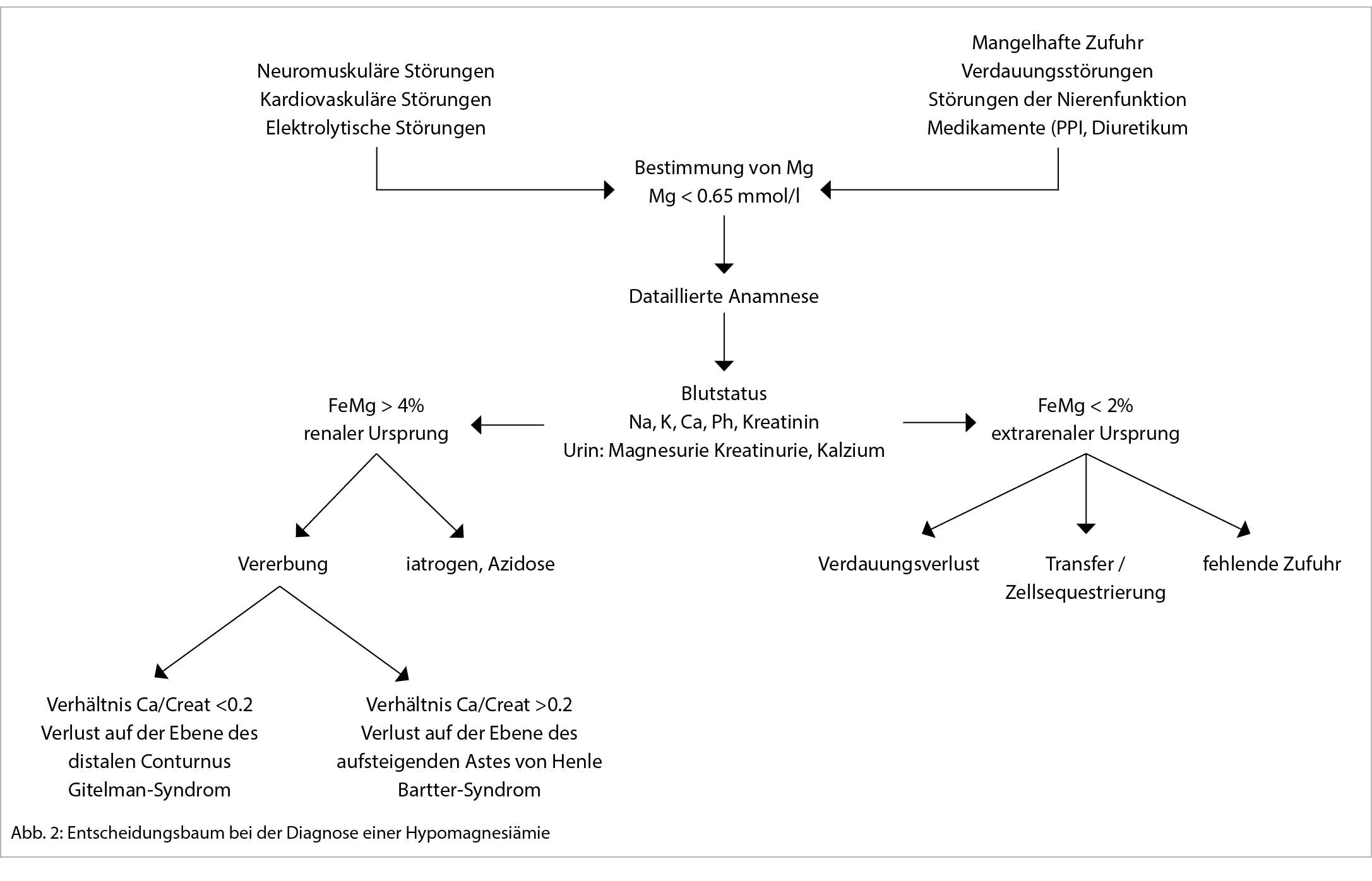
Bei einer typischen Präsentation eines Löfgren-Syndromes kann auf eine bioptische Diagnosesicherung verzichtet werden. Im Normalfall wird die Diagnose durch den Nachweis von epitheloidzelligen Granulomen und Auschluss einer anderen granulomatösen Erkrankung gestellt. So muss im Ausschlussverfahren das Vorliegen einer infektiösen Erkankung (vor allem Tuberkulose, Pilzinfekte), einer «sarkoid-like» Reaktion assoziiert mit malignen Erkrankungen, sowie unter weiteren einer Berylliose ausgeschlossen werden. Da in den meisten Fällen die Lunge betroffen ist, kommt der Bronchoskopie als sicheres und minimal-invasives Verfahren eine wichtige Rolle zu. Bei der Bronchoskopie kann eine Gewebeprobe asserviert und eine broncho-alveoläre Lavage durchgeführt werden. Bei einem extrapulmonalen Befall entscheidet häufig die Zugänglichkeit einer Gewebeprobe über die Durchführung des geeigneten Diagnoseverfahrens. Zudem ist initial ein Organscreening indiziert, um eine subklinische Organbeteiligung erfassen zu können. Hierfür wird eine ophtalmologische Untersuchung, ein Abdomenultraschall und eine kardiologische Beurteilung mit EKG, transthorakaler Echokardiographie und 24 h-EKG empfohlen. Die Labordiagnostik umfasst Differentialblutbild, Leber- (AP, γGT) und Nieren- (Kreatinin, GFR) Tests, Serumkalzium sowie eine Bestimmung der angiotensin-converting enzyme (ACE) und löslichen IL-2-Rezeptor alpha (sIL-2Rα). Dazu folgt eine Urinanalyse mit Kalziumspiegel und Sediment sowie eine fraktionierte Kalzium-Ausscheidung. Die radiologische Klassifikation nach John Scadding ist immer noch in Gebrauch und hat einen prognostischen Wert. Eine funktionelle Untersuchung der Lunge (Spirometrie, Bodyplethysmographie und CO-Diffusion) und eine hochauflösende Computertomographie (HRCT) sind die bevorzugten Methoden zur Beurteilung der Lungenbeteiligung und ihres Schweregrads (1). Eine Lungensarkoidose kann sowohl zu restriktiver, wie auch obstruktiver oder gemischter Ventilationsstörung führen.
Da die Sarkoidose eine Multisystemerkrankung ist und unterschiedliche Verläufe mit variabler Prognose zeigt, empfiehlt sich die Festlegung des Prozederes anhand einer Vorstellung an einem interdisziplinären Sarkoidose-Board.
Therapie
Nach der Diagnosestellung einer Sarkoidose kann es herausfordend sein zu entscheiden, wann, wie und ob eine Behandlung eingeleitet werden sollte, da der Krankheitsverlauf sehr variabel ist – von milden Verläufen mit spontaner Remission innerhalb weniger Wochen bis hin zu schweren Verläufen mit irreversibler Organschädigung bis hin zur Notwendigkeit einer Lungentransplantation. Bei leichten Formen ist der topischen Behandlung der Vorrang zu geben und auch ein abwartender Ansatz (watchful waiting) kann gerechtfertigt sein. Je nach Behandlungsziel, ob Symptomlinderung oder Remission, sollte die Entscheidung unter Berücksichtigung von therapeutischem Nutzen und Nebenwirkungen sowie in Abhängigkeit von Organmanifestationen getroffen werden. Bei anhaltender Krankheitsaktivität besteht in folgenden Situationen die Indikation zur immunosuppressiven Systemtherapie: relevante Einschränkung der Lungenfunktion bei parenchymatösem Lungenbefall, radiologische Progression des Lungenbefalls, pulmonal-arterielle Hypertonie, Herzbeteiligung, Manifestationen des zentralen Nervensystems, Hyperkalzämie, Nierenbeteiligung und ein Befall des hinteren Augenabschnittes. Es gibt keine spezifisch für die Sarkoidose zugelassene Medikamente. Die Wahl der immunsuppressiven Medikamente richtet sich nach den Erfahrungen aus meist nicht randomisierten Studien. Sollte eine systemische Therapie eingeleitet werden, sind orale Glukokortikoide die Therapie der ersten Wahl. Ein typisches Dosierungsschema besteht aus einer Initialdosis von 0.5 – 0.75 mg Prednison pro kg Körpergewicht pro Tag über vier Wochen. Danach kann die Prednison-Dosis langsam über 6 – 12 Monate ausgeschlichen werden. Bei einer voraussehbaren Immunsuppression mit Glukokortikoiden in einer Äquivalenzdosis von > 20 mg/d für länger als einen Monat ist eine Prophylaxe gegen Pneumocystis jiroveci mit Trimethoprim-Sulfamethoxazol 160/800 mg dreimal wöchentlich empfohlen (4). In refraktären oder chronisch aktiven Fällen sollte das Prednison nach Möglichkeit in einer Dosis unterhalb der Cushing-Schwelle in Kombination mit einem Steroid-sparenden Medikament fortgesetzt werden. Für die Zweitlinienbehandlung bei schwerem Organbefall, bei Steroid-refraktären, chronisch aktiven oder rezidivierenden Fällen oder als steroidsparendes Regime kommen mehrere alternative Immunsuppressiva in Betracht. Obwohl Medikamente wie Methotrexat, Azathioprin, oder Mycophenolatmofetil nur in kleinen randomisierten Studien untersucht wurden, wurden positive Wirkungen berichtet. TNF-α-Inhibitoren, insbesondere Infliximab oder Adalimumab, können als weitere Off-Label-Optionen dienen. Das Hydroxychloroquin kann zur Immunmodulation unterhalb der Steroid-Bedürftigkeit zum Einsatz kommen. Hydroxychloroquin wird zudem als Erstlinienbehandlung bei Hautbeteiligung eingesetzt und zeigt positive Wirkungen bei Hyperkalzämie, bei einigen Patienten mit Polymyalgie bzw. Arthralgie und Fatigue (5, 6). Selten kommt bei Sarkoidose eine Allotransplantation der Lunge, des Herzens, der Niere oder der Leber als ultima ratio in Betracht. Die umfassende, individualisierte Betreuung von Patienten mit Sarkoidose beinhaltet auch nicht-pharmakologische Massnahmen wie Physiotherapie und Ergotherapie, körperliches Training, Lungenrehabilitation, kognitive Verhaltenstherapie, psychosoziale Beratung usw. (1).
Die Art der Nachsorge richtet sich nach dem Schweregrad und der Art der Organbeteiligung. Immunsupprimierte Patienten sollten etwa alle 4x pro Jahr untersucht werden. Patienten mit selbstlimitierendem Verlauf sollten 2 Jahre lang zweimal jährlich, dann 3 Jahre lang in jährlichen Abständen konsultiert werden, gefolgt von Bedarfskonsultationen bei Rezidivfreiheit (4).
Fatigue
Die an Sarkoidose erkrankten Patienten berichten häufig über eine lähmende Müdigkeit/Antriebslosigkeit sowie kognitive Beschwerden wie Gedächtnisverlust und Konzentrationsprobleme. Diese Symptome reduzieren die Lebensqualität und können bis zur Invalidisierung führen (7, 8). Die Ätiologie der Fatigue ist unbekannt und häufig multifaktoriell. Darüber hinaus können systemische Therapie zur Behandlung der Sarkoidose selbst Müdigkeit verursachen, einschliesslich Kortikosteroide, so dass das Management dieser Symptome eine Herausforderung darstellen kann. Bisher wurden diverse potenzielle Behandlungsstrategien für Sarkoidose-Fatigue bereits vorgeschlagen, einschliesslich sowohl pharmakologischer als auch nicht-pharmakologischer Interventionen (1, 11). Verschiedene, allerdings kleine Studien bestätigten in ausgewählten Fällen die Wirksamkeit von TNF-α-Blockern (Infliximab und Adalumab) und Neurostimulantien (Methylphenidat und Dexmethylphenidat) auf die Sarkoidose-assoziierte Fatigue (9). Die Wirksamkeit einer körperlichen Trainingstherapie wird beim ausgeprägten Chronic Fatigue-Syndrom kontrovers diskutiert. Eine umfassende Rehabilitation in einem spezialisierten Zentrum mit psychosozialem Akzent fokussiert auf Verhaltens-Therapie (CBT) und ein Dosieren «Pacing» der Alltagsanforderungen kann notwendig werden (10).
Copyright by Aerzteverlag medinfo AG
Lungenzentrum, Kantonsspital St. Gallen
Rorschacher Str. 95/Haus 02
9007 St. Gallen
Institut für Pathologie, Kantonsspital St. Gallen
Rorschacher Str. 95/Haus 11
9007 St. Gallen
Lungenzentrum, Kantonsspital St. Gallen
Rorschacher Str. 95/Haus 02
9007 St. Gallen
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Franzen DP, Brutsche M, Nilsson J. et al., Sarcoidosis – a multisystem disease, Swiss Med Wkly. 2022;152:w30049
2. Deubelbeiss U, Gemperli A, Schindler C, Baty F, Brutsche MH, Prevalence of sarcoidosis in Switzerland is associated with environmental factors, European Respiratory Journal 2010 35: 1088-1097
3. Finger R, Rodriguez R, Schönegg R, Kluckert T, Brutsche M, Sarkoidose: ein klinisch orientierter Überblick, Schweiz Med Forum 2013;13(13–14):265–270
4. Gillissen A, Pietrzak S, Modern Treatment of Sarcoidosis, Pneumologie 2012; 66:539–546
5. Drent M, Crouser ED, Grunewald J, Challenges of Sarcoidosis and Its Management, N Engl J Med 2021; 385:1018-1032
6. Spagniolo P et al., Pulmonary sarcoidosis, Lancet Respir Med, 2018 May;6(5):389-402
7. Elfferich MD, Nelemans PJ, Ponds RW, De Vries J, Wijnen PA, Drent M, Everyday Cognitive Failure in Sarcoidosis: The Prevalence and the Effect of Anti-TNF- α Treatment, Respiration 2010;80:212–219
8. Lower EE, Malhotra A, Surdulescu V, Baughman RP, Armodafinil for Sarcoidosis-Associated Fatigue: A Double-Blind, Placebo-Controlled, Crossover Trial, J Pain Symptom Manage. 2013 February ; 45(2): 159–169
9. Atkins Ch and Wilson AM, Managing fatigue in sarcoidosis – A systematic review of the evidence, Chronic Respiratory Disease, 2017, Vol. 14(2) 161–173
10. Atkins Ch et al., Feasibility study of a randomised controlled trial to investigate
the treatment of sarcoidosis-associated fatigue with methylphenidate (FaSTMP):
a study protocol, BMJ Open 2017;7:e018532
11. Lower EE, Harman S, Baughman RP, Double-Blind, Randomized Trial of Dexmethylphenidate Hydrochloride for the Treatment of Sarcoidosis-Associated Fatigue, Chest 2008;133;1189-1195