Im folgenden Kongressbericht versuchen wir einige Highlights des diesjähigen Review Kurses des Herzgefäss Zentrums Zürich und der Mayo Klinik in Rochester vom 31.3. resp. 1.4.2022 in Zürich wiederzugeben. Seit jeher stand der ausgezeichnete Kurs unter der Leitung von Frau Prof. Dr. Ch. Attenhofer, Zürich und Prof. Dres. H.M. Connolly, Rochester und P. Elliott, London.
Update REANIMATION:
Im Vortrag von Prof. Dr. G. Sütsch, Zürich, wurden die Leitlinien 2021 der REA kurz zusammengefasst.
Gemäss ERC ergibt die Epidemiologie in Europa 2021 folgende Zahlen: Die jährliche Inzidenz des OHCA (Kreislaufstillstand ausserhalb Klinik) liegt zwischen 67-170/100’000 Einwohner. Die Häufigkeit der Laienreanimation ist je nach Land sehr unterschiedlich zwischen 13-83%, in DL 40,4%. Der Einsatz eines AED ist nach wie vor gering, im Durchschnitt bei 28%. Die Überlebensrate bei Entlassung aus der Klinik liegt im Durchschnitt bei 8%; in DL konnten 10,5% 2020 lebend entlassen werden. Innerklinische Kreislaufstillstände haben eine Überlebensrate nach 30 Tagen von 15-34%. Frühsymptome sollten unbedingt beachtet werden – vgl. www.grc-org.de
Die Kernaussagen zur Reanimation nach den neuen Guidelines finden sich in Abbildung 1:

5 KERNAUSSAGEN: «Big Five»
1. Das Bewusstsein für die Laienreanimation (3x höheres Überleben) und den frühen AED Einsatz muss gestärkt werden.
2. Lebensrettende Systeme um die Gemeinschaft mit einzubeziehen sind wichtig – Ersthelfer oft vor Rettungsdienst vor Ort.
3. Kids save life – Ausbildung in Schulen.
4. Cardiac Arrest Zentren – 2-faches Überleben.
5. Telefon REA – 2x mehr Überlebende, NNT:7.
Die 5 Kernaussagen der BLS sind: Erkenne den Herz-Kreislaufstillstand und beginne sofort mit CPR, Alarmiere den Rettungsdienst, Durchführung der Thoraxkompression mit minimalen Unterbrechungen, Lassen Sie einen AED holen, Lernen Sie wie eine Wiederbelebung durchgeführt werden muss. «PRÜFEN-RUFEN-DRÜCKEN».
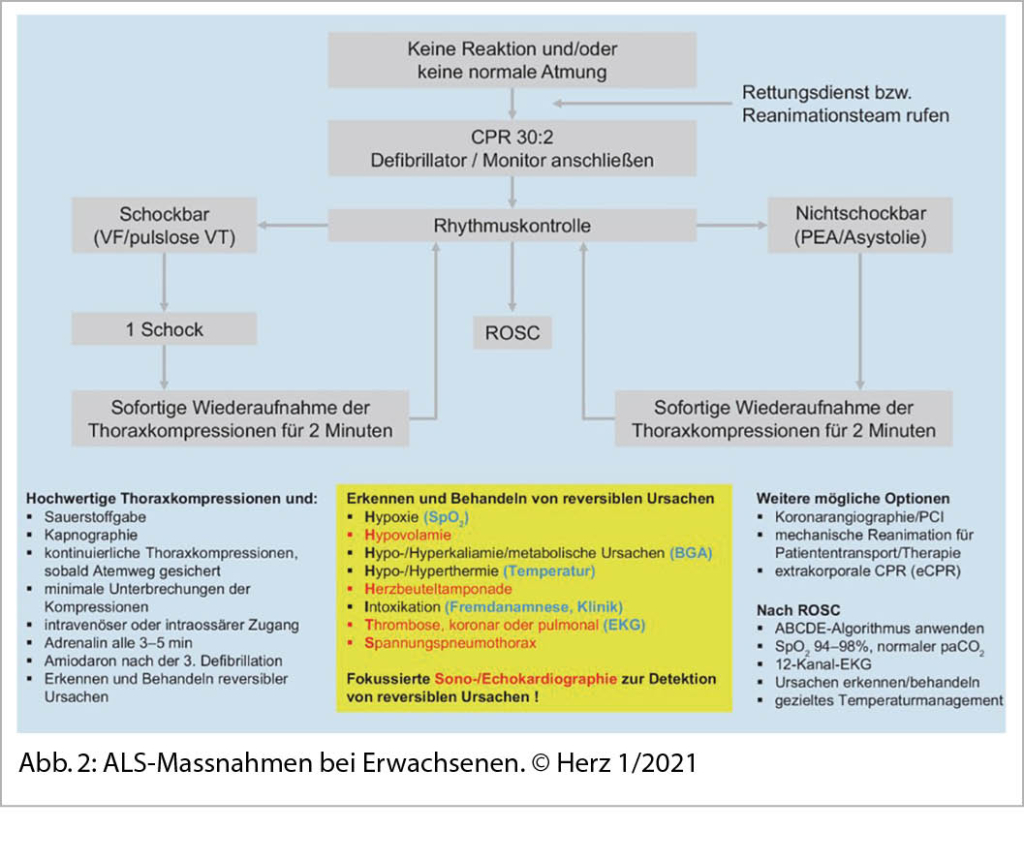
Das praktische Vorgehen, ALS-Massnahmen beim Erwachsenen. ist in Abbildung 2 aus der Zeitschrift Herz 1/2021 im Sinne der ERC Guidelines sehr schön zusammengefasst.
Eine hochwertige kontinuierliche Thoraxkompression (Drucktiefe 5cm, HF: 100-120/min) mit nur minimalster Unterbrechung ist entscheidend! Bei einem nicht defibrillierbaren Rhythmus (Asystolie/PEA) sollte frühzeitig alle 3-5 Minuten Adrenalin 1mg i.v. gegeben werden oder wenn nach 3x Defi eines defibrillierbaren Rhythmus kein Erfolg. Amiodaron nach der 3. Defibrillation – 300mg i.v. Wichtig sind das rasche Erkennen und Behandeln der reversiblen Ursachen (5 H u. 5 T).
Therapie der Herzinsuffizienz:
Prof. Dr. A. Flammer, USZ, nahm Stellung zu den aktuellen Leitlinien der Herzinsuffizienz insbesondere zu den SGLT2-Hemmern.
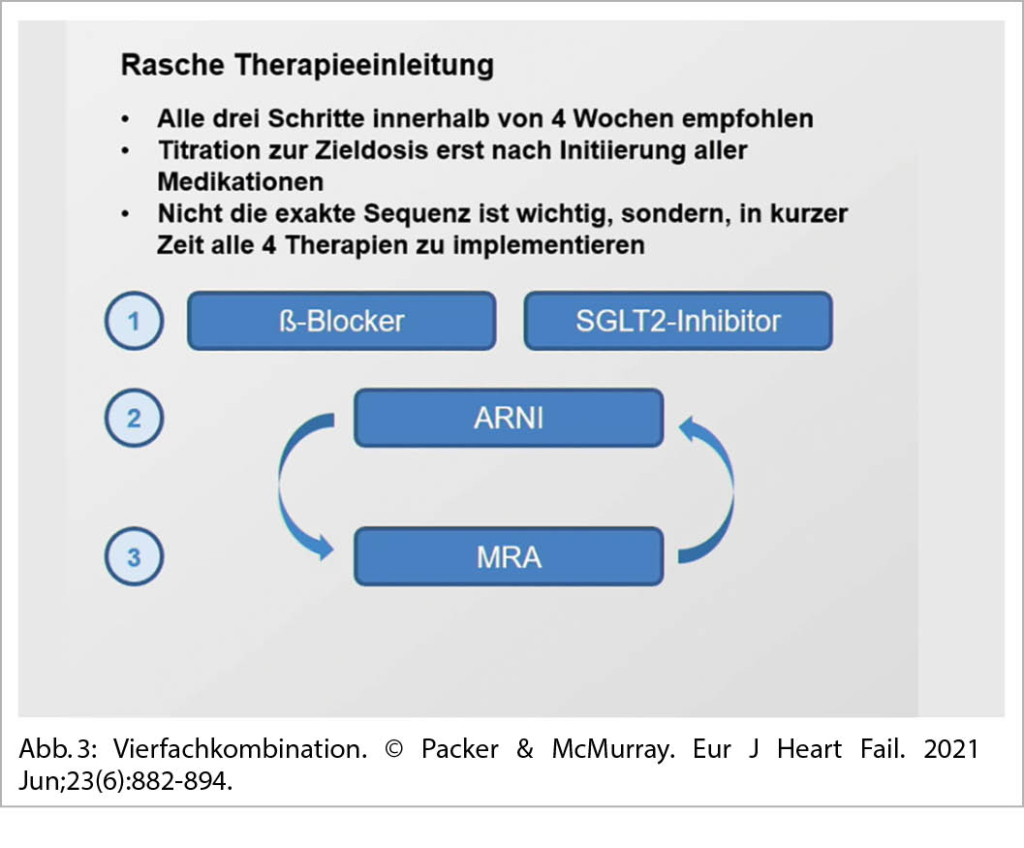
Neben Sacubitril/Valsartan, β-Blockern und Mineralokortikoidrezeptorantagonisten gehören auch SGLT2-Hemmer zur modernen 2021 leitlinienempfohlenen Standardbehandlung einer HFrEF (EF<40%). (Abb. 3).
Dapagliflozin und Empagliflozin gehören zur Erstlinienbehandlung bei der HFrEF mit einer Klasse-IA-Indikation. Die beiden SGLT2-Hemmer senken die kardiovaskulare Mortalität und reduzieren die Hospitalisierung bei Herzinsuffizienz – NNT 21 resp. 19.
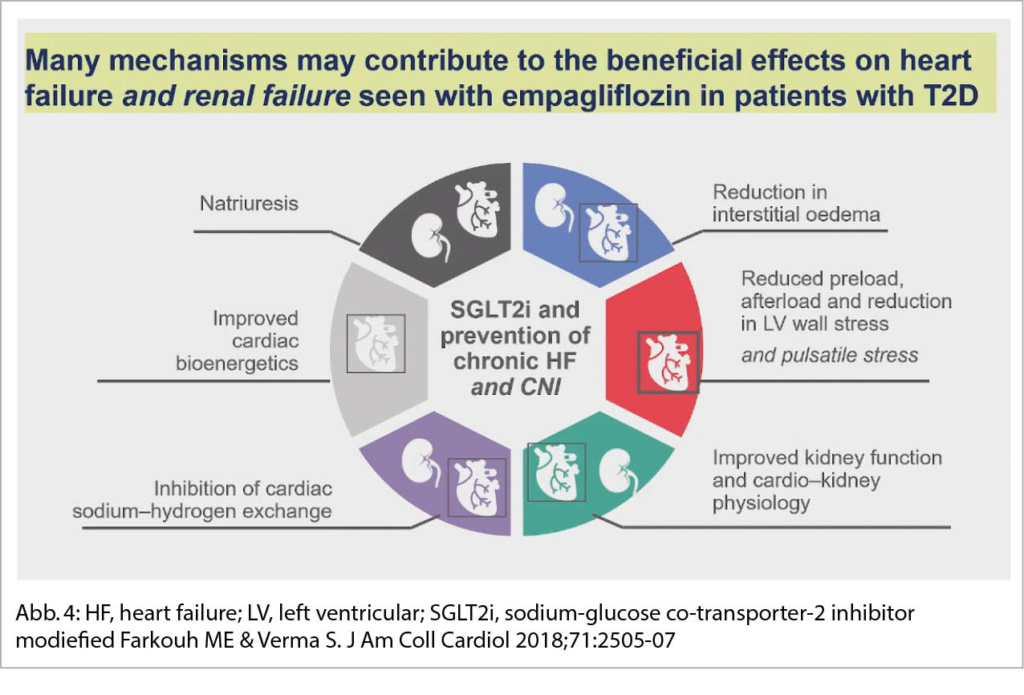
SGLT2-Hemmer sind kardio- und nephroprotektiv. SGLT2-Hemmer vermindern den Druck im Glomerulum und vermindern zusätzlich eine Albuminurie durch eine Vasokonstriktion im afferenten Gefäss-Schenkel des Glomerulums via eine Erhöhung des Natriums in der Macula densa. Durch eine RAAS-Blockade kommt es zu den gleichen Mechanismen aber via eine Vasodilatation der efferenten Arteriole des Glomerulums (Abb. 4).
HFpEF:
Aus dem Vortrag von Prof. Dr. H.P. Brunner-La Rocca aus Maastrich zum Thema HFpEF wurden folgende Aussagen festgehalten:
Mehr als 50% aller Herzinsuffizienzfälle sind auf eine HFpEF zurückzuführen. Diese beruht auf strukturellen und/oder funktionellen Veränderungen wie eine diastolische Dysfunktion/erhöhte Füllungsdrücke, inkl. Erhöhung von natriuretischen Peptiden bei einer LVEF ≥50%.
Die Hypertonie ist die wichtigste und häufigste Ursache der HFpEF mit einer Prävalenz von 60-89%.
Weitere Komorbiditäten sind: Adipositas, Diabetes II, chron. Niereninsuffizienz (CKD), COPD und eine Anämie. Frauen und ältere Patienten sind häufiger betroffen.
Die Herzinsuffizienz mit erhaltener Auswurffraktion (HFpEF) ist eine inflammatorische Systemerkrankung mit multiplen pathophysiologischen Manifestationen und klinischen Phänotypen.
Das myokardiale Remodelling bei HFpEF wird wesentlich durch extramyokardiale Entzündungsprozesse mitverursacht. Viszerales und epikardiales Fett spielen bei der Pathogenese einer HFpEF eine wichtige Rolle. Die chronotrope Inkompetenz, der dysproportionale Anstieg des pulmonal-venösen Drucks sowie eine verminderte Sauerstoffextraktion der Skelettmuskulatur tragen wesentlich zur Leistungsintoleranz bei HFpEF bei (vgl. Prof. Dr. O. Pfister, info@herz+gefäss 03/21). Der H2FPEF Score oder der HFA-PEFF Algorithmus sind zwei sehr hilfreiche Scores zur Erkennung einer HFpEF; ist doch die Diagnose nicht einfach (Abb. 5).
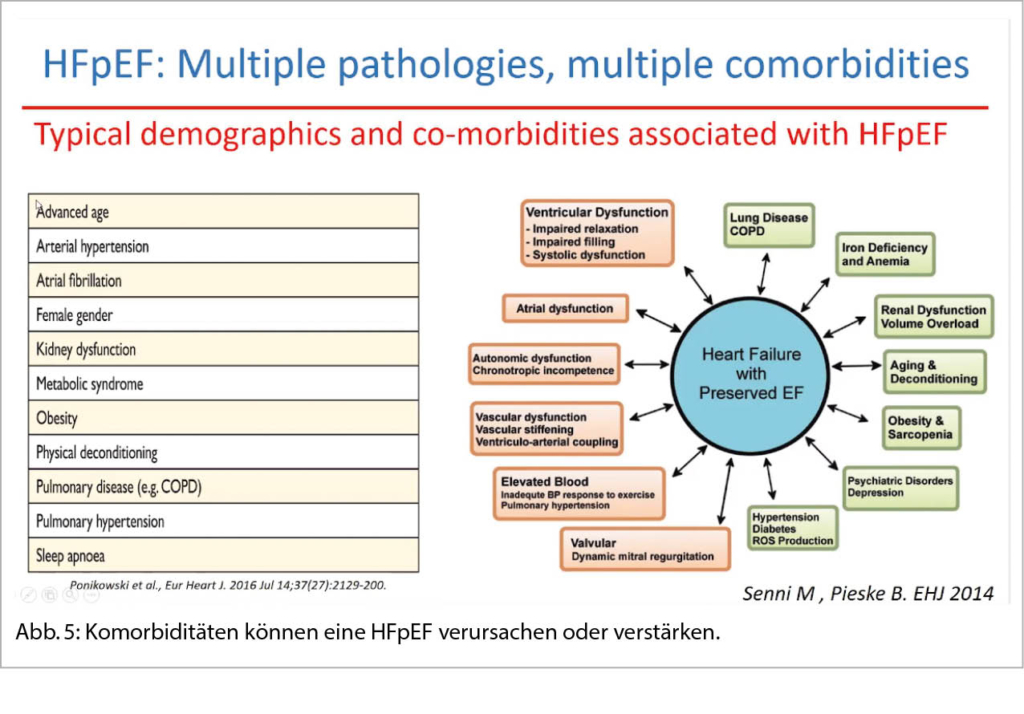
Komorbiditäten können eine HFpEF verursachen oder verstärken. Sie können zu einer falschen Diagnose führen oder können die Beschwerden einer HFpEF verstärken. Ein breiter diagnostischer Ansatz (Echo, Labor, 6 Minuten Gehtest, Lungenfunktion, Belastungstest, Ausschluss OSA, Koronar-CT, Holter EKG) ist wichtig. In Reserve Stressecho oder Rechtsherzkatheter mit angehobenen Beinen (mPAWP ≥19mmHg).
Wichtig ist auch die DD der HFpEF wie: linksseitige Klappenvitien, eine isolierte Rechtsherzinsuffizienz, eine Perikarderkrankung oder spezifische Kardiomyopathien. Dies hat therapeutische Konsequenzen.
Therapeutisch gab es bisher nur die Diuretika (IC). Die Ergebnisse der EMPEROR-Preserved®-Studie zeigen erstmalig eine beachtliche Wirksamkeit der SGLT2-Hemmer bei Patienten mit Herzinsuffizienz und einer LVEF >40 % bei einem günstigen Verträglichkeitsprofil:
- Die EMPEROR-Preserved-Studie erreichte als erste Studie mit HFpEF-Patienten ihren primären Endpunkt.
- Empagliflozin erzielte eine beachtliche 21%ige relative Risikoreduktion des primären Endpunktes aus CV-Mortalität oder HHI gegenüber Placebo und reduzierte das relative Risiko für Gesamt-hospitalisierungen aufgrund von Herzinsuffizienz um 27%.
- Empagliflozin, Jardiance, schützte die Niere durch eine gegenüber Placebo signifikant verringerte Abnahme der Nierenfunktion.
- Die Effekte waren konsistent in klinisch relevanten Subgruppen wie z. B. LVEF, Diabetesstatus, eGFR und Vorhofflimmern/-flattern bei Baseline.
In der PARAGON Studie wurde der primäre Endpunkt (Hosp. HI, cv-Tod) knapp verpasst beim Vergleich Valsartan vs. Sacubitril/Valsartan.
Eine moderate Sportempfehlung wirkt sich bei der HFpEF günstig auf die Leistungsfähigkeit, auf E/e` und das LA-Vorhofsvolumen aus. 11% Reduktion der Gesamtmortalität und der Gesamthospitalisation.
PFO:
Der Verschluss eines offenen Foramen ovale (PFO) wird für Patienten nach kryptogenem/Kardioembolischem Schlaganfall im Alter zwischen 16 und 60 Jahren in den aktuellen Konsensusleitlinien mehrerer Fachgesellschaften empfohlen (Empfehlungsklasse A, Evidenzlevel I). Die Anwendungen eines sog. Double-Disc-Okklusionssystems wird präferenziell empfohlen. Der Eingriff ist bei Erfahrung in Lokalanästhesie in 15 Min. durchführbar. Am Folgetag sind alle Aktivitäten wieder möglich.
Die «number needed to treat» (NNT), um ein Schlaganfallrezidiv in 5 Jahren zu verhindern, lag in der RESPECT-Studie bei 42, in der CLOSE-Studie sogar bei nur 20. In der REDUCE-Studie war die NNT 28, um ein Schlaganfallrezidiv in 2 Jahren zu verhindern. Mit längerer Beobachtungszeit reduziert sich die NNT weiter, z.B. nach 10 Jahren auf 18. Viele andere Krankheiten, wie Migräne, Platypnoea Orthodeoxia sind Gegenstand der Forschung als potenzielle Ziele für den PFO-Verschluss; aktuell fehlen aber ausreichend gepowerte Studien, sodass der Verschluss bei anderen Krankheiten von Fall zu Fall entschieden werden sollte. Die Migräne kann in Einzelfällen deutlich vermindert werden.
PD Dr. F. Nietlisbach aus der Klinik im Park erwähnte hier auch eine kleine Studie bei 153 Tauchern, wo es durch den Verschluss zu keinen Dekompressionstraumen mehr kam. Die seltenen Risiken des Eingriffs sind: VHFli, Erosionen, residuelle Lecks und Gefässverletzungen. Als Sekundärprävention (nach TIA, Stroke, embolischer Myokardinfarkt, embolischer Verschluss einer peripheren Arterie) kommt es im Gegensatz zu einer medikamentösen Therapie durch den PFO-Verschluss zu einer relativen Risikoreduktion von 54%. Gefährlich ist ein grosses PFO mit Vorhofsseptumaneurysma, einer Eustachschen Klappe oder einem Chiari Netzwerk.
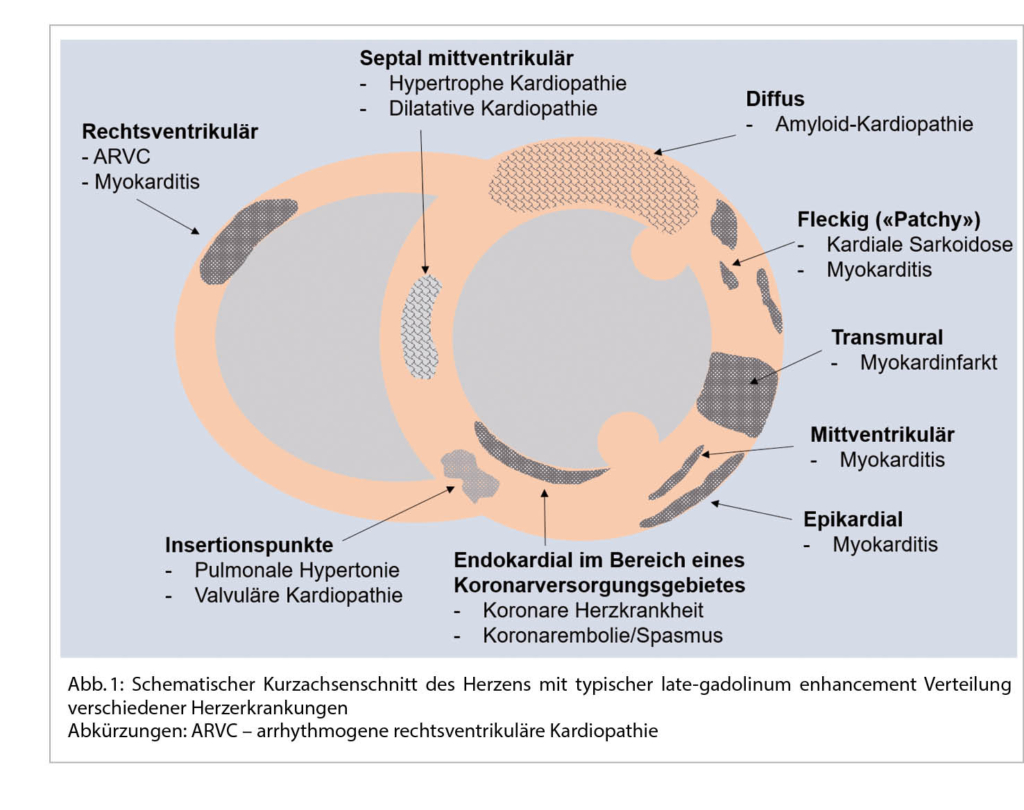
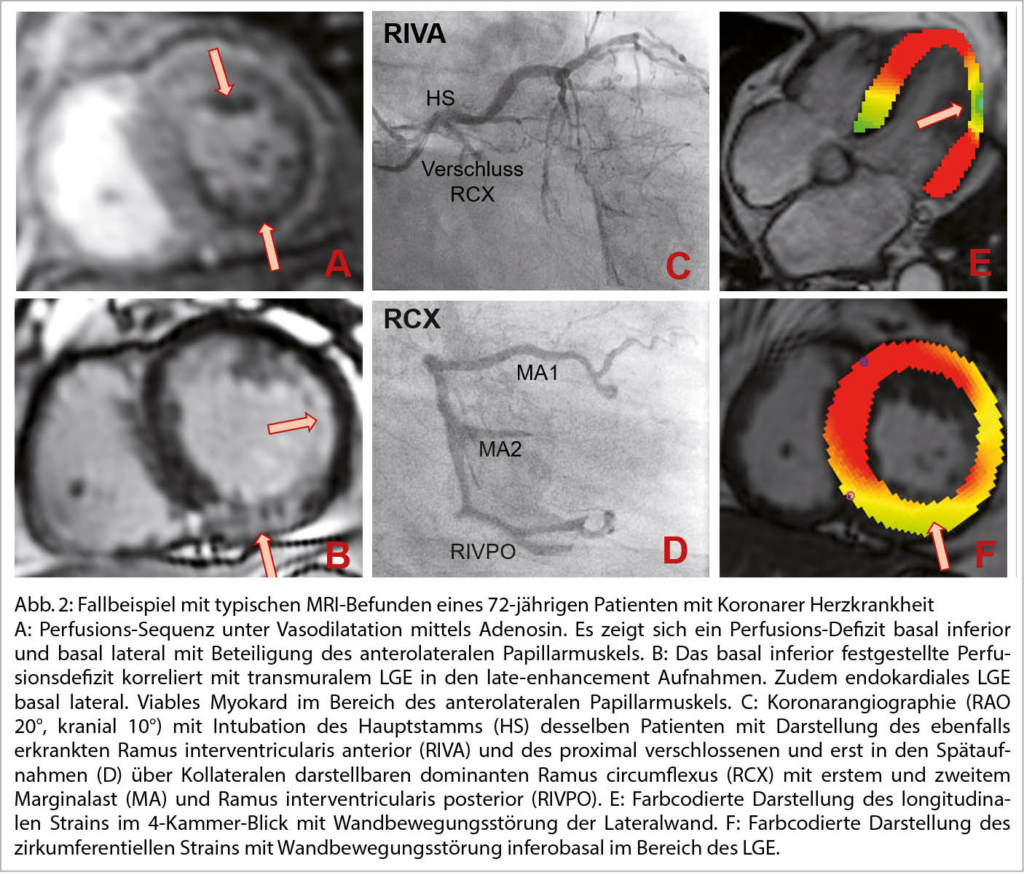
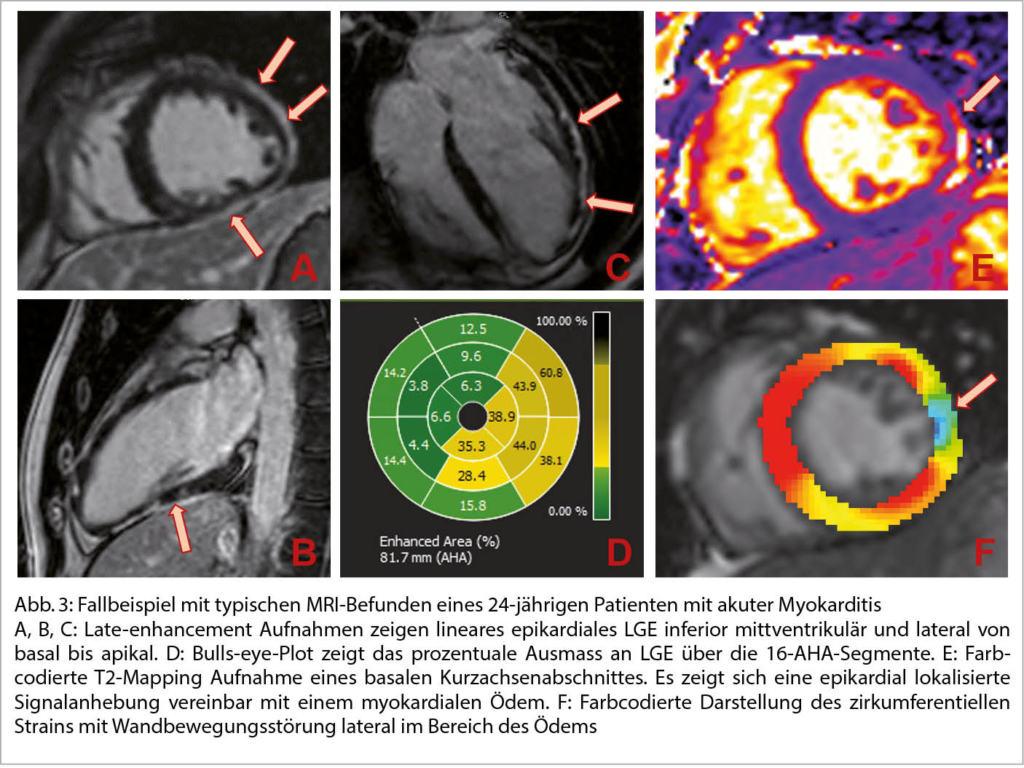
DD zur H(O)CM:
Neben der hypertensive Herzkrankheit, der kardialen Amyloidose, ist an die diversen Speichererkrankungen, neuromuskuläre und mitochondriale Störungen u.a. zu denken.
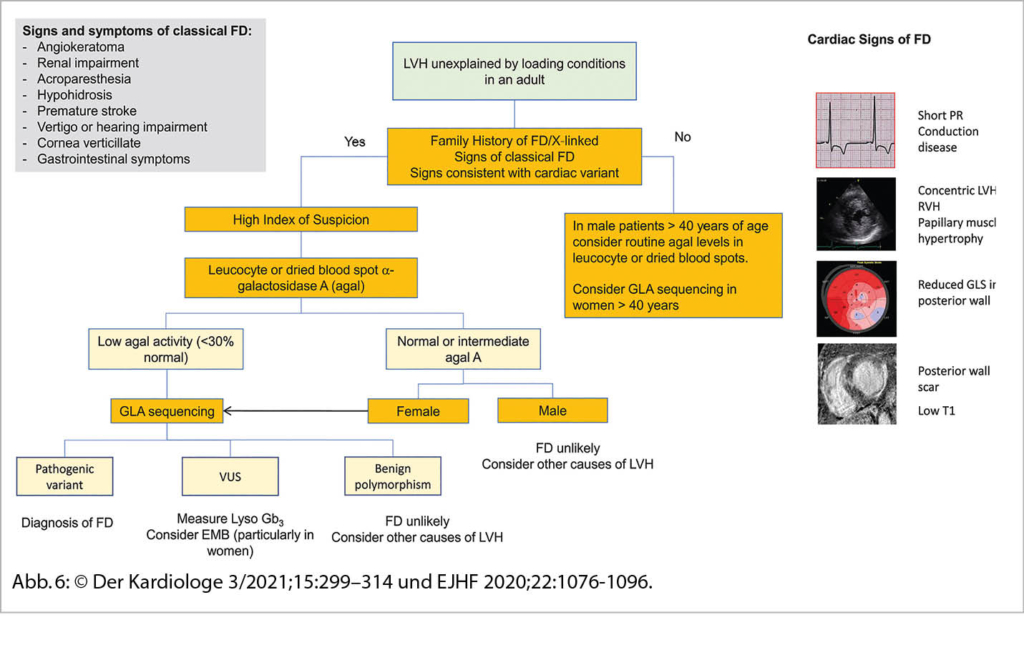
Eine sehr gute Übersicht gab Frau Prof. Dr. M. Patten aus Hamburg zum Morbus Fabry als eine der DD einer unklaren hypertrophen Kardiomyopathie. So sind 6-10% der Fälle diesem Krankheitsbild zugeordnet. Der Morbus Fabry ist eine angeborene X-chromosomale Speicher-Erkrankung mit Mutationen des α-Galaktosidase-A-Gens resp. einem Mangel an Alpha-Galaktosidase-A. Die Krankheit hat eine sehr variable Ausprägung und Symptomatik. Betroffen sind Männer und Frauen. Erkrankter Vater – Töchter Trägerin, Mutter Trägerin – Mädchen Trägerin und Knaben betroffen. Jungen bzw. Männer sind meist früher betroffen als Mädchen bzw. Frauen. Die Inzidenz liegt bei 1:40’000. Bei einem Neugeborenenscreening war die Zahl wesentlich tiefer. Durch den Enzymdefekt kommt es zu einer Anhäufung von Ceramid (Gb3) in Lysosomen. So können praktisch alle Organe betroffen sein. In 78 % ist die Haut betroffen: Angiokeratome, Hypo-, Hyperhidrose und akrale Oedeme. In 75% findet man eine Augenbeteiligung – Cornea, in 50% eine gastrointestinale Symptomatik mit Diarrhoe und abdominellen Krämpfen. In 84% Nierenbeteiligung mit Proteinurie und progredienter Niereninsuffizienz. Neurologisch: Akroparästhesien in 75%, Schlaganfälle in 15%, Epilepsien und Depressionen. Ab ca. 20-30 Jahren kommt es auch zu kardialen Veränderungen (70%). Im Echo konzentr. LVH, Papillarmuskelhypertrophie, LV-Dysfunktion, Relaxationsstörung und später eine Restriktion. Im EKG: kurzes PQ, Repol. störungen und Zeichen der LVH, später chronotrope Inkompetenz, gestörte Reizleitung und vermehrt VHFLi. Im MRI des Herzens Fibrose inferolateral, posterior und eine reduzierte T1-Zeit. Im Echo ist parallel der GLS in dieser Region vermindert. Bei einer frühen Diagnose (vor dem fibrotischen Umbau) kann eine Enzymersatztherapie alle zwei Wochen i.v. und oder eine Chaperontherapie die Kardiomyopathie aufhalten und das Outcome verbessern. Die Diagnosestellung erfolgt mittels Messung der Enzymaktivitat von α-Gal A (α-Galakto-sidase A), der genetischen Analyse und Quantifizierung des Markers Gb3 (Globotriaosylceramid) im Blut.
Vgl. Der Kardiologe 3/2021;15:299–314 und EJHF 2020;22:1076-1096 (Abb. 6)
In der gleichen Session wurde durch PD Dr. S. Stämpfli aus Luzern die kardiale Amyloidose als weitere nicht seltene DD der H(O)CM dargestellt. Über dieses Krankheitsbild haben wir ja schon öfters berichtet. 13% der Patienten mit einer HFpEF haben eine ATTR-Kardiomyopathie. Auch bei 16% der Patienten mit schwerer Aortenklappenstenose findet man diese Erkrankung. Tafamidis kann heute erfolgreich als Therapie eingesetzt werden. Die NNT beträgt 8, es kommt zu einer 30% Reduktion der Gesamtmortalität – HR 0,70 nach etwa 18 Monaten. Die Therapie ist sicher und sehr teuer. Gemäss BAG kann diese heute nur durch ein Zentrum verordnet werden. Einschlusskriterien sind: Dokumentierte ATTR-CM (Echo+GLS mit apical sparing, Skelettscintigraphie), Anamnese einer HI, 6 Minuten Gehtest >100 Meter, NT-proBNP≥600ng/l. AL-Screening mit fehlendem Nachweis freier Leichtketten im Serum und Serumprotein-/Urinprotein-Immunfixation.
GLP-1 RA und Herz:
Ein sehr interessanter und praxisrelevanter Vortrag von Prof. Dr. P. Wiesli aus Frauenfeld zum Thema GLP-1 Agonisten endete mit der Take home message: GLP1-Agonisten für (fast) alle Patienten mit einem Diabetes Typ 2 und einem BMI >28kg/m2 auch bevor sie Herzpatienten werden! Präparate wie Ozempic, Trulicity, Bydureon werden 1x wö s.c. gespritzt. Es gibt auch eine orale Form Rybelsus 3mg, nach 4 Wochen 7mg (max. 14mg). 30 Minuten vor dem Essen morgens nüchtern. Cave Kombination mit DPP-4!
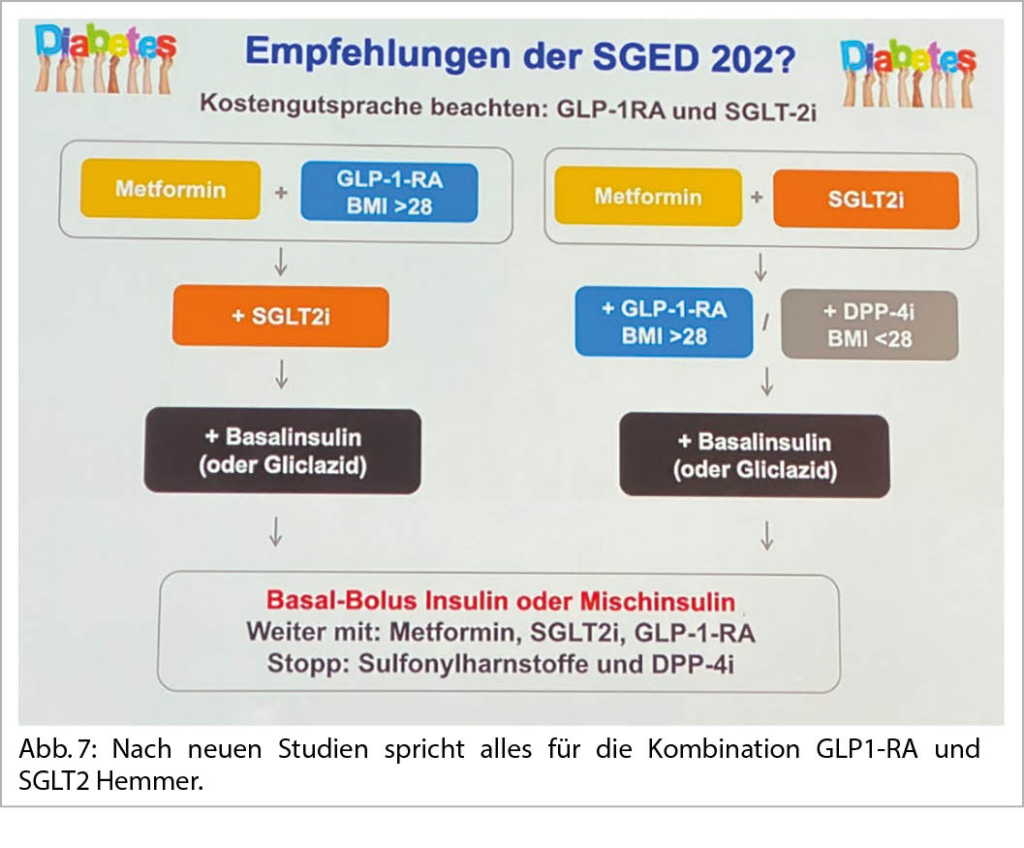
Mit diesen Medikamenten konnte die MACE Rate (kardivaskulärer Tod, Infarkte, Stroke) signifikant gesenkt werden. Auch die Hospitalisation wegen HI und die Nephroprotektion wird positiv beeinflusst. Bei 32% der Patienten mit einem Diabetes II gibt es kardiovaskuläre Vorerkrankungen und 68% haben CV-Risikofaktoren. Die NNT bei Patienten mit kardiovaskulärem Ereignis beträgt 18. Nach neuen Studien spricht alles für die Kombination GLP1-RA und SGLT2 Hemmer (Abb. 7).
Bei einer Herzinsuffizienz und bei einer Nephroprotektion steht der SGLT2-H an erster Stelle. Beim Gewichtsverlust und Apoplexieschutz der GLP-1 RA. Eine multifaktorielle Behandlung: Hypertonie, Lipide, Rauchstopp und Diabetes sind entscheidend. Das Erstlinien Diabetes Medikament ist in der Schweiz immer noch das Metformin.
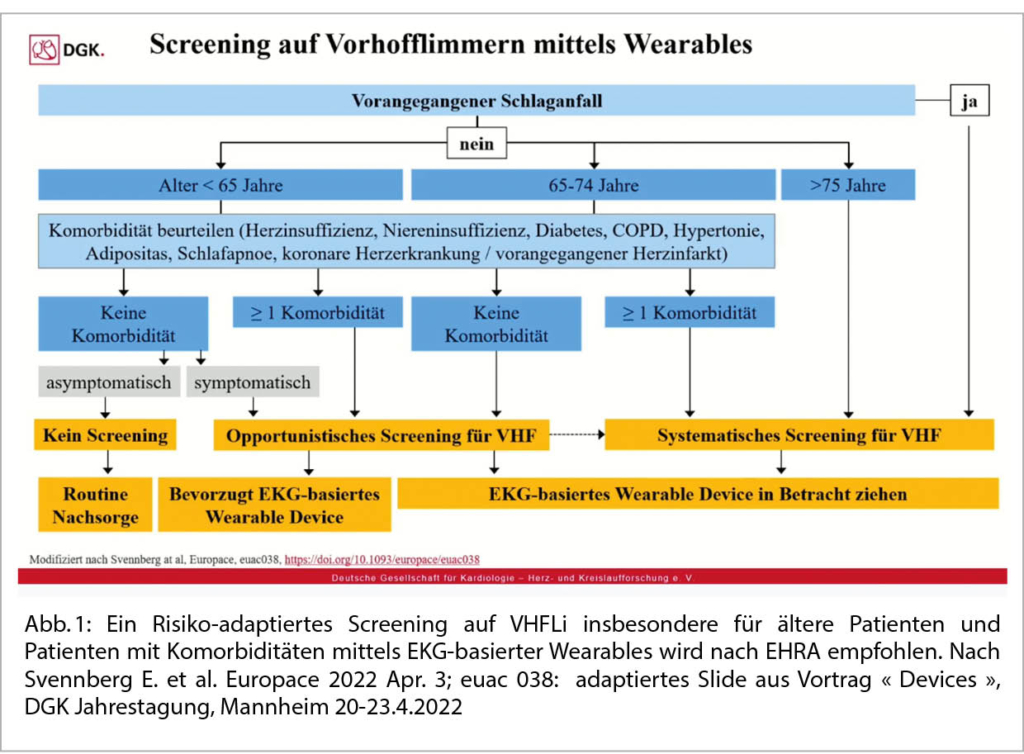
Holter-EKG, Smarwatch oder Looprecorder bei VHFLi:
PD Dr. A. Breitenstein am USZ hielt zu diesem Thema ein sehr schönes Referat. Die Take home message lautet: Viele Arrhythmien treten nur sporadisch auf, und somit ist eine konventionelle kurzzeitige Diagnostik wenig hilfreich. Beim VHFli ist eine «elektrische» Diagnose essentiell! Heutzutage ist ein 1 Kanal-EKG ≥30 Sekunden ausreichend für die Diagnose eines VHFli. Es gibt heute gute zusätzliche Tools (Smartwatch: Apple = 1 Kanal-EKG, Smartphone = PPG). Goldstandard ist immer noch die kontinuierliche Dokumentation mittels Ereignisrekorder/Looprecorder. Schwierig bleibt die Frage einer OAK Notwendigkeit bei Dokumentation eines VHFLi bei Device-Patienten resp. bei einem Ereignisrekorder. Heute wird eine OAK nur bei einem CHADS-VASc Score ≥2 beim Mann resp. ≥3 bei der Frau und einer VHFLi-Dauer >24 Stunden empfohlen. Unklar ist die Datenlage bei einer Dauer von 5 Minuten bis 24h. Hier fehlen aktuell noch Studiendaten.
Dr. med. Urs N. Dürst
Zelglistrasse 17
8127 Forch
u.n.duerst@ggaweb.ch