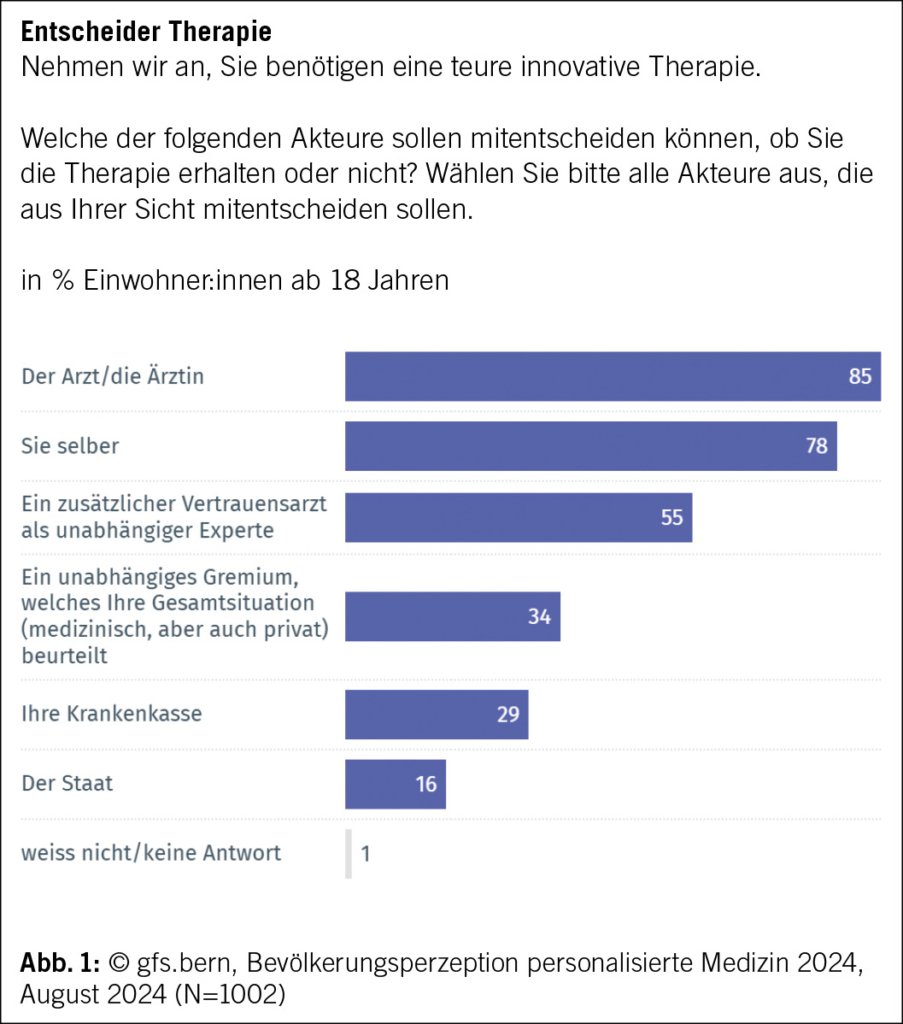
Phase-I/II-Studie zu adaptiv hergestellten lentiviralen Anti-CD20/Anti-CD19-chimären Antigenrezeptor-T-Zellen für rezidiviertes, refraktäres Mantelzelllymphom
Das Mantelzelllymphom (MCL) ist eine aggressive B-Zell-Malignität, die durch t(11;14) und eine starke CD20-Expression gekennzeichnet ist. Um die Ergebnisse von CD19-chimären Antigenrezeptor-(CAR)-T-Zellen mit einfacher Zielausrichtung zu verbessern, verwendeten die Autoren im Rahmen einer klinischen Phase-I/II-Studie bei rezidiviertem, refraktärem (R/R) MCL dual zielgerichtete lentivirale Anti-CD20/Anti-CD19-(LV20.19)-CAR-T-Zellen.
Methoden
Teilnahmeberechtigt waren Patienten mit MCL, bei denen zwei Therapielinien versagt hatten oder die nach einer Transplantation einen Rückfall erlitten hatten. Die LV20.19-CAR-T-Zellen wurden vor Ort mit dem CliniMACS Prodigy in einem adaptiven Verfahren, das 8 bis 12 Tage dauerte, hergestellt, um das endgültige CAR-Produkt hinsichtlich einer erhöhten Anzahl naiver und Stammzell-Gedächtnis-ähnlicher (SCM) T-Zellen zu optimieren.
Ergebnisse
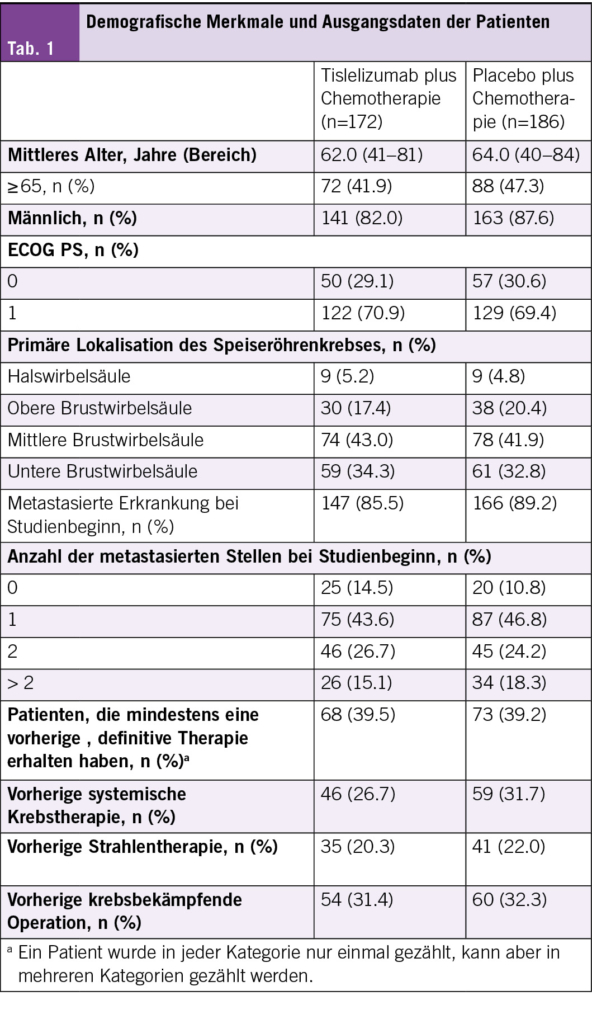
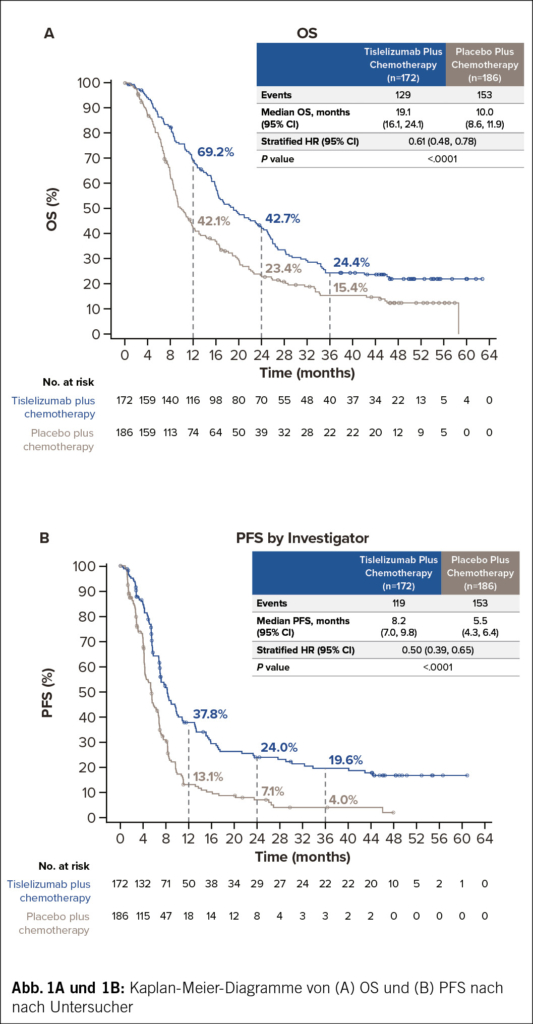
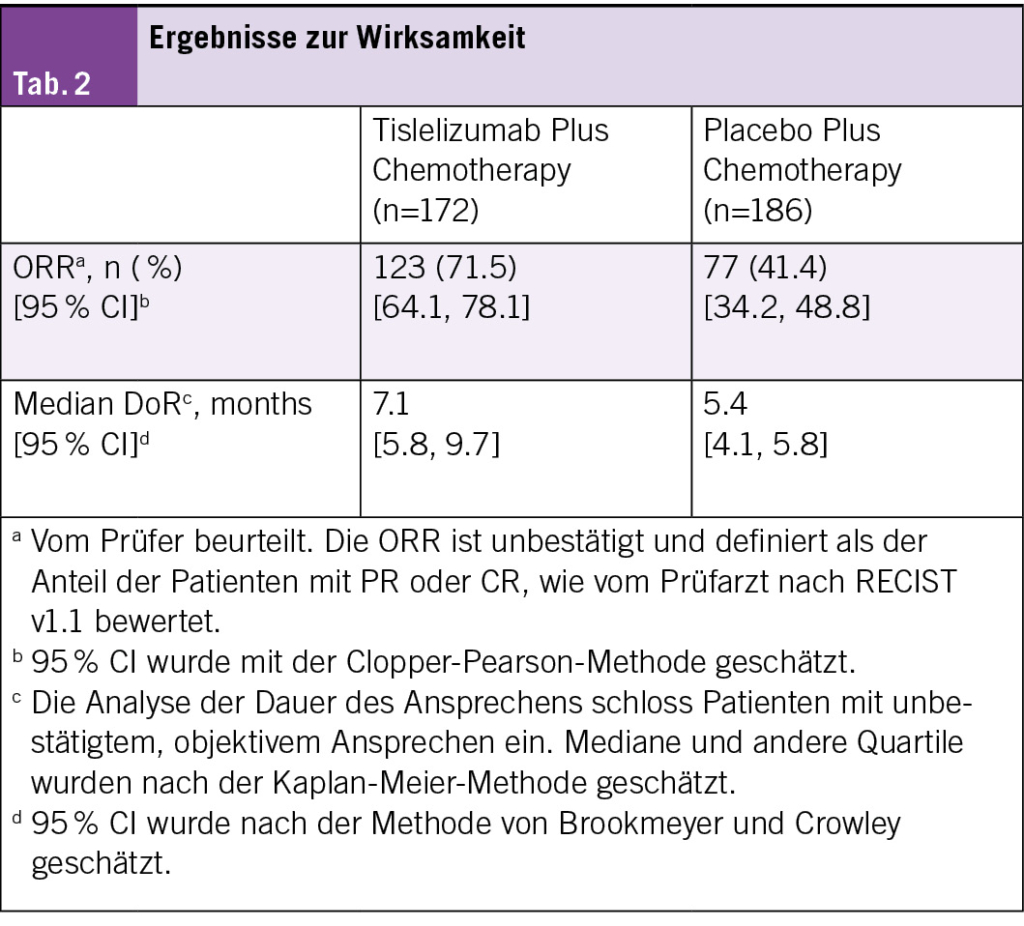
Siebzehn Patienten mit R/R MCL erhielten eine Einzeldosis von LV20.19 CAR-T-Zellen in einer Konzentration von 2.5 × 10⁶ Zellen/kg (Phase I: drei Patienten; Phase II: 14 Patienten). Die beste Gesamtansprechrate (ORR) betrug 100 % (komplettes Ansprechen [CR] = 88 %, partielles Ansprechen = 12 %), und die Phase-II-Wirksamkeitsschwelle für die CR-Rate am Tag 90 wurde überschritten. Zum Zeitpunkt der Datenerfassung waren zwei Patienten rezidiviert und weder das mediane progressionsfreie Überleben noch das Gesamtüberleben wurde bei einer medianen Nachbeobachtungszeit von 15.8 Monaten erreicht. Bei 94 % (n = 16) der Patienten trat ein Zytokinfreisetzungssyndrom vom Grad 1–2 auf. In den ersten 28 Tagen hatten 18 % (n = 3) ein immunzellassoziiertes neurotoxisches Syndrom, davon hatten zwei eine reversible Toxizität vom Grad 3. Drei Patienten erlitten nicht rezidivbedingte Mortalitätsereignisse, die alle im Rahmen einer anhaltenden B-Zell-Aplasie auftraten. Die endgültigen LV20.19-CAR-Produkte wiesen einen höheren Anteil an T-SCM-/T-naiven Zellen auf, und die meisten Patienten erhielten die CAR-T-Zellen innerhalb von acht Tagen nach der Apherese.
Schlussfolgerung
Zusammenfassend konnte gezeigt werden, dass vor Ort adaptiv hergestellte LV20.19-CAR-T-Zellen für R/R-MCL machbar, sicher und wirksam sind. Die beste ORR betrug 100 %, das Sicherheitsprofil war günstig und es kam bisher zu wenigen Rückfällen.
Quelle
Shah NN. Et al. Phase I/II Study of Adaptive Manufactured Lentiviral Anti-CD20/Anti-CD19 Chimeric Antigen Receptor T Cells for Relapsed, Refractory Mantle Cell Lymphoma. Journal of Clinical Oncology 2025 ; 43: 20.https://doi.org/10.1200/JCO-24-02158
Vorhersage des Nutzens einer langfristigen Hormontherapie und Strahlentherapie bei Männern mit hochriskantem Prostatakrebs
In einer kürzlich veröffentlichten Studie wurde die Entwicklung und Validierung eines Biomarkers für digitale Pathologie mit künstlicher Intelligenz zur Vorhersage des Nutzens einer langfristigen Hormontherapie und Strahlentherapie bei Männern mit Hochrisiko-Prostatakrebs über mehrere Phase III Studien hinweg beschrieben.
Der klinische Nutzen der Androgendeprivationstherapie (ADT) in Verbindung mit Strahlentherapie (RT) bei lokal fortgeschrittenem Prostatakrebs (PCa) ist gut dokumentiert. Studien haben einen klinischen Nutzen für Hochrisikopatienten gezeigt, die eine langfristige ADT (LT-ADT) im Vergleich zu einer kurzfristigen ADT (ST-ADT) erhalten, wodurch LT-ADT zum Standard der Versorgung wurde. Allerdings sind behandlungsassoziierte Toxizitäten ein wichtiges Anliegen für Patienten, die sich einer LT-ADT unterziehen, und es besteht ein Bedarf an prädiktiven Werkzeugen zur Steuerung der ADT-Dauer. Autoren einer kürzlich publizierten Studie bemühten sich, den ersten prädiktiven Biomarker für LT-ADT im Vergleich zu ST-ADT bei lokalisiertem PCa mithilfe mehrerer Phase-III-NRG-Oncology-RTOG-randomisierten-Studien zu trainieren und zu validieren.
Methoden
Ein multimodaler, auf künstlicher Intelligenz (MMAI) basierender prädiktiver Biomarker wurde für die langfristige (LT) versus kurzfristige (ST) ADT trainiert, wobei digitale Prostatabiopsiebilder und klinische Daten (Alter, prostataspezifisches Antigen, Gleason- und T-Stadium) aus sechs NRG-Oncology-Phase-III-Studien zur randomisierten Radiotherapie verwendet wurden. Der neuartige, auf MMAI basierende Biomarker wurde entwickelt, um den differenziellen Nutzen der LT-ADT bezüglich des primären Endpunkts, der Fernmetastasen (DM), vorherzusagen. Die prädiktive Nützlichkeit von MMAI wurde in einer siebten randomisierten Studie, RTOG 9202 (N = 1.192), validiert, in welcher Männer nach dem Zufallsprinzip der RT + ST-ADT (4 Monate) versus RT + LT-ADT (28 Monate) zugewiesen wurden. Fine-Gray- und kumulative Inzidenzanalyse für DM sowie sekundär für Tod mit DM wurden durchgeführt. Todesfälle ohne DM wurden als konkurrierende Risiken behandelt.
Ergebnisse
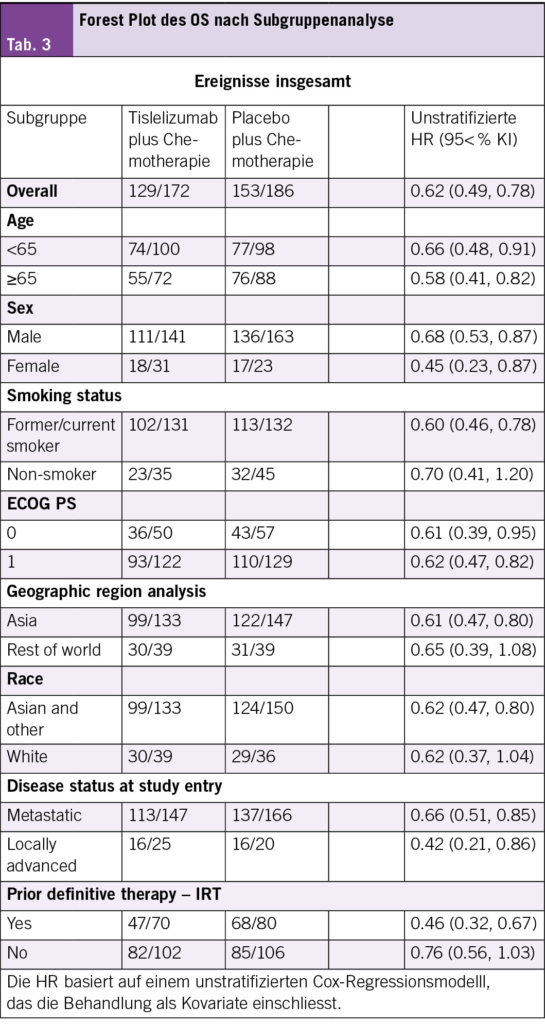
In der Validierungsgruppe (medianer Follow-up, 17,2 Jahre) verbesserte LT-ADT signifikant das DM von 26 % auf 17 % (Subdistributions-Hazard-Ratio [sHR], 0.64 [95 % CI, 0.50 bis 0.82], P < .001). Es wurde eine signifikante prädiktive Interaktion zwischen Biomarker und Behandlung beobachtet (P = .04) für DM, wobei Männer mit positiven MMAI-Biomarkern (n = 785, 66 %) ein reduziertes DM mit LT-ADT im Vergleich zu ST-ADT hatten (sHR, 0,55 [95 % CI, 0.41 bis 0.73], P < .001), während kein Behandlungsvorteil für Männer mit negativen MMAI-Biomarkern (n = 407; sHR, 1,06 [95 % CI, 0,61 bis 1.84], P = .84) beobachtet wurde. Der geschätzte 15-Jahres-DM-Risiko-Unterschied zwischen RT + LT-ADT und RT + ST-ADT betrug 14 % bei Männern mit positiven MMAI-Biomarkern und 0 % bei Männern mit negativen MMAI-Biomarkern. Der MMAI-Biomarker war auch prognostisch für DM, unabhängig von der Behandlung (sHR, 2.35 [95 % CI, 1.72 bis 3.19], P < 0.001).
Fazit
Soweit bekannt ist, ist das MMAI-Modell der erste validierte prädiktive Biomarker zur Bestimmung der Dauer der ADT mit RT bei lokalisiertem/lokal fortgeschrittenem PCa. Ungefähr ein Drittel der Männer mit hochriskantem Prostatakrebs könnte sicher von zusätzlichen 24 Monaten Androgendeprivationstherapie (ADT) und der damit verbundenen Morbidität verschont bleiben.
Quelle
Armstrong A et al. Development and Validation of an artificial intelligence digital pathology biomarker to predict benefit of long-termhormonal therapy and radiotherapy in men with high-risk prostate cancer across multiple phase III trials J Clin Oncol 2025 ; 00:1-11. DOI https://doi.org/10.1200/JCO.24.00365
SwissBreastCare
Bethanienspital
Toblerstrasse 51
8044 Zürich