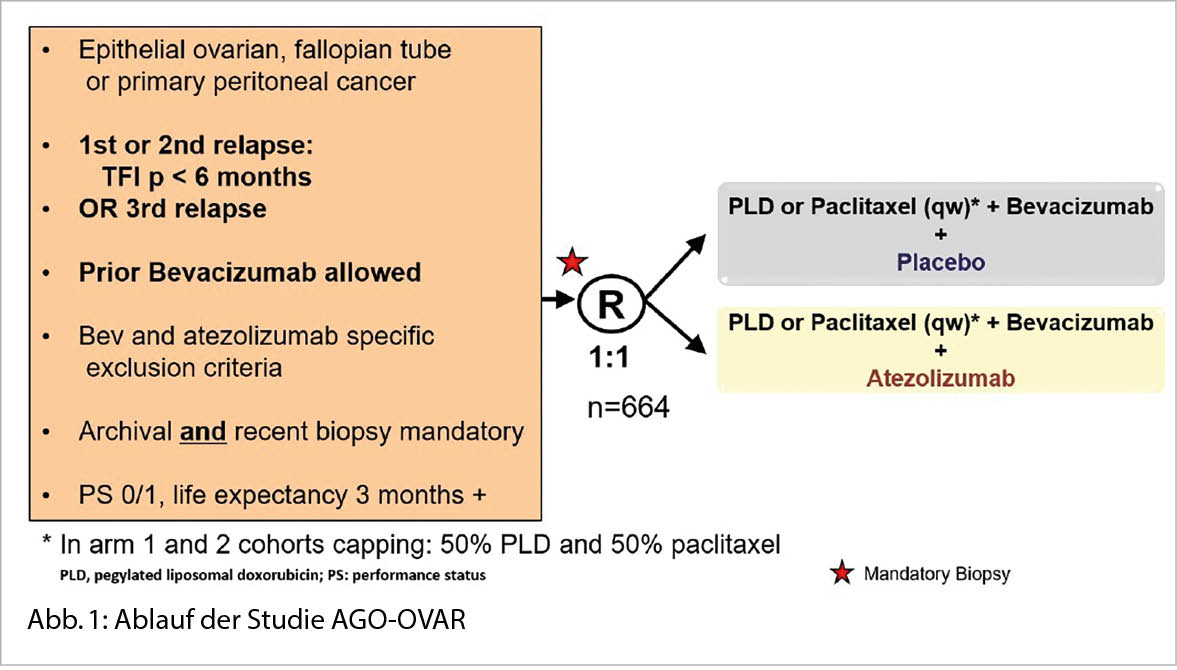
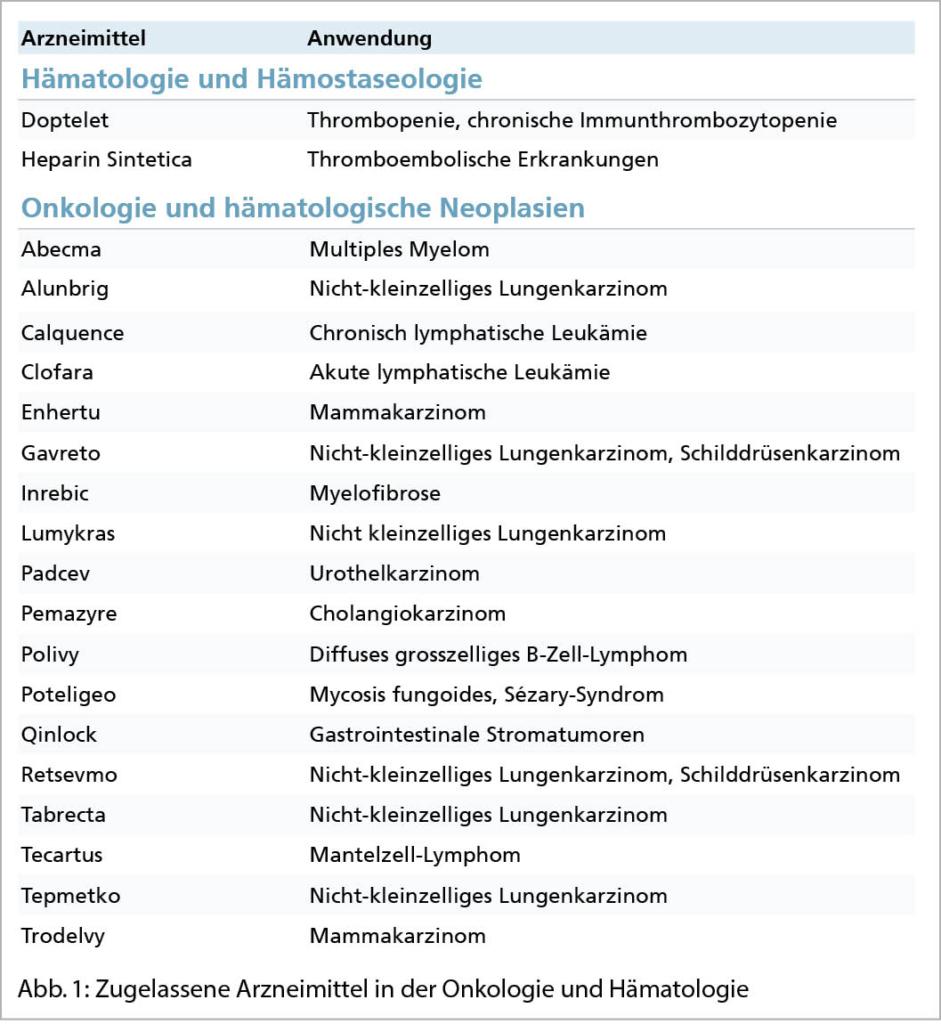
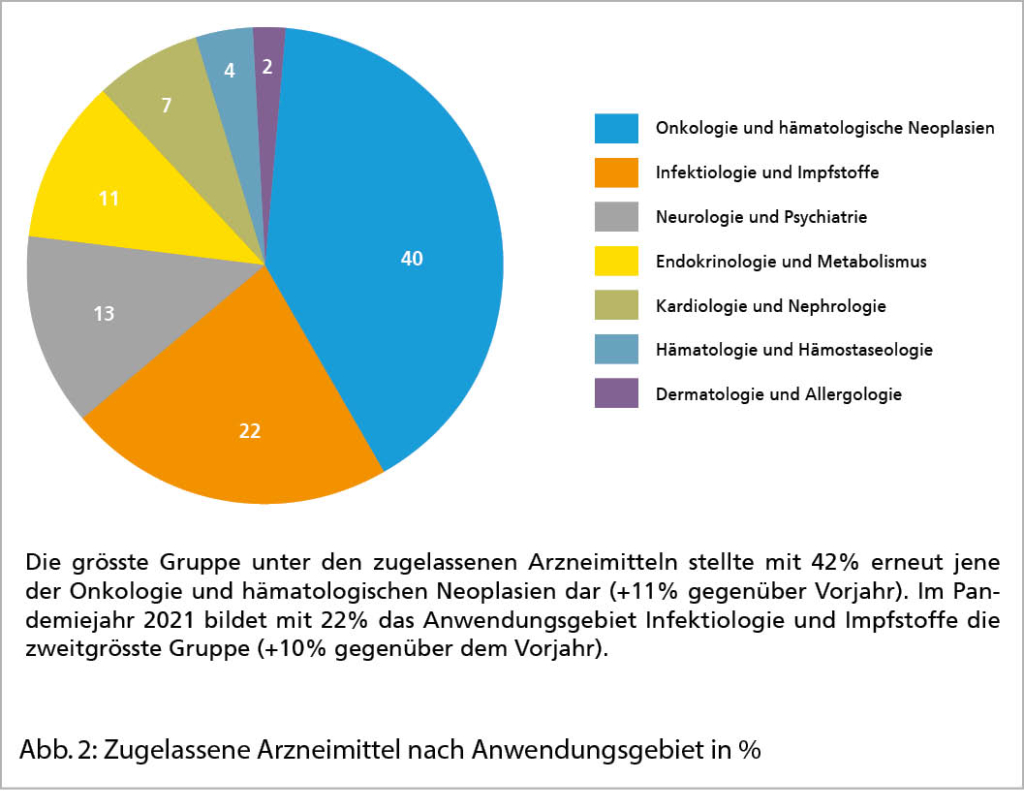
Aufnahme- und Überlebensergebnisse nach Immun-Checkpoint-Inhibitor-Therapie bei Patienten mit fortgeschrittenen soliden Krebserkrankungen, die für eine Studie nicht in Frage kommen
Quelle: Parikh RB et al. Uptake and Survival Outcomes Following Immune Checkpoint InhibitorTherapy Among Trial-Ineligible Patients With Advanced Solid Cancers. JAMA Oncolog. 2021;7(12):1843-1850. doi:10.1001/jamaoncol.2021.4971, Published online November 4, 2021.
Immun-Checkpoint-Inhibitoren (ICIs) gehören zur Standardbehandlung von Patienten mit vielen fortgeschrittenen soliden Tumoren.
Patienten mit schlechtem Leistungsstatus oder Organdysfunktion sind traditionell nicht für die Teilnahme an randomisierten klinischen Studien mit ICIs geeignet. Das Ziel einer kürzlich veröffentlichten Studie war die Bewertung des ICI-Einsatzes und der Überlebenschancen bei Patienten mit fortgeschrittenen Krebserkrankungen, die aufgrund ihres schlechten Leistungszustands oder ihrer Organfunktionsstörung traditionell nicht für Studien in Frage kommen.
Design und Teilnehmer
Diese retrospektive Kohortenstudie wurde in 280 Onkologiepraxen in den USA durchgeführt und umfasste 34’131 Patienten (9318 [27,3 %], die nicht für die Studie in Frage kamen), die zwischen Januar 2014 und Dezember 2019 eine systemische nicht-zielgerichtete Erstlinientherapie für neu diagnostiziertes, metastasiertes oder rezidiviertes nicht-kleinzelliges Lungen-, Urothelzell-, Nierenzell- oder Leberzellkarzinom begonnen hatten. Die Datenanalyse wurde vom 1. Dezember 2019 bis zum 1. Juni 2021 durchgeführt.
Die Studienuntauglichkeit wurde mit dem Eastern Cooperative Oncology Group Performance Status 2 oder dem Vorliegen einer Nieren- oder Leberfunktionsstörung definiert; die Therapie war eine systemische Erstlinientherapie.
Ergebnisse
Der Zusammenhang zwischen der Nichtteilnahme an der Studie und dem Einsatz von ICI Monotherapie wurde anhand von logistischen Regressionen mit inverser Wahrscheinlichkeitsgewichtung (IPW) untersucht. Die vergleichbaren Überlebensergebnisse nach ICI- und Nicht-ICI-Therapie bei Patienten, die für die Studie nicht in Frage kamen, wurden anhand von IPW-Überlebensanalysen bewertet.
Da die Autoren nicht proportionale Gefährdungen beobachteten, berichteten sie über 12- und 36-monatige eingeschränkte Überlebenszeiten (RMSTs) und zeitlich variierende Hazard Ratios von weniger als 6 Monaten und 6 Monate oder länger.
In der Gesamtkohorte (n = 34’131) lag das mittlere Alter (IQR) bei 70 (62-77) Jahren; 23’586 (69 %) waren Weisse, und 14’478 (42 %) waren Frauen. Während des Studienzeitraums stieg der Anteil der Patienten, die eine ICI-Monotherapie erhielten, von 0 % auf 30,2 % bei den Patienten, die für die Studie ungeeignet waren und von 0,1 % auf 19,4 % bei den Patienten, die für die Studie in Frage kamen. Die Nicht-Teilnahme an der Studie war ICI-Monotherapie assoziiert (IPW-bereinigte Odds Ratio im Vergleich zu Nicht-ICI-Therapie, 1,8; 95 % CI, 1,7-1,9). Bei den Patienten, die für die Studie nicht in Frage kamen, gab es im Gesamtüberleben keine Unterschiede zwischen ICI-Monotherapie, ICI-Kombinationstherapie und Nicht-ICI-Therapie nach 12 Monaten (RMST, 7,8 vs. 7,7 vs. 8,1 Monate) oder 36 Monaten (RMST, 15,0 vs. 13,9 vs. 14,4 Monate). Im Vergleich zur Nicht-ICI-Therapie zeigte die ICI-Monotherapie Hinweise auf einen frühen Schaden (IPW-bereinigte HR innerhalb von 6 Monaten, 1,2; 95 % KI, 1,1-1,2), aber einen späten Nutzen (bereinigte HR bei Patienten, die 6 Monate überlebten, 0,8; 95 % KI, 0,7-0,8).
Schlussfolgerungen und Relevanz
In dieser Kohortenstudie wurden Patienten, die für die Studie in Frage kamen, mit anderen Patienten mit fortgeschrittenen Krebserkrankungen verglichen, die für die Studie nicht in Frage kamen, bevorzugt eine ICI-Erstlinientherapie zu erhalten. Es wurde kein Unterschied im Überleben zwischen ICI- und Nicht-ICI-Therapien bei Patienten, die für die Studie nicht in Frage kamen festgestellt. Die positiven Ergebnisse für ICI in Phase-3-Studien lassen sich möglicherweise nicht auf diese anfällige Population übertragen.
Die Mär vom gesunden Dampfen – Das Einatmen von Aerosolen alternativer Tabakerzeugnisse birgt Gesundheitsrisiken
Quelle : Karey E. et al. Tobacco Use Insights 2022; 15: 1–6
Seit der Einführung elektronischer Zigaretten (E-Zigaretten) auf dem US-amerikanischen Markt vor 15 Jahren ist die Zahl der «Vaper» exponentiell angestiegen (1, 2). Auch der Konsum von Wasserpfeifentabak (Shisha) erfreut sich in den USA immer grösserer Beliebtheit, wobei der Konsum im Jahresvergleich um bis zu 40 % zunimmt (3).
Die Beachtung von Gesundheitsrisiken alternativer Tabakerzeugnisse (ATPs), einschliesslich E-Zigaretten und Shisha, hat nicht mit deren wachsender Beliebtheit und Nutzung Schritt gehalten (4). Nicht nur die Inhaltsstoffe und Toxizitätsprofile von ATPs unterscheiden sich tendenziell von denen von Tabakzigaretten (5-7), sondern auch die demografischen Merkmale der Konsumenten und die Art der Inhalation können je nach Tabakprodukt variieren (8-11). Wichtig ist, dass produktspezifische Verhaltensweisen das Gesundheitsrisiko beeinflussen können: Die Inhalationstiefe (ein Mass dafür, wie tief der Tabakrauch in die Lunge eingeatmet wird) ist bei Zigarettenrauchern grösser als bei Personen, die andere brennbare Tabakprodukte rauchen (12-14). Tatsächlich führen Ärzte seit mehr als einem Jahrhundert ein erhöhtes Auftreten von chronischer Bronchitis bei Zigarettenrauchern auf dieses zigarettenspezifische Verhalten zurück.
Mehrere Studien haben die Inhalationstiefe des Tabakrauchs als unabhängigen Risikofaktor für Lungen- und Kehlkopfkrebs ermittelt, unabhängig von der Anzahl der Packungsjahre (15-17). Unabhängig davon haben epidemiologische Studien zu den brennbaren Tabakerzeugnissen den stärksten Zusammenhang zwischen Zigaretten und Lungenkrebsdiagnosen festgestellt (12, 17-19). Zigarettenraucher, die den Tabakrauch nicht in die Lunge inhalieren, haben jedoch ein geringeres Lungenkrebsrisiko (20). Zigarettenrauch, der tiefer inhaliert wird, kann somit das Lungenkrebsrisiko erhöhen, da die Lungenexposition gegenüber Ablagerung von Tabakrauch-Schadstoffen erhöht wird.
Die unterschiedlichen Bestandteile und das Erhitzungspotenzial der ATPs und das Verhalten der Konsumenten haben es schwierig gemacht, die Gesundheitsrisiken der ATPS zu charakterisieren. Bislang wurden bei den meisten Toxizitätsstudien zu ATPs etablierte Endpunkte der Untersuchungen des Konsums von Zigaretten als Grundlage für das Studiendesign verwendet. Um zu beurteilen, wo ATPs auf dem Kontinuum der schädlichen Wirkungen des Tabaks einzuordnen sind, haben Studien dazu tendiert, die relativen biologischen Reaktionen auf ATPs mit denen von Zigaretten zu vergleichen.
Das Ziel einer kürzlich veröffentlichten Studie (21) war die Charakterisierung der Ausatmungsprofile von zwei beliebten ATPs: den elektronischen Zigaretten (E-Zigaretten) und den Wasserpfeifen (Shisha) und die Bestimmung, ob die Ausatmungsmuster von ATPs repräsentativ für die Ausatmungsmuster von Zigaretten sind.
Experimentelles
Die Ausatmungsmuster (nur Mund, nur Nase oder sowohl Mund als auch Nase) wurden bei Personen erfasst, die beim Konsum eines erkennbaren Tabakprodukts (Zigarette, E-Zigarette oder Wasserpfeife) beobachtet wurden. Zigarettenraucher und E-Zigarettenraucher wurden auf den Strassen der Stadt, Wasserpfeifenraucher in Wasserpfeifenbars beobachtet.
Ergebnisse
Insgesamt wurden 341 Personen beim Konsum von Tabakerzeugnissen beobachtet: 122 Zigarettenraucher, 96 Wasserpfeifenraucher und 123 E-Zigarettenraucher. Personen, die sich nach aussen hin als männlich präsentierten, machten mindestens zwei Drittel aller beobachteten Personen aus, unabhängig vom verwendeten Produkt. Von den E-Zigaretten-Nutzern verwendete etwa die Hälfte Behälter-ähnliche Geräte (52 %). Unabhängig von der Art des Geräts machten Frauen weniger als 25 % der «Vaper» aus. Chi-Quadrat-Analysen ergaben, dass sich die Ausatmungsmuster nicht signifikant nach Geschlecht unterschieden.
Unabhängig vom Tabakprodukt war die ausschliessliche Mundinhalation häufiger als die ausschliessliche Nasenexhalation. Proportionstests ergaben jedoch, dass ATP-Konsumenten (sowohl Wasserpfeifen- als auch E-Zigarettenkonsumenten) signifikant seltener eine ausschliessliche Mundausatmung praktizierten als Zigarettenraucher. Überraschenderweise praktizierten Personen, die E-Zigaretten rauchten, die ausschliessliche nasale Ausatmung fast viermal so häufig wie Zigarettenraucher (19,5 % bzw. 4,9 %). Interessanterweise wurde bei Wasserpfeifenrauchern nie beobachtet, dass sie ausschliesslich durch die Nase ausatmeten, obwohl 50 % eine doppelte Ausatmung praktizierten. Bei den Nutzern von E-Zigaretten wurde ein signifikanter Zusammenhang zwischen dem Gerätetyp und dem nasalen Ausatmungsmuster festgestellt: Nutzer von Pod-ähnlichen Geräten atmeten mehr als doppelt so häufig ausschliesslich durch die Nase aus wie Nutzer von Geräten mit modularem Tank (26,6 % bzw. 11,9 %). Allerdings wurden ca. 40 % mehr Nutzer von modularen Geräten beobachtet, die jemals durch die Nase ausatmeten (kumulativer Anteil der doppelten und ausschliesslichen nasalen Ausatmung).
Schlussfolgerung
Das nasale Ausatmen von Tabakemissionen scheint ein gemeinsames Merkmal verschiedener Arten von ATPs zu sein. Es ist daher plausibel, dass ATP-spezifisches Konsumverhalten zu einzigartigen gesundheitlichen Folgen für die oberen Atemwege führen kann, die bei Rauchern nicht beobachtet wurden. Daher sollten produktspezifische Verhaltensweisen in die Priorisierung biologischer Endpunkte einfliessen, die in Studien zur Bewertung der Toxizität von ATPs und den gesundheitlichen Auswirkungen von zigarettenspezifischem Verhalten seit mehr als einem Jahrhundert verwendet werden.
Brustzentrum, Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St.Gallen
1. Loukas A, Marti CN, Pasch KE, Harrell MB, Wilkinson AV, Perry CL. Rising vape pod popularity disrupted declining use of electronic nicotine delivery systems among young adults in Texas, USA from 2014 to 2019. Addiction. 2021.
2. Huang J, Duan Z, Kwok J, et al. Vaping versus JUULing: How the extraordinary growth and marketing of JUUL transformed the US retail e-cigarette market. Tobac Control. 2019;28(2):146-151
3. Soulakova JN, Pham T, Owens VL, Crockett LJ. Prevalence and factors associated with use of hookah tobacco among young adults in the U.S. Addict Behav. 2018;85: 21-25
4. Stepanov I, Woodward A. Heated tobacco products: things we do and do not know. Tobac Control. 2018;27(suppl 1):s7
5. Elsayed Y, Dalibalta S, El Kouche M. Chemical characterization and safety assessment of dokha: An emerging alternative tobacco product. Sci Total Environ. 2018;615:9-14
6. Cox S, Ko´smider L, McRobbie H, et al. E-cigarette puffing patterns associated with high and low nicotine e-liquid strength: effects on toxicant and carcinogen exposure. BMC Publ Health. 2016;16(1):999
7. Erythropel HC, Garcia Torres DS, Woodrow JG, et al. Quantification of flavorants and nicotine in waterpipe tobacco and mainstream smoke and comparison to E-cigarette aerosol. Nicotine Tob Res. 2021;23(3):600-604
8. Soule EK, Ramoa C, Eissenberg T, Cobb CO. Differences in puff topography, ˆ toxicant exposure, and subjective response between waterpipe tobacco smoking men and women. Exp Clin Psychopharmacol. 2018;26(5):440-447.
9. 13. McMillen R, Maduka J, Winickoff J. Use of emerging tobacco products in the United States. Journal of Environmental and Public Health. 2012;2012:989474.
10. 14. Meisutovi ˇ c-Akhtarieva M, Prasauskas T, ˇ Ciu ˇ zas D, Kaunelien ˇ e V, Martuzevi ˙ cius ˇ D. The dynamics of exhaled aerosol following the usage of heated tobacco product, electronic cigarette, and conventional cigarette. Aerosol Air Qual Res. 2021;21(8): 200653.
11. 15. Lee YO, Nonnemaker JM, Bradfield B, Hensel EC, Robinson RJ. Examining daily electronic cigarette puff topography among established and nonestablished cigarette smokers in their natural environment. Nicotine Tob Res. 2018;20(10):1283-1288.
12. Benhamou S, Benhamou E, Flamant R. Lung cancer risk associated with cigar and pipe smoking. Int J Cancer. 1986;37(6):825-829
13. Wynder EL, Stellman SD. Comparative epidemiology of tobacco-related cancers. Cancer Res. 1977;37(12):4608-4622
14. Rodenstein DO, Stanescu DC. Pattern of inhalation of tobacco smoke in pipe, ˘ cigarette, and never smokers. Am Rev Respir Dis. 1985;132(3):628-632
15. 17. Wynder EL, Stellman SD. Comparative epidemiology of tobacco-related cancers. Cancer Res. 1977;37(12):4608-4622. 18. Rodenstein DO, Stanescu DC. Pattern of inhalation of tobacco smoke in pipe, ˘ cigarette, and never smokers. Am Rev Respir Dis. 1985;132(3):628-632.
16. Ramroth H, Dietz A, Becher H. Intensity and inhalation of smoking in the aetiology of laryngeal cancer. Int J Environ Res Publ Health. 2011;8(4):976-984
17. Lubin JH, Jun-Yao L, Xiang-Ghen X, et al. Risk of lung cancer among cigarette and pipe smokers in Southern China. Int J Cancer. 1992;51(3):390-395.
18. 26. Levin ML, Goldstein H, Gerhardt PR. Cancer and Tobacco Smoking. J Am Med Assoc. 1950;143(4):336-338.
19. 27. Chow W-H, Schuman LM, McLaughlin JK, et al. A cohort study of tobacco use, diet, occupation, and lung cancer mortality. Cancer Causes Control. 1992;3(3): 247-254.
20. Fukumoto K, Ito H, Matsuo K, et al. Cigarette smoke inhalation and risk of lung cancer: a case-control study in a large Japanese population. Eur J Cancer Prev : The Official Journal of the European Cancer Prevention Organisation (ECP). 2015;24(3): 195-200
21. Karey E. et al. Tobacco Use Insights 2022; 15: 1–6