La prescription inappropriée d’ antibiotiques est courante pour les infections respiratoires. Cela est notamment le cas dans les établissements médico-sociaux (EMS), contribuant à l’ antibiorésistance et exposant les résidents à des effets indésirables évitables. Cet article explore différentes pistes d’ optimisation des prescriptions, en s’ appuyant à la fois sur des stratégies validées de programmes d’ antibiotic stewardship, et sur des approches innovantes, telles que des algorithmes décisionnels intégrant des tests point-of-care ou l’ utilisation de l’ échographie pulmonaire comme aide au diagnostic.
The inappropriate prescription of antibiotics is common for respiratory infections. This is particularly the case in nursing homes, contributing to antibiotic resistance and exposing residents to preventable adverse effects. This article explores various ways to optimise prescribing practices, drawing on both validated antibiotic stewardship programme strategies and innovative approaches, such as decision-making algorithms incorporating point-of-care tests or the use of lung ultrasound as a diagnostic aid.
Keywords: Antibiotic prescription, Nursing homes, Antibiotic stewardship, Respiratory infections, Rapid diagnostic tests
La consommation d’ antibiotiques
La résistance aux antibiotiques est une menace pour la santé publique mondiale, et l’ utilisation inappropriée des antibiotiques en est une contribution importante (1). Les résidents d’ établissements médicaux-sociaux (EMS) sont deux fois plus susceptibles de recevoir des antibiotiques que les personnes âgées vivant dans la communauté (2). Hors, la moitié de ces prescriptions serait inappropriée (3). Une récente étude sur la prévalence des prescriptions a montré qu’ en Suisse, 2.9 % des résidents recevaient un traitement antibiotique le jour de l’ enquête, avec une différence entre les établissements des cantons de Vaud et de Saint-Gall (3.9 % contre 1.8 %; p = 0.05) (4). Les situations les plus fréquentes de prescription inappropriée dans les EMS sont la bactériurie asymptomatique et les infections respiratoires. En plus des résistances, les antibiotiques peuvent nuire directement aux résidents en provoquant des effets secondaires, comme des troubles gastro-intestinaux et des éruptions cutanées, ainsi que des altérations du microbiote (5, 6). Les résidents d’ EMS à haute consommation d’ antibiotiques présentent un risque accru de troubles gastro-intestinaux, même sans être directement exposés aux antibiotiques, par rapport à ceux qui résident dans des établissements où la consommation est plus basse (7).
Les infections respiratoires
Le taux de prescription pour les infections respiratoires dans les établissements européens varie de 53 à 80 % (2), avec beaucoup de sur-prescription pour les bronchites aiguës qui sont la plupart du temps d’ origine virale et donc spontanément résolutives (8). Plusieurs facteurs expliquent cette consommation élevée: (i) une incidence accrue d’ infections respiratoires liée à l’ immunosénescence et aux troubles de la déglutition favorisant les fausses routes (9), et (ii) la difficulté d’ identifier les résidents avec une pneumonie en raison d’ une présentation clinique non spécifique (7), de la disponibilité limitée des tests diagnostiques notamment les examens sanguins et radiologiques et l’ absence de médecins rapidement sur place dans la plupart des établissements (3).
Les programmes d’ antibiotic stewardship
Les programmes d’ antibiotic stewardship, ou programmes de bon usage des antibiotiques, rassemblent l’ ensemble des stratégies visant à garantir la prescription d’ antibiotiques la plus adaptée aux patients nécessitant un traitement, en veillant à leur administration à la dose appropriée et pendant une durée optimale (10). La mise en place de programmes d’ antibiotic stewardship dans les EMS est une tâche difficile. Contrairement au contexte des soins aigus, ces programmes ont tendance à être moins bien organisés et à disposer de moins de ressources (3). Les autres obstacles à l’ implémentation de ces programmes sont: (i) l’ accès limité à certains tests diagnostiques sur site (analyses de laboratoire et radiologie), combiné à une utilisation inadéquate d’ autres tests (stix urinaires), (ii) l’ évaluation clinique initiale effectuée par le personnel infirmier avec de nombreuses prescriptions faites par téléphone, (iii) l’ absence de données sur les résistances dans ce setting, et (iv) le haut taux de colonisation, notamment des voies urinaires et de la peau (3). Même si peu d’ études évaluent l’ efficacité et la sécurité des programmes d’ antibiotic stewardship dans les EMS, certaines revues de littérature suggèrent que ces programmes tendent à améliorer l’ usage des antimicrobiens sans augmenter les hospitalisations ni la mortalité (11–14).
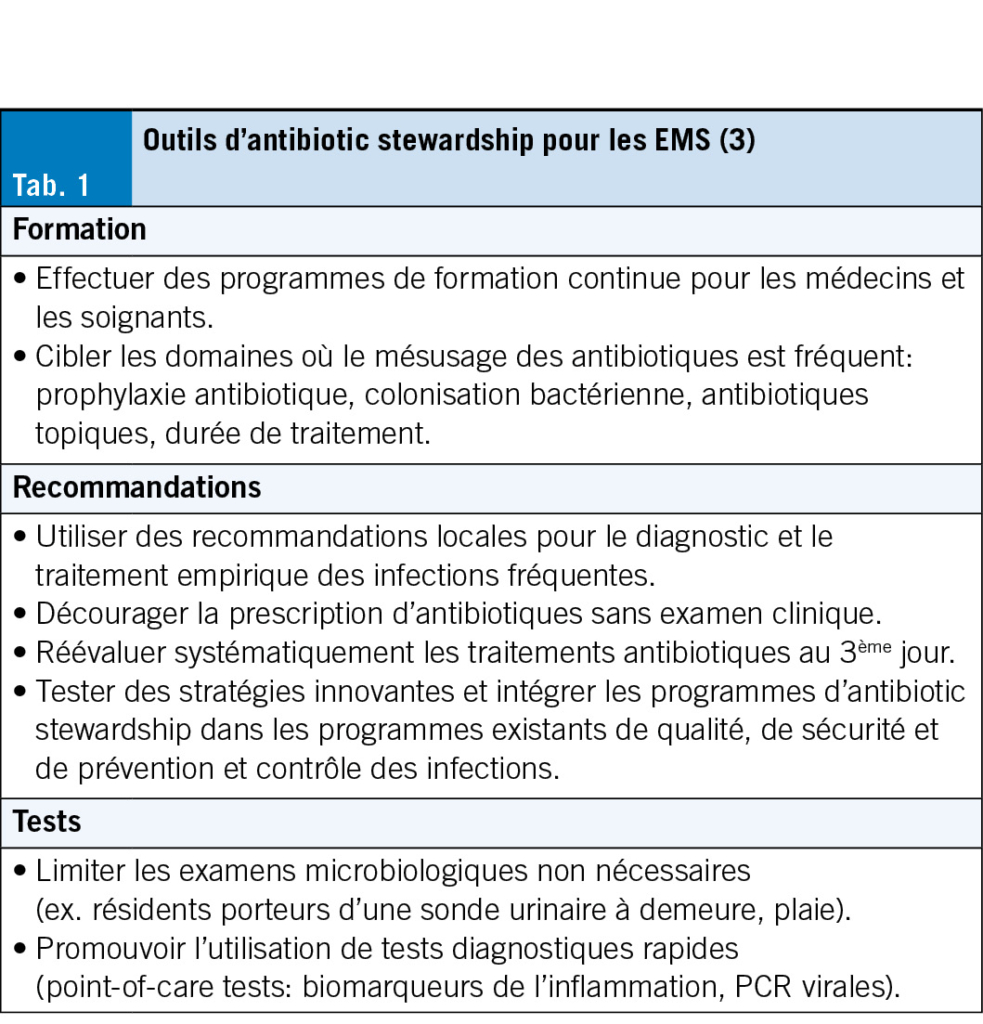
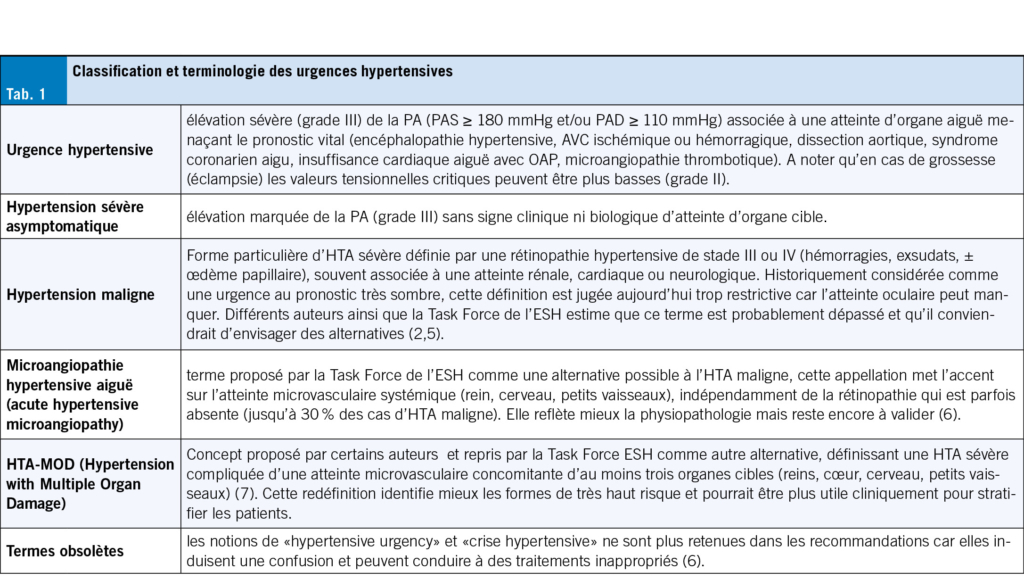
Compte tenu du taux élevé de sur-prescriptions et de l’ effet négatif sur les résidents, il est urgent de mettre en place des programmes d’ antibiotic stewardship adaptés au contexte des EMS afin de réduire la pression de sélection antibiotique et d’ améliorer la qualité des soins (11). De nombreuses interventions possibles existent (Tab. 1), telles que la promotion de recommandations locales pour le diagnostic et la prise en charge des infections fréquentes, la réduction des tests microbiologiques inutiles et la promotion des tests diagnostiques rapides «point-of-care» (POC), pouvant être réalisés sur place et avec un résultat disponible rapidement (3).
Outils d’ antibiotic stewardship pour les infections respiratoires
Recommandations locales
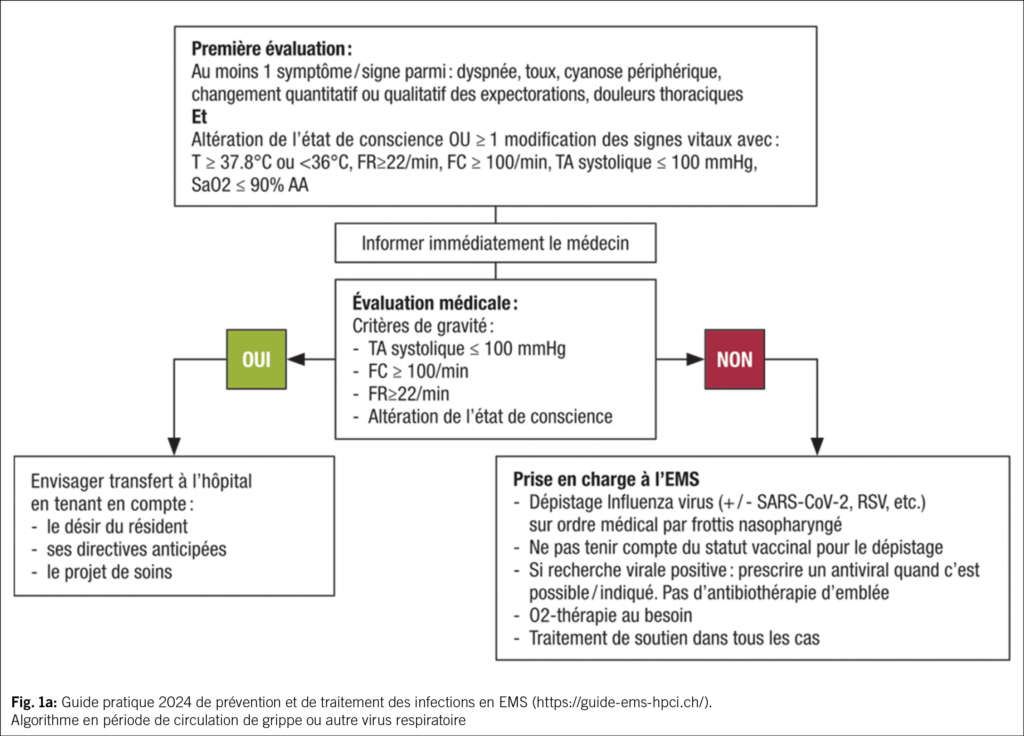
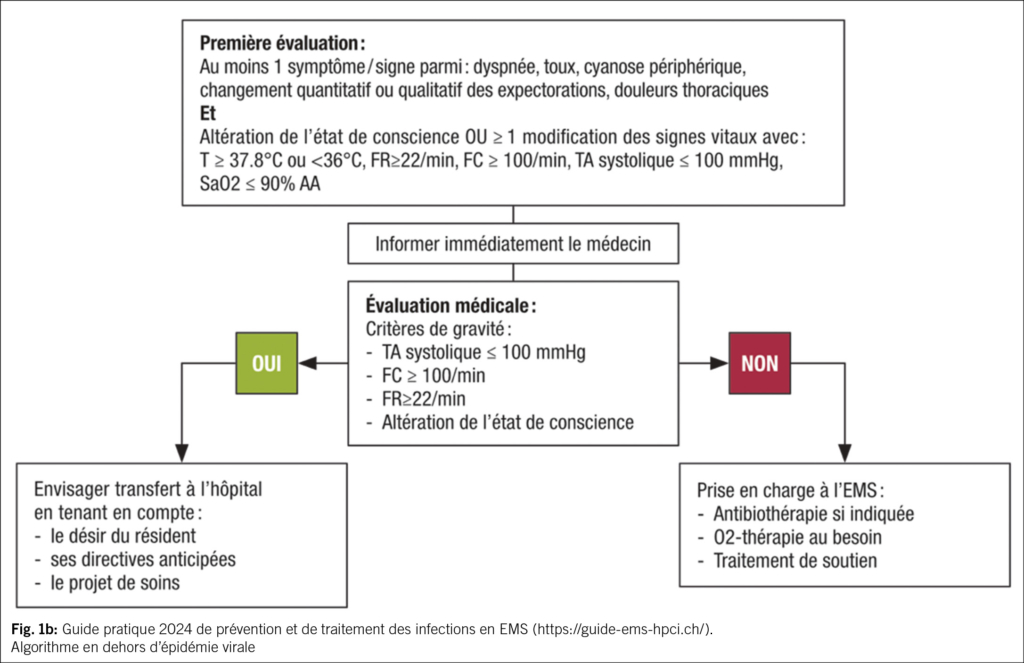
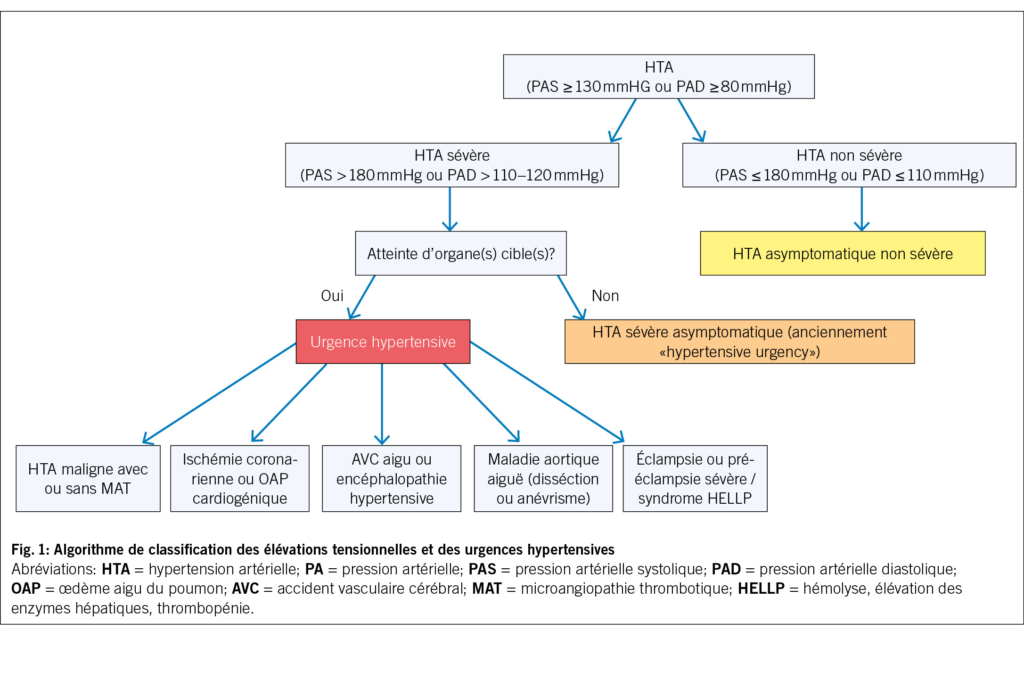
Une partie des EMS suisses (en Suisse romande, bernois et tessinois) bénéficie de recommandations locales afin de guider le diagnostic et la prise en charge empirique des infections fréquentes (https://guide-ems-hpci.ch/). Une étude « qualité des soins » dans les EMS vaudois a montré que la diffusion de recommandations de prescription empirique d’ antibiotiques et la mise en place de cercles de qualité regroupant médecins, pharmaciens et infirmiers, permettaient de diminuer les prescriptions (15). Concernant les infections respiratoires, les recommandations font la distinction entre leur prise en charge pendant et en dehors de la période de la grippe et autres virus respiratoires (Fig. 1a et 1b). En période d’ épidémie virale, il est recommandé de dépister les virus respiratoires et de ne pas prescrire une antibiothérapie d’ emblée si le dépistage revient positif.
Biomarqueurs de l’ inflammation
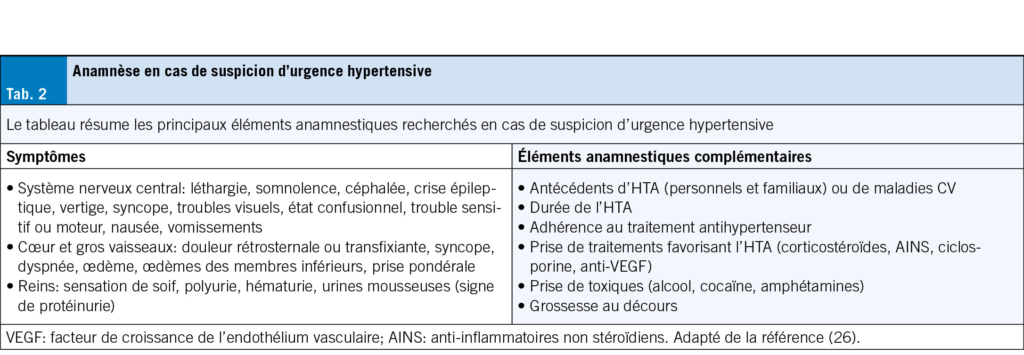
Une étude randomisée contrôlée récente menée dans des EMS hollandais a démontré une diminution significative des prescriptions d’ antibiotiques chez les résidents avec infections respiratoires dans les EMS qui avaient accès à la protéine C-réactive (CRP) en POC par rapport aux EMS du groupe contrôle (54 % versus 83 % de prescription, p < 0.001) (16). Bien que ces résultats soient encourageants, ils sont difficilement transposables au contexte suisse. En effet, dans l’ étude citée, des médecins étaient présents sur place pour l’ évaluation clinique des résidents, contrairement à notre contexte, où l’ évaluation clinique des résidents en EMS est principalement assurée par l’ équipe infirmière, et les décisions de prescription sont souvent prises par téléphone par les médecins.
Dépistage des virus respiratoires
Un deuxième exemple de test POC est le dépistage des virus respiratoires. Cependant, bien qu’ il s’ agisse de tests moléculaires dont le résultat est généralement disponible en 1 à 2 heures, ils sont aujourd’ hui effectués dans des laboratoires en dehors des EMS, ce qui retarde l’ obtention du résultat pour une prise de décision en temps réel. Une méta-analyse a montré que l’ utilisation systématique des tests rapides moléculaires pour les virus respiratoires aux urgences ne réduisait pas les prescriptions d’ antibiotiques (17). Cependant, l’impact de ces tests dans les EMS n’a pas été évalué, et les tests SARS-CoV-2 n’ont pas été étudiés dans cette étude.
Données dans les EMS suisses francophones
Facteurs associés aux prescriptions lors d’ infections respiratoires
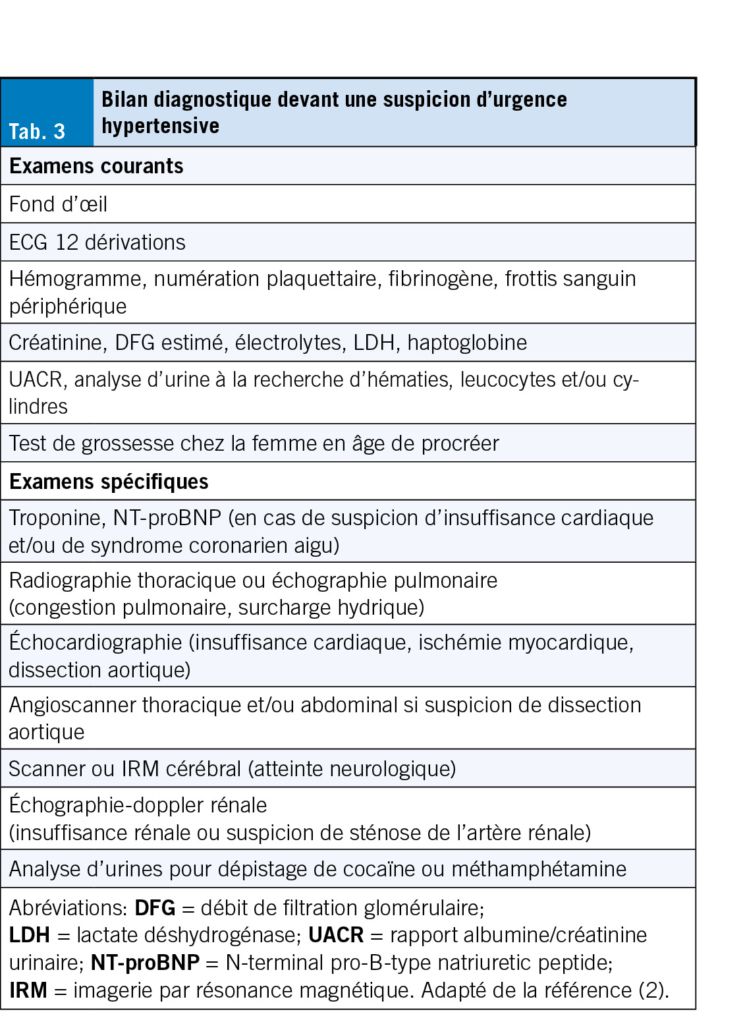
Dans une cohorte de 114 résidents présentant une infection respiratoire basse (18), 55 % ont reçu des antibiotiques, correspondant à un taux de prescription relativement faible par rapport à la moyenne observée dans les établissements européens (53 à 80 %) (2). Parmi les résidents traités par antibiotique, la majorité (74 %) n’ avait pas de signe de pneumonie radiologique, suggérant des prescriptions inappropriées.
Plusieurs facteurs étaient associés à la prescription d’ antibiotiques: (i) un score de fragilité (Frailty) ≥ 7 chez le résident, (ii) une saturation en oxygène < 92 %, reflétant la sévérité de l’ infection, (iii) l’ absence de bilan biologique incluant la CRP et/ou une formule sanguine, et (iv) des caractéristiques institutionnelles, telles qu’ un établissement situé en zone urbaine ou la présence d’ un médecin de sexe masculin. La réalisation d’ un test par PCR pour les virus respiratoires était le seul facteur protecteur contre les prescriptions inappropriées.
Cette étude suggère que les tests diagnostiques, en particulier les bilans sanguins et les PCR virales, pourraient réduire les prescriptions, notamment inappropriées, d’ antibiotiques. Pourtant, leur utilisation reste faible en pratique, avec dans cette cohorte seulement 44 % des résidents qui ont bénéficié d’ un test viral et 14 % d’ un test sanguin. Les tests POC apparaissent comme une solution adaptée et leur utilisation pourrait être encouragée comme outil d’ antibiotic stewardship.
Développement d’ un score de prédiction de la pneumonie
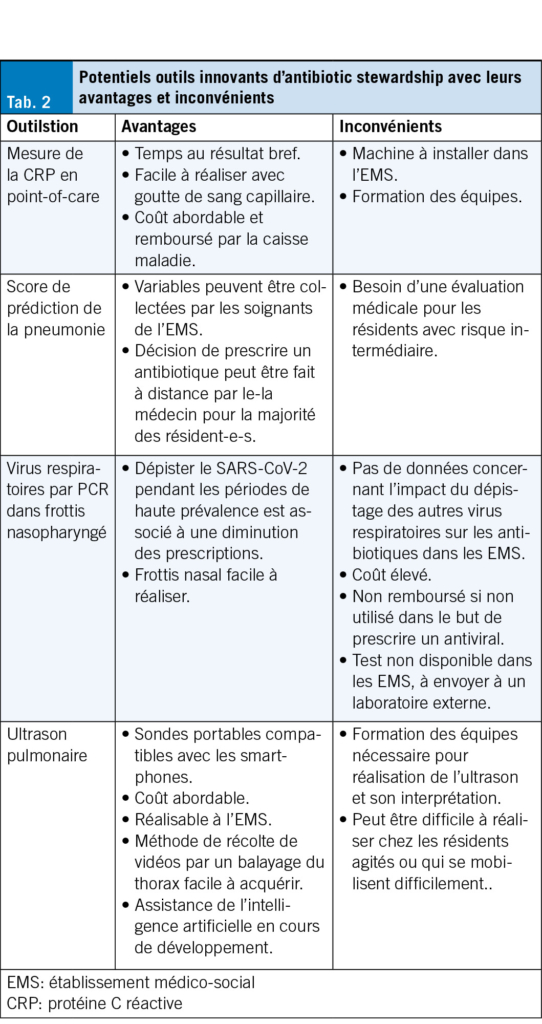
Dans cette même cohorte augmentée de 92 résidents depuis la première analyse (206 au total), un score décisionnel combinant signes vitaux et biomarqueurs de l’ inflammation disponibles en POC a été développé pour prédire la présence d’ une pneumonie (SGAIM 2025, abstract 254). Ce score repose sur cinq variables facilement récoltées par le personnel soignant: âge ≥ 80 ans [1 point], indice de masse corporelle < 18.5 kg/m2 [2 points], fréquence cardiaque > 100/min [1 point], fréquence respiratoire ≥ 22/min [1 point] et CRP > 60 mg/L [2 points], totalisant de 0 à 7 points. Trois niveaux de risque ont été définis: faible (0–1), intermédiaire (2) et élevé (3–7). Le score a montré une bonne performance diagnostique pour les groupes à faible et haut risque (sensibilité 86 %, spécificité 74 %, valeur prédictive positive 71 %, valeur prédictive négative 89 %). Il pourrait être utilisé pour guider la prescription: pas d’ antibiotiques pour les résidents avec un score faible, antibiotiques pour ceux avec un score élevé et évaluation médicale avant la décision pour les résidents avec un score intermédiaire. Bien qu’ il présente un potentiel prometteur pour guider les prescriptions, une étude randomisée contrôlée reste nécessaire pour en confirmer la sécurité clinique et l’ impact sur les prescriptions (Tab. 2).
Dépistage des virus respiratoires
Une étude observationnelle rétrospective menée dans 45 EMS du canton de Vaud (environ 2400 lits) entre 2021 et 2023 a évalué l’ association entre (i) le dépistage du SARS-CoV-2, (ii) un dépistage positif au SARS-CoV-2, et les prescriptions d’ antibiotiques (SGAIM 2025, abstract 257). Si le dépistage en soi n’était pas associé aux prescriptions, un résultat SARS-CoV-2 positif était associé à une réduction des antibiotiques. En moyenne, il faut 3.5 tests positifs pour éviter une prescription. Cela suggère qu’ en contexte de forte prévalence, le dépistage du SARS-CoV-2 pourrait contribuer à réduire les prescriptions d’ antibiotiques. Ces résultats vont dans le sens des recommandations locales de prise en charge des infections respiratoires en période d’ épidémie virale (Fig. 1, Tab. 2).
L’ ultrason pulmonaire
Le diagnostic de pneumonie repose sur un examen radiologique mais la radiographie du thorax est difficilement réalisable en pratique dans les EMS. Dans la cohorte de résidents atteints d’ infection respiratoire précédemment citée, seuls 3 % des résidents ont bénéficié de cet examen (18). L’ échographie pulmonaire, également recommandée par la Société Suisse des Maladies Infectieuses, constitue une alternative intéressante, combinant plusieurs avantages: une bonne performance diagnostique chez les personnes âgées (19) et l’ existence de sondes portables, compatibles avec tablettes et smartphones (20, 21). Réalisable au lit du patient, l’ ultrason pulmonaire permet d’ éviter des déplacements et pourrait devenir une méthode d’ imagerie de choix en EMS. Pour favoriser l’ implémentation de cet outil dans un environnement avec des utilisateurs sans expérience préalable, il a été démontré que des techniques de balayage du thorax, faciles à réaliser, sont aussi efficaces qu’un examen ciblé sur les signes pathologiques (ESCMID 2025, Poster P3146). De plus, l’ interprétation des images guidée par l’ intelligence artificielle semble être très prometteuse, avec le potentiel de faciliter l’ utilisation de l’ ultrason par les cliniciens (22) (Tab. 2).
Conclusion
La consommation inappropriée d’ antibiotiques en EMS, particulièrement en cas d’ infection respiratoire, est un enjeu majeur de santé publique, favorisant l’ antibiorésistance et exposant les résidents à des effets indésirables évitables. Malgré les contraintes structurelles propres à ces établissements, des stratégies ciblées telles que des recommandations adaptées, des tests POC, des outils d’ aide à la décision simples ou l’ échographie pulmonaire présentent un potentiel prometteur afin d’améliorer la pertinence des prescriptions pour les infections respiratoires. Nous avons besoin de plus d’ évidence dans ce contexte de soins sous-étudié afin de pouvoir implémenter des stratégies adaptées, sûres et efficaces. Il est donc nécessaire de valider ces approches novatrices dans des études prospectives pour pouvoir les intégrer aux programmes d’ antibiotic stewardship et optimiser la prescription d’ antibiotiques tout en préservant la qualité de vie des résidents et résidentes.
Dre Alexia Roux 1
Dr Nicola De Pasquale 1
M. Marc Jeanneret 1
Dre Diem-Lan Vu 2, 3
Dre Anne Niquille 4, 5
Dre Eve Rubli Truchard 6
Dre Tosca Bizzozzero 7
Dr Emmanouil Glampedakis 8
Pre Virginie Prendki 9, 10
Pre Noémie Boillat-Blanco 1
1 Service des maladies infectieuses, Hôpital universitaire de Lausanne et Université de Lausanne, Lausanne, Suisse.
2 Unité des maladies transmissibles, Division du médecin cantonal général, Direction de la santé publique, Genève, Suisse.
3 Unité des maladies infectieuses pédiatriques, Département de la femme, de l’enfant et de l’adolescent, Hôpitaux universitaires de Genève, Genève, Suisse.
4 Institut des sciences pharmaceutiques de Suisse occidentale, Université de Genève, Université de Lausanne, Genève, Suisse
5 Département des soins ambulatoires, Unisanté, Centre de soins primaires et de santé publique, Université de Lausanne, Lausanne, Suisse
6 Division de médecine gériatrique et de réadaptation gériatrique, Hôpital universitaire de Lausanne et Université de Lausanne, Lausanne, Suisse
7 Département de médecine interne et de gériatrie, Hôpital de Morges, Morges, Suisse
8 Unité cantonale de lutte contre les infections et de prévention, Service de santé publique, Lausanne, Suisse
9 Division des maladies infectieuses, Hôpitaux universitaires de Genève, Genève, Suisse
10 Division de médecine interne pour personnes âgées, Département de réadaptation et de gériatrie, Hôpitaux universitaires de Genève, Suisse
Copyright
Aerzteverlag medinfo AG
Service des maladies infectieuses
Hôpital universitaire de Lausanne et Université de Lausanne
Lausanne, Suisse
Service des maladies infectieuses
Hôpital universitaire de Lausanne et Université de Lausanne
Lausanne, Suisse
Service des maladies infectieuses
Hôpital universitaire de Lausanne et Université de Lausanne
Lausanne, Suisse
Les auteurs et autrices n’ ont pas déclaré de conflit d’ intérêts en rapport avec cet article
1. Prestinaci F, Pezzotti P, Pantosti A. Antimicrobial resistance: a global multifaceted phenomenon. Pathogens and Global Health. 3 oct 2015;109(7):309‑18.
2. Huang Y, Wei WI, Correia DF, Ma BHM, Tang A, Yeoh EK, et al. Antibiotic use for respiratory tract infections among older adults living in long-term care facilities: a systematic review and meta-analysis. Journal of Hospital Infection. janv 2023;131:107‑21.
3. Dyar OJ, Pagani L, Pulcini C. Strategies and challenges of antimicrobial stewardship in long-term care facilities. Clinical Microbiology and Infection. janv 2015;21(1):10‑9.
4. Héquet D, Kessler S, Rettenmund G, Lemmenmeier E, Qalla-Widmer L, Gardiol C, et al. Healthcare-associated infections and antibiotic use in long-term care residents from two geographical regions in Switzerland. Journal of Hospital Infection. nov 2021;117:172‑8.
5. Mullish BH, Williams HR. Clostridium difficile infection and antibiotic-associated diarrhoea. Clinical Medicine. juin 2018;18(3):237‑41.
6. Lawes T, Lopez-Lozano JM, Nebot CA, Macartney G, Subbarao-Sharma R, Wares KD, et al. Effect of a national 4C antibiotic stewardship intervention on the clinical and molecular epidemiology of Clostridium difficile infections in a region of Scotland: a non-linear time-series analysis. The Lancet Infectious Diseases. févr 2017;17(2):194‑206.
7. Daneman N, Bronskill SE, Gruneir A, Newman AM, Fischer HD, Rochon PA, et al. Variability in Antibiotic Use Across Nursing Homes and the Risk of Antibiotic-Related Adverse Outcomes for Individual Residents. JAMA Intern Med. 1 août 2015;175(8):1331.
8. Sloane PD, Zimmerman S, Nace DA. Progress and Challenges in the Management of Nursing Home Infections. Journal of the American Medical Directors Association. janv 2020;21(1):1‑4.
9. Montoya A, Cassone M, Mody L. Infections in Nursing Homes. Clinics in Geriatric Medicine. août 2016;32(3):585‑607.
10. Hwang S, Kwon KT. Core Elements for Successful Implementation of Antimicrobial Stewardship Programs. Infect Chemother. 2021;53(3):421.
11. Falcone M, Paul M, Yahav D, Orlando G, Tiseo G, Prendki V, et al. Antimicrobial consumption and impact of antimicrobial stewardship programmes in long-term care facilities. Clinical Microbiology and Infection. mai 2019;25(5):562‑9.
12. Nguyen HQ, Tunney MM, Hughes CM. Interventions to Improve Antimicrobial Stewardship for Older People in Care Homes: A Systematic Review. Drugs Aging. avr 2019;36(4):355‑69.
13. Crespo-Rivas JC, Guisado-Gil AB, Peñalva G, Rodríguez-Villodres Á, Martín-Gandul C, Pachón-Ibáñez ME, et al. Are antimicrobial stewardship interventions effective and safe in long-term care facilities? A systematic review and meta-analysis. Clinical Microbiology and Infection. oct 2021;27(10):1431‑8.
14. Wu JH, Langford BJ, Daneman N, Friedrich JO, Garber G. Antimicrobial Stewardship Programs in Long-Term Care Settings: A Meta-Analysis and Systematic Review. J American Geriatrics Society. févr 2019;67(2):392‑9.
15. Plüss-Suard C, Niquille A, Héquet D, Krähenbühl S, Pichon R, Zanetti G, et al. Decrease in Antibacterial Use and Facility-Level Variability After the Introduction of Guidelines and Implementation of Physician-Pharmacist-Nurse Quality Circles in Swiss Long-term Care Facilities. Journal of the American Medical Directors Association. janv 2020;21(1):78‑83.
16. Boere TM, Van Buul LW, Hopstaken RM, Van Tulder MW, Twisk JWMR, Verheij TJM, et al. Effect of C reactive protein point-of-care testing on antibiotic prescribing for lower respiratory tract infections in nursing home residents: cluster randomised controlled trial. BMJ. 21 sept 2021;n2198.
17. Brendish NJ, Schiff HF, Clark TW. Point-of-care testing for respiratory viruses in adults: The current landscape and future potential. Journal of Infection. nov 2015;71(5):501‑10.
18. Roux A, Vu DL, Niquille A, Rubli Truchard E, Bizzozzero T, Tahar A, et al. Factors associated with antibiotics for respiratory infections in Swiss long-term care facilities. Journal of Hospital Infection. nov 2024;153:90‑8.
19. Ticinesi A, Lauretani F, Nouvenne A, Mori G, Chiussi G, Maggio M, et al. Lung ultrasound and chest x-ray for detecting pneumonia in an acute geriatric ward. Medicine. juill 2016;95(27):e4153.
20. Baribeau Y, Sharkey A, Chaudhary O, Krumm S, Fatima H, Mahmood F, et al. Handheld Point-of-Care Ultrasound Probes: The New Generation of POCUS. Journal of Cardiothoracic and Vascular Anesthesia. nov 2020;34(11):3139‑45.
21. Haji-Hassan M, Lenghel LM, Bolboaca SD. Hand-Held Ultrasound of the Lung: A Systematic Review. Diagnostics. 31 juill 2021;11(8):1381.
22. Chu D, Liteplo A, Duggan N, Hutchinson AB, Shokoohi H. Artificial Intelligence in Lung Ultrasound. Curr Pulmonol Rep. 6 mars 2024;13(2):127‑34.