Bei der eosinophilen Ösophagitis (EoE) handelt es sich um eine allergie-artige TH2-Typ-vermittelte, chronische Entzündung der Speiseröhre mit steigender Prävalenz. Der genaue Pathomechanismus ist bis dato (noch) nicht geklärt, man geht primär von einer genetischen Prädisposition mit Exposition gegenüber verschiedenen Umweltfaktoren sowie einer atopischen Diathese aus. Zur Behandlung werden topisch-wirksame Steroide, Protonenpumpeninhibitoren (PPI) und Eliminationsdiäten empfohlen. Ohne adäquate Therapie gipfelt die EoE in Dysphagie, Bolusobstruktionen und einer progredienten (wahrscheinlich zumindest partiell irreversiblen) Fibrosierung. Das Leitsymptom bei der EoE ist bei adoleszenten und erwachsenen Patienten eine Dysphagie für solide Speisen. Da sich hinter diesem Symptom fast immer eine organische Erkrankung des Oesophagus verbirgt – Red Flag Symptom – muss eine EoE aktiv mittels Endoskopie (inklusive der Entnahme von multiplen Biopsien im proximalen und distalen Ösophagus) gesucht werden. Die EoE erfordert oft eine langfristige Erhaltungstherapie und wiederholte Endoskopien, weshalb Patienten schon bei Diagnosestellung auf eine Langzeitbehandlung hingewiesen werden sollten.
Die eosinophile Ösophagitis (EoE) wurde erstmals in den frühen 90er Jahren unabhängig voneinander durch Attwood und Straumann (notabene ein Schweizer Kollege) als eigenständige Krankheitsentität charakterisiert (1, 2). Ein erster internationaler Konsensus mit Krankheitsdefinition und Empfehlungen zu Diagnostik und Therapie wurde aber erst 2007 publiziert. Dies als Folge einer seit Mitte der 90er Jahre für Kinder und Erwachsene gleichermassen rasant angestiegenen Inzidenz (aktuell in der westlichen Welt 4.4/100.000 Einwohner) wie auch Prävalenz (aktuell weltweit bei 34.2/100.000 Einwohnern) (3). In der westlichen Welt lebt somit unter etwa 3000 Einwohnern ein Patient mit diagnostizierter EoE. Die Endoskopie- und Biopsieraten sind im selben Zeitraum jedoch nur geringfügig angestiegen, weshalb die Zunahme der EoE nicht allein als Folge eines gehäuften, technischen Einsatzes in der Gastroenterologie anzusehen ist. Genetisch bedingt tritt die Erkrankung überproportional häufig beim männlichen Geschlecht auf und der Altersgipfel liegt bei etwa 35 Jahren. Es können aber praktisch alle Altersgruppen, von Kleinkindern bis zu Senioren, und auch Frauen betroffen sein. In zahlreichen Untersuchungen wurde gezeigt, dass die EoE derzeit eine der häufigsten Ursachen für Dysphagie und Bolusobstruktionen ist (1).
Pathophysiologie
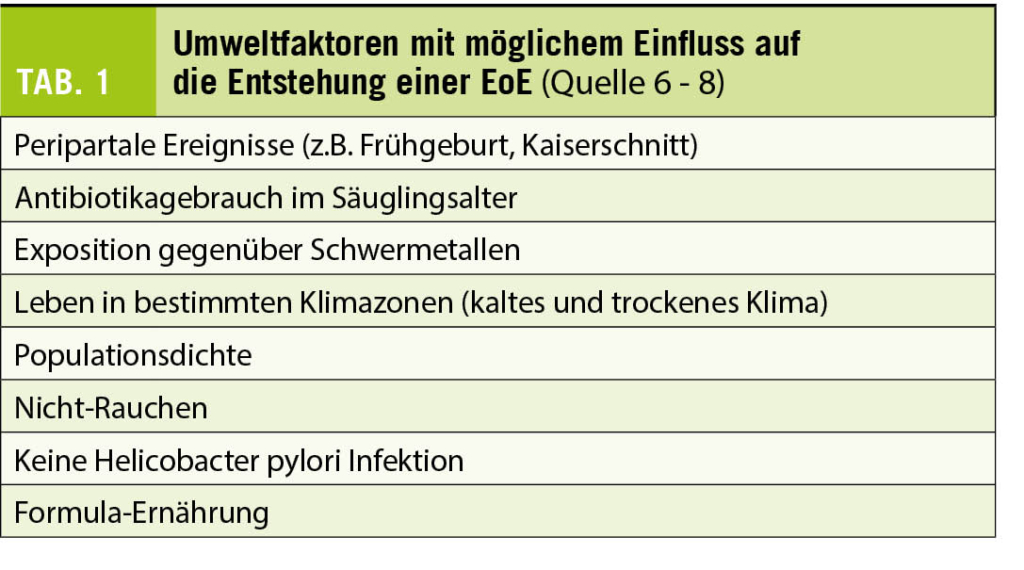
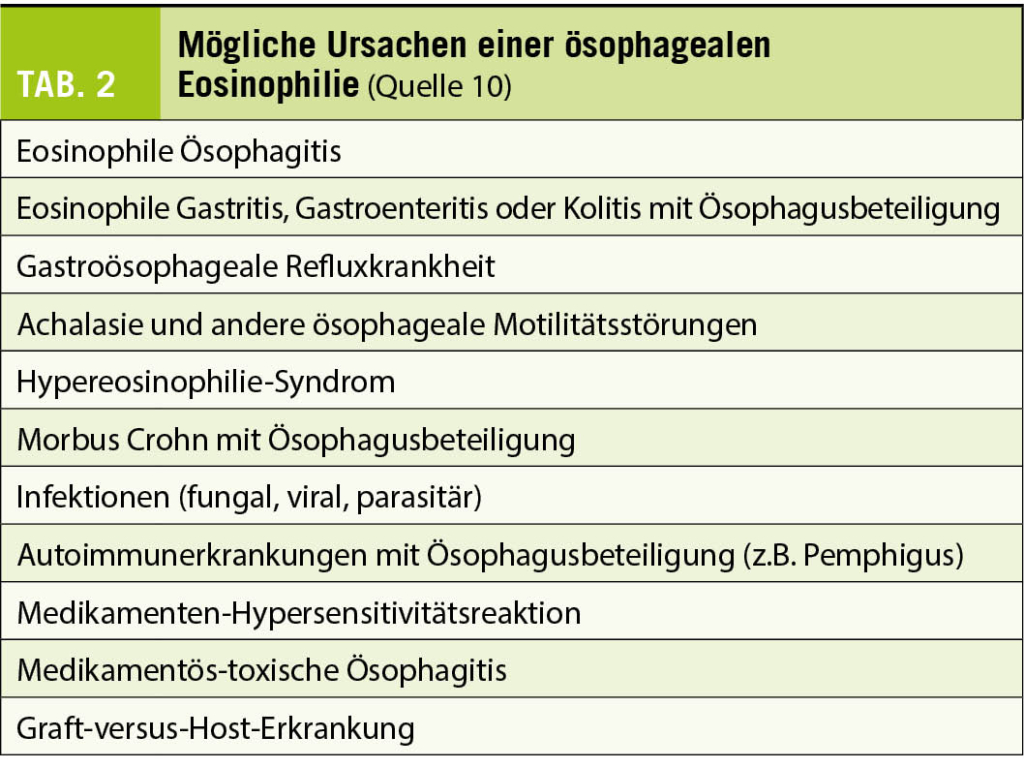
Im Gegensatz zu allen anderen Abschnitten des Gastrointestinal-Trakts beherbergt der Ösophagus im gesunden Zustand keine eosinophilen Granulozyten. Weshalb es bei der EoE zu einer allergie-ähnlichen TH2-Typ-vermittelten Rekrutierung von (primär) eosinophilen Granulozyten in den Ösophagus mit einer konsekutiv chronischen Entzündungsreaktion kommt, ist noch nicht abschliessend geklärt (4). Man geht in erster Linie von einem multifaktoriellen Pathomechanismus aus (5). Sehr wahrscheinlich wird die EoE bei entsprechender, genetischer Prädisposition durch die Exposition gegenüber verschiedenen Umweltfaktoren getriggert. Welche Faktoren dies im Einzelnen sind, ist bis anhin (noch) nicht abschliessend geklärt (Tab. 1). Eine zentrale Rolle dürften neben aerogenen vor allem Nahrungsmittel-Allergene wie Kuhmilch, Weizen, Eier, Soja, Hülsenfrüchte, Nüsse und Fisch/Meeresfrüchte spielen. Dementsprechend wurde auch eine Assoziation mit anderen atopischen Erkrankungen (z.B. allergische Rhinokonjunktivitis, Asthma bronchiale, allergische Dermatitis) beschrieben (9). Da die Inflammation im Ösophagus jedoch primär IgE-unabhängig vermittelt wird, gelingt es mittels IgE-basierter, allergologischer Diagnostik meist nicht das verantwortliche Antigen zu identifizieren. Eine laborchemische Erhöhung der Eosinophilenzahl und der Gesamt-IgE wird bei etwa 50%, respektive 70% der EoE Patienten gefunden, ist aber keinesfalls obligat. Im Langzeitverlauf kann es, bei fehlender oder inadäquater Therapie, durch ein Fortschreiten der Entzündungsreaktion zu einem sogenannten Remodeling (= Organumbau mit Wandverdickung und Wandstarre) der Speiseröhre mit Entwicklung von fibrotischen Strikturen und Beeinträchtigung der Funktion kommen. Dies erhöht das Risiko für die gefährlichen und praktisch nicht voraussehbaren Bolusimpaktationen.
Diagnose und Endoskopie
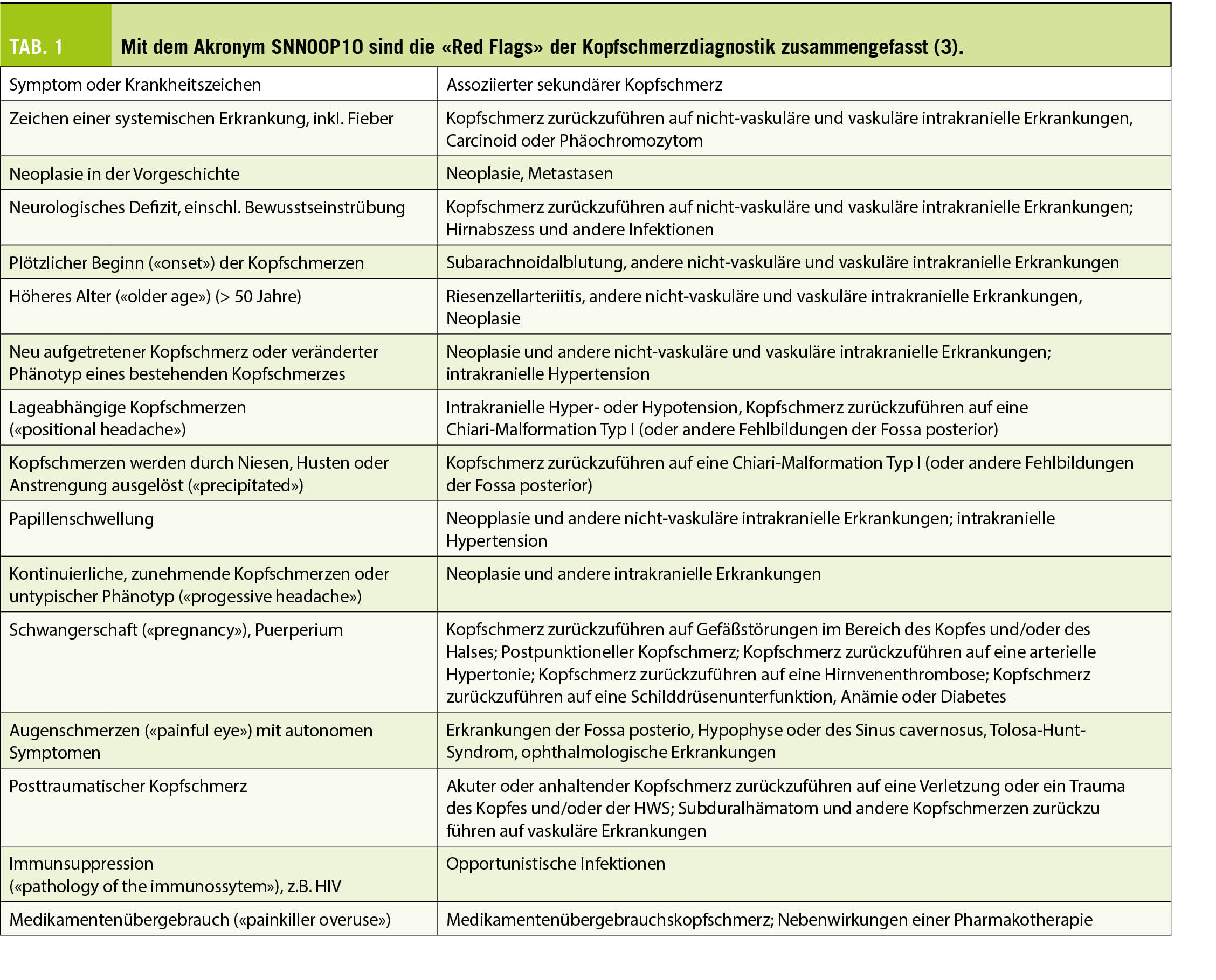
Die Diagnose einer EoE ist klinisch-pathologisch definiert und basiert auf dem Vorhandensein folgender Trias: Symptome passend zu einer ösophagealen Dysfunktion, histologischer Nachweis einer eosinophilen Gewebeinfiltration im Ösophagus (≥ 15 Eosinophile pro hochauflösendes Gesichtsfeld, HPF) kombiniert mit dem Ausschluss anderer Erkrankungen, welche mit einer eosinophilen Gewebeinfiltration einhergehen können und daher differentialdiagnostisch stets berücksichtigt werden sollten (Tab. 2).
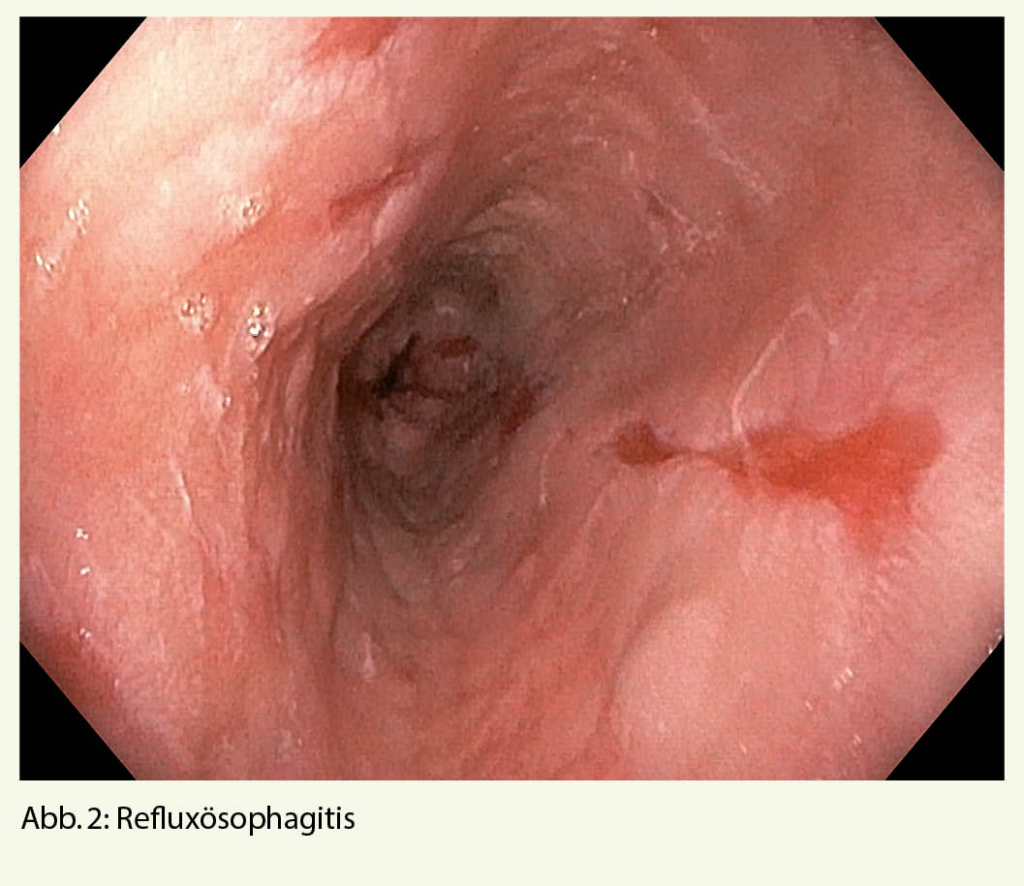
Schwierig kann in diesem Zusammenhang die Abgrenzung gegenüber der äusserst häufigen gastro-ösophagealen Refluxkrankheit (GERD) sein. Gemäss einer neuen Konsensus-Arbeit (10) ist nun aber die früher propagierte, probatorische Gabe von Protonenpumpeninhibitoren (PPI) zur Differenzierung zwischen GERD und EoE obsolet – man hat erkannt, dass GERD und EoE koexistieren können und dass PPI auch bei alleiniger EoE effektiv sein können – , was einen wesentlich einfacheren, diagnostischen Algorithmus zur Folge hat (Abb. 1).

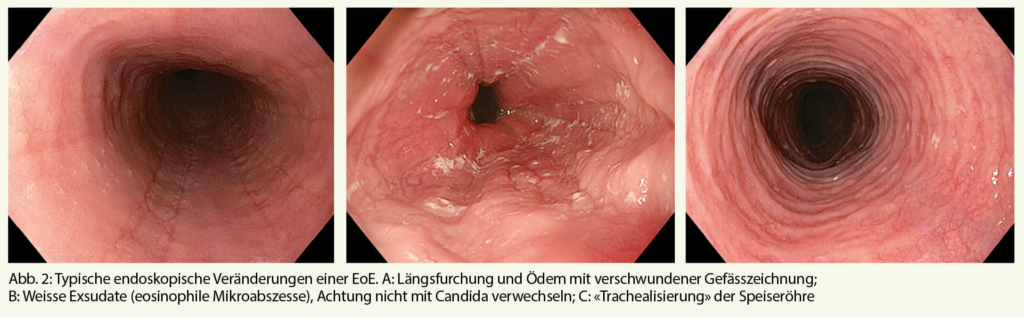
Dieser Paradigmenwechsel basiert primär auf der Annahme, dass sich eine GERD und eine EoE nicht gegenseitig ausschliessen, sondern sich eher gegenseitig beeinflussen und eine PPI-responsive ösophageale Eosinophilie eine Form der EoE sein kann. Deshalb sollten somit PPI’s bei der EoE als Therapeutikum und nicht als Diagnostikum eingesetzt werden. Eine zentrale Rolle in der primären Diagnostik aber auch der Aktivitätsbeurteilung im Verlauf der EoE stellt die Ösophago-Gastroduodenoskopie (ÖGD) mit fraktionierter Biopsieentnahme aus dem distalen, mittleren und proximalen Ösophagus dar. In Folge der chronischen Inflammation kann es zu typischen, makroskopischen Veränderungen kommen wie z.B. Längsfurchen (Abb. 2A) und/oder weissen Auflagerungen (teils stecknadelkopfartig, teils eher flächig), welche eosinophilen Mikroabszessen entsprechen (Abb. 2B). Zudem zeigt sich häufig auch eine Ringbildung im Sinne einer sog. «Trachealisierung» der Speiseröhre (auch als «feliner»= katzenartiger Ösophagus bezeichnet) (Abb. 2C) und nahezu pathognomonisch ist die sogenannte «Krepppapier-Mukosa». Hierunter versteht man eine äusserst fragile, unelastische Ösophagusschleimhaut, die bei geringster mechanischer Belastung reissen kann. Ist das Remodeling bereits weiter fortgeschritten, zeigen sich Strikturen und langstreckige Einengungen des Ösophaguslumens, welche zu Passagestörungen führen können. Diese makroskopischen Merkmale müssen aber nicht zwingend vorhanden sein. So zeigte eine Studie aus 2006 (11), dass in rund der Hälfte der untersuchten EoE-Patienten die typisch endoskopischen Befunde nur diskret ausgeprägt waren. Es ist deshalb wichtig bei Patienten mit Dysphagie auch bei endoskopisch unauffällig aussehendem Ösophagus fraktioniert mindestens 6-8 Biopsien aus allen drei Abschnitten des Ösophagus zu entnehmen. Dadurch wird der Tatsache einer oftmals inhomogenen, fleckförmigen und segmentären Verteilung der eosinophilen Infiltration Rechnung getragen. Histologisch zeigt sich bei der EoE ein primär eosinophiles Infiltrat mit Basalzonenhyperplasie und eosinophilen Mikroabszessen. Wie eingangs dieses Abschnitts beschrieben, basiert die Diagnose einer EoE auf dem Vorhandensein einer Trias. Deshalb sollten die Befunde nie isoliert, sondern stets im klinischen Gesamtkontext betrachtet werden.
Nicht nur bei Dysphagie muss an die EoE gedacht werden
Hinsichtlich der klinischen Manifestation klagen Patienten mit einer EoE – abhängig vom Alter – bei der Erstdiagnose über unterschiedliche Symptome. Kinder zeigen ein etwas diffuseres Beschwerdebild. Hier sollte insbesondere bei Nahrungsverweigerung, retrosternalen und abdominalen Schmerzen, Durchfällen, Erbrechen, Regurgitation und Gedeihstörung an eine EoE gedacht werden. Bei erwachsenen Patienten stellen die Dysphagie bis und mit Bolusobstruktion, sowie reflux-artige Retrosternalschmerzen die Leitsymptome der EoE dar. Die EoE ist mit 25% die häufigste Ursache für Bolusobstruktionen (18) und bei 54% der Patienten, die wegen einer Bolusimpaktation endoskopiert werden lässt sich eine EoE nachweisen (19). Von grosser Bedeutung bei Erwachsenen ist jedoch das Vorhandensein von sogenannten «avoidance signs». Dabei handelt es sich um diätetische «Ausweichstrategien»mit Weglassen kritischer Speisen und Anpassen der Essgewohnheiten, bedingt durch die ösophageale Motilitätsstörung oder eine beginnende Lumen-Einengung der Speiseröhre. Patienten (oder manchmal fast noch mehr deren Angehörige) berichten dabei vom Vermeiden einer hastigen Nahrungsaufnahme oder dem Meiden trockener und faseriger Speisen wie Fleisch oder Reis. Oder sie erwähnen ein auffallend langsames Verzehren von Speisen in Folge sorgfältigem Kauen und regelmässigem Trinken zwischen den einzelnen Nahrungsboli im Sinne eines «Nachspülens». Mit solchen Verhaltensanpassungen lassen sich die Schluckbeschwerden oftmals über lange Zeit verbergen. Diese Symptome stellen Hinweise für das Vorhandensein einer EoE dar und ermöglichen bei frühzeitigem Erkennen und richtiger Interpretation eine entsprechende Diagnostik und den Beginn einer Therapie vor dem Auftreten einer Akutsituation mit Bolusimpaktation infolge einer Striktur.
Therapiemöglichkeiten der EoE die drei D’s: «Drugs»«Diät»«Dilatation»
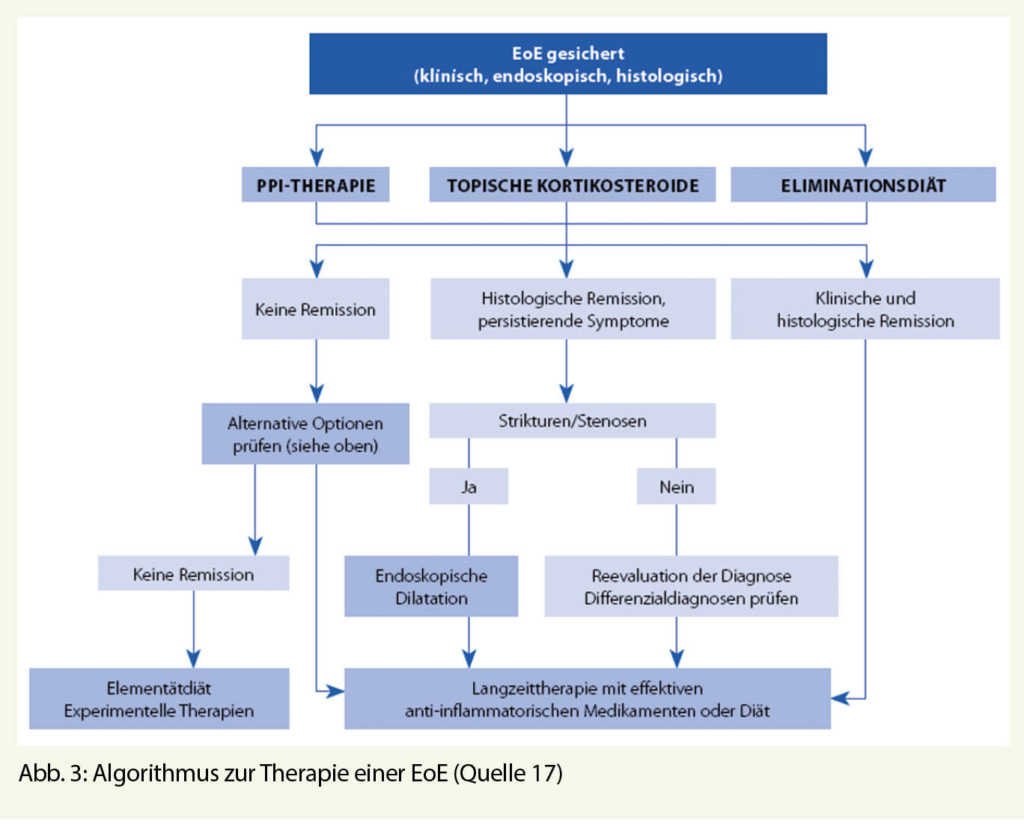
Die EoE ist eine chronische Erkrankung, die unbehandelt mit einem nicht zu unterschätzenden Risiko an Komplikationen einhergeht. Das Ziel der Therapie ist die Induktion und der langfristige Erhalt einer klinischen und histologischen Remission. Bei gesicherter EoE wird – gemäss aktueller Leitlinien (10,12,17) – die Therapie mit topischen Steroiden, PPI und/oder einer Eliminationsdiät empfohlen (Abb. 3). Kürzlich publizierte Daten, liefern zudem vielsprechende Resultate hinsichtlich einer Therapie mit dem rekombinanten, humanen, monoklonalen IgG4-Antikörper Dupilumab (Dupixent®), dessen Stellenwert innerhalb der Therapieoptionen bei der EoE jedoch noch definiert werden muss. Vermutlich dürfte diese Therapie primär – nicht zuletzt auch aus ökonomischen Gründen – nur bei Therapieversagern auf bisherige Therapieoptionen zum Einsatz kommen.
Topisch-wirksame Kortikosteroide
Eine hohe Evidenz liegt für die Wirkung von topischen Kortikosteroiden zur Induktionstherapie der EoE vor (13). Für Jugendliche und Erwachsene werden als Initialdosis Budesonid 2 x 1mg/Tag bzw. Fluticason 2 x 880 µg/Tag (nicht inhaliert sondern geschluckt) empfohlen, wobei tendenziell höhere Remissionsraten für Budesonid beobachtet werden konnten (14). In verschiedenen Studien konnten mit Budesonid in Form einer Schmelztablette histologische Remissionsraten von über 90% und klinisch-histologische Remissionsraten von bis zu 85% erreicht werden (7). Dementsprechend wurde 2018 eine Budesonid Schmelztablette (Jorveza®) zur medikamentösen Behandlung der eosinophilen Ösophagitis beim Erwachsenen entwickelt und zugelassen. Das Präparat entfaltet seine Wirkung direkt am Ort der Entzündung und ist allgemein gut verträglich. Durch die Unterdrückung der Entzündungsreaktion kann sich jedoch das Risiko für lokale Infektionen – besonders für milde bis mittelschwere Pilzinfektionen in Mund, Rachen und Speiseröhre – erhöhen. Es könnten sich theoretisch zudem systemische Kortikosteroid-Nebenwirkungen zeigen. Diese treten, gemäss aktuellem Wissensstand, im Vergleich zu Placebo jedoch nicht gehäuft auf (16). Obwohl Jorveza® in der Schweiz zur zeitlich limitierten Therapie der EoE zugelassen ist (Induktionstherapie für 6-12 Wochen), wurde das Medikament vom Bundesamt für Gesundheit (BAG) bis anhin noch nicht in die Spezialitäten Liste aufgenommen (Stand November 2020). Die Krankenkassen sind somit (noch) nicht verpflichtet die Kosten für Jorveza® zu übernehmen, weshalb die behandelnden Ärzte eine Kostengutsprache einzufordern haben. Alternativ können Magistralrezepturen in Form eines budesonidhaltigen Sirups oder topische Kortikosteroide welche für die Therapie von allergischen Atemwegserkrankungen entwickelt worden sind – zum Beispiel Axotide-Diskus, Pulmicort-Respules – verschrieben werden. Jedoch müssen die Patienten über die abgeänderte Anwendungsart genau instruiert werden. Diese benötigen keine Kostengutsprache, jedoch erheblich Sprechstundenzeit bei deren Verschreibung. Kürzlich hat die Europäische Arzneimittel-Agentur (EMA) zudem –
basierend auf einer grossen Europäischen Langzeit-Studie – die Zulassung für eine Langzeit-Therapie mit Jorveza® erteilt (16).
Protonenpumpeninhibitoren
Bisher ist die Datenlage, hinsichtlich eines direkten Vergleichs der Wirkung zwischen einer PPI-Therapie und den topischen Kortikosteroiden, beziehungsweise einer PPI-Therapie und einer Eliminationsdiät, sehr schwach (12). Zudem basiert der Grossteil der Studien zur Wirkung der Steroidtherapie bzw. der Eliminationsdiät auf einem Patientenkollektiv, welches kein Ansprechen auf eine PPI Therapie gezeigt hat. Die wenigen vorliegenden Daten zeigen aber, dass die Wirksamkeit der PPI eine EoE klinisch und histologisch in Remission zu bringen nur bei etwa 30% bis maximal 40% liegt, also deutlich tiefer als bei den Steroiden. Gemäss verschiedenen, internationalen Guidelines (10, 12) wird trotzdem der Einsatz von PPI empfohlen, basierend auf den langjährigen Erfahrungen in der Verschreibung von PPI bei vergleichsweise geringem Nebenwirkungsprofil sowie aufgrund einiger Studien, welche nachweislich einen positiven Effekt der PPI-Therapie bei Patienten mit einer EoE zeigen konnten (10). Wichtig zu erwähnen ist, dass die PPI-Therapie eine vorgängige, ergänzende oder anschliessende anti-entzündliche Therapie nicht ausschliesst, was auch der Möglichkeit einer Ko-Existenz von GERD und EoE Rechnung tragen soll.
Eliminationsdiäten
Im Gegensatz zu den Medikamenten, welche die allergische Entzündung lediglich unterdrücken, verfolgen die Eliminationsdiäten einen kausalen Therapieansatz. Denn wenn ein entzündungsauslösendes Lebensmittel konsequent vermieden werden kann, lässt sich die EoE mittels Diät oft ohne Medikamente erfolgreich behandeln. Man unterscheidet drei Diätformen (15): da allergisierende Substanzen meistens Eiweisse (Proteine) sind, werden bei der Elementardiät proteinhaltige Speisen komplett vermieden. Um eine Malnutrition zu verhindern, sind Patienten ergänzend auf proteinfreie-aminosäurehaltige Nährlösungen angewiesen. Leider sind diese Nährlösungen geschmacklich nicht sehr attraktiv und teuer, und müssen deshalb bei Kindern oft via Magensonde verabreicht werden. Diese Diätform wird deshalb vor allem bei schweren Formen der EoE eingesetzt. Bei der allergietest-basierten Eliminationsdiät werden lediglich diejenigen Speisen weggelassen, welche mittels Allergie-Testung identifiziert worden sind. Da praktisch alle Allergie-Tests IgE-basiert sind und es sich bei der EoE aber um eine nicht-IgE-vermittelte Allergie handelt, existieren bisher leider noch keine Tests, welche die allergisierenden Speisen zuverlässig identifizieren. Es gelingt deshalb nur bei etwa 20% der Erwachsenen und bei etwa 40% der Kinder die EoE erfolgreich mittels dieser mass-geschneiderten Diät zu behandeln. Die empirische Eliminationsdiät stellt die dritte Diätform dar und basiert auf dem Wissen, dass Milchprodukte (Achtung: Milchproteine, nicht Milchzucker), Weizen (eventuell Gluten), Eier, Nüsse, sowie seltener Soja, Fisch und Meeresfrüchte die häufigsten Trigger (Auslöser) der EoE darstellen. Beim Vermeiden von allen sechs Lebensmittelkategorien spricht man von einer «6-Food-Elimination Diet» (6-FED). Erreicht man dadurch eine Remission der EoE, wird in der Folge schrittweise und kontrolliert eine Kategorie nach der anderen wieder zugeführt, um die allergisierende Speise zu identifizieren (step-down Strategie). Diese Diät hat eine gut 70%-ige Erfolgschance, jedoch ist das Verfahren zeitintensiv und erfordert wiederholte Endoskopien sowie eine engmaschige Betreuung durch erfahrene Ernährungsberater und Gastroenterologen. Alternativ können auch nur eine oder zwei Lebensmittelkategorien (1-FED, 2-FED) weggelassen werden (vorzugsweise Milch oder Weizen), und falls nötig, noch weitere Kategorien dazu gefügt werden (step-up Strategie). Letztlich sollten diätetische Behandlungen ausschliesslich bei motivierten Patienten und nur an Zentren durchgeführt werden, welche die notwendige Expertise vorweisen können.
Endoskopische Dilatation
Endoskopische Verfahren (z.B. Bougierung, Ballondilatation) sind Patienten mit Stenosen bzw. Strikturen vorbehalten, welche nicht oder nur ungenügend auf eine vorgängige, medikamentöse Therapie angesprochen haben. Erwähnt werden sollte hier das Perforationsrisiko einer endoskopischen Therapie bei EoE Patienten, welches in früheren Arbeiten aber eher überschätzt wurde. Zudem wird durch diese Therapie die der EoE zu Grunde liegende Inflammation nicht beeinflusst. Dilatationen werden deshalb praktisch immer mit anti-entzündlichen Therapien kombiniert.
Follow-Up und Prognose
Der Schweregrad der Entzündung korreliert bei der EoE schlecht mit dem Schweregrad der klinischen Symptome bzw. der makroskopischen Befunde in der ÖGD (7, 8, 10, 12, 13). Deshalb wird primär die Bestimmung der histologischen Aktivität als Standard gefordert. Dies bedingt wiederholte, endoskopische Untersuchungen mit Biopsie-Entnahmen, insbesondere nach Anpassung der Therapie. Sind bei einem Patienten aber die beiden Therapieziele – Beschwerdefreiheit und Kontrolle der Entzündung – erreicht, reichen jährliche Kontrollen im Allgemeinen aus. Da es sich bei der EoE um eine chronische Erkrankung handelt sollten Patienten bereits anlässlich der Diagnosestellung über die Notwendigkeit einer Langzeitbehandlung aufgeklärt werden. Bisher konnte bei EoE Patienten, trotz der chronisch entzündlichen Genese der Erkrankung, zum Glück kein erhöhtes Risiko für Ösophaguskarzinome nachgewiesen werden.
Verdankung: Für die kritische Durchsicht und wertvollen Anregungen danken die Autoren PD Dr. med. Luc Biedermann, Leitender Arzt an der Klinik für Gastroenterologie und Hepatologie am Universitätsspital Zürich.
Copyright bei Aerzteverlag medinfo AG
Abteilung für Gastroenterologie / Hepatologie
Luzerner Kantonsspital
Spitalstrasse, 6000 Luzern 16
Jon-Duri.Senn@luks.ch
Abteilung für Gastroenterologie / Hepatologie
Luzerner Kantonsspital
Spitalstrasse
6000 Luzern 16
Die Autoren haben keine finanziellen oder persönlichen Verbindungen im Zusammenhang mit diesem Beitrag zu deklarieren.
1. Dellon ES, Hirano I. Epidemiology and natural history of eosinophilic esophagitis. Gastroenterology 2018;154:319–332
2. Straumann A, Spichtin HP, Bernoulli R, Loosli J, Vögtlin J. Idiopathische, eosinophile Ösophagitis: eine häufig verkannte Krankheit mit typischer Klinik und diskretem endoskopischem Bild. Schweiz Med Wochenschr. 1994;124:1419-1429
3. Navarro P, et al. Systematic review with meta-analysis: the growing incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther. 2019;49(9):116-25
4. Straumann A, et al. Idiopathic eosinophilic esophagitis is associated with a TH 2-type allergic inflammatory response. J Allergy Clin Immunol. 2001;108:954–6
5. O’Shea KM, et al. Pathophysiology of Eosinophilic Esophagitis. Gastroenterology. 2018;154(2):33-45
6. Jensen ET, et al. Early-life environmental exposures interact with genetic susceptibility variants in pediatric patients with eosinophilic esophagitis. J Allergy Clin Immunol Pract. 2018;141:632-37
7. Miehlke S. Eosinophile Ösophagitis. Falk Gasto-Kolleg. 2019;1:1-13
8. Miehlke S, et al. Eosinophilic Esophagitis: Recent Developments in Diagnosis & Treatment. Falk Gastro Review Journal. 2020;2:13-15
9. Hill DA, Cianferoni A, Spergel JM, Aceves S, Holbreich M, Venter C, et al. Eosinophilic esophagitis is characterized by a non-IgE-mediated food hypersensitivity. Allergy. 2016;71:611-20
10. Dellon ES, Liacouras CA, Molina-Infante J, Furuta GT, Spergel JM, Zevit N, et al. Updated international consensus diagnostic criteria for eosinophilic esophagitis: Proceedings of the AGREE conference. Gastroenterology. 2018;155:1022-1033
11. Gonsalves N, Policarpio-Nicolas M, Zhang Q, Rao S, HiranoI. Histopathologic Variability and endoscopic correlates inadults with Eosinophilic Esophagitis. Gastrointest Endoscopy. 2006;64:313–9
12. Hirano I, Edmond SC, Matthew AR, Rajiv NS, Neil HS, David RS, et al. AGA institute and the joint task force on allergy-immunology practice parameters clinical guidelines for the management of eosinophilic esophatitis. Gastroenterology. 2020;158:1776-86
13. Rank MA, Sharaf RN, Furuta GT, et al. Technical review on the management of eosinophilic esophagitis: a report from the AGA Institute and the joint Task Force on Allergy-Immunology Practice Parameters. Gastroenterology. 2020;158:1789-1810
14. De Heer J, Miehlke S, Rösch T, Morgner A, Aigner A, et al. Histologic and Clinical Effects of Different Topical Corticosteroids for Eosinophilic Esophagitis: Lessons from an Updated Meta-Analysis of Placebo-Controlled Randomized Trials. Digestion. 2020;1:1-9
15. Online unter URL: https://www.e-oe.ch/therapie.36de.html
16. Straumann A, Lucendo AJ, Miehlke S, et al. Budesonide Orodispersible Tablets Maintain Remission in a Randomized, Placebo-Controlled Trial of Patients With Eosinophilic Esophagitis. Gastroenterology 2020.
17. Miehlke S, Schlag C, Storr M, von Arnim U. Eosinophile Ösophagitis Update 2017: Neue Leitlinien der europäischen Studiengruppe EUREOS. Z Gastroenterol. 2018;56:139-50
18. Sengupta N, et al. The clinical predictors of aetiology and complications among 173 patients presenting to the Emergency Department with oesophageal food bolus impaction from 2004-2014. Aliment Phatmacol Ther. 2015;42:91-98
19. Arias A, et al. Systematic review with meta-analysis: the incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther. 2016 ;43 :3-15