Carfilzomib war bisher für die Behandlung des rezidivierten und refraktären multiplen Myeloms in Kombination entweder mit Lenalidomid und Dexamethason (KRd) oder nur mit Dexamethason (Kd) zugelassen (1). Basierend auf den Ergebnissen der randomisierten, multizentrischen, offenen Phase-III-Studie CANDOR ist neu die Zulassung für Carfilzomib in Kombination mit dem CD38-gerichteten Antikörper Daratumumab und Dexamethason (KdD) erteilt worden. Aktualisierte Daten der CANDOR-Studie (2) wurden bei der Jahrestagung der American Society of Hematology (ASH) 2020 präsentiert (3).
Extension d’ indication : Association de carfilzomib, dexaméthasone et daratumumab
Spätere Therapielinien bei Tumoren des Kopf-Hals-Bereichs
Trotz intensiver multimodaler Therapie kommt es bei ca. 30% der Patienten mit lokal fortgeschrittenen Plattenepithelkarzinomen des Kopf-Hals-Bereichs (LAHNSCC) zu Lokalrezidiven oder Fernmetastasierung (r/m HNSCC). In einigen Fällen besteht die Möglichkeit, die Patienten mit einer Salvage-Operation oder Re-Bestrahlung nochmals in kurativer Intention zu behandeln. Die Mehrheit der Patienten befindet sich jedoch in einer Palliativsituation.
Die CHECKMATE 141 (CM 141) war die erste randomisierte Phase 3 Studie für Patienten mit r/m HNSCC und Progredienz innerhalb sechs Monate nach einer cisplatinhaltigen Erstlinien-Chemotherapie. Auch Patienten, welche innerhalb von 6 Monaten nach einer kurativ intendierten, cisplatinhaltigen Radiochemotherapie progredient waren, konnten eingeschlossen werden. Es handelte sich dabei um eine intensiv vorbehandelte Population. Die Patienten wurden im Verhältnis 2: 1 entweder in den Arm mit Nivolumab (3 mg/kg alle 2 Wochen) oder in den Standardarm (SOC) mit Docetaxel, Methotrexat oder Cetuximab nach Wahl des behandelnden Arztes randomisiert. Der primäre Endpunkt war das Gesamtüberleben (1).
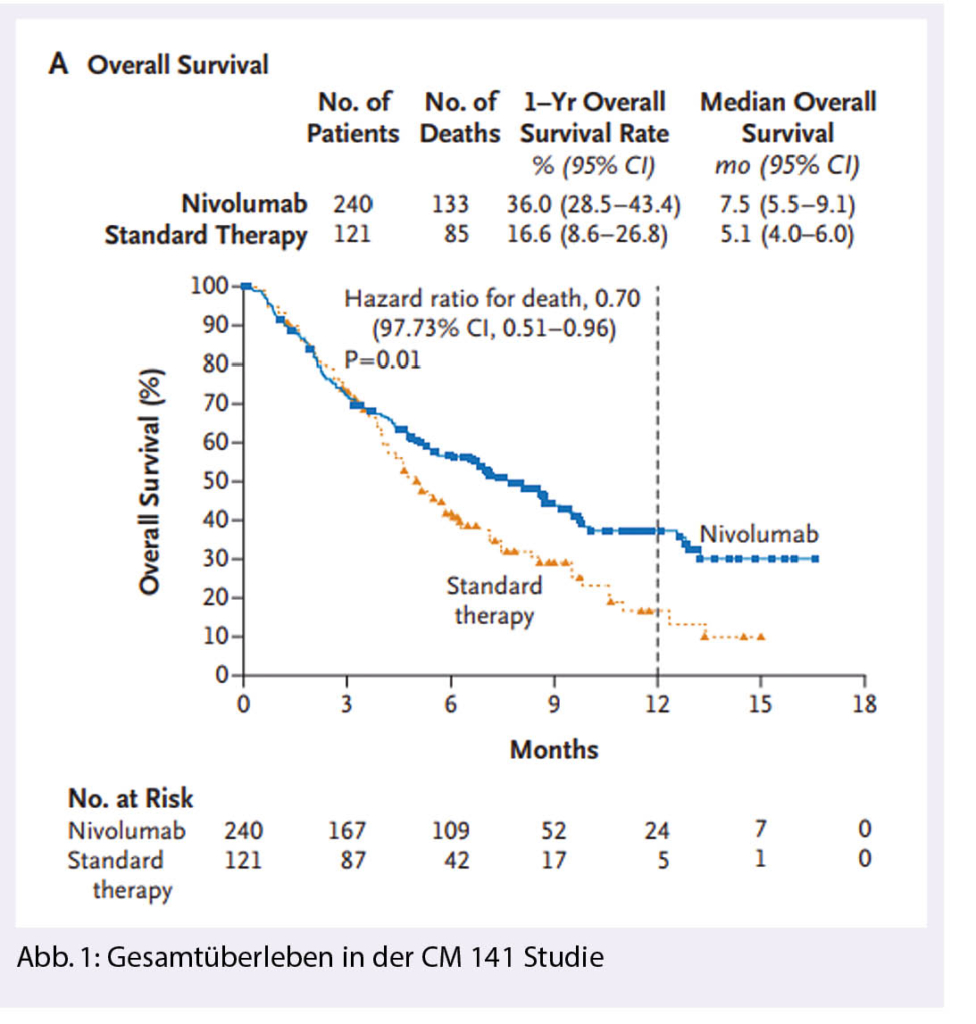
Nivolumab-Arm (N) war im primären Endpunkt sowie in verschiedenen sekundären Endpunkten dem SoC Arm überlegen. Das mediane Überleben war im Nivolumab-Arm mit 7.5 Monaten höher als im Kontrollarm mit 5.1 Monaten, was bei einer hazard ratio (HR) von 0.70 (CI 0.51–0.96) und mit einem p-Wert von < 0.01 statistisch signifikant war. Das Gesamtüberleben nach einem Jahr war im N mehr als doppelt so hoch als im SoC (36% vs. 16.6%) (Abb. 1). Das Ansprechen war im N (13.3%) ebenfalls höher als im SoC (5.8%).
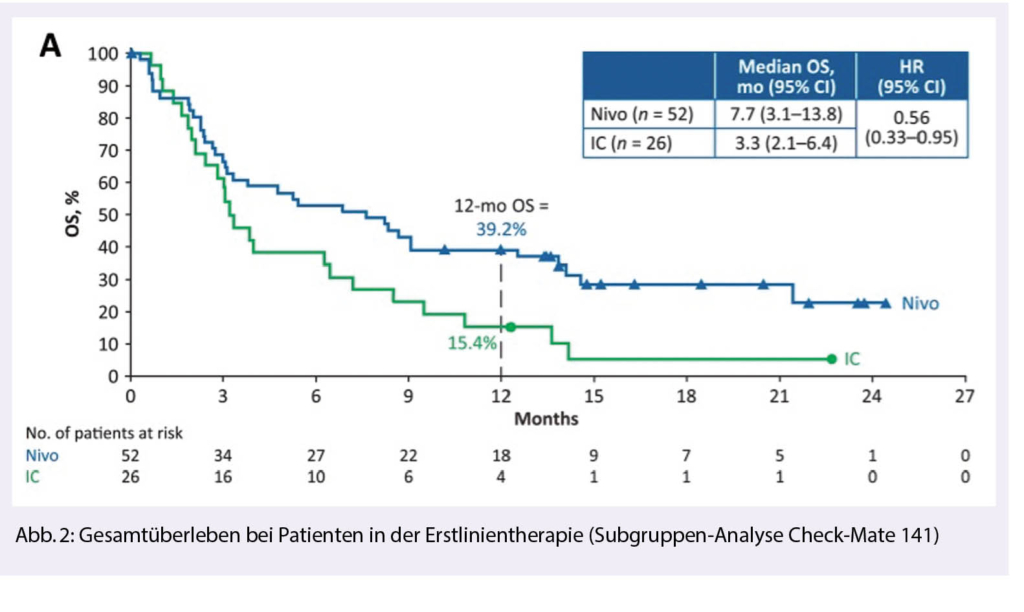
In Bezug auf das progressionsfreie Überleben bestand kein Unterschied zwischen den beiden Gruppen (2.0 vs. 2.3 Monate, HR 0.89 [CI 0.70-1.1], p 0.326). Die Patienten mit einer PD L-1 Expression von gleich oder mehr als 1% profitierten am meisten von einer Therapie mit Nivolumab. In dieser Gruppe betrug das mediane Überleben 8.7 Monate, verglichen mit 4.6 Monaten (HR 0.55, [95% CI, 0.36-0.83]) bei Patienten im Chemotherapie-Arm. Eine weitere Subgruppenanalyse zeigte, dass sowohl Patienten mit HPV-assoziierten als auch mit nicht HPV-assoziierten Tumoren von der Immuntherapie profitierten. In der späteren Subanalyse zeigte sich auch für die prognostisch sehr schlechte Population von Platin-resistenten Patienten eine Verbesserung des Gesamtüberlebens bei einer Therapie mit Nivolumab (2) (Abb. 2).
Aufgrund dieser Daten wurde Nivolumab im 2017 auch in der Schweiz als Therapie der Wahl für r/m HNSCC nach Progress nach einer platinhaltigen Therapie zugelassen. Zum Zeitpunkt der Zulassung war der Stellenwert von Checkpoint-Inhibitoren (CPI) in der Erstlinientherapie noch unbekannt, bzw. waren die entsprechenden Studien noch am Rekrutieren.
Seit der Publikation von Keynote 048-Studie im2019 und der Etablierung von Pembrolizumab als Monotherapie oder in Kombination mit der Chemotherapie in der Erstlinientherapie hat sich der Stellenwert von Nivolumab jedoch verändert (3). Nivolumab ist nun nur bei Patienten, die in der Erstlinientherapie Pembrolizumab nicht erhalten haben, eine Option. Das sind z.B. die Patienten mit einem CPS von < 1, bei denen es in der Erstlinientherapie kein Vorteil von P + C vs. E+C gibt und nach Extreme behandelt werden können. Die Patienten, die im Rahmen einer Studie im Standardarm Nach Extreme behandelt worden sind, gehören natürlich auch in diese Gruppe.
Keynote 040
Diese Phase 3 Studie hat ein ähnliches Design wie Checkmate141 gehabt (4). Die Patienten sind entweder in den Arm mit Pembrolizumab (P) oder in den Kontrollarm mit Therapie nach Wahl des behandelnden Arztes (SoC) randomisiert worden. Der primäre Endpunkt was das Gesamtüberleben. Im P Arm betrug das Überleben 8.4 und im SoC 6.9 Monate, was mit einer HR von 0.80 (95%, CI 0.65-0.98) und p = 0.061 signifikant war. Der Benefit war somit kleiner als in der Check Mate 141 Studie. Einer der Gründe dafür dürften die besseren Eigenschaften der Population in der Kontrollgruppe in KN040 sein. Im Vergleich zur Kontrollgruppe in der CM141 waren die Patienten in der KN040 weniger vorbehandelt und erhielten häufiger Docetaxel, welches als die wirksamste der drei Substanzen im SoC Arm gilt. Dazu erhielten mehr Patienten aus dem Kontrollarm der KN040 Studie in späteren Linien eine Therapie mit einem Checkpointinhibitor (CPI).
In der Patientengruppe mit CPS>50 zeigte sich jedoch eine deutliche Verbesserung des Gesamtüberlebens. Im P war das mediane Überleben 11.6 Monate (95%CI 8.3-19.5) und im SoC 6.6 (95% CI 4.8-9.2).
Swissmedic hat für Pembrolizumab bei platin-resistenten Patienten im Januar 2021 eine Zulassung für die Patienten mit einem CPS>50 erteilt. Bezüglich des Stellenwerts seit der Etablierung von CPI in der Erstlinie ist die Situation ähnlich wie bei Nivolumab jedoch mit zusätzlicher Einschränkung bzgl. des CPS.
Neben Nivolumab und Pembrolizumab sind bei platin-resistenten r/m HNSCC auch weitere Checkpoint-Inhibitoren untersucht worden. Der selektive anti-PD-L1 mAk Durvalumab ist in dieser Population in mehreren Studien geprüft worden.
HAWK war eine Phase 2 Studie für die Patienten mit einer PD-L1 Expression von > 25% (5). Der primäre Endpunkt war das Ansprechen. Sekundäre Endpunkte waren das Gesamtüberleben und das progressionsfreie Überleben. Die Patienten erhielten Durvalumab 10 mg/kg jede zweite Woche für maximal ein Jahr. Die Ansprechrate war 16.2% (95%CI: 9.9–24.4). Bei Patienten mit HPV assoziierten Tumoren waren die Ansprechraten mit 29.4% (95% CI, 15.1-47.5) höher als bei nicht HPV-assoziierten HNSCC (10.9%, 95% CI, 4.5-21.3). Das progressionsfreie Überleben war 2.1 Monate (95% CI: 1.9–3.7). Das mediane Überleben betrug 7.1 Monate (95% CI: 4.9–9.9).
CONDOR war eine randomisierte Phase 2 Studie für die Patienten mit platin-resistenten Rezidiven und tiefer PD-L1 Expression. Der primäre Endpunkt war auch hier das Ansprechen. Die Patienten sind in drei Arme im Verhältnis (2:1:1) randomisiert worden: Kombination von Durvalumab und dem anti-CTLA-4 Antikörper Tremelimumab (D + T); Durvalumab (D) Monotherapie und Tremelimumab Monotherapie (T). Im D + T Arm war die Dosis von Durvalumab 20 mg/kg und von Tremelimumab 1 mg/kg; verabreicht jede 4. Woche für 4 Zyklen. Danach erhielten die Patienten Durvalumab Monotherapie 10 mg/kg jede 2. Woche. Im D Arm war die Dosis 10 mg/kg. Im T Arm betrug die Dosis von Tremelimumab initial 10 mg/kg jede 4. Woche für insgesamt 7 Dosen, und danach jede 12. Woche für 2 Dosen.
Die Ansprechraten waren 7.8% im D + T Arm, 9.2% im D Arm und 1.6% im T Arm. Der primäre Endpunkt wurde somit nicht erreicht. Die Verträglichkeit war in allen drei Armen vergleichbar mit Grad 3–4 Toxizität vom 15.8%, 12.3% und 16.9% (6).
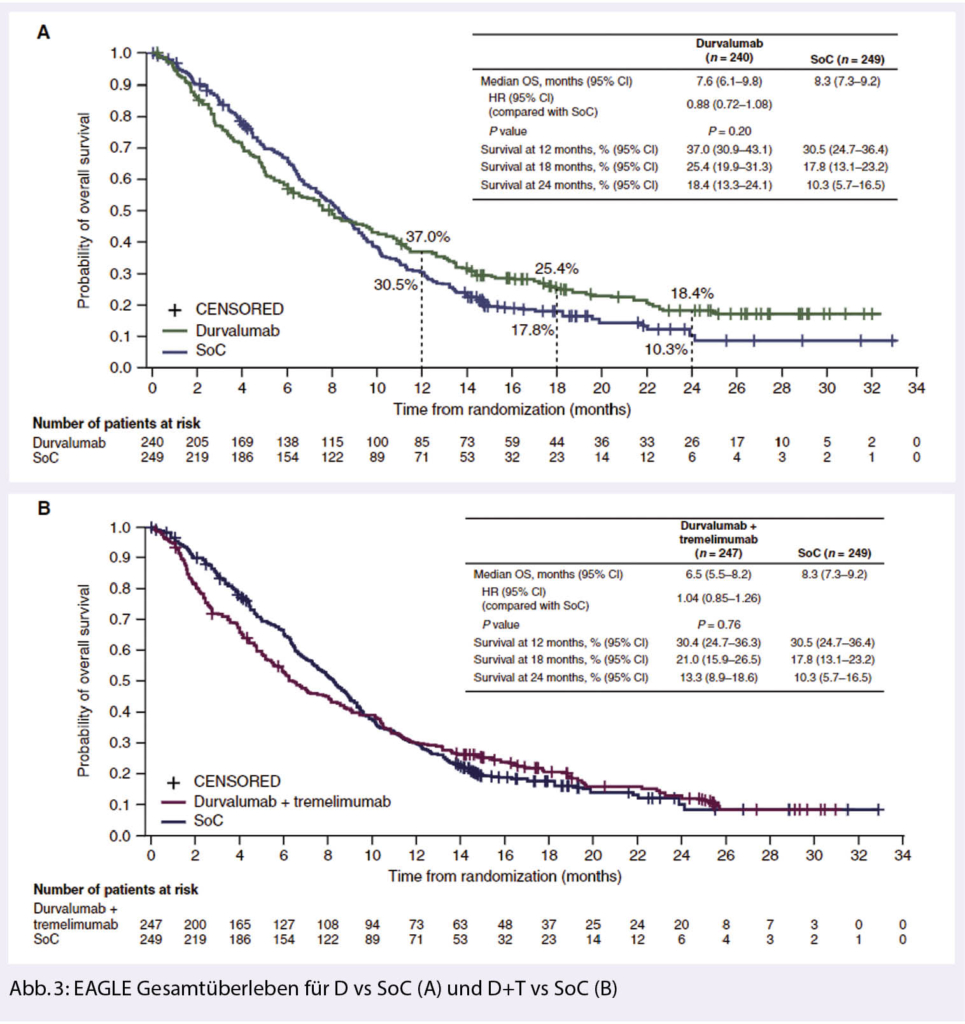
EAGLE war eine randomisierte Phase 3 Studie, die untersucht hat, ob eine Kombination von Durvalumab (D) und Tremelimumab (T) zu einer synergistischen Wirkung bei Patienten mit platin-vorbehandelten r/m HNSCC führt. Die Resultate dieser Phase 3 Studie sind vor kurzem publiziert worden (7). Insgesamt 736 Patienten wurden in drei Arme 1:1:1 randomisiert. In einem Arm erhielten die Patienten Durvalumab Monotherapie (10 mg/kg jede 2. Woche), im zweiten Arm Durvalumab in Kombination mit Tremelimumab (D 20 mg/kg und T 1mg/kg jede 4. Woche) und im Kontrollarm eine Monotherapie (Taxane, Methotrexat oder 5-FU). Primärer Endpunkt ist das Gesamtüberleben für D vs. SoC und für D+T vs. SoC.
Es zeigte sich kein statistisch signifikanter Unterschied im Gesamtüberleben weder für Durvalumab versus SoC (HR 0.88, 95%CI 0.72-1.08, p = 0.20) noch für die Kombination von D + T (HR 1.04 95%CI 0.85-1.26, p = 0.76) (Abb. 3).
Zusammenfassung: Therapieoptionen bei platin-resistenten r/m HNSCC
Seit der Etablierung von Pembrolizumab als Monotherapie oder Kombination mit Platin und 5FU in der Erstlinientherapie ist die Rolle von CPI in späteren Therapielinien eingeschränkt. Bei den Patienten, die in der Erstlinientherapie kein CPI erhielten, bleibt Nivolumab bei Progress Therapie der Wahl. Es kann sich z.B. um die Patienten handeln, die im Kontrollarm einer Studie behandelt worden sind; oder die Patienten mit Tumoren, die ein CPS< 1 haben und in der Erstlinie nach Extreme Schema behandelt werden. Bei CPI-naiven platinresistenen Patienten mit einem CPS> 50 ist neu in dieser Situation auch Pembrolizumab Monotherapie zugelassen.
Die Patienten, die während der kurativ intendierten Radiochemotherapie oder innerhalb von sechs Monate nach deren Abschluss ein Rezidiv erlitten haben, waren aus der KN 048 ausgeschlossen und haben in der CM141 von Nivolumab profitiert.
Somit besteht für die Patienten mit Progress nach Platin und CPI in der Erstlinientherapie für die späteren Therapielinien im Moment keine Standardbehandlung. Für die Patienten mit ECOG 0-1, die in der Erstlinie Pembrolizumab als Monotherapie erhalten haben, ist eine Behandlung nach Extreme Schema in der Zweitlinientherapie eine Option. Dazu kommen Taxane, 5FU, Capecitabine, Methotrexat, Cetuximab Monotherapie, Navelbine als Monosubstanzen oder Kombinationen in Frage.
Für sowohl platinsensitive wie auch platinresistente r/m HNSCC gilt jedoch, dass weitere Erkenntnisse bezüglich der prädiktiven Tumormarker dringend notwendig sind. Neben der Verlängerung des Überlebens ist eine Erhöhung des Ansprechens unbedingt nötig, um die Symptome, die bei diesen Patienten gravierend sein können, zu lindern und die Lebensqualität zu verbessern.
Klinische Studien und neue Therapieeinsätze bei platin-resistentem r/m HNSCC
SAKK 11/16 MVX-ONCO-1. In dieser Phase 2 Studie wird personalisierte Tumorvakzinierung bzw. zell-basierte, aktive Immuntherapie mit dem Medizinalprodukt MVX-ONCO-1 untersucht. Eine Metastase wird exzidiert, die Tumorzellen werden bestrahlt und anschliessend dem Patienten subkutan injiziert. Anschliessend werden die Kapseln (MVX-ONCO-1) mit genetisch modifizierten, GM-CSF-sezernierenden Zellen mehrmals subkutan platziert. Die immunmodulatorische Wirkung von GM-CSF stimuliert bzw. verstärkt die Immunantwort gegen die autologen bestrahlten Tumorzellen. Die Phase 1 Studie hat die Sicherheit der Methode geprüft und die Phase 2 Studie rekrutiert.
Die Kombination von Pembrolizumab und Lenvatinib bei verschiedenen Tumorentitäten wurde in einer Phase 1b/2 Basket-Studie mit insgesamt 137 Patienten untersucht. Davon waren 22 Patienten mit einem r/m HNSCC eingeschlossen. Andere Entitäten waren Nierenkarzinom, Endometriumkarzinom, Melanom, NSCLC und Urothelkarzinom.
Lenvatinib ist ein Multikinase-Inhibitor mit einer Wirkung auf vascular endothelial growth factor receptor (VEGFR). VEGF hat eine immunsuppressive Wirkung, welche durch die Stimulation von T-reg Lymphozyten und Verhinderung der Ausreifung von dendritischen Zellen erzielt wird. Die VGFR Inhibition durch Lenvatinib in Kombination mit Pembrolizumab soll zu einer verstärkten Tumorantwort führen. Von 22 Patienten mit HNSCC hat ein Patient eine komplette Remission erreicht, bei 9 Patienten zeigte sich ein partielles Ansprechen und bei 10 eine Krankheitsstabilisierung. Die häufigste Nebenwirkung war Hypothyroidismus (9).
Monalizumab ist ein first-in-class humanisierter IgG4 monokolonaler Antikörper, welcher NKG2A bindet. NKG2A ist auf den CD8+T-Zellen und NK Zellen exprimiert. Die Ergebnisse einer Phase Ib/II Studie mit Cetuximab in Kombination mit Monalizumab oder Placebo bei platin- und CPI-vorbehandelten Patienten sind am ESMO 2019 und am ASCO 2020 präsentiert worden. Die Ergebnisse zeigen die Ansprechraten von 27.5% und hohe Raten an klinischer Stabilisierung in der stark vorbehandelten Population. Medianes Überleben beträgt 8.5 Monate. Die Phase 3 Studie für die Patienten mit r/m HNSCC (Interlink-1) ist geplant (8, 10).
Eine Phase 1b/2a Studie mit der Kombination vom MEDIO457 mit Durvalumab bei HPV positiven r/m HNSCC wurde am ESMO2020 präsentiert. Es handelt sich um eine DNA Vakzine, welche aus drei Plasmiden, die HPV 16/18 Onkoproteine E6 und E7 exprimieren, besteht. Als molekulare Adjuvans fungiert IL-12. Im ersten Teil (run-in) wurden drei und in der anschliessender Kohorte 32 Patienten behandelt. Primäre Endpunkte waren Sicherheit und das objektive Ansprechen. Die häufigsten Nebenwirkungen waren Müdigkeit und Schmerzen an der Injektionsstelle. Das Ansprechen war 22%.
Seltene Tumore des Kopf-Hals-Bereichs
Nasopharynx-Ca (NPC)
Lokalisierte Stadien
Kurativ intendierte Standardtherapie des lokalisierten Nasopharynxkarzinoms (NPC) ist in frühen Stadien Radiotherapie und in lokal fortgeschrittenen Stadien (III und IVa) Radiochemotherapie mit Cisplatin 100 mg/m2 jede 3 Wochen. Der Stellenwert der neoadjuvanten Chemotherapie war lange unklar (11).
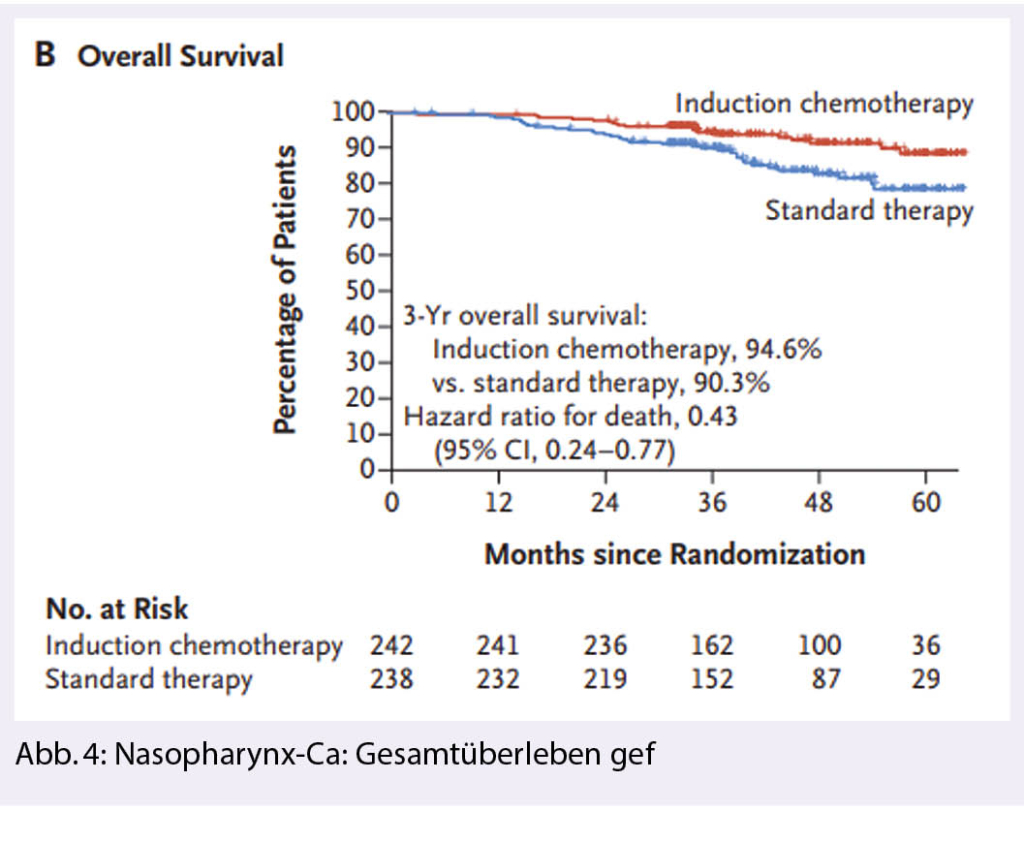
Die im Jahr 2020 publizierte Phase 3 Studie hat die Rolle der neoadjuvanten Chemotherapie als Teil der kurativ intendierten Behandlung von lokal fortgeschrittenen Stadien etabliert (12). Insgesamt480 Patienten mit lokal fortgeschrittenem NPC Stadium III und IVa wurden 1:1 randomisiert. Im Standardarm erhielten die Patienten eine Radiochemotherapie. Im Studienarm erhielten die Patienten vor der RCT zusätzlich drei Zyklen Induktionschemotherapie (IC) mit Cisplatin (80 mg/m2 d1) und Gemcitabine (1000 mg /m2 d1 + 8). Der primäre Endpunkt war rezidivfreies Überleben.
Im Studienarm haben 96.7% der Patienten die geplanten drei Induktionschemotherapiezyklen erhalten und 97.9% haben anschliessend konkomitierende RCT erhalten. Der Anteil von Patienten, die Cisplatindosis von mindestens 200 mg/m2 konkomitierend zu RT erhalten haben, war im IC Arm 79.9% und im Kontrollarm 95.8%.
Der Hauptendpunkt wurde erreicht. Die Resultate zeigten signifikante Verbesserung des rezidivfreien Überlebens (85.3% in IC vs. 76.5%; HR 0.51, 95%CI 0.34-0.77; p=0.001). Die objektive Ansprechrate nach 3 Zyklen IC war hoch (94.6%). Bei 13% der Patienten im Induktionsarm wurde Dosisreduktion vorgenommen, meistens aufgrund von hämatologischen Nebenwirkungen.
Nach drei Jahren waren 94.6 Patienten im Induktionsarm und 90.3 Patienten im Standardarm am Leben (HR 0.43 CI 0.24-0.77). Zu diesem Zeitpunkt waren 91.1% der Patienten im IC Arm und 84.4% im Kontrollarm am Leben ohne Fernmetastasen. Hingegen war der Anteil von Patienten, die nach drei Jahren am Leben und ohne Lokalrezidive waren, durch IC nicht verändert (91.8% vs. 91.0%) (Abb. 4).
Metastasiertes NPC
Bei metastasierendem NPC zeigte eine randomisierte Phase 3 Studie, dass das gleiche Schema (Cisplatin (80 mg/m2 d1 und Gemcitabine 1000 mg/m2 d1 und 8) einer Therapie mit Cisplatin und 5FU überlegen war (13). Der primäre Endpunkt, progressionsfreies Überleben, war im Cisplatin-Gemcitabine Arm signifikant länger als im Kontrollarm (7.0 Monate vs. 5.6 Monate, HR 0.55, CI 0.44-0.68, p < 0.0001) [You, 2020 #8024].
In der Zweitlinie werden Taxane, 5-FU, Capecitabine, Vinorelbine, Ifosfamid, Doxorubicin, Carboplatin, Oxaliplatin und Cetuximab eingesetzt, in Kombination oder als Monotherapie. Eine Standardtherapie existiert nicht. Immun-Checkpointinhibitoren zeigen in Basket-Studien versprechende Aktivität. Die Daten aus grösseren Studien werden erwartet.
Bei primär metastasiertem NPC verbessert RCT des Primärtumors zusätzlich zur palliativen Systemtherapie das Gesamtüberleben, wie eine randomisierte Phase 3 Studie zeigte. Die Patienten, bei welchen bereits bei der Diagnosestellung eines NPC Fernmetastasen vorhanden waren, wurden nach 3 Zyklen einer Chemotherapie mit Cisplatin und 5FU mit einer RCT behandelt. Der primäre Endpunkt, Verbesserung des Gesamtüberlebens, wurde erreicht. Nach 24 Monaten waren im Arm mit Chemotherapie/RCT
76.4% Patienten am Leben und im Arm ohne Radiotherapie 54.5%, was bei einem HR von 0.42 (95% CI, 0.23-0.77) und einem p = 0.004 signifikant war. Ebenfalls konnte das progressionsfreie Überleben verbessert werden (HR, 0.36; 95% CI, 0.23-0.57) (14).
Speicheldrüsenkarzinome
Systemtherapie hat in Behandlung von Speicheldrüsenkarzinomen eine Rolle vor allem in metastasierender Situation bzw. bei lokoregionären Rezidiven, die nicht mehr kurativ angegangen werden können. Die Chemotherapie hat eine limitierte Wirkung und längeres Ansprechen ist selten. Bei oligometastatischer Situation sollen Radiotherapie und Chirurgie im Rahmen von interdisziplinären Tumorboards diskutiert und eingesetzt werden.
Die gezielte Therapie hat einen Stellenwert vor allem bei Tumoren mit Her2-Amplifikation oder Überexpression, bzw. bei einer Expression von Androgenrezeptoren. Diese Eigenschaften sieht man am häufigsten in der Gruppe von Speichelgangkarzinomen (salivary duct cancer).
Bei Her2 exprimierenden Karzinomen zeigten die case reports bzw. kleine Serien bereits vor Jahren Wirksamkeit einer Therapie mit Trastuzumab als Monotherapie oder in Kombination mit Chemotherapie bei metastasierten Speicheldrüsekarzinomen.In den letzten Jahren wurden die Berichte publiziert, die Wirksamkeit von der dualen Her2-Blockade mit Trastuzumab und Pertuzumab bzw. deren Kombination mit Docetaxel gezeigt haben. Des Weiteren zeigten kleine Patientenserien die Wirksamkeit von Trastuzumab-Emtensine nach Progression unter Trastuzumab mit oder ohne Pertuzumab (15, 16, 17). Mehrere case reports haben ebenfalls das Ansprechen auf Androgenblokade gezeigt (18).
Adenoid-zystisches Karzinom (ACC) ist nach dem mukoepidermoid-Karzinom die zweithäufigste Gruppe und weist eine hohe Rate an Fernmetastasierung auf, die zum Teil spät (10-20 Jahre nach der Erstdiagnose) auftreten kann. Eine Standardtherapie in metastasierter Situation besteht nicht. Chemotherapie weist tiefe Ansprechraten auf. Resektion oder Radiotherapie der Lungenmetastasen wird häufig durchgeführt. Eine Phase 2 Studie mit Lenvatinib (24 mg po tgl.) bei 32 Patienten mit metastasiertem ACC und Progredienz nach mindestens einer Vortherapie zeigte ein partielles Ansprechen bei 5 Patienten (15.6%) und eine Krankheitsstabilisierung bei weiteren 24 Patienten (75%). Das mediane progressionsfreie Überleben war 17.5 Monate (19) (Abb. 5).
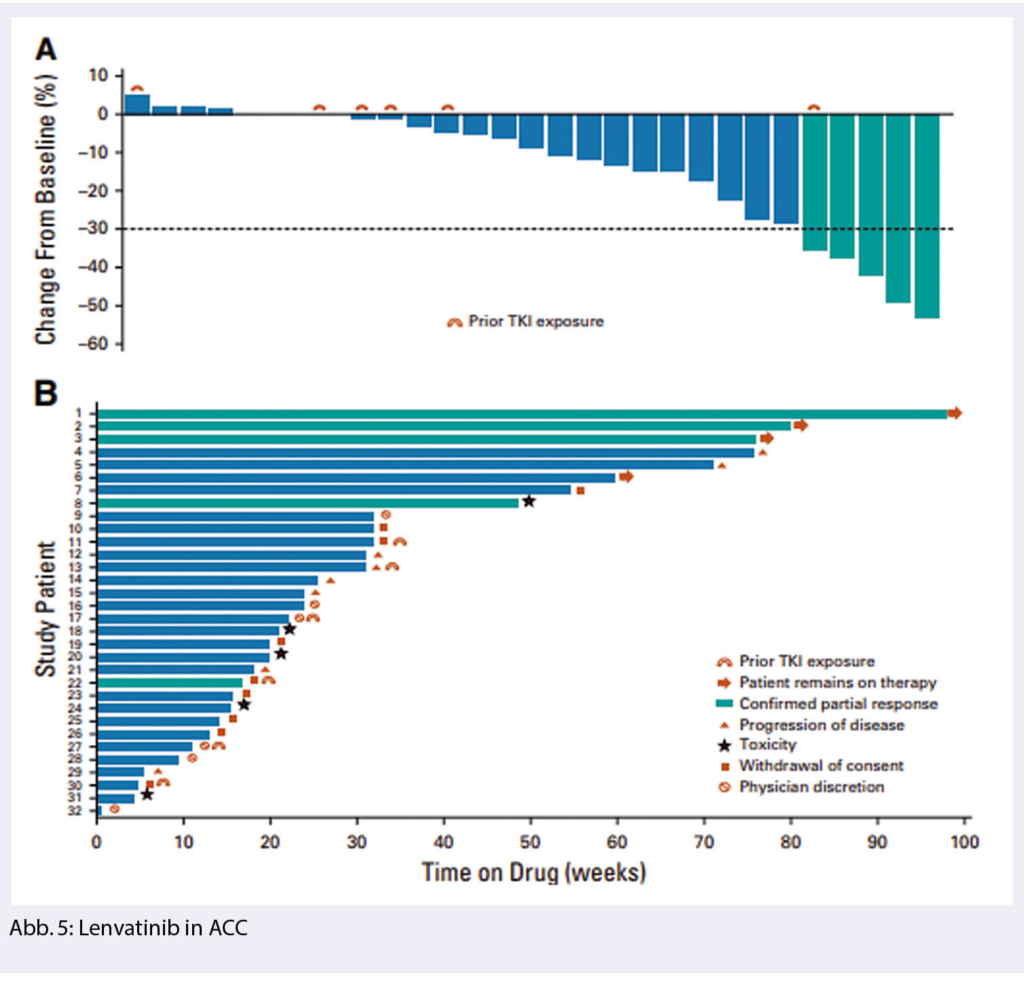
Eine weitere Studie bei mACC mit Axitinib vs. Placebo zeigte Verbesserung des progressionsfreien Überlebens, jedoch konnten auch Patienten, die nicht progredient waren, eingeschlossen werden, sodass die Daten schwierig zu interpretieren sind.
Sekretorisches Karzinom (mammary-analogue) (MASC) ist eine seltene Subgruppe von Speicheldrüsenkarzinomen bei welchen in praktisch allen Fällen eine ETV6 Translokation, meistens mit NTRK3, vorhanden ist. Für diese sehr seltene Krankheit bieten die NTRK Inhibitoren eine vielversprechende therapeutische Option. In der Studie im NEJM publizierten Studie mit verschiedenen Entitäten waren 11 Patienten mit MASC eingeschlossen. Zehn Patienten haben ein objektives Ansprechen gezeigt (20).
Copyright bei Aerzteverlag medinfo AG
Kantonsspital St. Gallen, Klinik für Hämatologie
und Onkologie und Brustzentrum
Rorschacherstrasse 95
9007 St. Gallen
Die Autorin deklariert Advisory board fees von BMS und MSD.
1. Ferris RL, Blumenschein G, Jr., Fayette J et al. Nivolumab for Recurrent Squamous-Cell Carcinoma of the Head and Neck. N Engl J Med 2016.
2. Gillison ML, Blumenschein G, Jr., Fayette J et al. CheckMate 141: 1-Year Update and Subgroup Analysis of Nivolumab as First-Line Therapy in Patients with Recurrent/Metastatic Head and Neck Cancer. Oncologist 2018; 23: 1079-1082.
3. Burtness B, Harrington KJ, Greil R et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet 2019; 394: 1915-1928.
4. Cohen EEW, Soulieres D, Le Tourneau C et al. Pembrolizumab versus methotrexate, docetaxel, or cetuximab for recurrent or metastatic head-and-neck squamous cell carcinoma (KEYNOTE-040): a randomised, open-label, phase 3 study. Lancet 2019; 393: 156-167.
5. Zandberg DP, Algazi AP, Jimeno A et al. Durvalumab for recurrent or metastatic head and neck squamous cell carcinoma: Results from a single-arm, phase II study in patients with >/=25% tumour cell PD-L1 expression who have progressed on platinum-based chemotherapy. Eur J Cancer 2019; 107: 142-152.
6. Siu LL, Even C, Mesía R et al. Safety and Efficacy of Durvalumab With or Without Tremelimumab in Patients With PD-L1-Low/Negative Recurrent or Metastatic HNSCC: The Phase 2 CONDOR Randomized Clinical Trial. JAMA Oncol 2019; 5: 195-203.
7. Ferris RL, Haddad R, Even C et al. Durvalumab with or without tremelimumab in patients with recurrent or metastatic head and neck squamous cell carcinoma: EAGLE, a randomized, open-label phase III study. Ann Oncol 2020; 31: 942-950.
8. Cohen R, Fayette J, Posner M et al. Abstract CT158: Phase II study of monalizumab, a first-in-class NKG2A monoclonal antibody, in combination with cetuximab in previously treated recurrent or metastatic squamous cell carcinoma of the head and neck (R/M SCCHN): Preliminary assessment of safety and efficacy. 2018; 78: CT158-CT158.
9. Taylor MH, Lee C-H, Makker V et al. Phase IB/II Trial of Lenvatinib Plus Pembrolizumab in Patients With Advanced Renal Cell Carcinoma, Endometrial Cancer, and Other Selected Advanced Solid Tumors. 2020; 38: 1154-1163.
10. Cohen RB, Lefebvre G, Posner MR et al. 1134P – Monalizumab in combination with cetuximab in patients (pts) with recurrent or metastatic (R/M) head and neck cancer (SCCHN) previously treated or not with PD-(L)1 inhibitors (IO): 1-year survival data. Annals of Oncology 2019; 30: v460.
11. Blanchard P, Lee A, Marguet S et al. Chemotherapy and radiotherapy in nasopharyngeal carcinoma: an update of the MAC-NPC meta-analysis. Lancet Oncol 2015; 16: 645-655.
12. Zhang Y, Chen L, Hu GQ et al. Gemcitabine and Cisplatin Induction Chemotherapy in Nasopharyngeal Carcinoma. N Engl J Med 2019; 381: 1124-1135.
13. Zhang L, Huang Y, Hong S et al. Gemcitabine plus cisplatin versus fluorouracil plus cisplatin in recurrent or metastatic nasopharyngeal carcinoma: a multicentre, randomised, open-label, phase 3 trial. Lancet 2016; 388: 1883-1892.
14. Huang T, Su N, Zhang X et al. Systemic chemotherapy and sequential locoregional radiotherapy in initially metastatic nasopharyngeal carcinoma: Retrospective analysis with 821 cases. Head Neck 2020; 42: 1970-1980.
15. Thorpe LM, Schrock AB, Erlich RL et al. Significant and durable clinical benefit from trastuzumab in 2 patients with HER2-amplified salivary gland cancer and a review of the literature. Head Neck 2017; 39: E40-E44.
16. Park JC, Ma TM, Rooper L et al. Exceptional responses to pertuzumab, trastuzumab, and docetaxel in human epidermal growth factor receptor-2 high expressing salivary duct carcinomas. Head Neck 2018; 40: E100-E106.
17. Swed BL, Cohen RB, Aggarwal C. Targeting HER2/neu Oncogene Overexpression With Ado-Trastuzumab Emtansine in the Treatment of Metastatic Salivary Gland Neoplasms: A Single-Institution Experience. JCO Precis Oncol 2019; 3.
18. Poxleitner P, Shoumariyeh K, Steybe D et al. Combined androgen deprivation therapy in recurrent androgen-receptor-positive salivary duct carcinoma – a case report and review of the literature. J Stomatol Oral Maxillofac Surg 2020; 121: 599-603.
19. Tchekmedyian V, Sherman EJ, Dunn L et al. Phase II Study of Lenvatinib in Patients With Progressive, Recurrent or Metastatic Adenoid Cystic Carcinoma. J Clin Oncol 2019; 37: 1529-1537.
20. Drilon A, Laetsch TW, Kummar S et al. Efficacy of Larotrectinib in TRK Fusion-Positive Cancers in Adults and Children. N Engl J Med 2018; 378: 731-739.
Eosinophile Ösophagitis
Bei der eosinophilen Ösophagitis (EoE) handelt es sich um eine allergie-artige TH2-Typ-vermittelte, chronische Entzündung der Speiseröhre mit steigender Prävalenz. Der genaue Pathomechanismus ist bis dato (noch) nicht geklärt, man geht primär von einer genetischen Prädisposition mit Exposition gegenüber verschiedenen Umweltfaktoren sowie einer atopischen Diathese aus. Zur Behandlung werden topisch-wirksame Steroide, Protonenpumpeninhibitoren (PPI) und Eliminationsdiäten empfohlen. Ohne adäquate Therapie gipfelt die EoE in Dysphagie, Bolusobstruktionen und einer progredienten (wahrscheinlich zumindest partiell irreversiblen) Fibrosierung. Das Leitsymptom bei der EoE ist bei adoleszenten und erwachsenen Patienten eine Dysphagie für solide Speisen. Da sich hinter diesem Symptom fast immer eine organische Erkrankung des Oesophagus verbirgt – Red Flag Symptom – muss eine EoE aktiv mittels Endoskopie (inklusive der Entnahme von multiplen Biopsien im proximalen und distalen Ösophagus) gesucht werden. Die EoE erfordert oft eine langfristige Erhaltungstherapie und wiederholte Endoskopien, weshalb Patienten schon bei Diagnosestellung auf eine Langzeitbehandlung hingewiesen werden sollten.
Die eosinophile Ösophagitis (EoE) wurde erstmals in den frühen 90er Jahren unabhängig voneinander durch Attwood und Straumann (notabene ein Schweizer Kollege) als eigenständige Krankheitsentität charakterisiert (1, 2). Ein erster internationaler Konsensus mit Krankheitsdefinition und Empfehlungen zu Diagnostik und Therapie wurde aber erst 2007 publiziert. Dies als Folge einer seit Mitte der 90er Jahre für Kinder und Erwachsene gleichermassen rasant angestiegenen Inzidenz (aktuell in der westlichen Welt 4.4/100.000 Einwohner) wie auch Prävalenz (aktuell weltweit bei 34.2/100.000 Einwohnern) (3). In der westlichen Welt lebt somit unter etwa 3000 Einwohnern ein Patient mit diagnostizierter EoE. Die Endoskopie- und Biopsieraten sind im selben Zeitraum jedoch nur geringfügig angestiegen, weshalb die Zunahme der EoE nicht allein als Folge eines gehäuften, technischen Einsatzes in der Gastroenterologie anzusehen ist. Genetisch bedingt tritt die Erkrankung überproportional häufig beim männlichen Geschlecht auf und der Altersgipfel liegt bei etwa 35 Jahren. Es können aber praktisch alle Altersgruppen, von Kleinkindern bis zu Senioren, und auch Frauen betroffen sein. In zahlreichen Untersuchungen wurde gezeigt, dass die EoE derzeit eine der häufigsten Ursachen für Dysphagie und Bolusobstruktionen ist (1).
Pathophysiologie
Im Gegensatz zu allen anderen Abschnitten des Gastrointestinal-Trakts beherbergt der Ösophagus im gesunden Zustand keine eosinophilen Granulozyten. Weshalb es bei der EoE zu einer allergie-ähnlichen TH2-Typ-vermittelten Rekrutierung von (primär) eosinophilen Granulozyten in den Ösophagus mit einer konsekutiv chronischen Entzündungsreaktion kommt, ist noch nicht abschliessend geklärt (4). Man geht in erster Linie von einem multifaktoriellen Pathomechanismus aus (5). Sehr wahrscheinlich wird die EoE bei entsprechender, genetischer Prädisposition durch die Exposition gegenüber verschiedenen Umweltfaktoren getriggert. Welche Faktoren dies im Einzelnen sind, ist bis anhin (noch) nicht abschliessend geklärt (Tab. 1). Eine zentrale Rolle dürften neben aerogenen vor allem Nahrungsmittel-Allergene wie Kuhmilch, Weizen, Eier, Soja, Hülsenfrüchte, Nüsse und Fisch/Meeresfrüchte spielen. Dementsprechend wurde auch eine Assoziation mit anderen atopischen Erkrankungen (z.B. allergische Rhinokonjunktivitis, Asthma bronchiale, allergische Dermatitis) beschrieben (9). Da die Inflammation im Ösophagus jedoch primär IgE-unabhängig vermittelt wird, gelingt es mittels IgE-basierter, allergologischer Diagnostik meist nicht das verantwortliche Antigen zu identifizieren. Eine laborchemische Erhöhung der Eosinophilenzahl und der Gesamt-IgE wird bei etwa 50%, respektive 70% der EoE Patienten gefunden, ist aber keinesfalls obligat. Im Langzeitverlauf kann es, bei fehlender oder inadäquater Therapie, durch ein Fortschreiten der Entzündungsreaktion zu einem sogenannten Remodeling (= Organumbau mit Wandverdickung und Wandstarre) der Speiseröhre mit Entwicklung von fibrotischen Strikturen und Beeinträchtigung der Funktion kommen. Dies erhöht das Risiko für die gefährlichen und praktisch nicht voraussehbaren Bolusimpaktationen.
Diagnose und Endoskopie
Die Diagnose einer EoE ist klinisch-pathologisch definiert und basiert auf dem Vorhandensein folgender Trias: Symptome passend zu einer ösophagealen Dysfunktion, histologischer Nachweis einer eosinophilen Gewebeinfiltration im Ösophagus (≥ 15 Eosinophile pro hochauflösendes Gesichtsfeld, HPF) kombiniert mit dem Ausschluss anderer Erkrankungen, welche mit einer eosinophilen Gewebeinfiltration einhergehen können und daher differentialdiagnostisch stets berücksichtigt werden sollten (Tab. 2).
Schwierig kann in diesem Zusammenhang die Abgrenzung gegenüber der äusserst häufigen gastro-ösophagealen Refluxkrankheit (GERD) sein. Gemäss einer neuen Konsensus-Arbeit (10) ist nun aber die früher propagierte, probatorische Gabe von Protonenpumpeninhibitoren (PPI) zur Differenzierung zwischen GERD und EoE obsolet – man hat erkannt, dass GERD und EoE koexistieren können und dass PPI auch bei alleiniger EoE effektiv sein können – , was einen wesentlich einfacheren, diagnostischen Algorithmus zur Folge hat (Abb. 1).

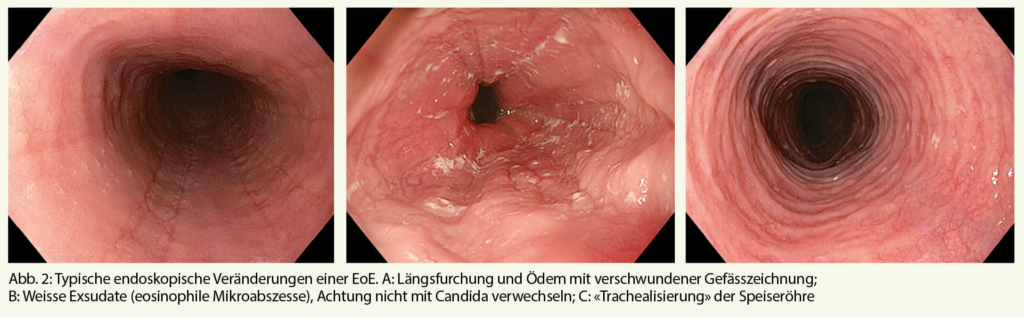
Dieser Paradigmenwechsel basiert primär auf der Annahme, dass sich eine GERD und eine EoE nicht gegenseitig ausschliessen, sondern sich eher gegenseitig beeinflussen und eine PPI-responsive ösophageale Eosinophilie eine Form der EoE sein kann. Deshalb sollten somit PPI’s bei der EoE als Therapeutikum und nicht als Diagnostikum eingesetzt werden. Eine zentrale Rolle in der primären Diagnostik aber auch der Aktivitätsbeurteilung im Verlauf der EoE stellt die Ösophago-Gastroduodenoskopie (ÖGD) mit fraktionierter Biopsieentnahme aus dem distalen, mittleren und proximalen Ösophagus dar. In Folge der chronischen Inflammation kann es zu typischen, makroskopischen Veränderungen kommen wie z.B. Längsfurchen (Abb. 2A) und/oder weissen Auflagerungen (teils stecknadelkopfartig, teils eher flächig), welche eosinophilen Mikroabszessen entsprechen (Abb. 2B). Zudem zeigt sich häufig auch eine Ringbildung im Sinne einer sog. «Trachealisierung» der Speiseröhre (auch als «feliner»= katzenartiger Ösophagus bezeichnet) (Abb. 2C) und nahezu pathognomonisch ist die sogenannte «Krepppapier-Mukosa». Hierunter versteht man eine äusserst fragile, unelastische Ösophagusschleimhaut, die bei geringster mechanischer Belastung reissen kann. Ist das Remodeling bereits weiter fortgeschritten, zeigen sich Strikturen und langstreckige Einengungen des Ösophaguslumens, welche zu Passagestörungen führen können. Diese makroskopischen Merkmale müssen aber nicht zwingend vorhanden sein. So zeigte eine Studie aus 2006 (11), dass in rund der Hälfte der untersuchten EoE-Patienten die typisch endoskopischen Befunde nur diskret ausgeprägt waren. Es ist deshalb wichtig bei Patienten mit Dysphagie auch bei endoskopisch unauffällig aussehendem Ösophagus fraktioniert mindestens 6-8 Biopsien aus allen drei Abschnitten des Ösophagus zu entnehmen. Dadurch wird der Tatsache einer oftmals inhomogenen, fleckförmigen und segmentären Verteilung der eosinophilen Infiltration Rechnung getragen. Histologisch zeigt sich bei der EoE ein primär eosinophiles Infiltrat mit Basalzonenhyperplasie und eosinophilen Mikroabszessen. Wie eingangs dieses Abschnitts beschrieben, basiert die Diagnose einer EoE auf dem Vorhandensein einer Trias. Deshalb sollten die Befunde nie isoliert, sondern stets im klinischen Gesamtkontext betrachtet werden.
Nicht nur bei Dysphagie muss an die EoE gedacht werden
Hinsichtlich der klinischen Manifestation klagen Patienten mit einer EoE – abhängig vom Alter – bei der Erstdiagnose über unterschiedliche Symptome. Kinder zeigen ein etwas diffuseres Beschwerdebild. Hier sollte insbesondere bei Nahrungsverweigerung, retrosternalen und abdominalen Schmerzen, Durchfällen, Erbrechen, Regurgitation und Gedeihstörung an eine EoE gedacht werden. Bei erwachsenen Patienten stellen die Dysphagie bis und mit Bolusobstruktion, sowie reflux-artige Retrosternalschmerzen die Leitsymptome der EoE dar. Die EoE ist mit 25% die häufigste Ursache für Bolusobstruktionen (18) und bei 54% der Patienten, die wegen einer Bolusimpaktation endoskopiert werden lässt sich eine EoE nachweisen (19). Von grosser Bedeutung bei Erwachsenen ist jedoch das Vorhandensein von sogenannten «avoidance signs». Dabei handelt es sich um diätetische «Ausweichstrategien»mit Weglassen kritischer Speisen und Anpassen der Essgewohnheiten, bedingt durch die ösophageale Motilitätsstörung oder eine beginnende Lumen-Einengung der Speiseröhre. Patienten (oder manchmal fast noch mehr deren Angehörige) berichten dabei vom Vermeiden einer hastigen Nahrungsaufnahme oder dem Meiden trockener und faseriger Speisen wie Fleisch oder Reis. Oder sie erwähnen ein auffallend langsames Verzehren von Speisen in Folge sorgfältigem Kauen und regelmässigem Trinken zwischen den einzelnen Nahrungsboli im Sinne eines «Nachspülens». Mit solchen Verhaltensanpassungen lassen sich die Schluckbeschwerden oftmals über lange Zeit verbergen. Diese Symptome stellen Hinweise für das Vorhandensein einer EoE dar und ermöglichen bei frühzeitigem Erkennen und richtiger Interpretation eine entsprechende Diagnostik und den Beginn einer Therapie vor dem Auftreten einer Akutsituation mit Bolusimpaktation infolge einer Striktur.
Therapiemöglichkeiten der EoE die drei D’s: «Drugs»«Diät»«Dilatation»
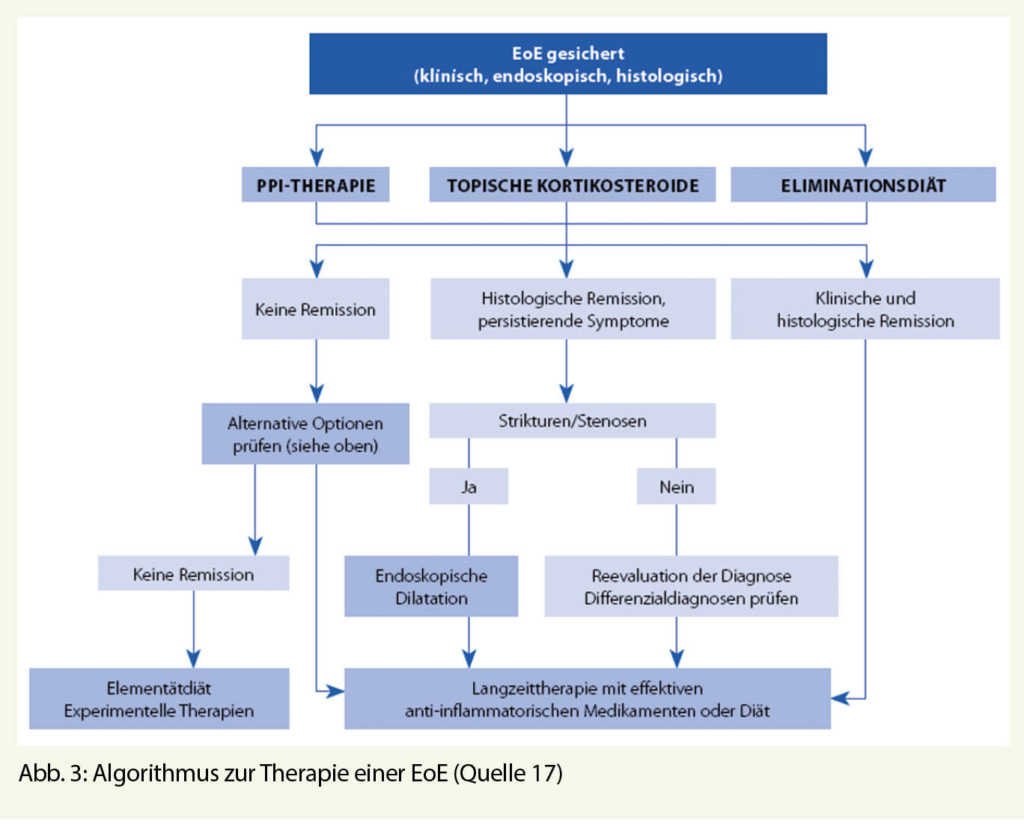
Die EoE ist eine chronische Erkrankung, die unbehandelt mit einem nicht zu unterschätzenden Risiko an Komplikationen einhergeht. Das Ziel der Therapie ist die Induktion und der langfristige Erhalt einer klinischen und histologischen Remission. Bei gesicherter EoE wird – gemäss aktueller Leitlinien (10,12,17) – die Therapie mit topischen Steroiden, PPI und/oder einer Eliminationsdiät empfohlen (Abb. 3). Kürzlich publizierte Daten, liefern zudem vielsprechende Resultate hinsichtlich einer Therapie mit dem rekombinanten, humanen, monoklonalen IgG4-Antikörper Dupilumab (Dupixent®), dessen Stellenwert innerhalb der Therapieoptionen bei der EoE jedoch noch definiert werden muss. Vermutlich dürfte diese Therapie primär – nicht zuletzt auch aus ökonomischen Gründen – nur bei Therapieversagern auf bisherige Therapieoptionen zum Einsatz kommen.
Topisch-wirksame Kortikosteroide
Eine hohe Evidenz liegt für die Wirkung von topischen Kortikosteroiden zur Induktionstherapie der EoE vor (13). Für Jugendliche und Erwachsene werden als Initialdosis Budesonid 2 x 1mg/Tag bzw. Fluticason 2 x 880 µg/Tag (nicht inhaliert sondern geschluckt) empfohlen, wobei tendenziell höhere Remissionsraten für Budesonid beobachtet werden konnten (14). In verschiedenen Studien konnten mit Budesonid in Form einer Schmelztablette histologische Remissionsraten von über 90% und klinisch-histologische Remissionsraten von bis zu 85% erreicht werden (7). Dementsprechend wurde 2018 eine Budesonid Schmelztablette (Jorveza®) zur medikamentösen Behandlung der eosinophilen Ösophagitis beim Erwachsenen entwickelt und zugelassen. Das Präparat entfaltet seine Wirkung direkt am Ort der Entzündung und ist allgemein gut verträglich. Durch die Unterdrückung der Entzündungsreaktion kann sich jedoch das Risiko für lokale Infektionen – besonders für milde bis mittelschwere Pilzinfektionen in Mund, Rachen und Speiseröhre – erhöhen. Es könnten sich theoretisch zudem systemische Kortikosteroid-Nebenwirkungen zeigen. Diese treten, gemäss aktuellem Wissensstand, im Vergleich zu Placebo jedoch nicht gehäuft auf (16). Obwohl Jorveza® in der Schweiz zur zeitlich limitierten Therapie der EoE zugelassen ist (Induktionstherapie für 6-12 Wochen), wurde das Medikament vom Bundesamt für Gesundheit (BAG) bis anhin noch nicht in die Spezialitäten Liste aufgenommen (Stand November 2020). Die Krankenkassen sind somit (noch) nicht verpflichtet die Kosten für Jorveza® zu übernehmen, weshalb die behandelnden Ärzte eine Kostengutsprache einzufordern haben. Alternativ können Magistralrezepturen in Form eines budesonidhaltigen Sirups oder topische Kortikosteroide welche für die Therapie von allergischen Atemwegserkrankungen entwickelt worden sind – zum Beispiel Axotide-Diskus, Pulmicort-Respules – verschrieben werden. Jedoch müssen die Patienten über die abgeänderte Anwendungsart genau instruiert werden. Diese benötigen keine Kostengutsprache, jedoch erheblich Sprechstundenzeit bei deren Verschreibung. Kürzlich hat die Europäische Arzneimittel-Agentur (EMA) zudem –
basierend auf einer grossen Europäischen Langzeit-Studie – die Zulassung für eine Langzeit-Therapie mit Jorveza® erteilt (16).
Protonenpumpeninhibitoren
Bisher ist die Datenlage, hinsichtlich eines direkten Vergleichs der Wirkung zwischen einer PPI-Therapie und den topischen Kortikosteroiden, beziehungsweise einer PPI-Therapie und einer Eliminationsdiät, sehr schwach (12). Zudem basiert der Grossteil der Studien zur Wirkung der Steroidtherapie bzw. der Eliminationsdiät auf einem Patientenkollektiv, welches kein Ansprechen auf eine PPI Therapie gezeigt hat. Die wenigen vorliegenden Daten zeigen aber, dass die Wirksamkeit der PPI eine EoE klinisch und histologisch in Remission zu bringen nur bei etwa 30% bis maximal 40% liegt, also deutlich tiefer als bei den Steroiden. Gemäss verschiedenen, internationalen Guidelines (10, 12) wird trotzdem der Einsatz von PPI empfohlen, basierend auf den langjährigen Erfahrungen in der Verschreibung von PPI bei vergleichsweise geringem Nebenwirkungsprofil sowie aufgrund einiger Studien, welche nachweislich einen positiven Effekt der PPI-Therapie bei Patienten mit einer EoE zeigen konnten (10). Wichtig zu erwähnen ist, dass die PPI-Therapie eine vorgängige, ergänzende oder anschliessende anti-entzündliche Therapie nicht ausschliesst, was auch der Möglichkeit einer Ko-Existenz von GERD und EoE Rechnung tragen soll.
Eliminationsdiäten
Im Gegensatz zu den Medikamenten, welche die allergische Entzündung lediglich unterdrücken, verfolgen die Eliminationsdiäten einen kausalen Therapieansatz. Denn wenn ein entzündungsauslösendes Lebensmittel konsequent vermieden werden kann, lässt sich die EoE mittels Diät oft ohne Medikamente erfolgreich behandeln. Man unterscheidet drei Diätformen (15): da allergisierende Substanzen meistens Eiweisse (Proteine) sind, werden bei der Elementardiät proteinhaltige Speisen komplett vermieden. Um eine Malnutrition zu verhindern, sind Patienten ergänzend auf proteinfreie-aminosäurehaltige Nährlösungen angewiesen. Leider sind diese Nährlösungen geschmacklich nicht sehr attraktiv und teuer, und müssen deshalb bei Kindern oft via Magensonde verabreicht werden. Diese Diätform wird deshalb vor allem bei schweren Formen der EoE eingesetzt. Bei der allergietest-basierten Eliminationsdiät werden lediglich diejenigen Speisen weggelassen, welche mittels Allergie-Testung identifiziert worden sind. Da praktisch alle Allergie-Tests IgE-basiert sind und es sich bei der EoE aber um eine nicht-IgE-vermittelte Allergie handelt, existieren bisher leider noch keine Tests, welche die allergisierenden Speisen zuverlässig identifizieren. Es gelingt deshalb nur bei etwa 20% der Erwachsenen und bei etwa 40% der Kinder die EoE erfolgreich mittels dieser mass-geschneiderten Diät zu behandeln. Die empirische Eliminationsdiät stellt die dritte Diätform dar und basiert auf dem Wissen, dass Milchprodukte (Achtung: Milchproteine, nicht Milchzucker), Weizen (eventuell Gluten), Eier, Nüsse, sowie seltener Soja, Fisch und Meeresfrüchte die häufigsten Trigger (Auslöser) der EoE darstellen. Beim Vermeiden von allen sechs Lebensmittelkategorien spricht man von einer «6-Food-Elimination Diet» (6-FED). Erreicht man dadurch eine Remission der EoE, wird in der Folge schrittweise und kontrolliert eine Kategorie nach der anderen wieder zugeführt, um die allergisierende Speise zu identifizieren (step-down Strategie). Diese Diät hat eine gut 70%-ige Erfolgschance, jedoch ist das Verfahren zeitintensiv und erfordert wiederholte Endoskopien sowie eine engmaschige Betreuung durch erfahrene Ernährungsberater und Gastroenterologen. Alternativ können auch nur eine oder zwei Lebensmittelkategorien (1-FED, 2-FED) weggelassen werden (vorzugsweise Milch oder Weizen), und falls nötig, noch weitere Kategorien dazu gefügt werden (step-up Strategie). Letztlich sollten diätetische Behandlungen ausschliesslich bei motivierten Patienten und nur an Zentren durchgeführt werden, welche die notwendige Expertise vorweisen können.
Endoskopische Dilatation
Endoskopische Verfahren (z.B. Bougierung, Ballondilatation) sind Patienten mit Stenosen bzw. Strikturen vorbehalten, welche nicht oder nur ungenügend auf eine vorgängige, medikamentöse Therapie angesprochen haben. Erwähnt werden sollte hier das Perforationsrisiko einer endoskopischen Therapie bei EoE Patienten, welches in früheren Arbeiten aber eher überschätzt wurde. Zudem wird durch diese Therapie die der EoE zu Grunde liegende Inflammation nicht beeinflusst. Dilatationen werden deshalb praktisch immer mit anti-entzündlichen Therapien kombiniert.
Follow-Up und Prognose
Der Schweregrad der Entzündung korreliert bei der EoE schlecht mit dem Schweregrad der klinischen Symptome bzw. der makroskopischen Befunde in der ÖGD (7, 8, 10, 12, 13). Deshalb wird primär die Bestimmung der histologischen Aktivität als Standard gefordert. Dies bedingt wiederholte, endoskopische Untersuchungen mit Biopsie-Entnahmen, insbesondere nach Anpassung der Therapie. Sind bei einem Patienten aber die beiden Therapieziele – Beschwerdefreiheit und Kontrolle der Entzündung – erreicht, reichen jährliche Kontrollen im Allgemeinen aus. Da es sich bei der EoE um eine chronische Erkrankung handelt sollten Patienten bereits anlässlich der Diagnosestellung über die Notwendigkeit einer Langzeitbehandlung aufgeklärt werden. Bisher konnte bei EoE Patienten, trotz der chronisch entzündlichen Genese der Erkrankung, zum Glück kein erhöhtes Risiko für Ösophaguskarzinome nachgewiesen werden.
Verdankung: Für die kritische Durchsicht und wertvollen Anregungen danken die Autoren PD Dr. med. Luc Biedermann, Leitender Arzt an der Klinik für Gastroenterologie und Hepatologie am Universitätsspital Zürich.
Copyright bei Aerzteverlag medinfo AG
Abteilung für Gastroenterologie / Hepatologie
Luzerner Kantonsspital
Spitalstrasse, 6000 Luzern 16
Jon-Duri.Senn@luks.ch
Abteilung für Gastroenterologie / Hepatologie
Luzerner Kantonsspital
Spitalstrasse
6000 Luzern 16
Die Autoren haben keine finanziellen oder persönlichen Verbindungen im Zusammenhang mit diesem Beitrag zu deklarieren.
1. Dellon ES, Hirano I. Epidemiology and natural history of eosinophilic esophagitis. Gastroenterology 2018;154:319–332
2. Straumann A, Spichtin HP, Bernoulli R, Loosli J, Vögtlin J. Idiopathische, eosinophile Ösophagitis: eine häufig verkannte Krankheit mit typischer Klinik und diskretem endoskopischem Bild. Schweiz Med Wochenschr. 1994;124:1419-1429
3. Navarro P, et al. Systematic review with meta-analysis: the growing incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther. 2019;49(9):116-25
4. Straumann A, et al. Idiopathic eosinophilic esophagitis is associated with a TH 2-type allergic inflammatory response. J Allergy Clin Immunol. 2001;108:954–6
5. O’Shea KM, et al. Pathophysiology of Eosinophilic Esophagitis. Gastroenterology. 2018;154(2):33-45
6. Jensen ET, et al. Early-life environmental exposures interact with genetic susceptibility variants in pediatric patients with eosinophilic esophagitis. J Allergy Clin Immunol Pract. 2018;141:632-37
7. Miehlke S. Eosinophile Ösophagitis. Falk Gasto-Kolleg. 2019;1:1-13
8. Miehlke S, et al. Eosinophilic Esophagitis: Recent Developments in Diagnosis & Treatment. Falk Gastro Review Journal. 2020;2:13-15
9. Hill DA, Cianferoni A, Spergel JM, Aceves S, Holbreich M, Venter C, et al. Eosinophilic esophagitis is characterized by a non-IgE-mediated food hypersensitivity. Allergy. 2016;71:611-20
10. Dellon ES, Liacouras CA, Molina-Infante J, Furuta GT, Spergel JM, Zevit N, et al. Updated international consensus diagnostic criteria for eosinophilic esophagitis: Proceedings of the AGREE conference. Gastroenterology. 2018;155:1022-1033
11. Gonsalves N, Policarpio-Nicolas M, Zhang Q, Rao S, HiranoI. Histopathologic Variability and endoscopic correlates inadults with Eosinophilic Esophagitis. Gastrointest Endoscopy. 2006;64:313–9
12. Hirano I, Edmond SC, Matthew AR, Rajiv NS, Neil HS, David RS, et al. AGA institute and the joint task force on allergy-immunology practice parameters clinical guidelines for the management of eosinophilic esophatitis. Gastroenterology. 2020;158:1776-86
13. Rank MA, Sharaf RN, Furuta GT, et al. Technical review on the management of eosinophilic esophagitis: a report from the AGA Institute and the joint Task Force on Allergy-Immunology Practice Parameters. Gastroenterology. 2020;158:1789-1810
14. De Heer J, Miehlke S, Rösch T, Morgner A, Aigner A, et al. Histologic and Clinical Effects of Different Topical Corticosteroids for Eosinophilic Esophagitis: Lessons from an Updated Meta-Analysis of Placebo-Controlled Randomized Trials. Digestion. 2020;1:1-9
15. Online unter URL: https://www.e-oe.ch/therapie.36de.html
16. Straumann A, Lucendo AJ, Miehlke S, et al. Budesonide Orodispersible Tablets Maintain Remission in a Randomized, Placebo-Controlled Trial of Patients With Eosinophilic Esophagitis. Gastroenterology 2020.
17. Miehlke S, Schlag C, Storr M, von Arnim U. Eosinophile Ösophagitis Update 2017: Neue Leitlinien der europäischen Studiengruppe EUREOS. Z Gastroenterol. 2018;56:139-50
18. Sengupta N, et al. The clinical predictors of aetiology and complications among 173 patients presenting to the Emergency Department with oesophageal food bolus impaction from 2004-2014. Aliment Phatmacol Ther. 2015;42:91-98
19. Arias A, et al. Systematic review with meta-analysis: the incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther. 2016 ;43 :3-15
Calprotectin
Erstmalig beschrieben wurde das Calprotectin im Jahre 1980 als Protein L1. Heutzutage ist der aktuell relevanteste fäkale Biomarker aus dem klinischen Alltag des Hausarztes, Internisten und Gastroenterologen kaum mehr wegzudenken. Er wird häufig in Arztpraxen und im Krankenhaus dazu gebraucht, organische von funktionellen gastrointestinalen Erkrankungen abzugrenzen.
Chronisch-entzündliche Darmerkrankungen und das Reizdarmsyndrom
Zwei Krankheitsentitäten, welche es im klinischen Alltag häufig auseinanderzuhalten gilt, sind chronisch-entzündliche Darmerkrankungen (engl. inflammatory bowel disease, IBD) und das Reizdarmsyndrom (engl. irritable bowel syndrome, IBS). IBD sind in westlichen Ländern mit einer Prävalenz von bis zu 0,5% auf dem Vormarsch und das IBS gehört mit einer Prävalenz von bis zu 11,2% zu den sog. Volkskrankheiten.
Da das fäkale Calprotectin eine Entzündung im Gastrointestinaltrakt anzeigt, spielt es eine besondere Bedeutung in der Diagnostik und Therapie der chronisch-entzündlichen Darmerkrankungen – namentlich Morbus Crohn und Colitis ulcerosa. In der Pathophysiologie dieses Krankheitsspektrums geht man von einer fehlgesteuerten Immunantwort in Zusammenhang mit dem intestinalen Mikrobiom aus. Beim Morbus Crohn liegt eine granulomatöse, transmurale Entzündung vor, welche prinzipiell den ganzen Gastrointestinaltrakt (von Mund bis Anus) betreffen kann. Im Falle der Colitis ulcerosa ist lediglich die Mukosa von der Entzündung, welche sich vom Rektum bis zum Zökum ausdehnen kann, betroffen. Prinzipiell kann die Erkrankung in jedem Alter auftreten, der dominante Altersgipfel liegt im jüngeren Erwachsenenalter (15-30 Jahre), wobei auch ein zweiter Peak im Alter (50-80 Jahre) existiert. Bei funktionellen Darmerkrankungen, hierunter stellt IBS die häufigste Entität dar, geht man u.a. von einer Dysregulation der Darm-Hirn-Achse und einer erhöhten Schmerzsuszeptibilität aus. Es handelt sich in der Regel um eine Ausschlussdiagnose, für welche die Rom-IV-Kriterien gelten.
Fäkales Protein, das bestimmten Einflüssen unterliegt
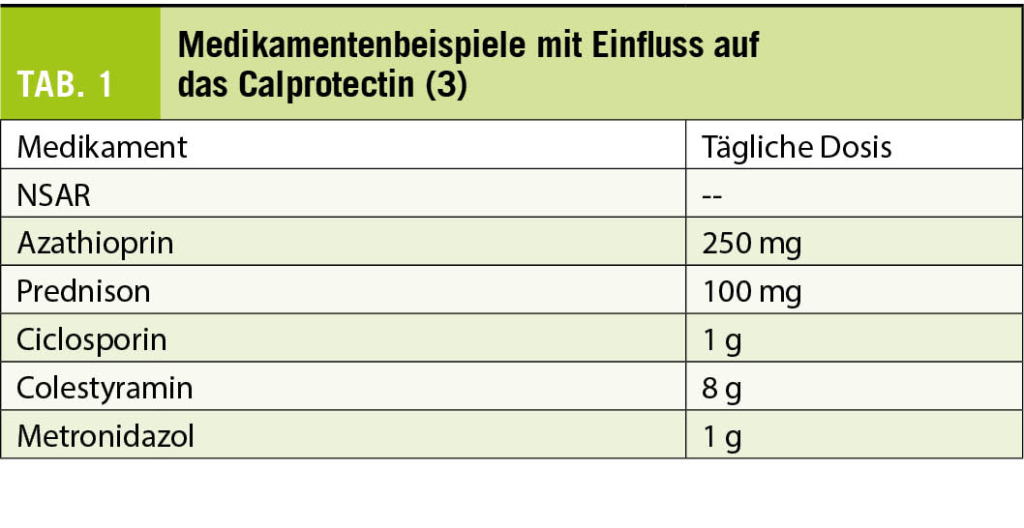
Calprotectin stammt überwiegend aus neutrophilen Granulozyten (weniger auch aus Makrophagen) und macht 60% des zytosolischen Proteins dieser Zellen aus. Es spielt eine Rolle im angeborenen Immunsystem und verfügt sogar über direkte antimikrobielle Effekte. Man kann es in verschiedenen Körperflüssigkeiten abhängig vom Entzündungsausmass nachweisen, wobei im Stuhl eine um bis zu sechsfach höhere Konzentration als im Plasma vorliegt.
Es sind viele kommerzielle Calprotectin-Assays vorhanden, welche zum Teil eine deutliche Inter-Assay-Variabilität aufweisen (von 5-1000 bis 5-8000 μg/g). Von den meisten Herstellern wird ein Cut-off von 50 μg/g als obere Grenze des normalen Referenzbereichs angegeben. Neuerdings werden bereits point-of-care Tests mit dem Smartphone angeboten. Dies wird in Studien von vielen Patienten als nützliches Eigenmonitoring wahrgenommen und könnte vermutlich gerade in Pandemiezeiten zunehmend an Bedeutung gewinnen. Insgesamt sollte der Kliniker beachten, dass Calprotectin gewissen Einflussfaktoren unterliegen kann: Alter, Medikation, GI-Blutungen und tagesabhängige Variationen gehören dazu. Bei Patienten unter 4 Jahren und denjenigen über 65 Jahren werden in der Literatur höhere Cut-off-Werte vorgeschlagen. Man geht davon aus, dass u.a. altersabhängige Veränderungen des Immunsystems relevant sein könnten. Zu den Medikamenten, die einen Calprotectin-Anstieg zur Folge haben können, gehören insbesondere NSAR (sowohl im Kurzzeit- als auch Langzeitgebrauch). Weitere Medikamente, welche das Calprotectin erhöhen können, sind Tab. 1 zu entnehmen. Auch GI-Blutungen per se scheinen eine Erhöhung des Calprotectins zu bewirken. Obwohl das Protein eine homogene Verteilung im Stuhl aufweist, liegt eine signifikante tageszeitabhängige Variabilität vor: insbesondere je grösser das Stuhlintervall, desto höher der Wert. Dies führte dazu, dass einige Autoren sich in der Vergangenheit für eine Calprotectin-Bestimmung aus dem ersten Stuhlgang des Tages aussprachen, was sich letztlich in Folgestudien nicht bestätigen liess. Dennoch kann es sicherlich nützlich sein, zwei Calprotectin-Messungen vor Therapieanpassung bei IBD-Patienten vorzunehmen (1).
Calprotectin in der (Differential-)Diagnostik gastrointestinaler Erkrankungen
Die Diagnosestellung gastrointestinaler Erkrankungen bleibt selbst für erfahrene Gastroenterologen eine diagnostische Herausforderung. Es ist in vielen Fällen nicht möglich, organische von funktionellen Erkrankungen rein klinisch auf Grundlage der Symptome zu differenzieren. Und laborchemische Untersuchungen (wie CRP und Leukozyten) haben keine ausreichende Sensitivität und Spezifität gezeigt. Daher bedarf es anderer diagnostischer Hilfsmittel. Die Endoskopie hat sich als Goldstandard etabliert, da sie die Vorteile der direkten Visualisierung mit der Möglichkeit der Biopsieentnahme kombiniert. Allerdings benötigt sie Ressourcen und kann unangenehm für den Patienten sein. Daher stellt das Calprotectin im Stuhl als nicht-invasiver fäkaler Biomarker ein sehr hilfreiches diagnostisches Instrument dar. Es eignet sich zur Beurteilung der Krankheitsaktivität und als Marker des mucosal healing. Zudem ist es ein Prädiktor für einen Schub bzw. ein Rezidiv (auch postoperativ). Damit dient es auch der Therapiesteuerung. Im Falle der Colitis ulcerosa hat sich eine enge Korrelation zur klinischen, endoskopischen und histologischen Krankheitsaktivität gezeigt, während es beim M. Crohn weniger mit der klinischen als vor allem mit der endoskopischen und histologischen Aktivität korrelierte.
Wichtig ist immer zu bedenken, dass das Calprotectin Ausdruck einer Entzündungsreaktion des Gastrointestinaltraktes ist und als solcher nicht spezifisch. So können infektiöse Gastroenteritiden genauso wie NSAR-assoziierte Enteropathien erhöhte Werte verursachen. Bei Erkrankungen wie der mikroskopischen Kolitis, Zöliakie, Divertikulitis und Ulzera des oberen GI-Traktes können erhöhte Werte festgestellt werden (2).
Mögliche Calprotectin-Grenzwerte
Die Interpretation der einzelnen Calprotectin-Werte ist aufgrund der eingangs bereits beschriebenen Variabilität oft nicht ganz einfach. Insbesondere diskrete Erhöhungen sind oft schwierig zu interpretieren. Grundsätzlich gilt, dass Calprotectin-Messungen immer im Kontext der Klinik des Patienten interpretiert werden müssen (abdominelle Schmerzen, Stuhlfrequenz und -konsistenz, Blut-oder Schleimauflagerungen, Fisteln, extraintestinale Manifestationen, etc.). Sie sollten nie isoliert betrachtet werden.
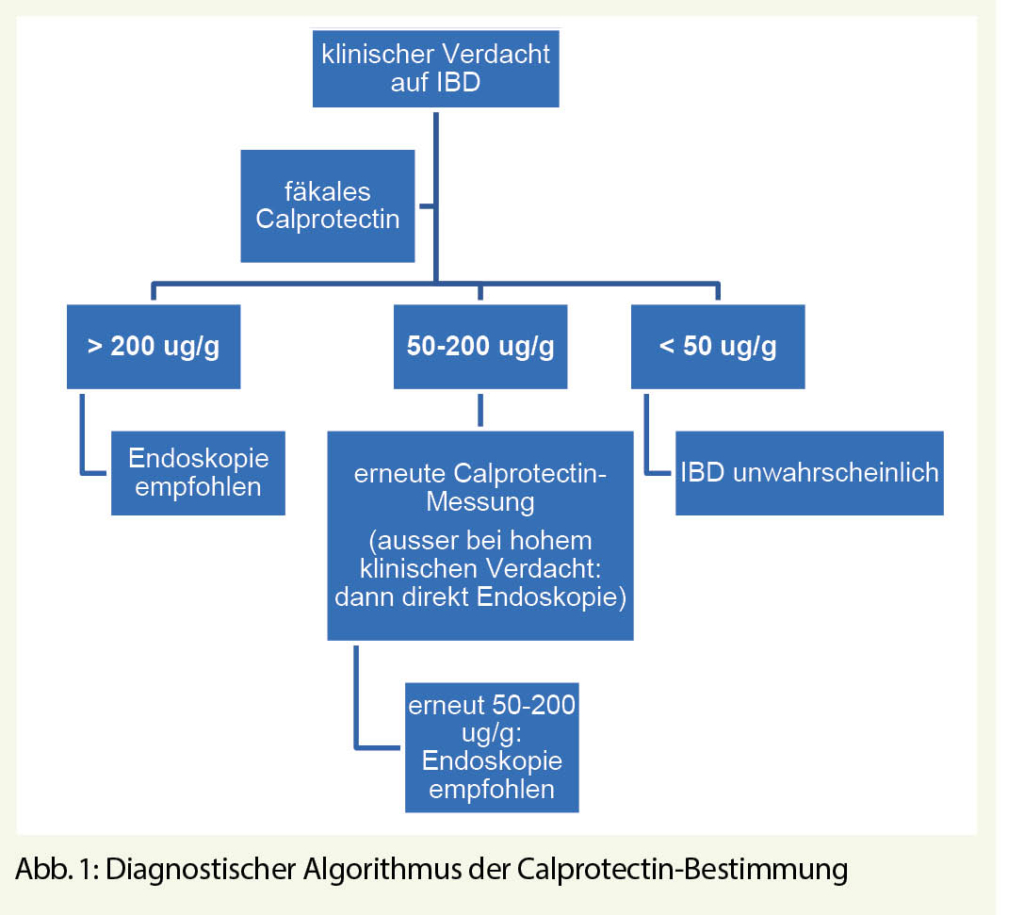
Der gängige Hersteller-Cut-off für das Calprotectin liegt bei 50 μg/g. Dieser Wert hat sicherlich seine Berechtigung als Screening-Verfahren (sehr hohe Sensitivität). Studien haben jedoch gezeigt, dass Werte bis 200 μg/g einen hohen negativ-prädikativen Wert von bis zu 97% aufweisen. Somit scheint es plausibel, diesen Wert als Cut-off für die Differenzierung von IBD und funktionellen Erkrankungen zu verwenden, um die Notwendigkeit einer ergänzenden Endoskopie einzuschätzen. Bei Patienten mit einem Wert zwischen 50 und 200 μg/g sollte allerdings eine zweite Calprotectin-Bestimmung (nach Elimination möglicher Störfaktoren wie NSAR) zur Verifizierung des Befundes erfolgen. IBD-Patienten haben im Gegensatz zu Patienten mit IBS in der Regel eine persistierende Calprotectin-Erhöhung (meist > 200 μg/g). Ein Algorithmus zur sinnvollen Calprotectin-Bestimmung in der Praxis findet sich in Abb. 1.
Ein möglicher Cut-off zur Therapiesteuerung bei IBD ist 250 μg/g, welcher eine Therapieeskalation rechtfertigt. Allerdings bedeutet dieser auch, dass 18% der Patienten ohne Krankheitsaktivität falsch-positiv und 20% mit Krankheitsaktivität falsch-negativ sind. In der STORI-Studie wurde bei Patienten mit initial doppelter Immunsuppression mit Azathioprin und Infliximab letzteres abgesetzt. Hier zeigte sich, dass ein Calprotectin über 300 μg/g ein Risikofaktor für ein Rezidiv war.
Calprotectin bei gastrointestinalen Malignomen
Auch Neoplasien des Gastrointestinaltraktes sind mit einer mukosalen Entzündungsreaktion vergesellschaftet. In Studien zeigte das Calprotectin bei einem Cut-off von 50 μg/g eine Sensitivität von 82% und einen negativ prädikativen Wert von 98%. Diesen Daten zufolge verringert ein negatives Testresultat die Wahrscheinlichkeit einer Neoplasie im GI-Trakt. Hieraus ergeben sich natürlich mögliche Implikationen für die Indikation zur Endoskopie. Es gilt allerdings immer, die Klinik des Patienten und aktuelle Guidelines miteinzubeziehen (kein Ersatz für die Vorsorgekoloskopie ab dem 50. Lebensjahr!). Auch Karzinome des oberen Gastrointestinaltraktes können Calprotectin-Werte erhöhen.
Copyright bei Aerzteverlag medinfo AG
Gastroenterologie und Hepatologie Kantonsspital Luzern
Spitalstrasse
6000 Luzern
houman.azam@luks.ch
Gastroenterologie und Hepatologie Kantonsspital Luzern
Spitalstrasse
6000 Luzern
Die Autoren haben deklariert, in Zusammenhang mit diesem Artikel keine Interessenkonflikte zu haben.
1. Ruth MA. Fecal Calprotectin. Adv Clin Chem. 2018; 87: 161 – 190
2. Burri E. The use of fecal calprotectin as a biomarker in gastrointestinal disease. Expert Rev Gastroenterol Hepatol. 2014; 8 (2): 197-210
3. Ton H. Improved assay for fecal calprotectin. Clin Chim Acta. 2000; 25: 41-54
Dyspepsie
Als Dyspepsie (vom griechischen dys (schlecht) und pepsis (Verdauung)) bezeichnet man Beschwerden, welche in den Oberbauch lokalisiert werden. Dyspeptische Beschwerden werden meistens in Form von Brennen, Ziehen, Schmerzen, Völlegefühl oder auch Krämpfe angegeben. Der Begriff erlaubt keine exakte ätiologische Zuordnung, wobei im Alltag meist eine vermutete Herkunft von Magen/Duodenum gemeint ist.
Die häufigsten Differentialdiagnosen der Dyspepsie sind in Tabelle 1 zusammengestellt. Die obere Panendoskopie (Oesophago-Gastro-Duodenoskopie) ist die Methode der Wahl, den dyspeptischen Beschwerden weiter auf den Grund zu gehen.

Etwa 20-40% der Bevölkerung klagen regelmässig über dyspeptische Beschwerden, wobei weniger als die Hälfte davon deswegen einen Arzt aufsucht. Trotzdem verursachen dyspeptische Beschwerden eine signifikante Einschränkung der Lebensqualität von Betroffenen und nicht unerhebliche Gesundheitskosten (1), weshalb eine genaue Abklärung durchaus sinnvoll ist.
Als wichtigstes sollten in Anamnese und Labor Alarmsymptome (Gewichtsverlust, Dysphagie, Odynophagie, Anämie, postprandiales Erbrechen, neu aufgetretene Beschwerden im Alter > 50 Jahren) nicht verpasst werden.
Liegen keine Alarmsymptome vor, muss v.a. auch bei jüngeren Personen nicht zwingend endoskopiert werden.
Eine Oberbauchsonographie, um insbesondere eine ursächliche Cholezystolithiasis auszuschliessen, ist sicher v.a. bei postprandialen, kolikartigen Oberbauchbeschwerden indiziert.
Weiter empfiehlt sich vor Einleitung einer allfälligen probatorischen Gabe eines Protonenpumpeninhibitors eine Abklärung auf Helicobacter pylori. Am besten geeignet sind als nicht-invasive Diagnostik ein Stuhl- oder Atemtest (beide haben eine Sensitivität von 85-95% und Spezifität 85-95%). Ist Helicobacter pylori nachgewiesen, sollte dieser auch behandelt werden. Eine Testung auf Helicobacter pylori sollte frühestens 2 Wochen nach Beendigung der PPI-Gabe und frühestens 4 Wochen nach Beendigung einer Antibiotikatherapie erfolgen.
Eine obere Panendoskopie mit Biopsien aus dem Magen würde ich nach erfolglosem erstem Eradikationsversuch durchführen lassen, um abzuklären, ob eine Helicobactergastritis, ein Helicobacter-induzierter Ulkusleiden oder ein Normalbefund (funktionelle Dyspepsie, Helicobacter POSITIV) vorliegt, um die Notwendigkeit zur erneuten Eradikationsbehandlung zu erhärten.
Bei anhaltenden, störenden Beschwerden und negativem Helicobacter-Nachweis kann bei weiterhin fehlenden Alarmzeichen bei jüngeren Personen eine 4-wöchige Therapie mit einem Protonenpumpeninhibitor in Standarddosis 1x/d erfolgen. Bei Säure-bedingten Beschwerden kommt es in diesem Zeitraum meist zu einer guten Linderung der Symptome. Bei Persistenz der Beschwerden sollte aber auch dann zur weiteren Abklärung eine obere Panendoskopie erfolgen.
Bei Vorliegen von Alarmsymptomen oder auch auf Wunsch der Patienten sollte auf jeden Fall eine obere Panendoskopie erfolgen.
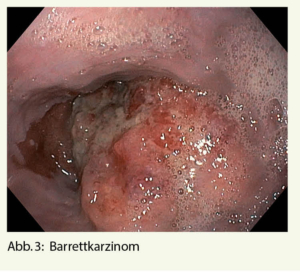
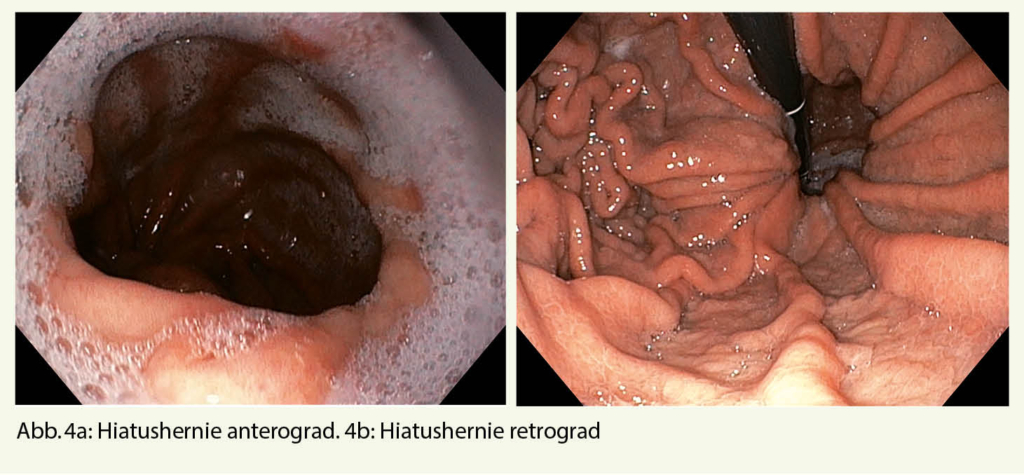
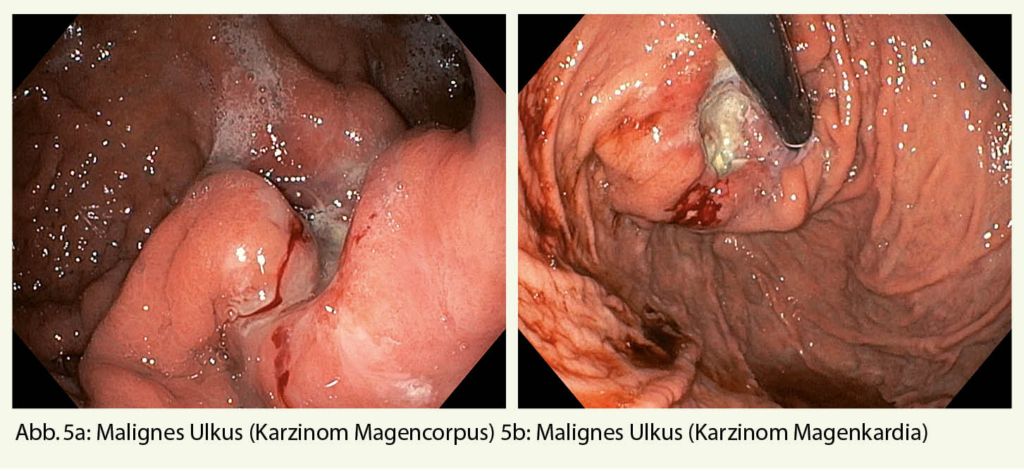
Hierbei könnten ein gastroduodenales Ulkus (Abb. 1), Manifestationen einer gastroösophagealen Refluxerkrankung (Refluxösophagitis (Abb. 2), Barrettkarzinom (Abb. 3) oder eine für Reflux-prädisponierende Hiatushernie (Abb. 4) oder ein Magenkarzinom (Abb. 5) gefunden werden.
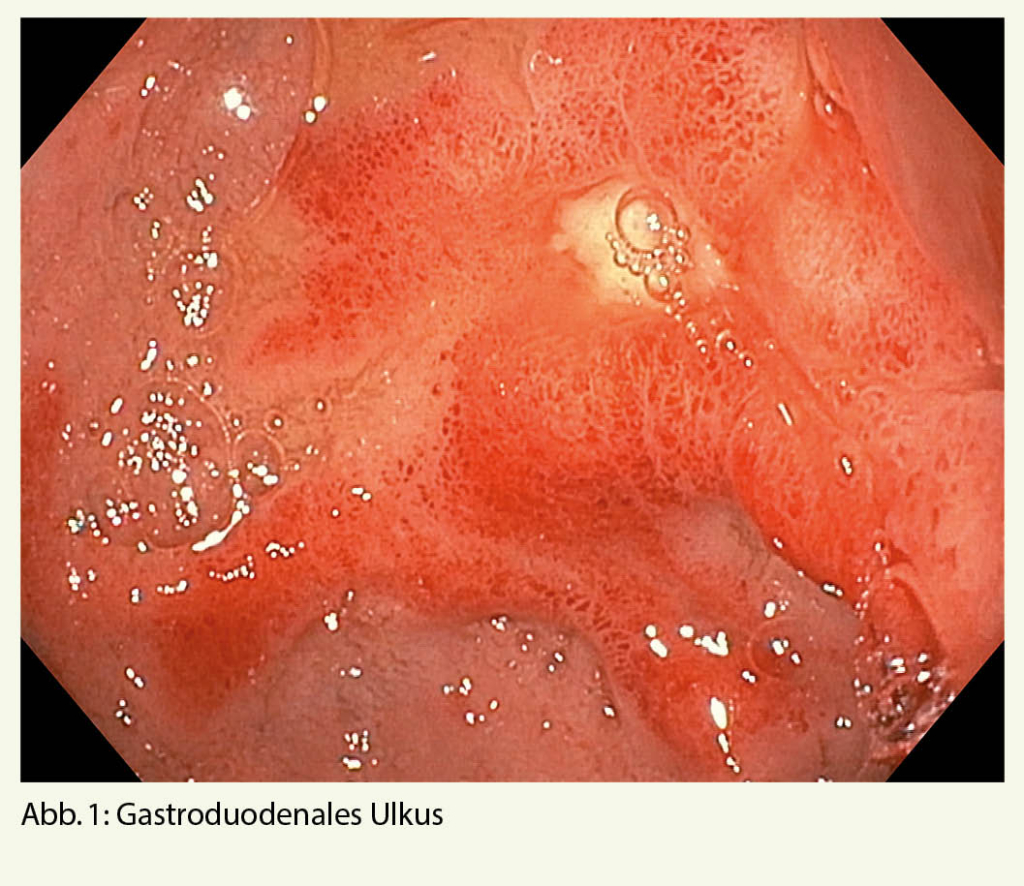
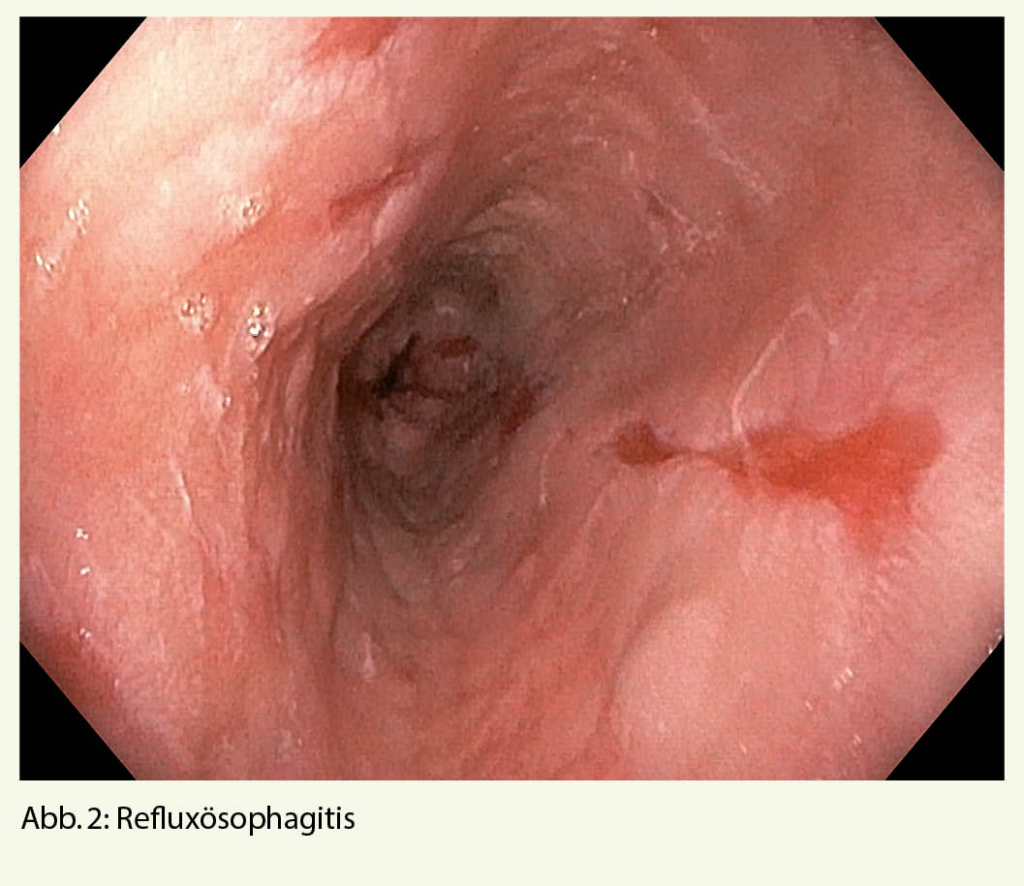
Zusätzlich kann mit einem Normalbefund auch ein allfälliger Verdacht auf eine funktionelle Dyspepsie erhärtet werden.
Nur etwa 25% der Dyspepsien haben eine organische Ursache, 75% sind funktioneller Genese (2).
Funktionelle Dyspepsie ist eine Ausschlussdiagnose und bedingt eine vorgängige obere Panendoskopie mit Normalbefund (3).
Ein weiterer häufiger Grund von dyspeptischen Beschwerden sind medikamentöse Nebenwirkungen. In der Anamnese sollte insbesondere nach nicht-steroidalen Antirheumatika, Steroiden, Eisenpräparaten und Antibiotika gefragt werden. Meist bessern die dyspeptischen Symptome nach Absetzen der Präparate innert einiger Wochen und eine obere Panendoskopie ist nicht zwingend nötig.
FMH Gastroenterologie
Aerztehaus Fluntern
Zürichbergstrasse 70
8044 Zürich
marcel.halama@hin.ch
Der Autor hat in direktem Zusammenhang mit diesem Artikel keine Interessenkonflikte deklariert.
1. Lacy et al; Aliment Pharmacol Ther 2013;Jul (2):170-7
2. Talley et al; Gastroenterology 1998;114:582
3. Drossmann et al; Gastroenterology 2016;150:1257-61