Die Kinder- und Jugendpsychiatrischen Dienste St. Gallen haben zusammen mit der Erwachsenenpsychiatrie des Kantons St. Gallen und Appenzell Ausserrhoden im Jahr 2019 eine Studie mit 100 psychisch kranken Müttern und Vätern durchgeführt. Die Ergebnisse der Studie zeigen, dass die Eltern einer erheblichen Belastung ausgesetzt sind und bei ihnen ein grosser Unterstützungsbedarf besteht. Insbesondere brauchen sie Angebote, die nicht mit zusätzlichem Zeit- und Energieaufwand verbunden sind und die möglichst an ihren Behandlungsorten integriert werden. Die Ergebnisse der Studie sind die Basis für die Entwicklung von passenden Angeboten in der Region.
In unserer Gesellschaft ist Elternschaft trotz des Wandels bezüglich Familienformen (1) und der damit einhergehenden Herausforderungen nach wie vor ein für Identität bedeutsamer Aspekt. Insbesondere Frauen nehmen ihre Mutterschaft als eine Bereicherung für die eigene Persönlichkeitsentwicklung und den eigenen Lebensentwurf wahr. Für psychisch kranke Elternteile kann Elternschaft einen Resilienzfaktor darstellen, der massgeblich zu ihrer Rehabilitation beizutragen vermag (2). Gleichzeitig stellt die Elternschaft für die betroffenen Personen auch eine grosse Herausforderung dar und kann zusammen mit der psychischen Erkrankung zu einer doppelten Belastung werden (3). Psychisch kranke Eltern und ihre Familien brauchen Angebote, die zu ihrem Bedarf und ihren Ressourcen gut passen, da Untersuchungen zeigen, dass die Inanspruchnahme bestehender Angebote durch psychisch kranke Eltern häufig gering ist (4).
Behandlungen und Angebote im Zusammenhang mit Elternschaft und elterlicher psychischer Erkrankung sowie mit deren Auswirkungen auf die Kinder bedürfen unbedingt einer multidimensionalen und generationenübergreifenden Betrachtung, um wirksam und nachhaltig zu sein (5). Dafür sind auch Forschungsansätze nötig, die Menschen in ihren Lebenswelten zu ihrem subjektiven Erleben und ihren Bedürfnissen befragen.
Psychische Gesundheit aus der Generationen-perspektive: Die wichtigsten Daten zum Design der PGG-Studie
Der Hauptzweck der PGG-Studie (PGG für: Psychische Gesundheit aus der Generationenperspektive) (6) bestand, neben dem Erkenntnisgewinn, darin, in der Region eine gute Grundlage für die Implementierung konkreter, möglichst passgenauer Angebote für Familien mit psychisch kranken Elternteilen zu schaffen.
Die untersuchte Gruppe setzte sich aus psychisch kranken Müttern und Vätern zusammen, die zum Zeitpunkt der Erhebungen (Mai bis September 2019) ambulant oder (teil-)stationär in psychiatrischen Institutionen der Kantone St. Gallen und Appenzell Ausserrhoden in Behandlung waren. Für die umfassende Beantwortung der Fragestellungen wurden die Querschnittdaten mittels Fragebögen wie auch halbstrukturierten Interviews erhoben. Es wurden zum einen Basisdaten (Alter, Familiensituation, Beruf, Anzahl Kinder, Betreuungssituation der Kinder) und Informationen zur psychischen Erkrankung (Diagnose, Dauer der Erkrankung, Anzahl Hospitalisationen, aktuelles Befinden) erhoben. Zum Zweiten wurden verschiedene standardisierte Fragebögen verwendet, die die elterliche Belastung messen (7) und die Einschätzung der Stärken und Schwächen aus elterlicher Sicht erheben (8, 9). Zum Dritten füllten die Eltern einen Fragebogen zu ihren Erfahrungen mit verschiedenen Angeboten sowie ihren Erwartungen und ihrem Bedarf bezüglich Unterstützung aus (6).
Für die Interviews wurde ein Interviewleitfaden eingesetzt, der Fragen zur Rolle der Elternschaft in der psychiatrisch-psychotherapeutischen Behandlung der Eltern, zur Lebenssituation und Charakterisierung der Kinder, zum Einfluss der elterlichen Erkrankung auf die Kinder sowie zu Erfahrungen mit bestehenden Angeboten und zum individuellen Hilfebedarf beinhaltete.
Voraussetzung zur Studienteilnahme waren ausreichende Deutschkenntnisse und dass die Kinder noch minderjährig waren. Die Teilnehmenden wurden von ihren Bezugspersonen und vom wissenschaftlichen Team sowohl schriftlich wie mündlich zu verschiedenen Zeitpunkten über den Datenschutz, Anonymität und den Forschungshintergrund aufgeklärt. Die Studie wurde von der Ethikkommission des Kantons St. Gallen unter der Projektnummer 2019-00180 bewilligt. Insgesamt dauerte die Erhebungsphase vier Monate, wobei in den teilnehmenden Institutionen an einzelnen Stichtagen Daten erhoben wurden.
Ergebnisse der Studie
Es wurden 100 Personen1 (68% weiblich) in psychiatrischer Behandlung befragt, die Eltern von 189 Kindern im Alter zwischen einem Monat und 18 Jahren waren (Durchschnittsalter: 9.7 Jahre). Die an der Studie Teilnehmenden hatten im Schnitt zwei Kinder. Eine Mehrheit (62%) war zum Zeitpunkt der Befragung in einer festen Partnerschaft, mehr als die Hälfte war berufstätig und über ein Drittel (davon 89% weiblich) primär mit Familienarbeit beschäftigt. Knapp die Hälfte (45%) der Stichprobe wies als höchsten Ausbildungsabschluss eine Berufslehre auf. Als Erstsprache wurde in 70% der Fälle Schweizerdeutsch oder Hochdeutsch angegeben. 40% der Elternteile nahmen nach dem Ausfüllen der Fragebogen an einem Einzelinterview teil. Diese Gruppe unterschied sich nicht signifikant von der Gesamtgruppe.
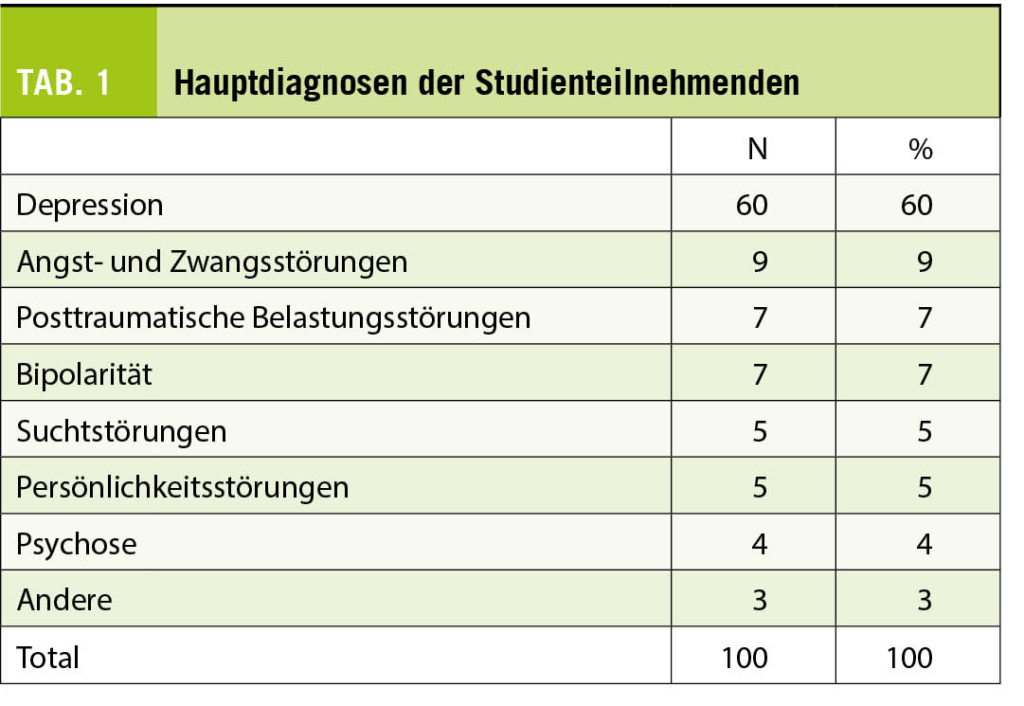
Diagnosen und Behandlungssetting
Die 100 Studienteilnehmerinnen und -teilnehmer litten mehrheitlich (60%) unter einer depressiven Erkrankung. Zusammen mit Angst- und Zwangsstörungen sowie Posttraumatischen Belastungsstörungen machten diese Erkrankungen drei Viertel der Hauptdiagnosen der Stichprobe aus. Die Studienteilnehmerinnen und -teilnehmer litten im Durchschnitt seit 5.8 Jahren an der psychischen Erkrankung und waren im Schnitt 1.51-mal psychiatrisch hospitalisiert gewesen (Tab. 1). Rund drei Viertel (73%) der an der Studie Teilnehmenden waren zum Zeitpunkt der Studie entweder in ambulanter (54%) oder in tagesklinischer (19%) Behandlung, die übrigen waren in stationärer Behandlung.
Zusätzliche Belastungen und Einschätzung der Befindlichkeit der Kinder
Die befragten Eltern gaben neben ihrer psychischen Erkrankung durchschnittlich noch zwei weitere Belastungen an: Häufig wurden finanzielle Probleme, Konflikte mit dem anderen Elternteil und zusätzliche körperliche Erkrankungen genannt. Die Daten aus dem elterlichen Belastungsinventar zeigen, dass Items, welche die elterliche Kompetenz betreffen («Es fällt mir manchmal schwer herauszufinden, was mein Kind braucht», oder: «Ich bin mir manchmal nicht sicher, ob ich den Anforderungen als Mutter/Vater gewachsen bin»), besonders häufig als «sehr zutreffend» angekreuzt wurden. Aufgrund der Daten aus den Fragebogen, die Stärken und Schwächen der Kinder abfragten, müssen über zwei Drittel der Kinder in ihrem Verhalten als «grenzwertig» oder «auffällig» betrachtet werden.
Wichtige Ergebnisse aus den Einzelinterviews
In den 40 durchgeführten Einzelinterviews berichteten die Eltern häufig über verschiedene Sorgen im Zusammenhang mit ihren Kindern, beispielsweise von der Befürchtung, diese könnten selbst psychisch erkranken. Genannt wurden auch Insuffizienzgefühle in der Elternrolle sowie konkrete Einschränkungen in der Alltagsbetreuung der Kinder sowie die Sorge um eine adäquate Kinderbetreuung während möglicher Klinikaufenthalte. Einige Elternteile sprachen von einem belastenden Verantwortungsgefühl gegenüber ihren Kindern, welches teilweise ihren eigenen Heilungsprozess beeinträchtige, weil sie gedanklich zu sehr auf die Kinder fokussiert seien. Die beschriebenen Belastungen und Sorgen wurden vorwiegend von den Müttern genannt, da sie mehrheitlich für die Betreuung der Kinder zuständig waren. Die Väter machten sich hingegen gehäuft Gedanken zu genetischen Komponenten einer möglichen psychischen Erkrankung ihrer Kinder oder waren mit Besuchsregelungen beschäftigt, die sie als ungerecht und belastend beschrieben.
Die meisten Eltern haben aber auch betont, wie wichtig ihnen die Beziehung zu ihren Kindern sei und wie viel Kraft (v.a. Mütter) sie daraus schöpfen würden. Viele haben einige positive Eigenschaften ihrer Kinder genannt und stimmige Episoden mit ihnen geschildert. Der grossen Mehrheit der interviewten Eltern war bewusst, dass ihre Kinder wegen ihrer psychischen Erkrankung immer wieder mit schwierigen Situationen würden umgehen müssen und dass sie sich als Eltern mehr Unterstützung wünschten, um den Bedürfnissen der Kinder besser gerecht werden zu können.
Unterstützungsbedarf
Die befragten Eltern gaben sowohl im Fragebogen als auch in den Einzelinterviews einen deutlichen Unterstützungsbedarf an: Sie möchten in den psychiatrisch-psychotherapeutischen Behandlungen als Eltern gesehen und angesprochen werden. Des Weiteren möchten sich bei der Entwicklung und Gestaltung passender familiärer Lösungen und Hilfestellungen von ihren Betreuerinnen begleitet werden, um nicht verschiedene Fachstellen aufsuchen und mit unterschiedlichen Fachpersonen interagieren zu müssen. Niederschwellige, aufsuchende Angebote würden die Bedürfnisse vieler psychisch kranker Mütter und Väter – laut eigener Einschätzung – am besten decken. An der Entwicklung ihrer elterlichen Kompetenzen würden sie gerne in der gleichen Institution, in der sie psychiatrisch und/oder psychotherapeutisch behandelt werden, arbeiten. Dafür wären Elterngruppen oder «Kinderspezialistinnen» vor Ort aus ihrer Sicht hilfreich.
Geplante Angebote aufgrund der PGG-Studie im Kanton St. Gallen
Die durchgeführte Studie sollte auf empirischer Grundlage Daten generieren, die für die Implementierung von Angeboten für psychisch kranke Eltern und ihre Kinder nutzbar sind. Aufgrund der Informationen aus dem Fragebogen zum familiären Unterstützungsbedarf sowie insbesondere auch auf der Basis der differenzierten Angaben aus den Einzelinterviews mit psychisch kranken Müttern und Vätern konnten erste mögliche Angebote konzeptualisiert werden. Leitend bei der Entwicklung und Entscheidung waren der Wunsch nach Niederschwelligkeit sowie nach Integrierung im Rahmen der von den Eltern genutzten psychiatrisch-psychotherapeutischen Behandlungsangebote. Die Studie hat gezeigt, dass psychisch kranke Mütter und Väter, die stationär betreut werden, einen anderen Bedarf aufweisen als diejenigen, die ambulant oder in einem tagesklinischen Setting behandelt werden. Für die erste Gruppe bietet sich eine Weiterentwicklung an, die die Elternschaft in den Mittelpunkt stellt, in Form der bereits seit 2018 in der Klinik St. Pirminsberg durchgeführten «Recovery Wege»-Kurse. In diesen Kursen sollen Eltern, die stationär oder teilstationär behandelt werden, sich austauschen können und Informationen erhalten, die sie in ihrem Elternsein stärken. Der Kurs wird von einer Fachperson zusammen mit einer Peer-Mitarbeiterin durchgeführt, die über geeignete berufliche Kompetenzen verfügt. Der Kurs findet innerhalb von 3 Monaten in Form von 6 Modulen à 2 Tage statt. Des Weiteren möchten die Kinder- und Jugendpsychiatrischen Dienste St. Gallen und die Psychiatrie St. Gallen Nord gemeinsam am Standort Wil 2021 im Rahmen eines Pilotprojekts in den Räumen der Erwachsenenpsychiatrie zwei Angebote für psychisch kranke Eltern, die in ambulanter oder teilstationärer Behandlung sind, umsetzen. Zum einen soll 14-täglich an einem Nachmittag eine kinderzentrierte Beratung vor Ort angeboten werden, die durch die Eltern nach vorgängiger Anmeldung oder auch ad hoc wahrgenommen werden kann. Zum anderen sollen Elterngruppen für psychisch kranke Eltern stattfinden, in welchen während 6 Monaten in 10 Sitzungen unter der Leitung zweier Fachpersonen (Tandem Kinder- und Jugendpsychiatrie und Erwachsenenpsychiatrie) am Thema der Elternschaft, der elterlichen Reflexionsfähigkeit und der elterlichen Kompetenzen gearbeitet werden soll. Die drei Angebote werden wissenschaftlich begleitet und evaluiert. In Abhängigkeit von den Ergebnissen ist eine Überführung in das Regelangebot sowie eine regionale Ausweitung angedacht.
Copyright bei Aerzteverlag medinfo AG
Forschungsleitung
Kinder- und Jugendpsychiatrische Dienste St. Gallen
Brühlgasse 35 / 37
9004 St. Gallen
mariateresa.diez@kjpd-sg.ch
Die Autorin hat keinen Interessenkonflikt im Zusammenhang mit diesem Beitrag deklariert.
1. Fustenberg FF, Harris LE, Pesando LM, Reed MN. Kinship Practices Among Alternative Family Forms in Western Industrialized Societies. Journal of Marriage and Family 2020; 82(5): 1403–1430
2. Bonfils KA, Adams EL, Firmin RL, White LM. Parenthood and Severe Mental Illness: Relationships With Recovery. Psychiatric Rehabilitation Journal. 2014; 37(3): 186–193
3. Grube M, Dorn A. Elternschaft bei psychisch Kranken. Psychiatrische Praxis 2007; 34: 66–71
4. Kühnis R, Müller-Luzi S, Schröder M, Schmid M. Zwischen Stuhl und Bank – Hindernisse bei der Inanspruchnahme von Hilfsangeboten für Familien mit einem psychisch kranken Elternteil. Praxis der Kinderpsychologie und Kinderpsychiatrie. 2016; 65(4): 249–265
5. Lenz A, Wiegand-Grefe S. Kinder psychisch kranker Eltern. (Leitfaden Kinder- und Jugendpsychotherapie) 2017; Göttingen: Hogrefe
6. Diez Grieser, MT, Flükiger D, Schenkel S, Schmid TB, Simonetta F, Tylla S. Psychische Gesundheit aus der Generationenperspektive (PGG). Bericht zu den Ergebnissen der explorativen Studie zu Belastungserleben und Unterstützungsbedarf psychisch belasteter Eltern. Unveröffentlichter Bericht. 2020; (https://www.kjpd-sg.ch/2020/06/24/studie-psychische-gesundheit-aus-der-generationenperspektive-pgg/; Zugriff: 7.12.2020)
7. Abidin R.R. Parenting Stress Index. Professional Manual (3. Aufl.) 1995; Odessa, Fla.: Psychological Assessment Resources. Dt. Version: Tröster H. Eltern-Belastungs-Inventar. EBI. Deutsche Version des Parenting Stress Index (PSI) von R. R. Abidin. 2011; Göttingen u. a.: Hogrefe
8. Briggs-Gowan MJ, Carter AS. BITSEA. Brief Infant Toddler Social and Emotional Assessment 2006; San Antonio, Texas: Pearson. (Deutsche Übersetzung: Hänggi, Y., Bindernagel, D. & Mögel, M. (2011), unveröffentlicht.)
9. Woerner W, Becker A, Friedrich C, Klasen H, Goodman R, Rothenberger, A. Normierung und Evaluation der deutschen Elternversion des Strengths and Difficulties Questionnaire (SDQ): Ergebnisse einer repräsentativen Felderhebung (Normative Data and Evaluation of the German Parent-rated Strengths and Difficulties Questionnaire (SDQ): Results of a Representative Field Study). Zeitschrift für Kinder- und Jugendpsychiatrie und Psychotherapie. 2002; 30, 105–112