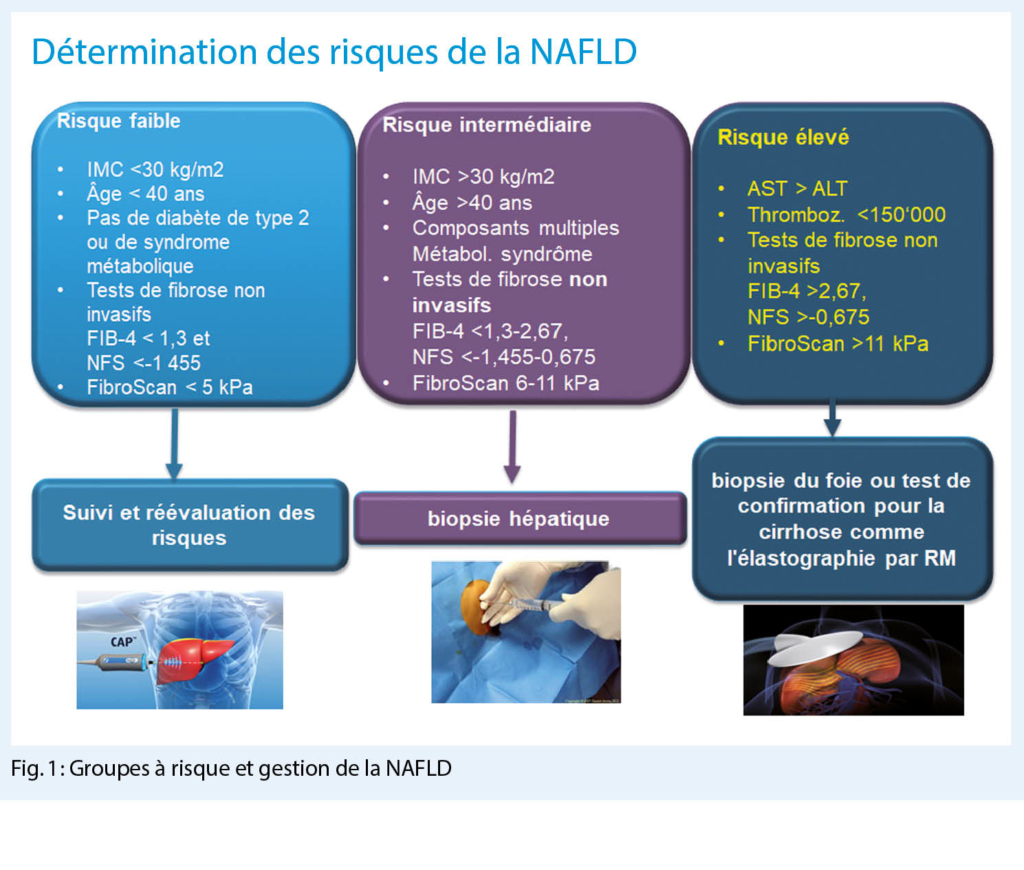
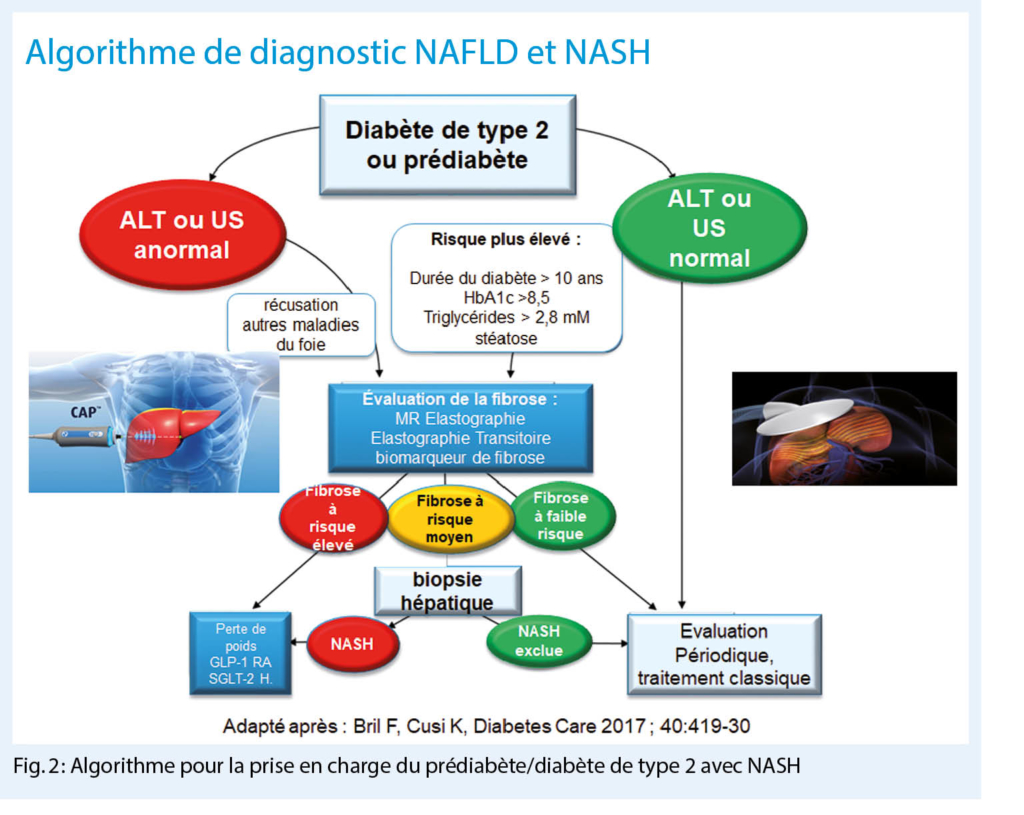
Im Gespräch mit PD Dr. med. Richard Cathomas, Chur
Welches waren Ihre Highlights am ESMO 2019 ?

Der diesjährige ESMO Kongress war sehr gut organisiert und meiner Meinung nach von sehr hoher Qualität, sowohl was die Qualität der präsentierten Studien wie auch die Qualität der Educational sessions betrifft. ESMO hat es mit einer klugen und flexiblen Politik
geschafft, dass viele der wichtigsten klinischen Studien neuerdings zuerst in Europa präsentiert werden. Eine erfreuliche Entwicklung. Sämtliche drei presidential sessions waren hervorragend und können qualitativ gut mit der plenary session am ASCO Kongress mithalten.
Welche Resultate/Erkenntnisse haben Sie überrascht? Positiv oder negativ?
Beim metastasierten Blasenkarzinom wurde die erste randomisierte Phase III Studie mit Immuntherapie (Chemo mit Platin/Gem vs Chemo + Atezolizumab vs Atezolizumab mono) für die Erstlinientherapie vorgestellt (IMvigor 130, LBA14_PR). Dabei zeigte sich eine signifikante Verbesserung des PFS (primärer Endpunkt) aber noch kein OS Benefit. Hier muss noch etwas abgewartet werden, bevor sich die Praxis ändern kann. Spannend waren erste Resultate einer kleinen Phase II Studie (N=45) beim vorbehandelten Blasenkarzinom, welche das antidbody drug conjugate Enfortumab vedotin in Kombination mit Pembrolizumab prüfte und hohe Ansprechrate von 71% nachwies (901O).
Welche Erkenntnisse haben für Ihre tägliche Praxis eine grosse Bedeutung?
Im Bereich des Prostatakarzinoms gab es mehrere Studien mit Relevanz für die Praxis. Die wichtigste Erkenntnis brachte die RADICALS Studie aus England. Diese zeigte auf, dass die «salvage» Radiotherapie der adjuvanten Radiotherapie beim lokalisierten Prostatakarzinom ebenbürtig ist (LBA49_PR). Zwei Studien untersuchten beim metastasierten kastrationsresistenten Prostatakarzinom (mCRPC) die optimale Sequenz. Beide wiesen nach, dass man nach einer Therapie mit einem neuartigen Antihormon (Abiraterone oder Enzalutamid) nicht auf das jeweils andere Medikament, sondern auf eine Chemotherapie (CARD Studie, BLA13) oder auf eine Therapie mit PARP-Inhibitor , falls ein DNA repair defect vorliegt, wechseln soll (PROFOUND Studie, LBA12_PR). Entsprechend empfiehlt sich bereits während der Erstlinientherapie die Testung der mCRPC Patienten auf das Vorliegen von DNA Reparaturdefekten.
Welches sind Bereiche mit noch grösstem Forschungsbedarf?
Weiterhin fehlen bei den urogenitalen Tumoren die prädiktiven Biomarker weitgehend. Mit dem PAPR Inhibitor Olaparib wurde beim Prostatakariznom nun erstmals ein gewisser Erfolg bei einer selektionierten Patientengruppe erzielt (LBA12_PR) , aber dies ist hoffentlich nur der Anfang. Beim Blasenkarzinom und vor allem dem Nierenzellkarzinom sind wir noch deutlich von einer prädiktiven Patientenselektion entfernt. Auch müssen die Kombinationen der neuartigen Therapie weiter vorangetrieben werden, neben interessanten Resultaten zeigten sich hier leider auch Fehlschläge (z.B. BISCAY Studie beim Blasenkarzinom, Präsentation 902O).
Wie sehen Sie die Schweiz als Forschungsplatz am ESMO repräsentiert?
Am diesjährigen ESMO konnten wiederum verschiedene Projekte aus der Schweiz prominent platziert werden. So präsentierte Yannis Metaxas aus Chur die Resultate der SAKK 17/16 Studie in der Proffered Paper Session für Lungentumore. Diese Phase II Studie prüfte das neuartige Chemotherapeutikum Lurbinectedin bei vorbehandelten Patienten mit Pleuramesotheliom und zeigte erfreulich positive Resultate. Daneben waren einige Schweizer Experten als Discussants oder Chairs tätig und zeigten meines Erachtens, dass die klinische Onkologieforschung in der Schweiz lebt und gelebt wird.
Eleonore E. Droux
Im Gespräch mit Prof. Dr. med. Reinhard Dummer, UniversitätsSpital Zürich
 Welches waren Ihre Highlights am ESMO 2019 ?
Welches waren Ihre Highlights am ESMO 2019 ?
Am diesjährigen ESMO sind im Bereich Melanom wieder einige sehr wichtige Studienergebnisse vorgestellt worden. Aus meiner Sicht waren die Highlights vier Late-breaker-Präsentationen zur Behandlung des metastasierenden Melanoms. Die erste berichtete über eine prospektiv randomisierte Studie, die den neoadjuvanten Einsatz des replizierenden genetisch modifizierten Herpesvirus Talimogen laherparepvec (T-VEC) untersuchte, kombiniert mit Chirurgie im Vergleich zu Chirurgie alleine. Der Kontrollarm mit Chirurgie alleine stellt den heutigen Standardtherapieansatz dar. Eine zusätzliche adjuvante Therapie war erlaubt. Die zweite sehr positive Studie war die IMMUNED-Studie, die den adjuvanten Einsatz von Nivolumab der Kombination Ipilimumab und Nivolumab versus Placebo in einer kleinen, prospektiv randomisierten Doppelblindstudie der Arbeitsgemeinschaft der dermatologischen Onkologie (ADO) untersuchte.
Dann kam es zu einem Update der Ergebnisse der CheckMate 067-Studie, die die 5- Jahres-Überlebensdaten dieser grossen prospektiv randomisierten Studie zeigte, bei der Ipilimumab allein versus Nivolumab alleine gegenüber der Kombination aus den beiden Medikamenten miteinander vergleicht.
Und letztlich sahen wir die Ergebnisse einer prospektiv randomisierten Studie, bei der Pembrolizumab als Kontrollgruppe diente und die Kombination des Anti-PD-L1 Antikörpers Atezolizumab mit dem MEK-Inhibitor Cobimetinib untersuchte. Diese Studie wird IMspire170 genannt.
Welche Resultate/Erkenntnisse haben Sie überrascht? Positiv oder negativ?
Erwartet hatte ich die Resultate der CheckMate 067-Studie.
Die Studie bestätigte im Wesentlichen die Ergebnisse der letztjährigen Auswertung. Das Gesamtüberleben der Patienten, die nur Ipilimumab erhalten, lag nach 5 Jahren bei 26% versus 44% für Nivolumab-Monotherapie versus 52% für die Kombination Ipilimumab und Nivolumab. Die Hazard Ratio für den Vergleich Monotherapie Nivolumab zu Kombinationsbehandlung Ipilimumab und Nivolumab lag bei 0.83. Diese Ergebnisse beweisen, dass die Kombination der Monotherapie überlegen ist, wobei der Unterschied jedoch nicht gewaltig ist. Es muss im Einzelfall besprochen werden, ob diese Verbesserung im Gesamtüberleben die erhöhte Toxizität der Kombinationsbehandlung rechtfertigt. Als besonders positiv hervorzuheben ist, dass 74% der Patienten im Kombinationsarm nach Beendigung der Studie keine weiteren therapeutischen Massnahmen benötigten.
Besonders positiv überraschten mich die Ergebnisse der sogenannten IMMUNED-Studie. Im Rahmen dieser relativ kleinen Studie wurden nur ca. 160 Patienten eingeschlossen und auf drei Arme mit jeweils gut 50 Patienten randomisiert. Prinzipiell hätte ich aufgrund dieser kleinen Fallzahl keine klaren Ergebnisse erwartet.
Überraschenderweise zeigten sich sehr deutliche Unterschiede: Im Vergleich zum Placeboarm verbesserte die Behandlung mit Nivolumab-Monotherapie die Prognose mit einer Hazard Ratio von 0.56 und die Behandlung mit Ipi Nivo sogar mit einer Hazard Ratio von 0.23. Das sind äusserst eindrückliche Unterschiede, die meines Erachtens bereits heute Einfluss auf unsere zukünftigen Behandlungsstrategien in der adjuvanten Situation bei vollständig resezierten Fernmetastasen haben.
Sehr interessant war auch neoadjuvante Therapie mit T-VEC. Nur 6 Injektionen mit diesem Medikament führten bei einer Nachbeobachtungszeit von 2 Jahren zu einem signifikant verbesserten Gesamtüberleben mit einer Hazard Ratio unter 0.5. Das hatte ich auch in keiner Art und Weise erwartet.
Etwas enttäuschend waren die Ergebnisse der IMspire170-Studie. Hier sprach meines Erachtens alles für ein positives Resultat. Dies wurde jedoch nicht erreicht. Es stellt sich nun die Frage wieso. Meines Erachtens hat die Patientenselektion (Ausschluss von BRAF-mutierten Patienten) dazu geführt, dass vermehrt ältere Patienten mit normaler LDH eingeschlossen werden, die besonders gut auf die Monotherapie mit Pembrolizumab ansprachen.
Welche Erkenntnisse haben für Ihre tägliche Praxis eine grosse Bedeutung?
Am wichtigsten sind für mich die Ergebnisse der IMMUNED-Studie. Wir werden die Kombinationsbehandlung Ipi Nivo in der adjuvanten Situation bei Patienten mit Stadium IV auf jeden Fall diskutieren.
Welches sind Bereiche mit noch grösstem Forschungsbedarf?
Der wichtigste Forschungsbedarf steht in der Identifizierung von prognostischen Parametern. Wir müssen unbedingt wissen, welche Patienten im Stadium IV von der Kombinationsbehandlung profitieren. Heute setzen wir nur klinische Parameter ein wie erhöhte LDH bei eher jungen Patienten sowie BRAF-Mutationsstatus. Hierzu ist es notwendig, wichtige Biomarker zu etablieren (siehe unten).
Gibt es Fortschritte bei der Identifizierung von Biomarkern, die als Prädiktoren für das Ansprechen der Immuntherapie eine ausreichende Zuverlässigkeit garantieren?
Leider gibt es noch keine Biomarker, die das Ansprechen auf Immuntherapie zuverlässig vorhersagen. Wir verstehen jedoch schon wesentlich mehr. So ist die Kombination aus erhöhter Mutationslast und einer Interferon-gamma Transkriptionssignatur ein wichtiger Faktor, der für ein schnelles und langfristiges Ansprechen spricht. In diese Signatur passt auch die Expression von PD-L1 im Tumorgewebe.
Wie sehen Sie die Schweiz als Forschungsplatz am ESMO repräsentiert?
Die Schweiz ist als führender Forschungsplatz in Europa etabliert. Leider sind nicht alle Krebsentitäten gut bearbeitet, das Melanom jedoch schon. Im Bereich der Hautkrebsforschung ist der Beitrag der Schweiz zu den positiven Entwicklungen deutlich sichtbar. Andere Länder holen jedoch auf, unter anderem Italien und Spanien. Diese Länder zentralisieren ihre klinischen und translationalen Forschungsaktivitäten auf wenige Zentren.
In der Schweiz ist jedoch eine gegenteilige Entwicklung zu bemerken. Immer mehr Patienten mit Hautkrebs werden auch in der Peripherie in kleinen Zentren behandelt und stehen damit nicht für zentral angebotene grosse klinische Forschungsprojekte einschliesslich der translationalen Forschung zur Verfügung.
Falls diese Entwicklung nicht umgekehrt wird, wird die Schweiz ihre international anerkannten und qualitativ hochstehenden Aktivitäten in diesem Bereich nicht fortsetzen können.
Im Gespräch mit PD Dr. med. Christian Rothermundt, Kantonsspital St. Gallen
 Welches waren Ihre Highlights am ESMO 2019 ?
Welches waren Ihre Highlights am ESMO 2019 ?
Mein Fokus beim ESMO in Barcelona lag auf urogenitalen Tumoren und Sarkomen. Spannend waren die Daten der IMvigor130-Studie, welche erstmalig eine IO-Chemotherapie-Kombination bei Patienten mit metastasiertem Urothelkarzinom prüfte. Der primäre Endpunkt PFS wurde erreicht (mPFS = 8.2 Monate gegenüber 6.3 Monate im Kontrollarm; HR = 0.82, (95% CI: 0,70-0,96; p =v0,007)), zudem zeigt sich in der Interim-Analyse ein – aktuell statistisch noch nicht signifikanter – Überlebensvorteil. Auch die komplette Remissionsrate von 13% ist ein Argument für den Einsatz der IO-Chemotherapie-Kombination.
Die Kombination aus dem Antibody Drug Conjugate Enfortumab Vedontin und dem Immuncheckpoint-Inhibitor Pembrolizumab zeigt sehr überzeugende Ansprechraten beim Platin-ineligiblen Blasenkarzinom – das lässt auf mehr positive Daten zu diesem Thema hoffen.
Persönliches Highlight war, dass ich in Vertretung von Frau Dr. Antonia Digklia und den Co-Investigatoren ein Poster zum Phase-I-Teil der SAKK 57/16 NAPAGE-Studie präsentieren konnte. Die Daten weisen auf eine gute Verträglichkeit von nab-Paclitaxel 150 mg/m2 und Gemcitabine 1000 mg/m2 alle 2 Wochen bei Patienten mit metastasiertem Weichteilsarkom hin. Besonders froh bin ich, dass wir als SAKK Sarcoma Working Group solch eine Studie bei einer seltenen Tumorentität durchführen können. Die Zusammenarbeit ist ausgezeichnet und aufgrund der hohen Motivation werden die Patienten rasch rekrutiert.
Welche Resultate/Erkenntnisse haben Sie überrascht? Positiv oder negativ?
Positiv überrascht und überzeugt haben mich die genetische und epigenetische Charakterisierung cholangiozellulärer Karzinome und die daraus resultierenden zielgerichteten Therapien, z. B. der Einsatz von Ivosidenib (IDH1-Inhibitor) beim IDH1 mutierten Cholangiokarzinom. Dr. Ian Chau vom Royal Marsden Hospital hat die Daten auch mit grosser Begeisterung kommentiert.
Welche Erkenntnisse haben für Ihre tägliche Praxis eine grosse Bedeutung?
Praxisrelevant sind die Ergebnisse der CARD-Studie: Cabazitaxel vs. Abirateron Acetat oder Enzalutamid – nach vorgängiger Therapie mit Docetaxel und dem jeweils anderen Androgenrezeptor-Signalweg-Inhibitor beim kastrationsresistenten Prostatakarzinom. Nun ist dank dieser Studie geklärt, dass nach stattgehabter Chemotherapie mit Docetaxel und nur kurzem Ansprechen (< 12 Monate) auf Abirateron Acetat oder Enzalutamid der Einsatz von Cabazitaxel mit einem besseren PFS und OS verbunden ist. Dies spricht gegen einen Wechsel von einem Androgenrezeptor-Signalweg-Inhibitor zum nächsten.
Wie sehen Sie die Schweiz als Forschungsplatz am ESMO repräsentiert?
Erfreulich ist insbesondere, dass junge Forscher aus der Schweiz Daten aus SAKK- Studien vorstellen konnten: Frau Dr. Antonia Digklia, Dr. Yannis Metaxas und Dr. Michael Mark. Ansonsten sind natürlich prominente Vertreter aus der Schweiz als Chairs, Presenter und Discussants am ESMO in Erscheinung getreten: Die Professorinnen Solange Peters und Silke Gillessen sowie Prof. Miklos Pless – um nur einige zu nennen.
Eleonore E. Droux
Im Gespräch mit Dr. med. Yannis Metaxas, Kantonsspital Graubünden, Chur
 Welches waren Ihre Highlights am ESMO 2019 ?
Welches waren Ihre Highlights am ESMO 2019 ?
Wie fast an allen grossen Kongressen in den letzten Jahren beschäftigte sich ein sehr grosser Teil der Studien mit der Rolle der Immuntherapie in unterschiedlichen Entitäten. ESMO 2019 war keine Ausnahme und ich würde auf drei Studien hinweisen.
Die CheckMate 067-Phase-III-Studie bei metastasierten Melanomen hat nun das 5-Jahre-Follow-Up gezeigt. Hier wurden Patienten mit metastasiertem Melanom 1:1:1 randomisiert, um eine Therapie entweder mit Nivolumab+Ipilimumab, Nivolumab allein oder Ipilimumab allein zu bekommen. Nach dem 5 Jahres-Follow-up ist das mediane OS noch nicht erreicht im Kombinationsarm (>60 Monate) vs 36.9 Monate mit Nivolumab und 19.9 Monate mit Ipilimumab. In Anbetracht der sehr infausten Prognose des metastasierten Melanoms bis vor wenigen Jahren, ist es erstaunlich, dass mehr als die Hälfte der Patienten nach 5 Jahren noch am Leben sind.
Im Weiteren wurden in der CheckMate 227-Studie Patienten mit metastasiertem Lungenkarzinom in der Erstlinien-Therapie 1:1:1 randomisiert, um entweder Nivolumab + Ipilimumab oder Nivolumab allein oder Chemotherapie mit Platinum-Pemetrexed allein zu erhalten; dies, wenn sie eine PD-L1 Expression von > = 1% hatten. Sonst erhielten die Patienten entweder Nivolumab+Ipilimumab oder Nivolumab + Chemotherapie oder Chemotherapie allein. Der Arm mit Nivolumab + Ipilimumab hat gegenüber dem Chemotherapie-mono-Arm eine signifikante Verlängerung des OS unabhängig von PD-L1 Status gezeigt. Bei Patienten mit einer PD-L1 Expression von < 1% war dieser Unterschied sehr eindeutig mit einem HR von 0.62 (median OS 17.2 vs 12.2 zugunsten Nivolumab+Ipilimumab).
Schliesslich ist zu erwähnen, dass nicht überall die Immuntherapie besser als die Chemotherapie ist: In der Phase-III-PROMISE-meso Studie wurden Patienten mit progredientem Mesotheliom 1:1 entweder zu einer Therapie mit Pembrolizumab oder zu einer Mono-Chemotherapie mit Gemcitabine oder Navelbine randomisiert. Der primäre Endpunkt dieser Studie war das PFS, welches bei den beiden Gruppen identisch ist. Auch das OS war nicht unterschiedlich, wobei ca. 63% im Chemotherapie-Arm nach initialer Progression Immuntherapie bekamen.
Welche Resultate/Erkenntnisse haben Sie überrascht? Positiv oder negativ?
Wie gesagt, wir haben wiederum sehr spannende Daten über die Rolle der Immuntherapie gehört. Dass andererseits dass die Immuntherapie z.B. bei Mesotheliomen nicht so wirksam gegenüber «klassischer» Chemotherapie erscheint, war sicher eine negative Überraschung.
Welche Erkenntnisse haben für Ihre tägliche Praxis eine grosse Bedeutung?
Es ist faszinierend zu wissen, dass mit einer Immuntherapie > 50% der Melanom-Patienten ein so langes Überleben haben können, was sicher diese Behandlung zu einer Standardbehandlung bei Melanomen macht. Gleichzeitig muss man im Hinterkopf behalten, dass jede Tumorentität anders ist und es keine «goldene Regel» gibt; was in einer Entität sehr versprechend sein kann, kann bei einem anderen Tumor unwirksam sein.
Welches sind Bereiche mit noch grösstem Forschungsbedarf?
Ich komme nochmals auf das Beispiel der Melanom-Patienten zurück. Obwohl 50% der Patienten ein sehr langes Überleben haben können, stirbt die andere Hälfte deutlich schneller. Man soll nun auf diese Gruppe fokussieren und versuchen, die dahinterliegenden Gründe zu eruieren.
Gibt es Fortschritte bei der Identifizierung von Biomarkern, die als Prädiktoren für das Ansprechen der Immuntherapie eine ausreichende Zuverlässigkeit garantieren?
In letzter Zeit ist sowohl die Rolle der PD-L1 Expression als auch die Bedeutung der Tumor Mutation Load gross untersucht worden. In vielen klinischen Studien sind Patienten entsprechend stratifiziert, so wie das z.B. auch in der CheckMate 227 gemacht wurde. Allerdings erbrachte diese Klassifizierung, ähnlich wie bei vielen anderen Beispielen, keine eindeutige Aussage für die prognostische/ prädiktive Rolle dieser Biomarker, wie die Autoren in der entsprechenden Subgruppen-Analyse gezeigt hatten. Hier gibt es sicher ein sehr offenes Feld für die Forschung.
Wie sehen Sie die Schweiz als Forschungsplatz am ESMO repräsentiert?
Wir hatten das Privileg, drei unserer Studien an diesem ESMO zu präsentieren. Die Studien SAKK 57/16 sowie die SAKK 95/16 wurden als Poster gezeigt, die SAKK 17/16 sogar als Oral Presentation. Die 57/16 Phase-I/II-Studie untersuchte eine Chemotherapie mit Gemcitabine und Nab-Paclitaxel in metastasierten Sarkomen und am ESMO wurden die Resultate des Phase-I-Teils gezeigt; nun läuft der Phase-II-Teil, dessen Resultate mit grossem Interesse erwartet werden.
Die SAKK 95/16-Studie analysierte das alltägliche Behandlungsmuster (pattern of care) für Patienten mit ossären Metastasen in der Schweiz, welches den Therapieschemata in den entsprechenden prospektiven Studien nicht immer entspricht. Das macht solche Analysen sehr signifikant für den klinischen Alltag!
Die prospektive Phase-II-SAKK-Studie 17/16 schliesslich untersuchte die Rolle eines neuen Moleküls, Lurbinectedin, in progredienten malignen Pleuramesotheliomen. Die Studie erreichte ihren primäreren Endpunkt, nämlich progressionsfreies Überleben nach 12 Wochen, und zeigte viel versprechende PFS- und OS-Daten gegenüber historischen Daten. Dieses Molekül soll nun in einer grösseren, randomisierten Studie analysiert werden, um zu evaluieren, ob dies ein neuer Standard-of-Care für diese Entität sein könnte.
Im Gespräch mit PD Dr. Alexandra Curioni, Universitätsspital Zürich
 Welches waren Ihre Highlights am ESMO 2019 ?
Welches waren Ihre Highlights am ESMO 2019 ?
– Die Resultate der FLAURA-Studie mit einer Verbesserung des gesamten Überlebens in Patienten, die Osimertinib bekamen
– Die OS-Daten von CheckMATE 227: Immuntherapie
Kombi ohne Chemotherapie in der Erstlinien-Behandlung: Vielleicht können wir den Patienten eine Chemotherapie ersparen
Welche Resultate / Erkenntnisse haben Sie überrascht? Positiv oder negativ?
– Positiv :
– Die NVALT19-Studie mit Gemcitabine als Erhaltungstherapie nach Erstlinien-Chemotherapie, die sehr vielversprechend ist
– Die Daten von Lenvantinib von der REMORA-Studie bei Thymus-Karzinom mit einer Ansprechrate von knapp 40%
– Negativ:
– Die Daten von Pembrolizumab im Vergleich mit Chemotherapie in der Zweitlinien-Behandlung des Mesothelioms
Welche Erkenntnisse haben für Ihre tägliche Praxis eine grosse Bedeutung?
– Die Daten der FLAURA-Studie unterstützen die Einleitung einer Erstlinien-Therapie mit Osimertinib.
Welches sind Bereiche mit noch grösstem Forschungsbedarf?
– Prospektive Analysen z.B. bezüglich TMB für Immuntherapie in der Erstlinie
– Ein Vergleich zwischen Chemo-Immuntherapie in der Erstlinie vs 2x Immuntherapie wäre wünschenswert.
– Die Daten der FLAURA-Studie zeigen, dass nur wenige Patienten auf Zweitlinientherapie kommen; hier müssen wir verstehen, welches die beste Therapie ist und welches die Resistenzmechanismen (basiert auf Tumor und nicht nur Liquid Biopsy) sind.
– Die Systemtherapie bei Mesotheliom ergab noch keine neuen Hinweise auf das Ansprechen, wir sollten noch weitere Therapie entwickeln.
Gibt es Fortschritte bei der Identifizierung von Biomarkern, die als Prädiktoren für das Ansprechen der Immuntherapie eine ausreichende Zuverlässigkeit garantieren?
– Genau das ist etwas Neues und Unerwartetes vom ESMO 2019: die OS-Daten von CheckMATE 227 sind unabhängig von der TMB, das heisst es braucht noch Forschung zu diesem Thema, um die Patienten genauer zu identifizieren.
Wie sehen Sie die Schweiz als Forschungsplatz am ESMO repräsentiert?
– Die Schweiz ist ziemlich aktiv, vor allem in Bezug auf die Immunonkologie-Forschung (präklinisch und klinisch).
Eleonore E. Droux
Im Gespräch mit PD Dr. med. Ulf Petrausch, Klinik Hirslanden, Zürich
 Welches waren Ihre Highlights am ESMO 2019 ?
Welches waren Ihre Highlights am ESMO 2019 ?
Die 5-Jahres-Daten beim metastasierten Melanom sind sicherlich der finale Beweis für die Wirksamkeit der Checkpointblockade. Diese Studie schliesst aber aus meiner Sicht auch die Ära der alleinigen Checkpointblockade beim Melanom und bei anderen metastasierten Krebserkrankungen ab, da ca. 50% der Patienten noch nicht langfristig profitieren. Somit ist nun Zeit für innovative Kombinationstherapien gekommen. Was mich sehr fasziniert hat waren die Vorträge zum Mikrobiom und dem Ansprechen auf Checkpointblockade. Hier öffnet sich gerade ein ganz neues Spektrum für die Immuntherapie.
Welche Erkenntnisse haben für Ihre tägliche Praxis eine grosse Bedeutung?
Spannend ist die Beobachtung, welche sicher mit Vorsicht zu geniessen ist, da sie retrospektiv ist, dass Antibiotikagaben einen Einfluss auf das Ansprechen einer Checkpointblockade haben könnten. Somit muss der Einsatz von Antibiotika noch kritischer hinterfragt werden, gerade zu Beginn einer Therapie mit Checkpointblockern. Auch hier könnte das Mikrobiom einen grossen Einfluss haben.
Welches sind Bereiche mit noch grösstem Forschungsbedarf?
Nach wie vor ist die Prädiktion des Ansprechens oder Nichtansprechens auf Checkpointblocker von immenser Wichtigkeit. Es werden zwar immer mehr Faktoren wie PD-L1, TMB oder Immunprofile beschrieben, die einen gewissen prädiktiven Wert haben, aber das Zusammenspiel dieser Faktoren ist nicht verstanden. Mir scheint, dass es hier ein komplexeres Verständnis braucht als die Suche nach dem einen Marker.
Wie sehen Sie die Schweiz als Forschungsplatz am ESMO repräsentiert?
Die SAKK konnte wieder Beiträge zu verschiedenen Themen zeigen (2 Poster (SAKK 57/16 und SAKK 95/16), 2 Oral Presentations (SAKK 17/16 und ETOP promise-meso)), bei der Lunge konnte Dr. Metaxas aus Chur eine Studie beim SCLL als Präsentation vorstellen. Frau Dr. Curioni und ich haben eine sehr innovative Studie mit CARs beim Mesotheliom (FAPME-1) als Poster zeigen dürfen.
Eleonore E. Droux