Vorhofflimmern (VHF) ist die häufigste kardiale Arrhythmie
(1, 2). Es ist mit signifikanter Mortalität und Morbidität assoziiert und verfünffacht das Risiko eines Schlaganfalls (3, 4). Als stark altersassoziierte Erkrankung steigt die Prävalenz auf 10 % der ≥ 75-Jährigen. Entsprechend ist das Schlaganfall-Risiko bei älteren Patienten (definiert als ≥ 75 Jahre) erhöht und gemäss der Framingham Studie waren 23.5 % der Schlag-
anfälle bei über 80-Jährigen mit VHF assoziiert (5). Die orale Antikoagulation ist die etablierte Therapie zur Prävention von kardioembolischen Komplikationen bei VHF. In der Folge wird die verfügbare Evidenz bezüglich Sicherheit und Effekt von Antikoagulation bei älteren Patienten mit VHF beleuchtet.
Der Bevölkerungsanteil älterer Menschen in entwickelten Ländern ist im Wachstum begriffen. Entsprechend ist auch mit einem Anstieg der Prävalenz von VHF zu rechnen (6, 7), was den Bedarf an sicheren und effektiven Behandlungsmethoden für diese Gruppe unterstreicht.
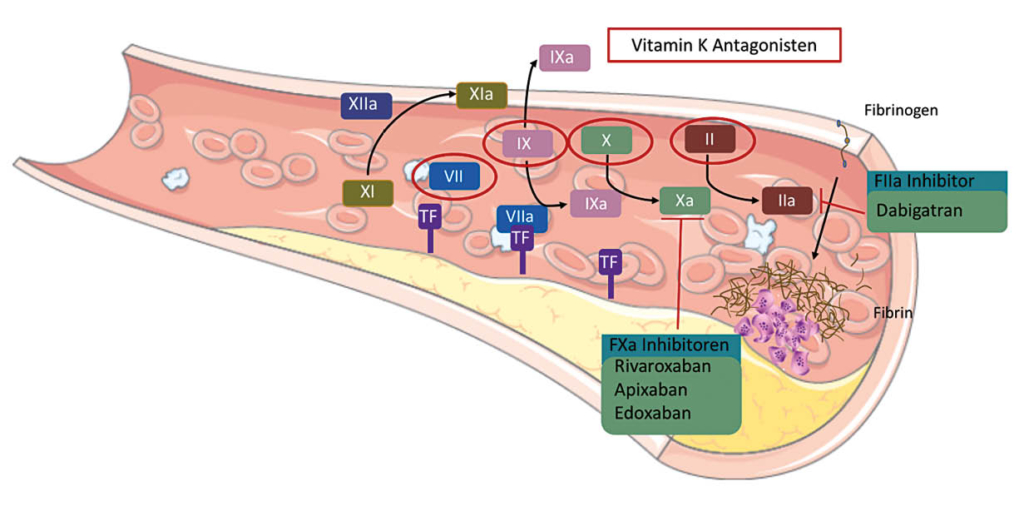
Orale Antikoagulation (OAK) ist die etablierte Standardtherapie zur Prävention von kardioembolischen Komplikationen bei VHF, wobei seit 2009 neben den Vitamin-K-Antagonisten (VKA) auch Nicht-Vitamin K abhängige Orale Antikoagulantien (NOACs) zur Verfügung stehen (Fig. 1).
Allerdings wird der OAK bei älteren Patienten oft kritisch begegnet, da bei dieser Population das hämorrhagische Risiko zunimmt (8). Andererseits zeigen Daten aus einem grossen Register, dass thromboembolische Komplikationen am häufigsten bei den ≥ 85-Jährigen auftreten und das Blutungsrisiko hierbei deutlich übersteigen (4.8 vs. 4 pro 100 Patienten/Jahr) (9).
Dies unterstützt die Wertigkeit der OAK auch bei älteren Patienten, wobei mögliche altersbedingte Ko-Faktoren wie Niereninsuffizienz, Sturzgefahr und tiefes Körpergewicht im Sinne einer vorsichtigen Nutzen-Risiko Analyse berücksichtigt werden müssen.
Vitamin K Antagonisten
In der randomisierten BAFTA Studie bei > 75-jährigen VHF-Pa-
tienten wurden VKA mit Aspirin verglichen. Hierbei führten VKA zu einer signifikanten (52%) Reduktion des relativen Risikos für den gemeinsamen Endpunkt von Schlaganfall, systemischer Embolie oder intrakranieller Blutung (10). Sogenannte «real world» Daten bestätigten später die Reduktion thromboembolischer Komplikationen unter OAK verglichen mit Aspirin, wobei das Blutungsrisiko nicht erhöht wurde. Entsprechend nahmen die klinischen Netto-Vorteile einer OAK mit steigendem Alter gar zu (9). Diese Ergebnisse wurden in einer Meta-Analyse mit 13 559 VHF-Patienten bestätigt (11).
Dennoch werden VKA bei älteren Patienten oft nicht eingesetzt, weil sie von vielen Ärzten als nicht sicher wahrgenommen werden (12-15). So wurden in einer Kohorte fast die Hälfte der älteren VHF-Patienten selbst nach Schlaganfall nicht antikoaguliert (16). Tatsächlich sind einige Limitationen der VKA-Therapie bei älteren Patienten überrepräsentiert. Hierzu zählen tiefe Zeiten im therapeutischen Rahmen, erschwerte Compliance und Medikamenten-Interaktionen (17-19).
Trotzdem ist eine OAK auch bei älteren VHF Patienten wichtig. Dies wird unterstrichen durch die Daten obengenannter Kohorte, welche signifikant verbesserte 1-Jahres-Überlebensraten bei antikoagulierten Patienten demonstrierte (16).
NOACs im Allgemeinen
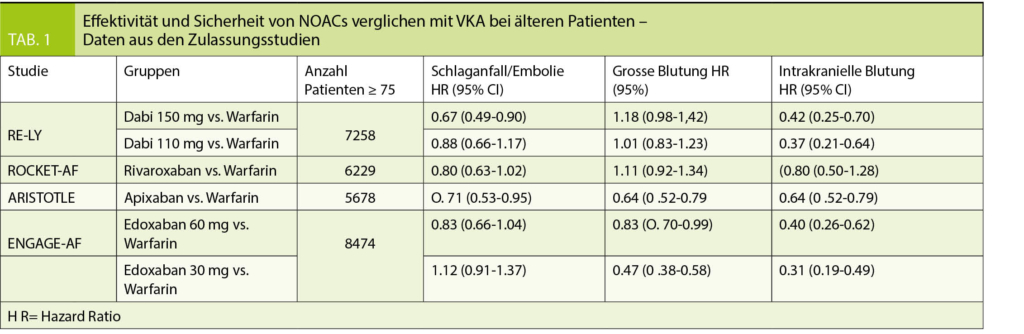
NOACs im Allgemeinen erfreuen sich seit ihrer Zulassung grosser Beliebtheit aufgrund ihrer einfachen Handhabung und des günstigen Nutzen-Risiko Profils. Eine Meta-Analyse randomisierter Studien verglich NOACs (Rivaroxaban, Apixaban und Dabigatran) mit Standardtherapie bei > 75-jährigen Patienten mit VHF oder VTE. Hierbei zeigten sich unter NOACs keine erhöhten Blutungsraten bei überlegener anti-thrombotischer Wirksamkeit (20).
Eine weitere Meta-Analyse bestätigte die gegenüber VKA ebenbürtige oder überlegene anti-thrombotische Effektivität von NOACs bei älteren Patienten (21). Allerdings traten gastrointestinale Blutungen unter beiden Dabigatran Dosierungen numerisch häufiger auf, während intrakranielle Blutungen unter beiden Dosierungen seltener waren. Signifikant tiefere Blutungsraten verglichen mit VKA wurden für Apixaban und Edoxaban verzeichnet, während Rivaroxaban ähnlich zu VKA abschnitt.
In der Folge werden die Daten zu einzelnen NOACs bei älteren Patienten vorgestellt.
Apixaban
In der Zulassungsstudie für Apixaban (ARISTOTLE) waren 31% der Teilnehmer ≥ 75 Jahre und 13 % ≥ 80 Jahre alt. Verglichen mit VKA war Apixaban altersunabhängig mit tieferen Blutungsraten assoziiert und senkte das thromboembolische Risiko und die Mortalität konsistent, sodass die absoluten Vorteile von Apixaban versus VKA in der älteren Population noch ausgeprägter ausfielen.
So waren bei den ≥ 80-Jährigen (n = 2436) das thromboembolische Risiko (HR 0.81), das allgemeine Blutungsrisiko (HR 0.66) und das intrakranielle Blutungsrisiko (HR 0.36) gegenüber VKA reduziert (22).
In der AVERROES Studie wurden VHF-Patienten mit Kontraindikationen für VKA entweder mit Aspirin oder Apixaban behandelt (23). Hierbei wurden 1898 ≥ 75-Jährige und 366 ≥ 85-Jährige miteingeschlossen. Auch bei diesen Patienten senkte Apixaban das thromboembolische Risiko, ohne dabei das Blutungsrisiko zu erhöhen (24).
Dabigatran
Unter Dabigatran wurden bei älteren Patienten Fälle von Blutungen beschrieben, insbesondere in Kombination mit Niereninsuffizienz und allgemeiner Gebrechlichkeit (25, 26).
Eine grosse, retrospektive Kohortenstudie mit älteren Patienten zeigte reduzierte Raten an Schlaganfall, intrakranieller Blutung und Tod unter der höheren Dabigatran-Dosis (2 x 150 mg), während die gastrointestinale Blutungsfrequenz erhöht war (27).
Eine Subanalyse der Zulassungsstudie RE-LY indes demonstrierte, dass die kleinere Dabigatran Dosis (2 x 110 mg) bei älteren Patienten gleich viele Blutungskomplikationen wie VKA bedingte, während die höhere Dosis bei > 75-Jährigen mit signifikant mehr Blutungen assoziiert war. Dieser alters-abhängige Anstieg des Blutungsrisikos war auch hier auf extrakranielle Blutungen beschränkt (28).
Aufgrund der postulierten Altersabhängigkeit der Blutungskomplikationen (29) wird bei ≥ 80-Jährigen eine reduzierte Dosis von 2 x 110 mg empfohlen.
Edoxaban
In der ENGAGE-AF-TIMI 48 Studie waren 8474 Teilnehmer ≥ 75 Jahre alt, was der bis anhin grössten Zahl von älteren Patienten in einer randomisierten NOAC Studie entspricht.
Die Rate ischämischer Komplikationen war auch bei älteren Patienten ähnlich wie unter VKA, während relevante Blutungen unter Edoxaban signifikant seltener auftraten. Die Risikoreduktion für relevante und intrakranielle Blutungen unter Edoxaban nahm mit dem Alter sogar zu, sodass die Netto-Vorteile von Edoxaban gegenüber VKA bei älteren Patienten besonders deutlich waren (8).
Interessanterweise ergaben prä-spezifizierte Subanalysen der ENGAGE-AF-TIMI 48 Studie, dass die Blutungs- und Überlebens-Vorteile von Edoxaban gegenüber VKA bei Patienten mit erhöhtem Sturzrisiko besonders zu Tage traten. So war Edoxaban bei älteren, sturzgefährdeten Patienten mit einer deutlichen Risikoreduktion für lebensbedrohliche Blutungen (HR 0.32) und intrakranielle Blutungen (HR 0.16) assoziiert (30).
Rivaroxaban
Eine Analyse der Rivaroxaban-Zulassungsstudie (ROCKET-AF) zeigte erwartungsgemäss höhere thromboembolische und hämorrhagische Komplikationsraten bei älteren (≥ 75 Jahre) verglichen mit jüngeren Patienten – sowohl unter Rivaroxaban als auch VKA.
Es gab keine altersbedingten Unterschiede bezüglich der antithrombotischen Wirksamkeit von Rivaroxaban verglichen mit VKA, wobei ältere Patienten unter Rivaroxaban häufiger klinisch-relevant bluteten. Dies war jedoch auf extra-kranielle Blutungen beschränkt und wurde hauptsächlich durch erhöhte gastrointestinale Blutungsraten getrieben.
Hinsichtlich des klinischen Nettovorteils, bedingt durch Vermeidung ischämischer Schlaganfälle, lebensbedrohlicher Blutungen, intrakranieller Blutungen und Tod, konnte aber ein mit dem Alter zunehmender Vorteil von Rivaroxaban gegenüber VKA festgestellt werden (31).
Zwischenzeitlich bestätigen auch sogenannte «real world» Studien diese positiven Ergebnisse und zeigen eine gute Sicherheit von NOACs auch bei älteren Pateinten mit einer Blutungsrate von 1.37/100 Personenjahre (32).
Spezielle Erwägungen für den Gebrauch von NOACs bei älteren Patienten
Die Elimination von NOACs bei älteren Patienten unterscheidet sich von derjenigen bei Jüngeren. So sind die «area under the curve» (AUC) und die Plasmakonzentrationen von Dabigatran, Rivaroxaban und Apixaban bei älteren Menschen erhöht, während bei Rivaroxaban auch eine Verlängerung der Halbwertszeit von 5-9 auf 11-13 Stunden festgestellt wurde. Die Pharmakokinetik von Edoxaban derweil zeigte sich durch fortschreitendes Alter unbeeinflusst (33).
Basierend auf diesen Daten wird für Dabigatran offiziell eine altersabhängige (≥ 80 Jahre) Dosisreduktion empfohlen, während die ESC Guidelines die Erwägung einer Dosisreduktion schon bei ≥ 75-Jährigen nahelegen. Für die anderen NOACs ist Alter allein keine Indikation zur Dosisreduktion, sondern nur in Kombination mit weiteren entsprechenden Kriterien.
Gerade bei älteren Patienten kann die Nierenfunktion ausschlaggebend für die Wahl eines spezifischen NOACs sein, weshalb häufigere Kontrollen derselben indiziert sind (34).
Weiterhin finden sich bei älteren Patienten öfters Komorbiditäten, welche interaktionsträchtige Ko-Medikationen bedingen können. Eine Übersicht wichtiger Interaktionspartner findet sich in den Praxisguidelines der EHRA zur Konsultation (35). Als Klasse interagieren alle NOACs mit Substanzen, welche das P-Glycoprotein (P-gp) Transportsystem beeinflussen. Entsprechende Dosisreduktionen sind teilweise nötig. Ebenso ist bei der Kombination mit CYP3A4 Induktoren oder Inhibitoren Vorsicht geboten.
Bedingt durch das schnelle An- und Abfluten der NOAC-Wirkung ist gute Therapie-Adhärenz von grosser Bedeutung. Bei älteren Patienten könnten verschiedene Faktoren die Compliance beeinflussen, welche es entsprechend zu eruieren gilt. Dazu zählen kognitive Einschränkungen, Depression, soziale Isolation oder Polypharmazie (36, 37).
Malnutrition und Hypalbuminämie bei älteren Patienten können Einfluss auf die Plasma-Proteinbindung von NOACs haben. Hierbei weisen Rivaroxaban und Apixaban hohe Proteinbindung auf (93 % und 87 %), während diese bei Edoxaban und Dabigatran tiefer ist (50 % und 35 %). Während der Einfluss von Malnutrition auf das Blutungsrisiko noch spezifisch untersucht werden muss, sollte sie bei den vulnerablen älteren Patienten generell aktiv gesucht und behandelt werden.
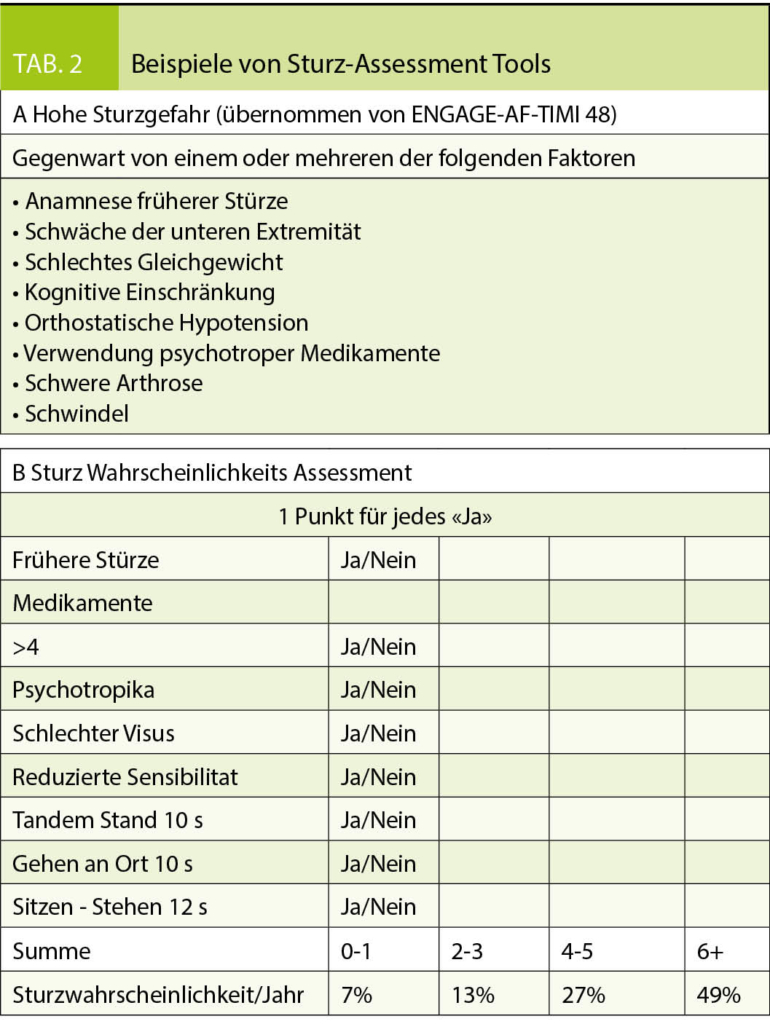
Die altersbedingte Sturzgefahr wird häufig als Kontraindikation für OAK gewertet (17). Interessanterweise hat ein analytisches Modell gezeigt, dass ein Patient unter VKA 295 Mal stürzen müsste, bevor das Risiko eines Subduralhämatoms die Vorteile der OAK überwiegen würde (38). Angesichts der tieferen intrakraniellen Blutungsrate unter NOACs, dürfte die «number needed to fall» hier noch grösser sein. Der Effekt von NOACs versus VKA bei Patienten mit erhöhter Sturzgefahr wurde in zwei NOAC Studien spezifisch untersucht (ENGAGE-AF TIMI 48 und ARISTOTLE). Hierbei war der Behandlungserfolg der NOACs gegenüber VKA auch bei sturzgefährdeten Patienten konsistent. Da diese aber auch ein grösseres absolutes Risiko für thromboembolische Komplikationen hatten, war die absolute Risikoreduktion unter NOACs verglichen mit VKA ausgeprägter, sodass die «number needed to treat» bei sturzgefährdeten Patienten noch tiefer ausfiel (8, 39). Entsprechend sollte Gebrechlichkeit per se nicht als Ausschlusskriterium für OAK geltend gemacht werden, da gerade diese Patienten ein erhöhtes Risiko für Schlaganfall aufweisen und entsprechend profitieren können. Edoxaban und Apixaban sind die in diesem Zusammenhang am besten untersuchten NOACs. Weiterhin empfiehlt es sich, bei allen älteren Patienten mit OAK Indikation das Sturzrisiko mittels entsprechender Risiko-Tools zu ermitteln (Tabelle 2), häufige Stürze interdisziplinär abzuklären und das Sturzrisiko durch gezielte Interventionen (Bewegungsprogramme, Heimabklärung) zu reduzieren.
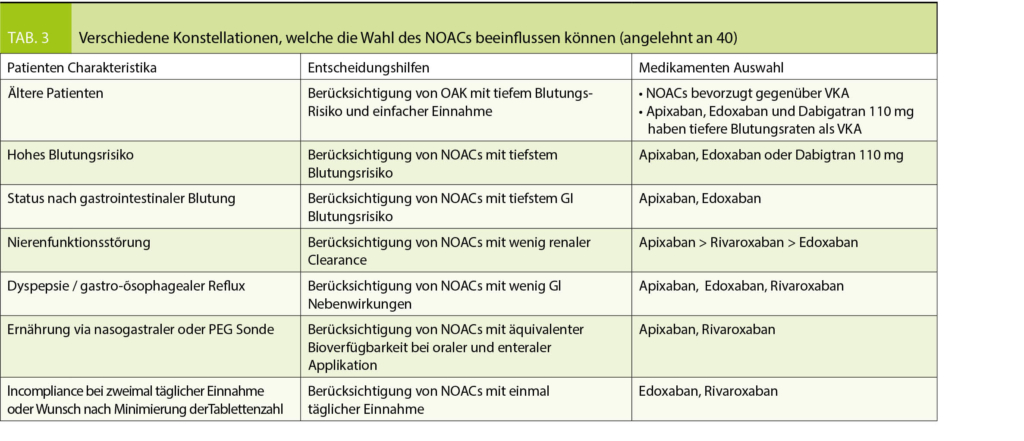
Bezüglich Auswahl des geeigneten NOACs für den individuellen Patienten gibt es keine allgemeingültige Standardlösung. Von direkten Vergleichen der Substanzen untereinander sollte möglichst abgesehen werden, da sich die Zulassungsstudien bezüglich Ein- und Ausschlusskriterien und Definition der Endpunkte unterscheiden. Dennoch können gewisse patientenspezifische Faktoren besondere Ansprüche an das verschriebene NOAC stellen, welche in die Wahl der geeigneten Substanz einfliessen (40). Tabelle 3 gibt eine Übersicht über mögliche Konstellationen.
Center for Molecular Cardiology, Universität Zürich
Klinik für Innere Medizin, Kantonsspital Baden
Im Ergel 1
5404 Baden
nicole.bonetti@ksb.ch
Leiter Gerinnungssprechstunde Kantonsspital Baden, 5404 Baden
Labor für Molekulare Kardiologie, Leiter Plättchenforschung,
Universität Zürich
Wagistrasse 12
8952 Schlieren
juerg-hans.beer@ksb.ch
Prof. Beer erhielt Beiträge des SNF und der Schweizerischen Herzstiftung sowie Bayer und Vortragshonorare von Daiichi-Sankyo, Sanofi Aventis und Amgen an die Institution ausserhalb dieses Artikels. Dr. Bonetti hat keine Interessenskonflikte.
1. Zoni-Berisso M, Lercari F, Carazza T and Domenicucci S. Epidemiology of atrial fibrillation: European perspective. Clin Epidemiol. 2014;6:213-20.
2. Go AS, Hylek EM, Phillips KA, Chang Y, Henault LE, Selby JV and Singer DE. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA. 2001;285:2370-5.
3. Writing Group M, Mozaffarian D, Benjamin EJ, Go AS, Arnett DK, Blaha MJ, Cushman M, Das SR, de Ferranti S, Despres JP, Fullerton HJ, Howard VJ, Huffman MD, Isasi CR, Jimenez MC, Judd SE, Kissela BM, Lichtman JH, Lisabeth LD, Liu S, Mackey RH, Magid DJ, McGuire DK, Mohler ER, 3rd, Moy CS, Muntner P, Mussolino ME, Nasir K, Neumar RW, Nichol G, Palaniappan L, Pandey DK, Reeves MJ, Rodriguez CJ, Rosamond W, Sorlie PD, Stein J, Towfighi A, Turan TN, Virani SS, Woo D, Yeh RW, Turner MB, American Heart Association Statistics C and Stroke Statistics S. Heart Disease and Stroke Statistics-2016 Update: A Report From the American Heart Association. Circulation. 2016;133:e38-360.
4. Wolf PA, Abbott RD and Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke. 1991;22:983-8.
5. Lip GY, Nieuwlaat R, Pisters R, Lane DA and Crijns HJ. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the euro heart survey on atrial fibrillation. Chest. 2010;137:263-72.
6. Miyasaka Y, Barnes ME, Gersh BJ, Cha SS, Bailey KR, Abhayaratna WP, Seward JB and Tsang TS. Secular trends in incidence of atrial fibrillation in Olmsted County, Minnesota, 1980 to 2000, and implications on the projections for future prevalence. Circulation. 2006;114:119-25.
7. Lee H, Kim TH, Baek YS, Uhm JS, Pak HN, Lee MH and Joung B. The Trends of Atrial Fibrillation-Related Hospital Visit and Cost, Treatment Pattern and Mortality in Korea: 10-Year Nationwide Sample Cohort Data. Korean Circ J. 2017;47:56-64.
8. Kato ET, Giugliano RP, Ruff CT, Koretsune Y, Yamashita T, Kiss RG, Nordio F, Murphy SA, Kimura T, Jin J, Lanz H, Mercuri M, Braunwald E and Antman EM. Efficacy and Safety of Edoxaban in Elderly Patients With Atrial Fibrillation in the ENGAGE AF-TIMI 48 Trial. J Am Heart Assoc. 2016;5.
9. Patti G, Lucerna M, Pecen L, Siller-Matula JM, Cavallari I, Kirchhof P and De Caterina R. Thromboembolic Risk, Bleeding Outcomes and Effect of Different Antithrombotic Strategies in Very Elderly Patients With Atrial Fibrillation: A Sub-Analysis From the PREFER in AF (PREvention oF Thromboembolic Events-European Registry in Atrial Fibrillation). J Am Heart Assoc. 2017;6.
10. Mant J, Hobbs FD, Fletcher K, Roalfe A, Fitzmaurice D, Lip GY, Murray E, investigators B and Midland Research Practices N. Warfarin versus aspirin for stroke prevention in an elderly community population with atrial fibrillation (the Birmingham Atrial Fibrillation Treatment of the Aged Study, BAFTA): a randomised controlled trial. Lancet. 2007;370:493-503.
11. Singer DE, Chang Y, Fang MC, Borowsky LH, Pomernacki NK, Udaltsova N and Go AS. The net clinical benefit of warfarin anticoagulation in atrial fibrillation. Ann Intern Med. 2009;151:297-305.
12. Pugh D, Pugh J and Mead GE. Attitudes of physicians regarding anticoagulation for atrial fibrillation: a systematic review. Age Ageing. 2011;40:675-83.
13. Scowcroft AC, Lee S and Mant J. Thromboprophylaxis of elderly patients with AF in the UK: an analysis using the General Practice Research Database (GPRD) 2000-2009. Heart. 2013;99:127-32.
14. Gattellari M, Worthington J, Zwar N and Middleton S. Barriers to the use of anticoagulation for nonvalvular atrial fibrillation: a representative survey of Australian family physicians. Stroke. 2008;39:227-30.
15. Perera V, Bajorek BV, Matthews S and Hilmer SN. The impact of frailty on the utilisation of antithrombotic therapy in older patients with atrial fibrillation. Age Ageing. 2009;38:156-62.
16. McGrath ER, Go AS, Chang Y, Borowsky LH, Fang MC, Reynolds K and Singer DE. Use of Oral Anticoagulant Therapy in Older Adults with Atrial Fibrillation After Acute Ischemic Stroke. J Am Geriatr Soc. 2017;65:241-248.
17. Hylek EM, D’Antonio J, Evans-Molina C, Shea C, Henault LE and Regan S. Translating the results of randomized trials into clinical practice: the challenge of warfarin candidacy among hospitalized elderly patients with atrial fibrillation. Stroke. 2006;37:1075-80.
18. Tulner LR, Van Campen JP, Kuper IM, Gijsen GJ, Koks CH, Mac Gillavry MR, van Tinteren H, Beijnen JH and Brandjes DP. Reasons for undertreatment with oral anticoagulants in frail geriatric outpatients with atrial fibrillation: a prospective, descriptive study. Drugs Aging. 2010;27:39-50.
19. Zarraga IG and Kron J. Oral anticoagulation in elderly adults with atrial fibrillation: integrating new options with old concepts. J Am Geriatr Soc. 2013;61:143-50.
20. Sardar P, Chatterjee S, Chaudhari S and Lip GY. New oral anticoagulants in elderly adults: evidence from a meta-analysis of randomized trials. J Am Geriatr Soc. 2014;62:857-64.
21. Sharma M, Cornelius VR, Patel JP, Davies JG and Molokhia M. Efficacy and Harms of Direct Oral Anticoagulants in the Elderly for Stroke Prevention in Atrial Fibrillation and Secondary Prevention of Venous Thromboembolism: Systematic Review and Meta-Analysis. Circulation. 2015;132:194-204.
22. Halvorsen S, Atar D, Yang H, De Caterina R, Erol C, Garcia D, Granger CB, Hanna M, Held C, Husted S, Hylek EM, Jansky P, Lopes RD, Ruzyllo W, Thomas L and Wallentin L. Efficacy and safety of apixaban compared with warfarin according to age for stroke prevention in atrial fibrillation: observations from the ARISTOTLE trial. Eur Heart J. 2014;35:1864-72.
23. Connolly SJ, Eikelboom J, Joyner C, Diener HC, Hart R, Golitsyn S, Flaker G, Avezum A, Hohnloser SH, Diaz R, Talajic M, Zhu J, Pais P, Budaj A, Parkhomenko A, Jansky P, Commerford P, Tan RS, Sim KH, Lewis BS, Van Mieghem W, Lip GY, Kim JH, Lanas-Zanetti F, Gonzalez-Hermosillo A, Dans AL, Munawar M, O’Donnell M, Lawrence J, Lewis G, Afzal R, Yusuf S, Committee AS and Investigators. Apixaban in patients with atrial fibrillation. N Engl J Med. 2011;364:806-17.
24. Ng KH, Shestakovska O, Connolly SJ, Eikelboom JW, Avezum A, Diaz R, Lanas F, Yusuf S and Hart RG. Efficacy and safety of apixaban compared with aspirin in the elderly: a subgroup analysis from the AVERROES trial. Age Ageing. 2016;45:77-83.
25. Legrand M, Mateo J, Aribaud A, Ginisty S, Eftekhari P, Huy PT, Drouet L and Payen D. The use of dabigatran in elderly patients. Arch Intern Med. 2011;171:1285-6.
26. Harper P, Young L and Merriman E. Bleeding risk with dabigatran in the frail elderly. N Engl J Med. 2012;366:864-6.
27. Graham DJ, Reichman ME, Wernecke M, Zhang R, Southworth MR, Levenson M, Sheu TC, Mott K, Goulding MR, Houstoun M, MaCurdy TE, Worrall C and Kelman JA. Cardiovascular, bleeding, and mortality risks in elderly Medicare patients treated with dabigatran or warfarin for nonvalvular atrial fibrillation. Circulation. 2015;131:157-64.
28. Eikelboom JW, Wallentin L, Connolly SJ, Ezekowitz M, Healey JS, Oldgren J, Yang S, Alings M, Kaatz S, Hohnloser SH, Diener HC, Franzosi MG, Huber K, Reilly P, Varrone J and Yusuf S. Risk of bleeding with 2 doses of dabigatran compared with warfarin in older and younger patients with atrial fibrillation: an analysis of the randomized evaluation of long-term anticoagulant therapy (RE-LY) trial. Circulation. 2011;123:2363-72.
29. Lauw MN, Eikelboom JW, Coppens M, Wallentin L, Yusuf S, Ezekowitz M, Oldgren J, Nakamya J, Wang J and Connolly SJ. Effects of dabigatran according to age in atrial fibrillation. Heart. 2017;103:1015-1023.
30. Steffel J, Giugliano RP, Braunwald E, Murphy SA, Mercuri M, Choi Y, Aylward P, White H, Zamorano JL, Antman EM and Ruff CT. Edoxaban Versus Warfarin in Atrial Fibrillation Patients at Risk of Falling: ENGAGE AF-TIMI 48 Analysis. J Am Coll Cardiol. 2016;68:1169-1178.
31. Halperin JL, Hankey GJ, Wojdyla DM, Piccini JP, Lokhnygina Y, Patel MR, Breithardt G, Singer DE, Becker RC, Hacke W, Paolini JF, Nessel CC, Mahaffey KW, Califf RM, Fox KA, Committee RAS and Investigators. Efficacy and safety of rivaroxaban compared with warfarin among elderly patients with nonvalvular atrial fibrillation in the Rivaroxaban Once Daily, Oral, Direct Factor Xa Inhibition Compared With Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation (ROCKET AF). Circulation. 2014;130:138-46.
32. Khan F, Huang H and Datta YH. Direct oral anticoagulant use and the incidence of bleeding in the very elderly with atrial fibrillation. J Thromb Thrombolysis. 2016;42:573-8.
33. Su S, Votaw J, Faber T, Khan D, Bremner JD, Goldberg J, Nichols K, Van Tosh A and Vaccarino V. Measurement of heritability of myocardial blood flow by positron emission tomography: the Twins Heart Study. Heart. 2012;98:495-9.
34. Andreotti F, Rocca B, Husted S, Ajjan RA, ten Berg J, Cattaneo M, Collet JP, De Caterina R, Fox KA, Halvorsen S, Huber K, Hylek EM, Lip GY, Montalescot G, Morais J, Patrono C, Verheugt FW, Wallentin L, Weiss TW, Storey RF and Group ESCTW. Antithrombotic therapy in the elderly: expert position paper of the European Society of Cardiology Working Group on Thrombosis. Eur Heart J. 2015;36:3238-49.
35. Steffel J, Verhamme P, Potpara TS, Albaladejo P, Antz M, Desteghe L, Georg Haeusler K, Oldgren J, Reinecke H, Roldan-Schilling V, Rowell N, Sinnaeve P, Collins R, Camm AJ, Heidbuchel H and Group ESCSD. The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation: executive summary. Europace. 2018;20:1231-1242.
36. Gellad WF, Grenard JL and Marcum ZA. A systematic review of barriers to medication adherence in the elderly: looking beyond cost and regimen complexity. Am J Geriatr Pharmacother. 2011;9:11-23.
37. Wimmer BC, Cross AJ, Jokanovic N, Wiese MD, George J, Johnell K, Diug B and Bell JS. Clinical Outcomes Associated with Medication Regimen Complexity in Older People: A Systematic Review. J Am Geriatr Soc. 2017;65:747-753.
38. Man-Son-Hing M, Nichol G, Lau A and Laupacis A. Choosing antithrombotic therapy for elderly patients with atrial fibrillation who are at risk for falls. Arch Intern Med. 1999;159:677-85.
39. Rao MP, Vinereanu D, Wojdyla DM, Alexander JH, Atar D, Hylek EM, Hanna M, Wallentin L, Lopes RD, Gersh BJ, Granger CB and Apixaban for Reduction in Stroke Other Thromboembolic Events in Atrial Fibrillation I. Clinical Outcomes and History of Fall in Patients with Atrial Fibrillation Treated with Oral Anticoagulation: Insights From the ARISTOTLE Trial. Am J Med. 2018;131:269-275 e2.
40. J.W CNCE. How I manage anticoagulant therapy in older individuals with atrial fibrillation or venous thromboembolism. Blood. 2019.