Vorhofflimmern betrifft rund 2% der Bevölkerung mit einer dreifach höheren Inzidenz in der älteren Population. Die Herzinsuffienz ist eine weitere Erkrankung der Alters und rund 20% der herzinsuffizienten Patienten leiden unter Vorhofflimmern. Herzinsuffizienz erhöht zum einen das Risiko für das Auftreten von Vorhofflimmern und hat zum anderen eine schlechtere Prognose bei Vorhofflimmern. Die Koexistenz der beiden Erkrankungen ist also häufig und es ist oft unklar, ob das Vorhofflimmern Folge oder Ursache einer Herzinsuffizienz ist.
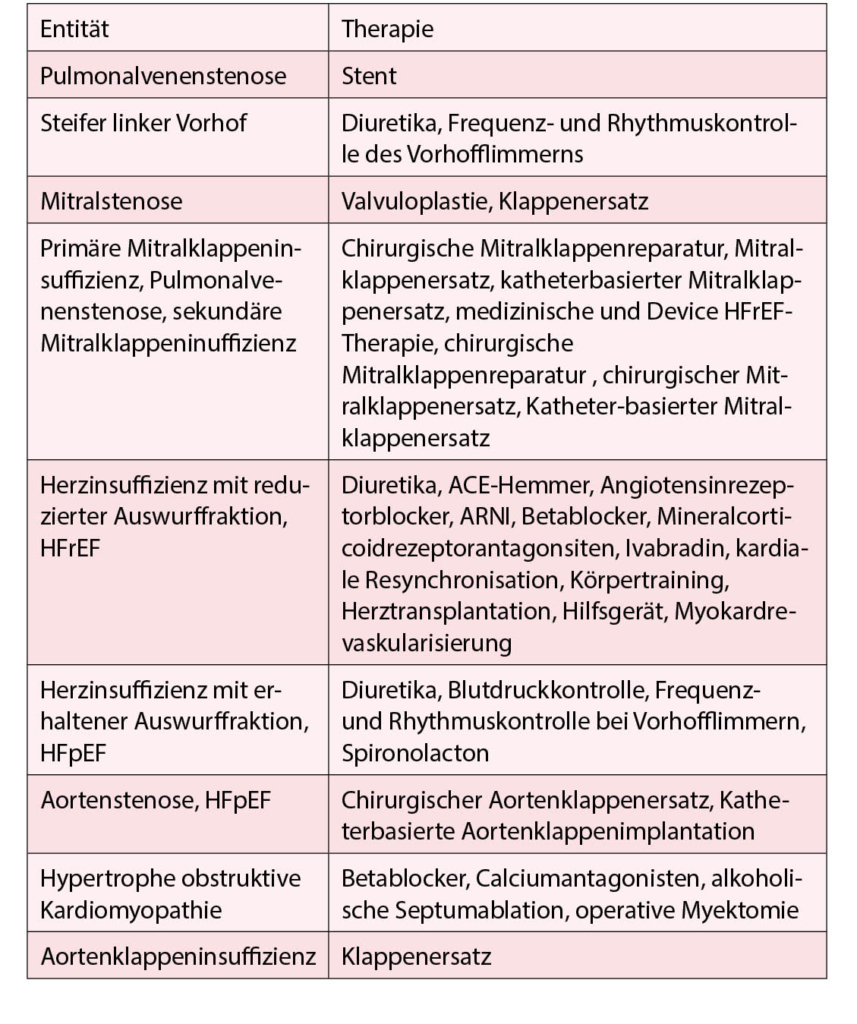
Herzinsuffizienz
Herzinsuffizienz ist eine klinische Manifestation mit charakteristischen Symptomen und variabel vorhandenen typischen Zeichen. Ursache hierfür ist eine zugrundeliegende strukturelle oder funktionelle Herzerkrankung, die in einem reduzierten kardialen Output und/oder erhöhten intrakardialen Füllungsdrücken in Ruhe bzw. unter Belastung resultiert.
Vorhofflimmern
Im Jahr 2030 werden europaweit 14 bis 17 Millionen Patienten mit Vorhofflimmern erwartet, mit einer jährlichen Inzidenz von ca. 120 000 – 215 000 Fällen pro Jahr (1). Die steigende Prävalenz resultiert aus Fortschritten in der apparativen Diagnostik mit zunehmender Detektion asymptomatischer Patienten, sowie aus der demographischen Entwicklung mit steigender Lebenserwartung und damit einhergehender Comorbidität (2, 3, 4). Vorhofflimmern erhöht per se Morbidität und Mortalität.
Physiologische Beziehung zwischen Vorhofflimmern und Herzinsuffizienz
Herzinsuffizienz und Vorhofflimmern haben gemeinsame Risikofaktoren, wie arterielle Hypertonie, zunehmendes Alter, Diabetes mellitus, Hyperlipidämien und Atherosklerose; darüber hinaus erhöht die jeweilige Entität die Prävalenz der anderen. Vorhofflimmern kann durch die Entwicklung einer Tachymyopathie direkt zu Symptomen einer Herzinsuffizienz und zu einer Einschränkung der linksventrikulären Pumpfunktion führen. Herzinsuffizienz führt wiederum zu Vorhofflimmern infolge hämodynamischer Effekte und hormoneller Alterationen, mit dem Endergebnis eines Remodellings auf Vorhofebene. So ist eine valvuläre Herzerkrankung beispielsweise in fast der Hälfte der Fälle mit Vorhofflimmern vergesellschaftet.
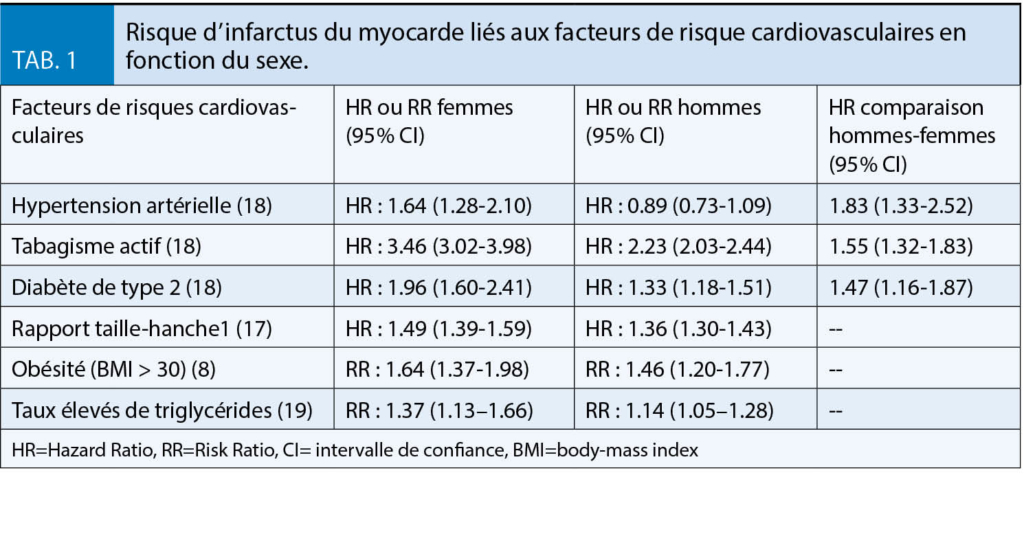
Auf der Suche nach modifizierbaren Risikofaktoren wurden Daten von rund 40 000 im US-amerikanischen Gesundheitswesen beschäftigten Frauen aus der Women,s Health Study über einen Zeitraum von rund 20 Jahren analysiert. Neu aufgetretenes Vorhofflimmern ging mit einem erhöhten Risiko für Herzinsuffizienz einher (Hazard Ratio 9,03). Risikofaktoren für die Entwicklung einer Herzinsuffizienz waren ein erhöhter Blutdruck (systolisch > 120 mmHg), Übergewicht (Body Mass Index > 30), Rauchen und ein Diabetes mellitus Typ 2. Diesen vier modifizierbaren Risikofaktoren konnte ein Risiko von 62% zugeordnet werden (5). Dies unterstreicht die Wichtigkeit einer adäquaten Prävention und konsequenten Behandlung dieser häufigen Komorbiditäten.
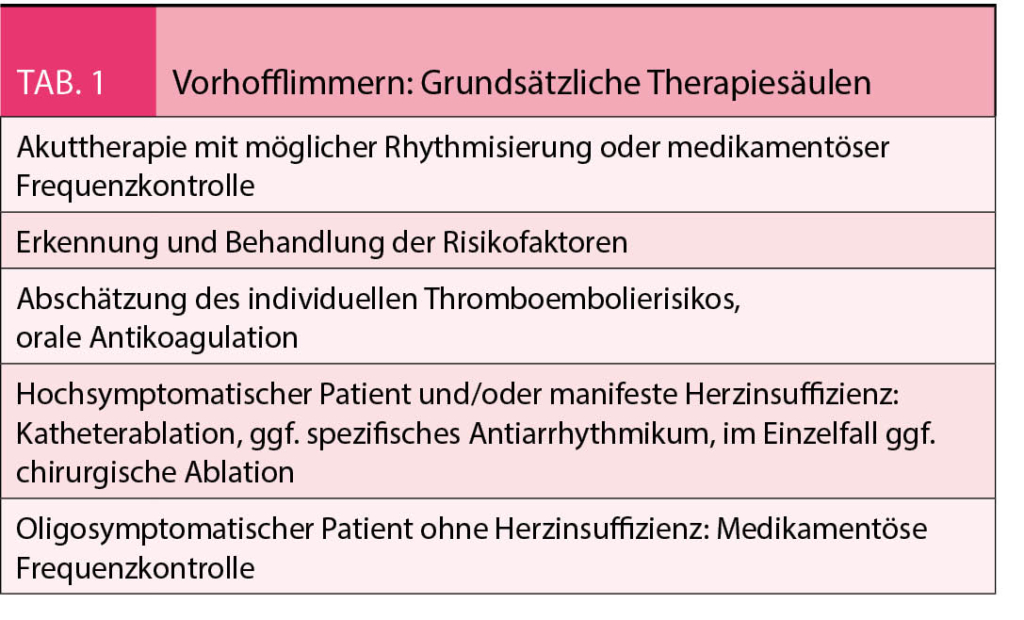
Therapie des Vorhofflimmerns bei Herzinsuffizienz
Orale Antikoagulantien (NOAK)
Eine manifeste Herzinsuffizienz stellt einen Risikofaktor für thromboembolische Komplikationen bei Vorhofflimmern dar, erhöht jedoch zugleich das Blutungsrisiko. Dies spiegelt sich in beiden üblichen Scores zur Risikostratifizierung (CHA2DS2-Vasc- und HAS-BLED-Score) wider. Neue orale Antikoagulantien könnten in dieser Situation aufgrund ihrer pharmakokinetischen Eigenschaften von Vorteil sein, randomisierte Studien zum direkten Vergleich mit Vitamin K-Antagonisten speziell bei herzinsuffizienten Patienten fehlen jedoch.
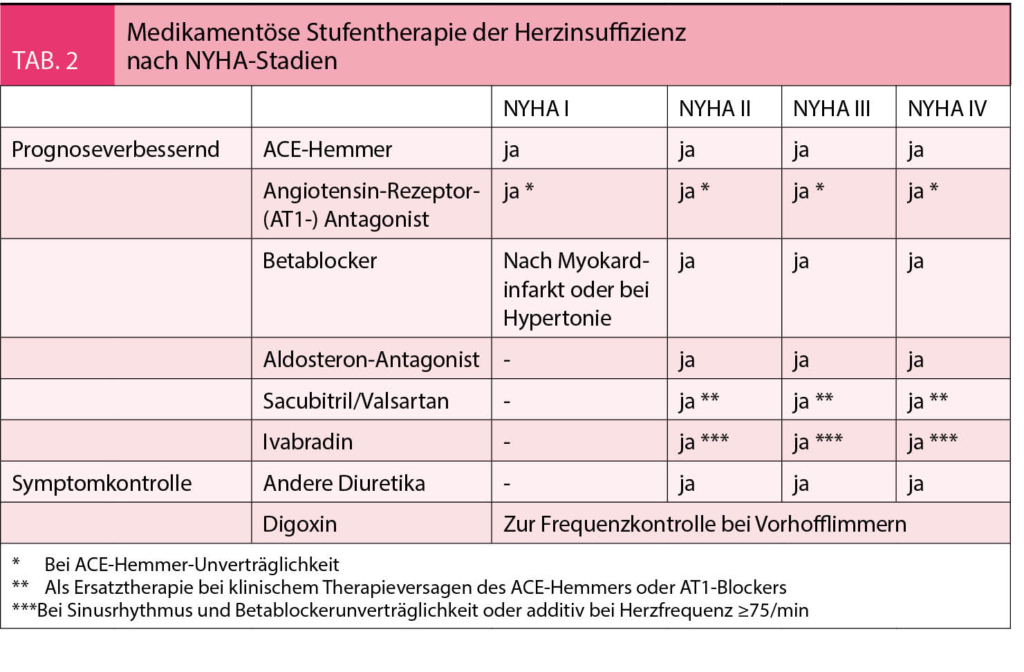
Medikamentöse Therapie
ACE-Hemmer, AT1-Rezeptorblocker, Aldosteronantagonisten und Angiotensinrezeptor-Neprilysininhibitoren finden bei Patienten mit Vorhofflimmern und einer HFrEF analog zu den Patienten mit Sinusrhythmus breite Anwendung. Herzglykoside werden in den Leitlinien zur Herzinsuffizienztherapie nicht routinemässig empfohlen (IIb-Indikation), einen höheren Stellenwert haben sie jedoch im Rahmen der medikamentösen Frequenzkontrolle bei Vorhofflimmern (Ib-Indikation).
Frequenz- oder Rhythmuskontrolle?
In der klinischen Praxis werden die ersten Episoden von Vorhofflimmern bei herzinsuffizienten Patienten häufig mithilfe einer elektrischen Kardioversion behandelt. Von medikamentöser Seite stehen lediglich Amiodarone und eingeschränkt Sotalol als spezifische Antiarrhythmika zur medikamentösen Rhythmuskontrolle bei Patienten mit struktureller Herzerkrankung zur Verfügung.
Mehrere Studien haben sich dem Vergleich zwischen einer rhythmuserhaltenden und einer frequenzkontrollierenden medikamentösen Strategie untersucht.
Weder die AF-CHF-Studie noch die AFFIRM-Studie konnten einen Vorteil der Rhythmuskontrolle im Hinblick auf kardiovaskuläre Mortalität oder Symptomkontrolle und Lebensqualität zeigen (6, 7). Hingegen konnte eine Subgruppenanalyse der CHF-STAT-Studie nachweisen, dass eine Therapie mit Amiodarone mit dadurch erzielter Konversion in Sinusrhythmus zu einer signifikanten Mortalitätssenkung bei herzinsuffizienten Patienten im Vergleich zu einer Kontrollgruppe führen konnte (8). Ein direkter kausaler Zusammenhang zwischen medikamentös nicht konvertierbarem Vorhofflimmern und Verschlechterung der Prognose konnte jedoch nicht unmittelbar geschlussfolgert werden.
Die Katheterablation Pulmonalvenenisolation
Khan und Kollegen konnten 2008 erstmalig nachweisen, dass die Pulmonalvenenisolation zu einer besseren Lebensqualität, zu einer Besserung der kardiopulmonalen Belastbarkeit (gemessen am 6-Minuten-Gehtest) und zu einer Zunahme der linksventrikulären Ejektionsfraktion bei Patienten mit Vorhofflimmern und Herzinsuffizienz führen kann (9).
Weitere Forschungsgruppen, so zum Beispiel Di Biase at al. (10), konnten zeigen, dass eine Katherablation wesentlich erfolgreicher in der Erhaltung des Sinsurhythmus ist als eine spezifische antiarrhythmische Therapie mit Amiodarone.
Die bisher umfangreichste Studie zu diesem Thema ist die CASTLE-AF-Study (11). Hierfür wurden 363 herzinsuffiziente Patienten mit paroxysmalem (ca. 30%) oder persistierendem (ca. 70% der Fälle) Vorhofflimmern in zwei Gruppen randomisiert, die entweder eine Katheterablation oder eine rein medikamentöse Therapie erhielten. Alle wiesen eine linksventrikuläre Ejektionsfraktion ≤ 35%, eine NYHA-Klasse ≥II und das Vorhandensein eines implantierbaren Kardioverter-Defibrillators (ICD) mit Homemonitoring aus primär- oder sekundärprophylaktischer Indikation auf. Weiteres Kriterium war eine im Vorfeld wegen Nebenwirkungen oder Ineffektivität (jeweils 13% bzw. 46% der Teilnehmer) abgebrochene oder grundsätzlich vom Patienten abgelehnte antiarrhythmische Therapie mit Amiodarone. Als primärer Endpunkt wurden ein Tod jeglicher Ursache und eine Hospitalisierung wegen Herzinsuffizienz definiert. Nach einer durchschnittlichen Nachbeobachtungszeit von 3 Jahren konnte dieser relativ um 38% bzw. absolut um 16% mit einem «number needed to treat» von 8,3 gesenkt werden. Somit konnte zum ersten Mal dokumentiert werden, dass eine Katheterablation die Überlebensrate von herzinsuffizienten Patienten mit eingeschränkter LV-Pumpfunktion (HFrEF) signifikant erhöhen kann.
Ablate and Pace
Patienten mit verminderter Leistungfähigkeit bei persistierendem Vorhofflimmern und nicht ausreichender Frequenzkontrolle trotz optimaler medikamentöser Therapie können von einer kombinierten Therapie mit AV-Knoten-Ablation und Implantation eines Schrittmachers profitieren.
Im Falle einer reduzierten LV-Pumpfunktion ist eine biventrikuläre Stimulation gegenüber einer alleinigen rechtsventrikulären Stimulation zu favorisieren. (12)
In der APAF-CRT-Studie konnten Brignole und Coautoren die Überlegenheit des CRT-Systems im Vergleich zur medikamentösen frequenzkontrollierenden Therapie bezüglich Hospitalisierung und Symptomkontrolle zeigen. In dieser Population haben die Patienten mit LVEF < 35% am meisten profitiert. Ein Trend im Hinblick auf eine Reduktion der Mortalität wurde auch gezeigt, sodass im Moment eine Substudie läuft (13).
Stellenwert des Telemonitorings mithilfe aktiver medizinischer Implantate
Spannend und Objekt einer stetigen technischen Weiterentwicklung ist das Feld der Telekardiologie. Mittlerweile haben alle Hersteller aktiver medizinischer Implantate (Herzschrittmacher, Defibrillatoren und kardiale Resynchronisationssysteme) Konzepte und Systeme zum Telemonitoring in den klinischen Alltag gebracht.
Die frühzeitige Erfassung von z.B. asymptomatischen Episoden von Vorhofflimmern ermöglicht die unmittelbare Umsetzung in therapeutische Massnahmen (medikamentöse Frequenz- vs. Rhythmuskontrolle, orale Antikoagulation, Planung einer elektrischen Kardioversion oder Ablation).
Zusammenfassend sind wir klinisch häufig mit dem gemeinsamen Auftreten von Vorhofflimmern und Herzinsuffizienz konfrontiert. Die Therapie zielt auf eine optimale Herzinsuffizienztherapie und wenn immer möglich den Erhalt des Sinusrhythmus ab. Medikamentös steht in dieser Population meist nur Amiodarone zur Verfügung. Es verdichten sich aber die Hinweise dafür, dass gerade herzinsuffiziente Patienten von einer invasiven Therapie im Sinne einer Pulmonalvenenisolation profitieren.
Sollte die Rhythmuskontrolle kein realistisches Therapieziel mehr sein, kann zur, medikamentös häufig schwer zu erzielenden, ventrikulären Frequenzkontrolle die Implantation eines CRT-Schrittmachers oder CRT-ICD mit anschliessender Ablation des AV-Knotens zum Einsatz kommen.
Kardiologie
Universitätsspital Basel
Petersgraben 4
4031 Basel
Antonio.Madaffari@usb.ch
Kardiologie
Universitätsspital Basel
Petersgraben 4
4031 Basel
Die Autoren haben keine Interessenskonflikte in Zusammenhang mit diesem Artikel.
1. Kirchhof P et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS, Eur Heart J 37:2893–2962(2016)
2. Wang TJ et al. Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart Study, Circulation 107:2920–2925(2003)
3. Sanna T et al. Cryptogenic stroke and underlying atrial fibrillation, N Engl J Med 370:2478–2486(2014)
4. Schnabel RB et al. 50 year trends in atrial fibrillation prevalence, incidence, risk factors, and mortality in the Framingham Heart Study: a cohort study, Lancet 386:154–162(2015)
5. Chatterjee NA et al. Modifiable Risk Factors for Incident Heart Failure in Atrial Fibrillation, JACC Heart Fail 5(8):552–560(2017)
6. Roy D et al. Rhythm control versus rate control for atrial fibrillation and heart failure, N Engl J Med 358:2667-2677(2008)
7. Wyse DG et al. A comparison of rate control and rhythm control in patients with atrial fibrillation, N Engl J Med 347:1825-1833(2002)
8. Naccarelli GV et al. Old and new antiarrhythmic drugs for converting and maintaining sinus rhythm in atrial fibrillation: comparative efficacy and results of trials, Am J Cardiol 91:15D-26D(2003)
9. Khan MN et al. Pulmonary-vein isolation for atrial fibrillation in patients with heart failure, N Engl J Med 359:1778-1785(2008)
10. Di Biase L et al. Ablation Versus Amiodarone for Treatment of Persistent Atrial Fibrillation in Patients With Congestive Heart Failure and an Implanted Device: Results From the AATAC Multicenter Randomized Trial, Circulation 133:1637-1644(2016)
11. Marrouche NF et al. Catheter Ablation for Atrial Fibrillation with Heart Failure N Engl J Med 378:417-427(2018)
12. Slotwiner DJ et al. Impact of Physiologic Pacing Versus Right Ventricular Pacing Among Patients With Left Ventricular Ejection Fraction Greater Than 35%: A Systematic Review for the 2018 ACC/AHA/HRS Guideline on the Evaluation and Management of Patients With Bradycardia and Cardiac Conduction Delay J Am Coll Cardiol. 2018 Oct
13. Brignole M et al. A randomized controlled trial of atrioventricular junction ablation and cardiac resynchronization therapy in patients with permanent atrial fibrillation and narrow QRS Eur Heart J. Dec 1;39(45):3999-4008(2018)