In der gynäkologischen Sprechstunde stellen Blasenfunktionsstörungen bei der stetigen Zunahme der Lebenserwartung ein immer häufigeres Krankheitsbild dar. Viele Betroffene berichten aus Schamgefühl erst auf aktives Nachfragen von ihren Symptomen. Dabei ist es äusserst wichtig, das Krankheitsbild frühzeitig zu erkennen, um eine sorgfältige Abklärung und adäquate Behandlung einleiten zu können. Unbehandelt kann dies später zur einer somatischen wie auch psychischen Erkrankung führen und die Patientin in die soziale Isolation treiben (1).
Bei den Blasenfunktionsstörungen muss zwischen einer Störung während der Harnspeicherphase (Kontinenz) bzw. der Harnentleerungsphase (Miktion) unterschieden werden. Im klinischen Alltag kann dies eine Herausforderung darstellen, da beide Störungen nicht selten in unterschiedlicher Ausprägung nebeneinander auftreten können. Während in der Fachliteratur wiederholt und ausführlich auf die Harnspeicherstörungen (Belastungsinkontinenz, OAB, Mischformen) eingegangen wird, möchten wir im vorliegenden Artikel den Fokus auf die Entleerungsstörungen legen. Dieses komplexe, multifaktoriell bedingte Krankheitsbild ist weiterhin nicht ausreichend verstanden (2) und wird in der Häufigkeit deutlich unterschätzt (3).
Epidemiologie
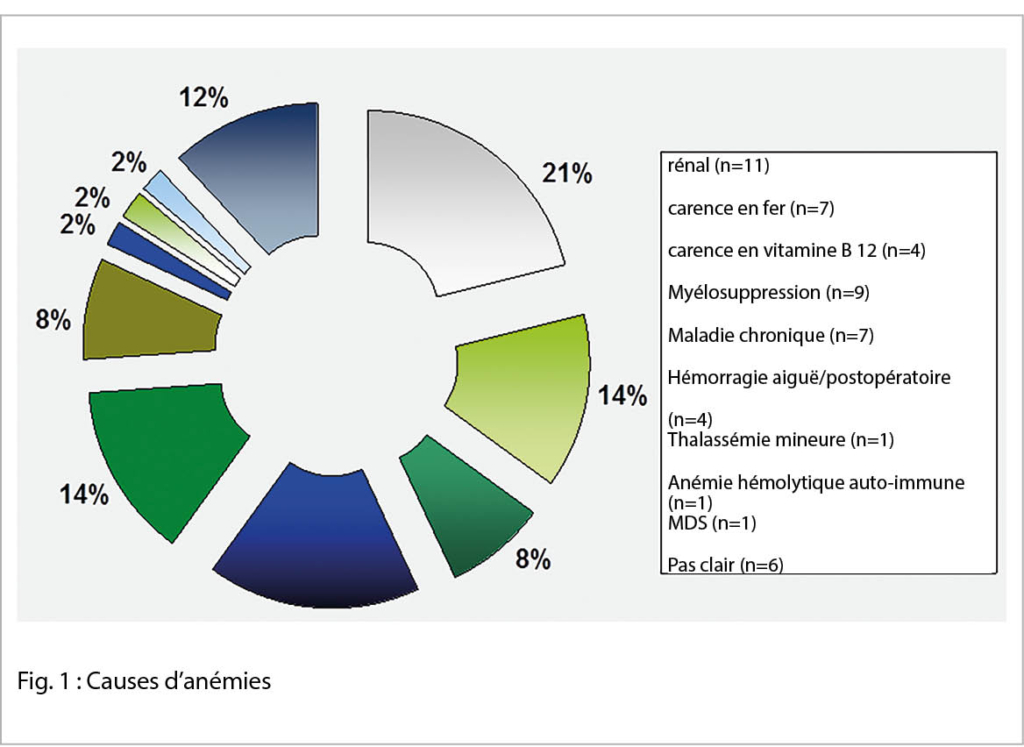
Die Häufigkeit der Blasenentleerungsstörung nimmt mit dem Alter zu, je nach Definition liegt der Anteil bei 14% – 39% und ist somit die vierthäufigste Diagnose in der Urodynamik nach Belastungsinkontinenz, Deszensusproblematik und OAB (3, 4, 5).
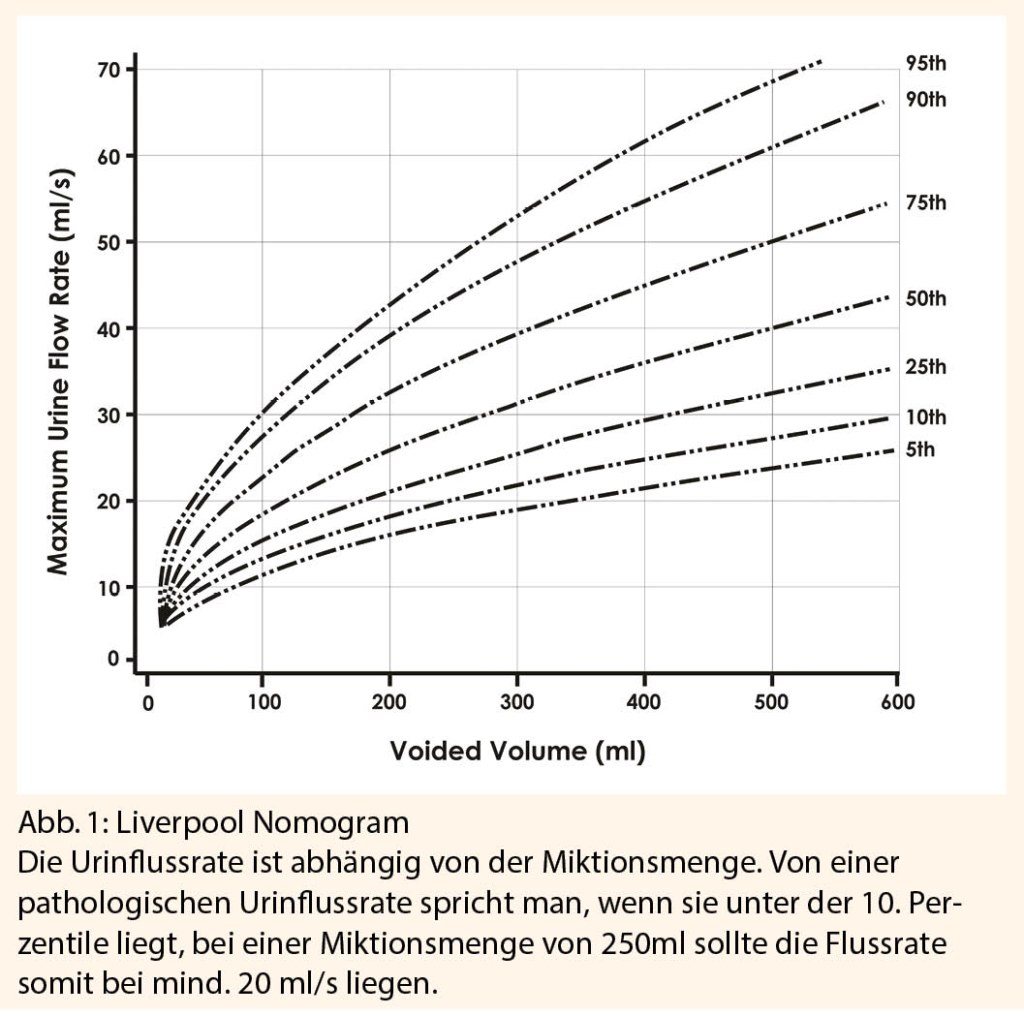
Von einer Blasenentleerungsstörung wird ausgegangen, wenn die Urinflussrate unter der 10. Perzentile gemäss Liverpool Nomogram liegt (Abb. 1) und/oder ein Restharnvolumen von > 50 ml besteht, idealerweise bei mehreren Messungen nachweisbar (6, 7).
Einteilung
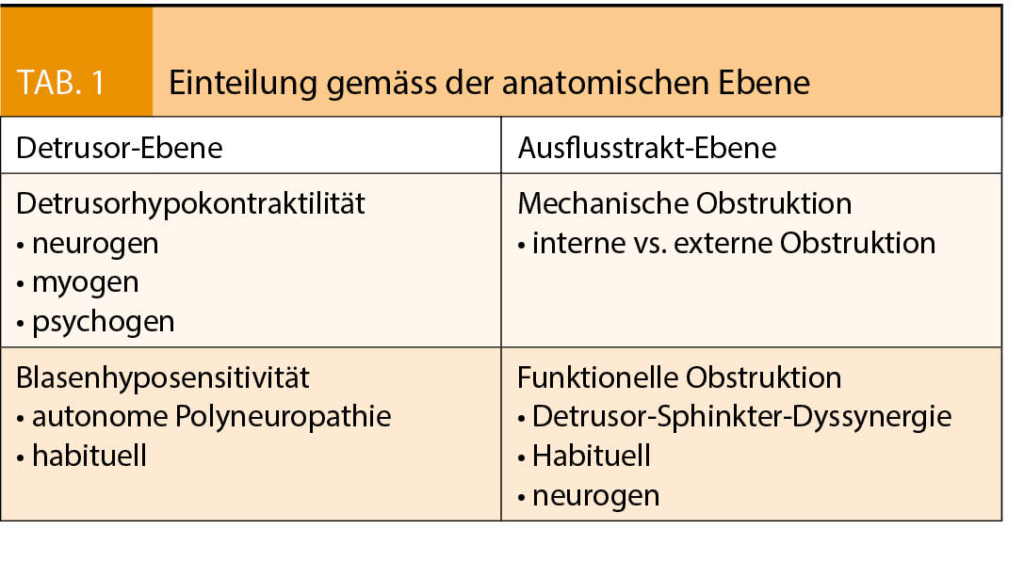
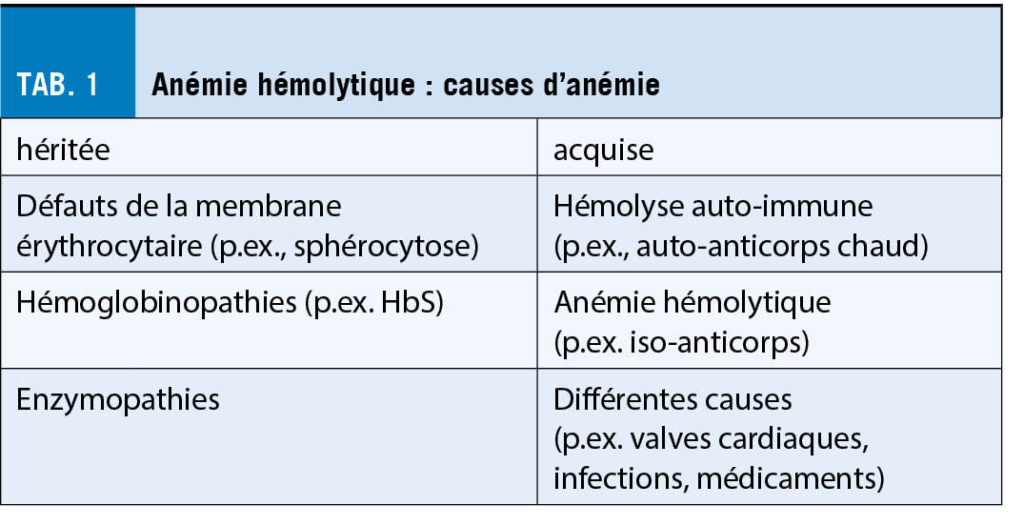
Da der Ablauf einer Blasenentleerung komplex ist und Blasenentleerungsstörungen häufig multifaktoriell bedingt sind, lassen die geäusserten Symptome nur erschwert einen Rückschluss auf die dahinterliegende Pathophysiologie zu. Die Einteilung orientiert sich deshalb am anatomischen Ort des Problems (8). Prinzipiell wird zwischen einer funktionellen Störung auf Ebene des Detrusors und einer funktionellen bzw. mechanisch-obstruktiven Störung auf Ebene des Ausflusstraktes unterschieden (Tab. 1) (9).
A) Störung auf Ebene des Detrusors
Bei einer funktionellen Störung kann pathophysiologisch zwischen einer Detrusorhypokontraktilität und einer Blasenhyposensitivität unterschieden werden (10). Bei einer Detrusorhypokontraktilität kann nur ein geringer Detrusordruck aufgebaut werden, was zu einem reduzierten Uroflow führt mit unvollständiger Blasenentleerung bzw. Restharnbildung.
- Klinik: Schwacher Harnstrahl, Restharngefühl, rezidivierende Harnwegsinfektionen
- Ätiologie: neurogen, myogen, teils auch psychogen
o Polyneuropathie
o Multiple Sklerose
o Erkrankungen des kleinen Beckens
o iatrogen nach Operationen (vor allem nach Hysterektomie und Rektumresektionen)
o postpartal: durch die Belastung des Plexus pelvicus im Rahmen der Schwangerschaft und Geburt, meist komplett regredient nach einer Erholungsphase von 1-4 Wochen (11, 12, 13, 14)
o Bandscheibenprolaps
o medikamentös (Anticholinergika, Antidepressiva, Opioide, Neuroleptika, Muskelrelaxantien, Calciumantagonisten, Parkinsonmedikamente und Adrenergika)
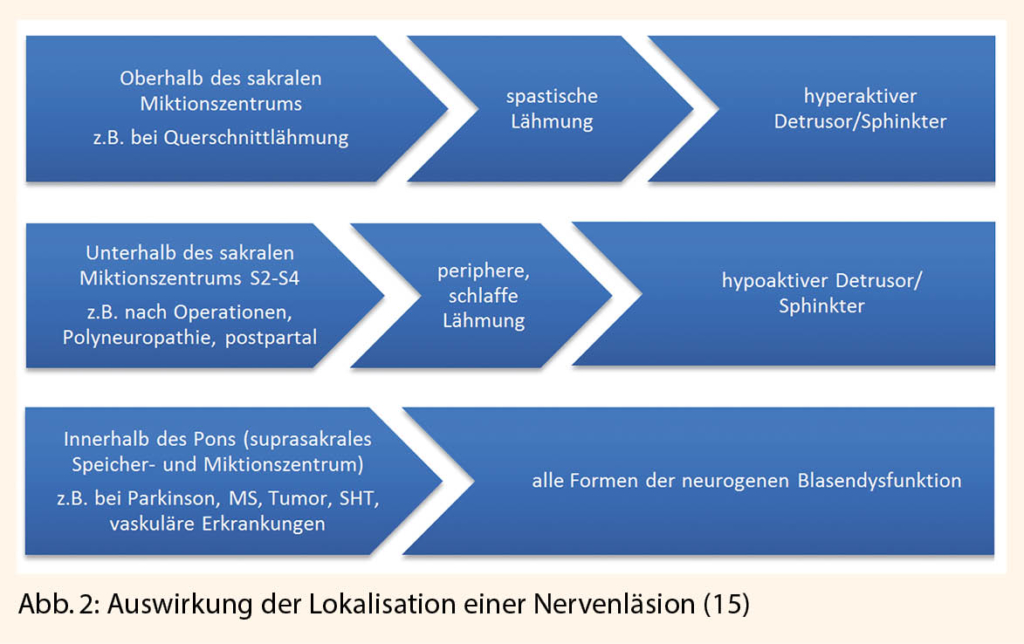
Eine isolierte neurogene Detrusorfunktionsstörung ist selten, wobei dann meist zusätzliche neurologische Ausfälle wie Reithosenanästhesie oder ein fehlender Anal- bzw. Bulbocavernosusreflex bestehen (Abb. 2).
Bei der Blasenhyposensitivität führt der erst spät spürbare Harndrang zu überhöhten Füllungsvolumina mit chronischer Blasenüberdehnung mit sekundärer Detrusorhypokontraktilität und Restharnbildung.
- Klinik: Lange Miktionsintervalle durch verspäteten Harndrang, grosse Miktionsvolumina
- Ätiologie:
o autonome Polyneuropathie (z.B. bei Diabetes mellitus)
o habituell: die anfangs willkürliche, später unwillkürliche Unterdrückung des Harndranggefühls führt zu einer chronischen Überdehnung des Detrusors (Lazy-Bladder-Syndrom)
Auch hier ist eine isolierte Form selten, dies meist bei peripheren Nervenläsionen.
B) Störung auf Ebene des Ausflusstraktes
Auf Ebene des Ausflusstraktes kann eine mechanisch-obstruktive Störung zu einer verlängerten Miktionszeit mit reduziertem Uroflow bei erhöhtem Detrusordruck führen und dadurch ebenfalls zu einer unvollständigen Blasenentleerung bzw. Restharnbildung.
- Klinik: schwacher Harnstrahl, Stakkato-Miktion, Restharngefühl
- Ätiologie:
o Harnröhrenstriktur, Blasenhalssklerose, Meatusstenose
o grosser Karunkel
o Tumor der Harnröhre
o rotatorischer Deszensus (Quetschhahnphänomen)
o Inkontinenzoperationen (TVT, Hypersuspension der Urethra, Kolposuspension) (16)
Bei einer funktionellen Obstruktion ist die Koordination der Sphinkter-/Blasenhals-Relaxation eingeschränkt. Pathophysiologisch kann diese Koordinationsstörung entweder dem glattmuskulären oder quergestreiften Verschlussmechanismus zugeordnet sein (Detrusor-Blasenhals-Dysfunktion bzw. Detrusor-Sphinkter-Dyssynergie).
Eine Detrusor-Sphinkter-Dyssynergie wird auch als Ursache für die häufigste Form, die habituelle Blasenentleerungsstörung gesehen. Dabei führt ein chronischer Entleerungsaufschub von Blase und Darm zu einer chronischen Überdehnung der Muskelfasern des Detrusors und erst sekundär zu einer Detrusorhypo- bzw. -akontraktilität (9).
- Klinik: Startschwierigkeiten, unterbrochener Harnstrahl
- Ätiologie:
o habituell
o neurogen
o (komplette) Querschnittlähmung
o Multisystematrophie
o Multiple Sklerose
o konnatal (z.B. bei Myelomeningozele)
Klinik von Frauen mit Blasenentleerungsstörungen
Die Patientinnen berichten über eine erschwerte, prolongierte Miktion, wodurch die Blasenentleerung häufig unter Einsatz der Bauchpresse erfolgt und zu einer intravesikalen Druckerhöhung führen kann. Dadurch leiden sie an intermittierend bis konstantem Restharngefühl, was zu einer eingeschränkten Blasenkapazität mit nachfolgend erhöhter Miktionsfrequenz (Pollakisurie) führt und letztendlich rezidivierende Harnwegsinfekte begünstigt (Tab. 2).
Eine habituelle Blasenentleerungsstörung ist häufig mit einer chronischen Obstipation kombiniert. Langfristig kann dies zu einer OAB-Symptomatik, interstitiellen Zystitis (IC) bzw. «bladder pain syndrome» BPS) oder chronischen Beckenschmerzen führen. Zudem kann sich ein vesikoureteraler Reflux mit konsekutiver Hydronephrose ausbilden und in schweren Fällen zu einer Nierenschädigung führen (17).
Diagnostik
Bis zum heutigen Zeitpunkt existieren keine klaren, universellen Diagnosekriterien. Die subjektiv wahrgenommenen Blasensymptome korrelieren nicht eindeutig mit der Diagnose (18). Bei unmittelbar postpartal bzw. postoperativ bedingten Blasenentleerungsstörungen sollte man mit weitreichenden dia-
gnostischen und invasiv therapeutischen Massnahmen zurückhaltend sein.
Mittels Basisdiagnostik können einfache Ursachen schnell erkannt und gelöst, komplexe Störungen erkannt und einer Abklärungsstrategie zugeführt werden. Zur Erfassung der Beschwerden ist neben der Anamnese das Blasentagebuch bzw. Miktionsprotokoll äusserst hilfreich, da die Symptome damit auf einfache Art und Weise quantifiziert werden können. Die gynäkologische Untersuchung gehört zur Basisdia-
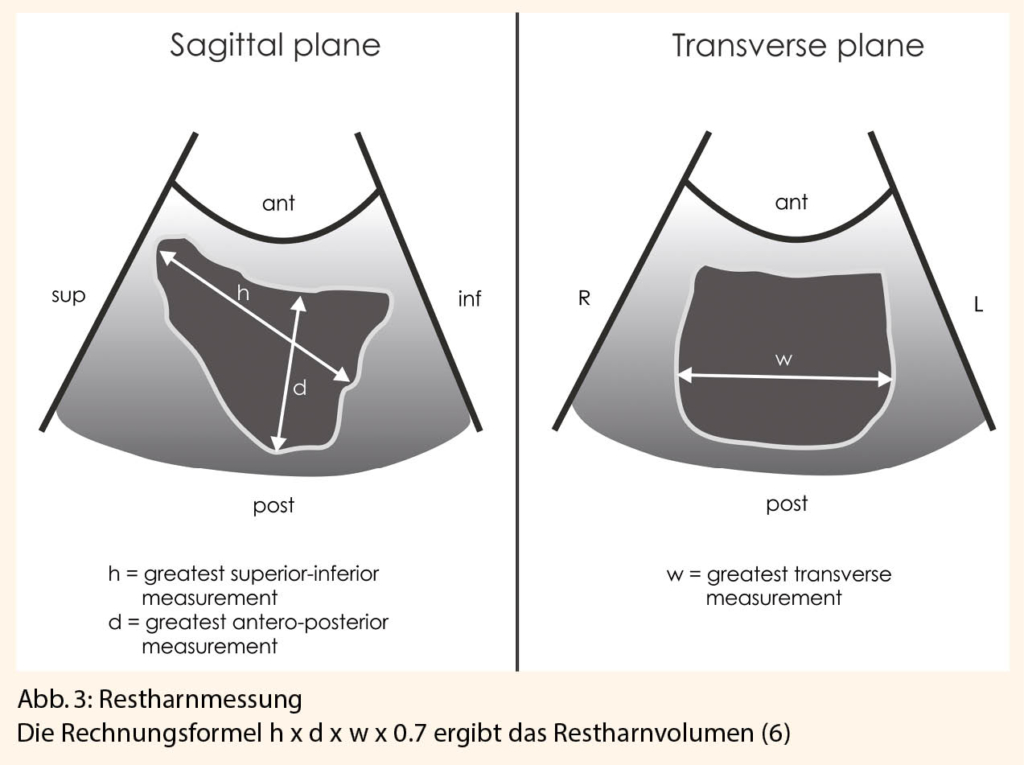
gnostik. Ziele sind: Diagnose eines möglichen Deszensus, einer Stenose, einer Karunkel des Meatus externus urethrae, vaginale Atrophie, des Weiteren eine Urinuntersuchung zum Ausschluss eines Infektes sowie eine sonographische Restharnmessung (Abb. 3) und eine Nierensonographie.
Die sonographische Detrusordickenmessung zum Nachweis einer durch eine subvesikale Obstruktion bedingte Detrusorüberaktivität konnte sich wegen ungenügender Aussagekraft nicht durchsetzen.
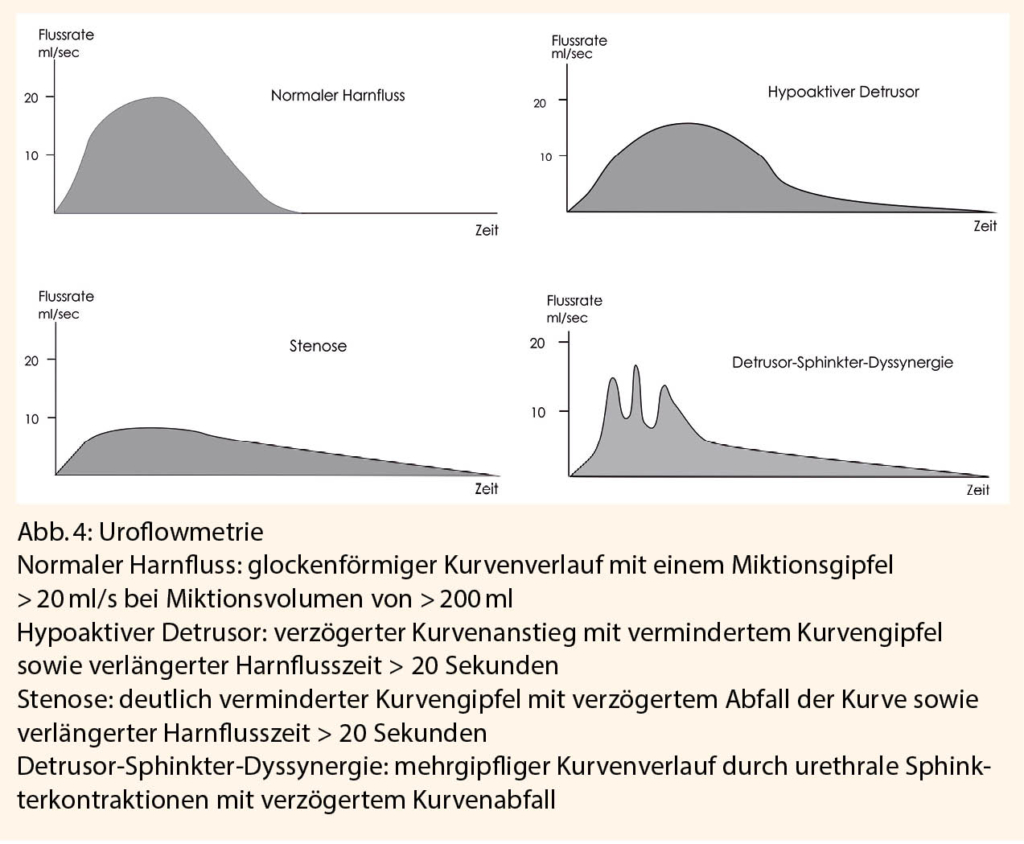
Eine weiterführende Diagnostik beinhaltet eine Uroflowmetrie (Abb. 4) (mit optional einer Beckenboden-EMG) zur Unterscheidung einer funktionellen bzw. einer mechanischen Obstruktion, eine Harnröhrenkalibrierung (bei Verdacht auf eine mechanische Obstruktion, normal > 22 Ch), eine Urethro-Zysto-skopie sowie eine urodynamische Untersuchung mit Videozystourethrographie (19).
Therapie
Die verschiedenen Behandlungsmöglichkeiten sollten gemäss der dahinterliegenden Pathophysiologie gewählt werden, müssen aber immer auch den individuellen Bedürfnissen der Patientinnen angepasst werden. Bei vielen Formen kann nicht von einer kompletten Remission der Beschwerden ausgegangen werden, weshalb das Ziel die Sicherstellung einer suffizienten Blasendrainage ist, um Langzeitfolgen zu minimieren.
Bei einer funktionellen Störung soll die Patientin in der physiotherapeutischen Urotherapie (entspannte Miktionshaltung ohne Aktivierung der Bauchpresse, regelmässige Blasenentleerung alle 2.5 bis 3 Stunden) unterrichtet werden (9). Durch ein Miktionstraining mit Biofeedback kann eine koordinierte Miktion mit optimal relaxiertem Beckenboden wiedererlernt werden. Ein Double-/Triple-Voiding kann durch eine Wiederholung der Miktion nach 15 Min. bzw. 30 Min. eine adäquate Blasenentleerung und somit Senkung des Restharns ermöglichen (9).
Bei rezidivierenden Harnwegsinfekten sollte möglichst auf eine antibiotische Therapie aufgrund zunehmender Antibiotikaresistenz wie auch der vermuteten negativen Auswirkung auf das vesikale Mikrobiom verzichtet werden. Zu bevorzugen sind alternative Behandlungsmethoden (NSAR (20, 21)), D-Mannose (22), Immunprophylaxe mit Urovaxom® (23) oder StroVac®, Phytotherapeutika (wie z.B. Angocin® (24, 25)) (26). Die therapeutische Beeinflussung des vesikalen Mikrobioms ist in Erforschung und wird in den nächsten Jahren hoffentlich vertiefte diagnostische und therapeutische Erkenntnisse bringen.
Bei persistierendem Restharn (> 100 ml) trotz den adäquat durchgeführten, oben genannten Therapiemassnahmen kann zur Beurteilung der Detrusorkontraktilität ein Eiswassertest (NaCl 0.9% bei 4°C) durchgeführt werden (9). Bei Hypokontraktilität bzw. Akontraktilität sollte die Patientin alle 6 Stunden eine Selbstkatheterisierung durchführen. Ansonsten ist das Intervall des Selbstkatheterismus abhängig vom subjektiven Restharngefühl nach erfolgter Spontanmiktion und kann ein- bis mehrmals am Tag erfolgen. Eine chronische Blasenüberdehnung sollte vermieden werden, da dies zu einer Denervierung der Harnblase mit nachfolgend Detrusoratonie und weiteren Funktionsstörungen der Blase führen kann (27).
Eine medikamentöse Therapie mit einem Cholinergikum (z.B. Distigminbromid, Betanechol) kann zu einer Tonisierung eines hypokontraktilen Detrusors führen. Eine weitere medikamentöse Therapiemöglichkeit besteht bei einer Detrusor-Sphinkter-Dyssynergie mittels selektivem alpha-Blocker (z.B. Tamsulosin – off-label) (28), in Kombination mit einem Antispastikum (Butylscopolamin, Baclofen, Tizanidinhydrochlorid). Damit kann eine Tonusverminderung der quergestreiften Sphinkter-Muskulatur erreicht und die Wirkung verbessert werden.
Als Zweitlinientherapie spielen neuromodulative Therapieansätze wie eine intravesikale Elektrostimulation (IVES) nach Katona (15, 29), eine transkutane elektrische bzw. perkutane tibiale Nervenstimulation (TENS/PTNS) (30) sowie eine sakrale Neuromodulation (SNM) (31, 32) eine immer bedeutendere Rolle, wobei der Wirkmechanismus weiterhin nicht vollständig geklärt ist. Die Neuromodulation bringt im Vergleich zu anderen Therapieverfahren den grossen Vorteil mit sich, dass damit auch Darmfunktionsstörungen therapeutisch angegangen werden können. Dies ist insbesondere bei der habituellen Blasenentleerungsstörung sowie bei neurologischen Patienten, die oft an kombinierten Funktionsstörungen leiden, von grossem Nutzen (33). Zudem kann mit der Neuromodulation auch in aussichtslosen Situationen oft eine erstaunliche Wirkung erzielt werden. Es ist mit einer relevanten Weiterentwicklung dieser Therapieverfahren zu rechnen (34), wobei bereits vielversprechende Daten hinsichtlich pudendaler Neuromodulation (35, 36), kaudaler epiduraler Neuromodulation (37) und tiefer Hirnstimulation (38, 39, 40, 41) vorliegen.
Bezüglich der Magnetfeldtherapie liegen weiterhin keine ausreichenden wissenschaftlichen Daten vor. Ein weiterer Therapieansatz mittels extrakorporaler Stosswellentherapie der Blase ist in Erforschung und zeigte bisher am Tiermodell eine verbesserte Muskelkontraktilität des Detrusors mit zudem einer Regenerierung der Blaseninnervation (42). Jedoch sind weitere prospektive Studien notwendig, um das Management von therapierefraktären Harnblasenfunktionsstörungen zu optimieren.
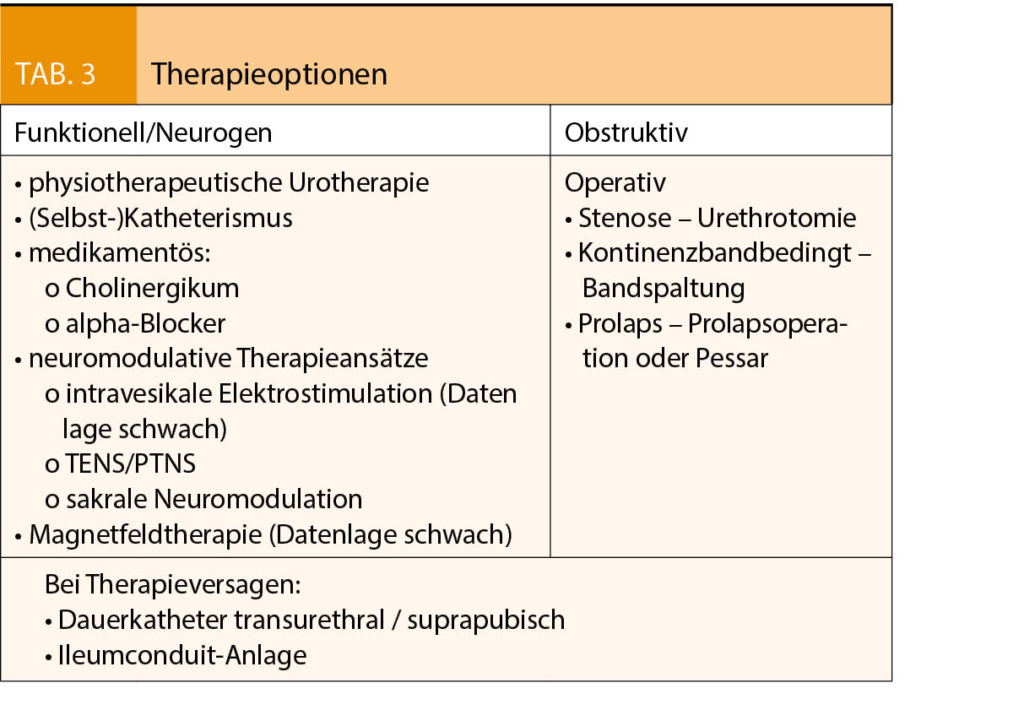
Bei einer obstruktiven Störung stehen die operativen Behandlungsmöglichkeiten im Vordergrund. Bei einer mechanischen infravesikalen Obstruktion ist eine operative Sanierung zwingend (je nach Ursache eine Meatotomie, externe Urethrotomie, Urethrotomie nach Otis oder Blasenhalsinzision). Eine Überkorrektur durch eine suburethrale Schlingeneinlage kann mittels einer Bandspaltung behoben werden (43), während bei einem Deszensus mit Abknicken der Harnröhre neben einer chirurgischen Deszensusbehandlung auch eine Pessar-Anwendung bei korrekter Lage gute Ergebnisse zeigen kann.
Bei Therapieversagen stehen mechanische Hilfsmittel mittels ableitender Systeme zur Verfügung wie Dauerkatheter transurethral/suprapubisch (44), oder als ultima ratio eine Ileumconduit-Anlage (Tab. 3) (15).
Schlussbemerkung
Blasenentleerungsstörungen können ein weites ätiologisches Spektrum von einfachen bis komplexen, multifaktoriell bedingten Krankheitsbildern haben. Sie werden häufig unterschätzt und meist erst verzögert diagnostiziert. Die einfach durchzuführende Basisdiagnostik kann Hinweise für die Ursache der Blasenentleerungsstörung liefern, woraus sich erste Therapieschritte ergeben (physiotherapeutische Urotherapie, Selbstkatheterismus). Postpartale Entleerungsstörungen sind meist innerhalb von wenigen Tagen komplett regredient und benötigen nur selten eine tiefergehende Abklärung. Bei komplexen Beschwerdebildern ist die Zuweisung an ein Beckenbodenzentrum sinnvoll. Diese Patientinnen benötigen nach komplexer interdisziplinärer Diagnostik meist auch eine langfristige spezialärztliche Betreuung.
Oberärztin Gynäkologie / Geburtshilfe
Frauenklinik
Kantonsspital Aarau
5001 Aarau
Christina.Prevost@ksa.ch
Aarau
gabriel.schaer@usz.ch
Die Autoren haben keine Interessenskonflikte in Zusammenhang mit diesem Artikel.
1. Joelsson-Alm E, Micturition Problems After bladder distension during Hospitalization in Sweden. Nurs Res. 2014;63:418–425
2. Panicker JN, Do we understand voiding dysfunction in women? Current understanding and future perspectives: ICI-RS 2017, Neurourol Urodyn. 2018 Jun;37(S4):75-85
3. Haylen BT, Has the true prevalence of voiding difficulty in urogynecology patients been underestimated? Int Urogynecol J Pelvic Floor Dysfunct. 2007 Jan;18(1):53-6
4. Abdel Raheem A, Voiding dysfunction in women: How to manage it correctly, Arab J Urol. 2013 Dec; 11(4): 319–330
5. Haylen BT, de Ridder D, Freeman RM, Swift SE, Berghmans B, Lee J, Monga A, Petri E, Rizk DE, Sand PK, Schaer GN, An International Urogynecological Association (IUGA)/International Continence Society (ICS) joint report on the terminology for female pelvic floor dysfunction, Int Urogynecol J (2010) 21:5–26
6. Haylen BT, Maher CF, Barber MD, Camargo S, Dandolu V, Digesu A, Goldman HB, Huser M, Milani AL, Moran PA, Schaer GN, Withagen MI, An International Urogynecological Association (IUGA) / International Continence Society (ICS) joint report on the terminology for female pelvic organ prolapse (POP), Int Urogynecol J. 2016 Apr;27(4):655-84
7. Haylen BT, Urine flow rates and residual urine volumes in urogynecology patients, Int Urogynecol J Pelvic Floor Dysfunct. 1999;10(6):378-83
8. Hill Wg, Control of urinary drainage and voiding. Clinical Journal of the American Society of nephrology 2015 10:480–492
9. Tunn R, Hanzal E, Perucchini D, Urogynäkologie in Praxis und Klinik. DeGruyter (Berlin-Heidelberg-New York) 2. Auflage, 2009
10. Leitlinien Blasenfunktionsstörungen, Klingler HC et al, Journal für Urologie und Urogynäkologie 2007; 14 (Sonderheft 5), 4-27
11. Groutz A, Protracted postpartum urinary retention: the importance of early diagnosis and timely intervention. Neurourol. Urodyn. 2011; 30(1):83
12. Glavind K, Incidence and treatment of urinary retention postpartum, Int Urogynecol J Pelvic Floor Dysfunct. 2003 Jun;14(2):119-21
13. Yip SK, Urinary retention in the post-partum period. The relationship between obstetric factors and the post-partum post-void residual bladder volume. Acta Obstet. Gynecol. Scand. 1997; 76(7):667
14. Yip SK, Sahota D, Chang AM, Chung TK. Four-year follow-up of women who were diagnosed to have postpartum urinary retention. Am J Obstet Gynecol. 2002;187:648–52
15. Leitlinien für Diagnostik und Therapie in der Neurologie, Diagnostik und Therapie von neurogenen Blasenstörungen, 2015, AWMF-Registernummer: 030/121
16. Dropkin BM, Kowalik CG, Jaunarena JH, Delpe SD, Reynolds WS, Dmochowski RR, Kaufman MR, Proximal location of explanted midurethral slings is associated with urinary storage symptoms, Neurourol Urodyn. 2019 May 6. doi: 10.1002/nau.24022
17. Zeidel ML, Obstructive uropathy. In: Goldman’s Cecil Medicine, edited by Goldman L, Schafer AI, editors, 24th Ed., Philadelphia, Elsevier, 2011;776–780
18. Kuo HC. Clinical symptoms are not reliable in the diagnosis of lower urinary tract dysfunction in women. J Formos Med Assoc. 2012;111:386–391
19. Nitti VW, Pressure flow urodynamic studies: the gold standard for diagnosing bladder outlet obstruction. Rev Urol. 2005;7(Suppl 6):S14–S21
20. Bleidorn J, Gágyor I, Kochen MM, Wegscheider K, Hummers-Pradier E, Symptomatic treatment (ibuprofen) or antibiotics (ciprofloxacin) for uncomplicated urinary tract infection?-results of a randomized controlled pilot trial. BMC Med. 2010;26;8:30
21. Falagas ME, Kotsantis IK, Vouloumanou EK, Rafailidis PI, Antibiotics versus placebo in the treatment of women with uncomplicated cystitis: a meta-analysis of randomized controlled trials. J Infect. 2009;58(2):91-102
22. Kranjčec B, Papeš D, Altarac S, D-mannose powder for prophylaxis of recurrent urinary tract infections in women: a randomized clinical trial, World J Urol. 2014 Feb;32(1):79-84
23. Beerepoot MA, „Nonantibiotic Prophylaxis for Recurrent Urinary Tract Infections, A Systematic Review and Meta-Analysis of Randomized Controlled Trials.“ J Urol. 2013;190(6):1981-9
24. Lau I, Albrecht U, Kirschner-Hermanns R, Phytotherapy in catheter-associated urinary tract infection : Observational study recording the efficacy and safety of a fixed herbal combination containing Tropaeoli majoris herba and Armoraciae rusticanae radix, Urologe A. 2018 Dec;57(12):1472-1480
25. Marcon J, Schubert S, Stief CG, Magistro G, In vitro efficacy of phytotherapeutics suggested for prevention and therapy of urinary tract infections, Infection. 2019 May 8. doi: 10.1007/s15010-019-01315-4
26. Grabe M, Bartoletti R, Bjerklund Johansen TE, Cai T, Çek M, Köves B, Naber KG, Pickard RS, Tenke P, Wagenlehner F, Wullt B. Guidelines on Urological Infections. EAU, Guidelines (2015). http://uroweb.org/wp-content/uploads/19-Urological- infections_LR2.pdf
27. Madersbacher H, Cardozo L, Chapple C, Abrams P, Toozs-Hobson P, Young JS, Wyndaele JJ, De Wachter S, Campeau L, Gajewski JB, What are the causes and consequences of bladder overdistension? ICI-RS 2011, Neurourol Urodyn. 2012 Mar;31(3):317-21
28. Kim DK, Alpha-1 Adrenergic Receptor Blockers for the Treatment of Lower Urinary Tract Symptoms in Women: A Systematic Review and Meta-Analysis, Int Neurourol J. 2019 Mar;23(1):56-68
29. Primus G, Kramer G, Pummer K, Restoration of micturition in patients with acontractile and hypocontractile detrusor by transurethral electrical bladder stimulation, Neurourol Urodyn. 1996;15(5):489-97
30. Gaziev G, Topazio L, Iacovelli V, Asimakopoulos A, Di Santo A, De Nunzio C, Finazzi-Agro E (2013) Percutaneous Tibial Nerve Stimulation (PTNS) efficacy in the treatment of lower urinary tract dysfunctions: a systematic review. BMCUrol 13:61
31. Jonas U., Fowler C.J., Chancellor M.B. Efficacy of sacral nerve stimulation for urinary retention: results 18 months after implantation. J Urol. 2001;165:15–19
32. Medical Advisory Secretariat Sacral nerve stimulation for urinary urge incontinence, urgency-frequency, urinary retention, and fecal incontinence: an evidence-based analysis. Ont Health Technol Assess Ser. 2005;5:1–64
33. Panicker JN, Fowler CJ, Kessler TM (2015) Lower urinary tract dysfunction in the neurological patient: clinical assessment and management. LancetNeurol 14:720–732
34. Kessler TM, Neuromodulation of lower urinary tract dysfunction, Urologe A. 2017 Dec;56(12):1591-1596
35. Spinelli M, Malaguti S, Giardiello G, Lazzeri M, Tarantola J, Van Den Hombergh U (2005) A new minimally invasive procedure for pudendal nerve stimulation to treat neurogenic bladder: description of the method and preliminary data.NeurourolUrodyn24:305–309
36. Balog BM, Electrical stimulation for neuroregeneration in urology: a new therapeutic paradigm, Curr Opin Urol. 2019 Jul;29(4):458-465
37. Maher MG, Mourtzinos A, Zabihi N, Laiwalla UZ, Raz S,Rodriguez LV(2007)Bilateral caudalepidural neuromodulation for refractory urinary retention: a salvage procedure. J Urol 177:2237–2240
38. Finazzi-Agro E, Peppe A, D’ Amico A, Petta F, Mazzone P, Stanzione P, Micali F, Caltagirone C (2003) Effects of subthalamic nucleus stimulation on urodynamic findings in patients with Parkinson’ s disease. JUrol169:1388–1391
39. Kessler TM, Burkhard FC, Z’ Brun S, Stibal A, Studer UE, Hess CW, Kaelin-Lang A (2008) Effect of thalamic deep brain stimulation on lower urinary tract function. EurUrol53:607–612
40. Mordasini L, KesslerTM, KissB, SchupbachM,Pollo C,Kaelin-LangA(2014)Bladderfunctioninpatients with dystonia undergoing deep brain stimulation. ParkinsonismRelatDisord20:1015–1017
41 Yani MS, Fenske SJ, Rodriguez LV, Kutch JJ, Motor cortical neuromodulation of pelvic floor muscle tone: Potential implications for the treatment of urologic conditions, Neurourol Urodyn. 2019 May 1. doi: 10.1002/nau.24014
42. Wang HS, Oh BS, Wang B, Ruan Y, Zhou J, Banie L, Lee YC, Tamaddon A, Zhou T, Wang G, Lin G, Lue TF, Low-intensity extracorporeal shockwave therapy ameliorates diabetic underactive bladder in streptozotocin-induced diabetic rats, BJU Int. 2018 Sep;122(3):490-500
43. Nguyen JK, Diagnosis and treatment of voiding dysfunction caused by urethral obstruction after anti-incontinence surgery, Obstet Gynecol Surv. 2002 Jul;57(7):468-75
44. Tambyah PA & Oon J. Catheter-associated urinary tract infection. Current opinion in infectious diseases 2012;25:365–370