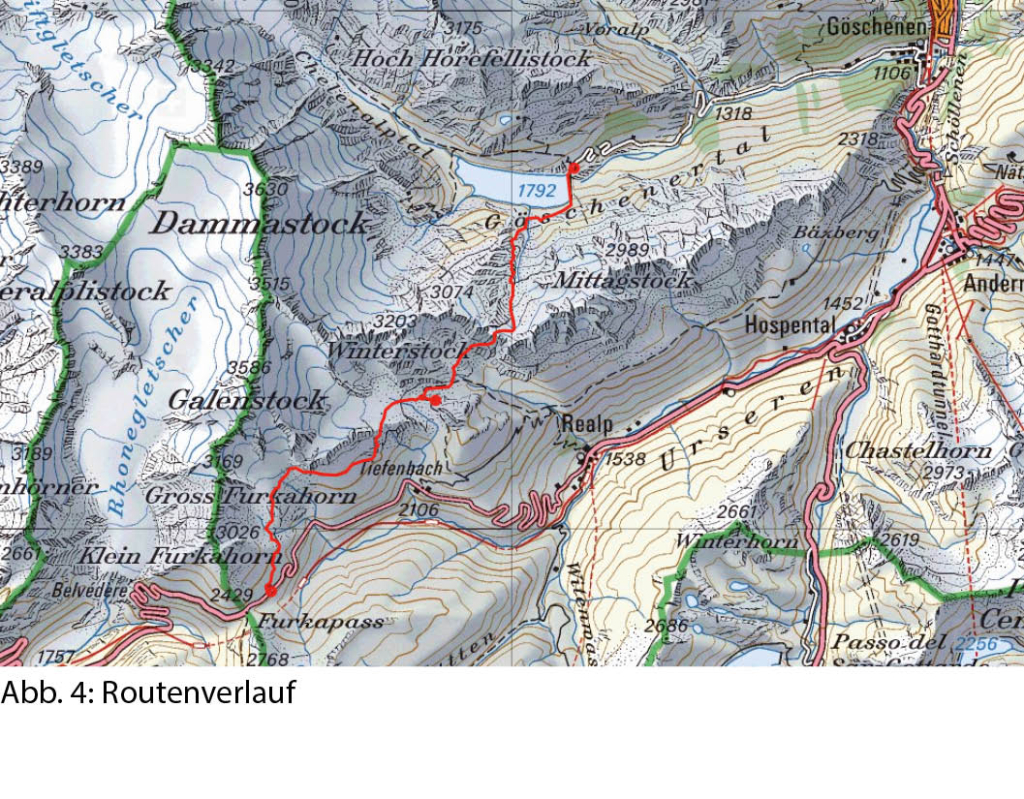
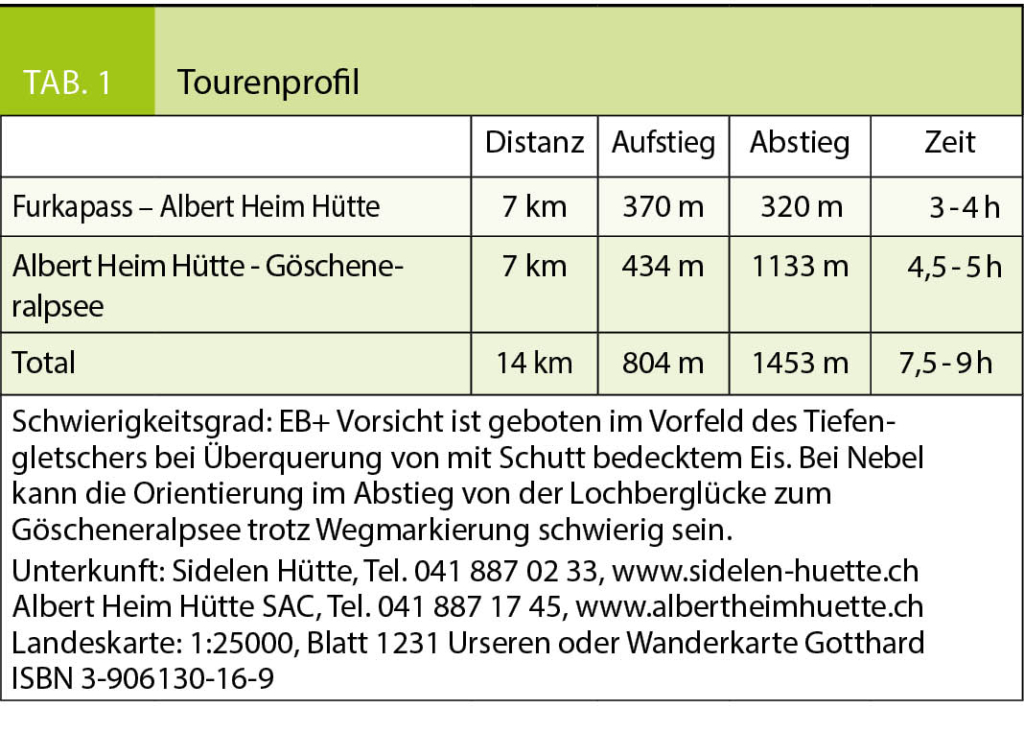
Der Nepali Highway hoch über dem Urseren Tal ist ein Höhenweg der Superlative und findet für gut trainierte, trittsichere Berggänger seinen logischen Höhepunkt und Abschluss durch die Überschreitung der Lochberglücke ins Göschener Tal. Diese weiss-blau-weiss markierten Bergwege können in einem oder zwei Tagen mit Übernachtung in der Albert Heim Hütte begangen werden.
Nomen est omen – ein Weg wie im Himalaya
Wer den ersten Postautokurs von Andermatt zum Furkapass erwischt, der kann bereits um neun Uhr losmarschieren und hat so den ganzen Tag noch vor sich. Das erste Wegstück des Nepali Highways beginnt bei den Militärbaracken auf Galenbödmen kurz vor der Furka-Passhöhe und führt gemächlich ansteigend, noch weiss-rot-weiss markiert, zur Sidelen Hütte (Übernachtungsmöglichkeit). Diese liegt in aussichtsreicher Position über einem kleinen See am Rande des Sidelengletschers. Hinter der Hütte erheben sich die Felswände des Gross Furka-, Sidelen- und Gross Bielenhorns sowie des Galenstocks. Gegen Südwesten schweift der Blick bis zum Blinnenhorn im Oberwallis.


Bei der Sidelen Hütte beginnt der weiss-blau-weiss markierte Bergweg und folgt nach einem kurzen Abstieg mit einer kurzen, Seil gesicherten Passage dem Wandfuss des Chli Bielenhorns. Der Weg ist schmal, aber sehr gut begehbar. Der Blick ins Urseren Tal und auf die Tessiner Alpen ist atemberaubend. Die Landschaft ändert sich grundlegend, sobald man die Zunge des Tiefengletschers erreicht hat. Es öffnet sich ein grosser Gletscherkessel mit Blick auf Galen- und Tiefenstock sowie Gletscherhorn und Winterstock. Die Wegmarkierungen führen um die Gletscherzunge herum zur Albert Heim Hütte, die, von weitem sichtbar, erhöht auf einem Felsbuckel liegt. Nun gilt es zu entscheiden, ob Kräfte und Zeit ausreichen, um am selben Tag auch die Lochberglücke zu bewältigen. So oder so lohnt es sich, an dieser Stelle eine längere Pause einzulegen und die prächtige Aussicht zu geniessen.

Auf der Himmelsleiter
Den Einstieg zur Lochberglücke erreicht man über einen Weg, der durch das von Geröllhalden durchsetzte Tälchen nördlich der Albert Heim Hütte zum Urschner Höhenweg hinunterführt. Nach etwas mehr als einem halben Kilometer und einem Abstieg von rund 100 Höhenmetern zweigt der erneut weiss-blau-weiss markierte Bergweg in nördlicher Richtung ab. Vorerst geht es etwas stotzig hinauf bis Saas, einer kleinen Ebene mit See, wo man nochmals kurz Atem holen kann, bevor der eigentliche Steilanstieg zur Lochberglücke beginnt. Die Landschaft wird immer alpiner, die Bergwiesen bleiben zurück und der Weg schlängelt sich durch steile Blockfelder aus bunt gekörntem Aaregranit. Der Blick öffnet sich weiter und weiter gegen Süden, während in der unmittelbaren Umgebung die Felstürme des Winterstocks, des Lochbergs und des Blauberg Stocks die Szenerie beherrschen. Man scheint wie eine Bergdohle in der Luft zu schweben, immer höher über der nur noch ganz klein erscheinenden Albert Heim Hütte.

Weiss-blau-weisser Orientierungslauf
Von der hochalpinen Stimmung auf der Lochberglücke nimmt man nur schwer Abschied. Selbst im Herbst kann man hier wunderbar ruhen und sonnen. Das Wetter sollte dabei allerdings nicht ausser Acht gelassen werden. Sehr rasch kann Nebel aufziehen, der die Orientierung auf dem Abstieg über die riesigen Blockfelder bis zum Älpergensee schwierig machen kann. Eine Route ist zwar markiert, stellenweise allerdings spärlich und nicht immer Sinn gebend. Bei Altschnee ist Vorsicht vor einstürzenden Schneebrücken geboten.
Der Älpergensee lädt nach dem Orientierungslauf durch die Geröllfelder zu einem erfrischenden Bad ein. Dabei kann man die wunderbare Aussicht auf Loch- und Blauberg sowie Hinter und Vorder Feldschijen geniessen. Der weitere Abstieg über die Älpergenplatten führt durch eine eindrückliche glaziale Erosionslandschaft. Dabei schlängelt sich der Weg steil über ehemals vom Blauberg Gletscher glatt geschliffene Felsstufen zum Göscheneralpsee hinunter, wo man den Weg zur Damma Hütte erreicht. Auf dem letzten kurzen Wegabschnitt bis zur Staumauer öffnet sich der Blick auf Dammastock und die Bergkette des Chelenalptals. Auf der Terrasse des Bergrestaurants ist leider die lärmige Betriebsamkeit des Alltags wieder erreicht, aber der Blick zurück beschwört nochmals die gewaltige Stille des «Highways to heaven».
Aufgepasst
In dieser Rubrik werden Berg- und Schneeschuhwanderungen vorgestellt, die in der Regel wenig bekannt sind, zu aussergewöhnlichen Orten führen und die Genugtuung einer besonderen persönlichen Leistung bieten, sei es, dass man sich am Abend nach der Arbeit noch zu einer kleinen körperlichen Anstrengung überwindet, bzw. sich in ein oder zwei Tagen abseits breit getretener Wege unvergessliche Naturerlebnisse erschliesst. Zur besseren Beurteilbarkeit des Schwierigkeitsgrades der Tourenvorschläge wird jeweils eine Einschätzung anhand der SAC-Skala für Berg- (B, EB, BG) und für Schneeschuhwanderungen (WT 1–6) gegeben. Die schwierigste Wegstelle, unabhängig von ihrer Länge, bestimmt jeweils die Gesamtbewertung der Route. Letztendlich bleibt aber jeder selbst für die Beurteilung seiner Fähigkeiten und Eignung für die vorgestellte Wanderung verantwortlich. Die Gehzeiten sind Richtwerte und gelten für normal trainierte Wanderer. Sie müssen nicht zwingend mit den Angaben auf Wegweisern übereinstimmen.
Riedstrasse 9
6430 Schwyz
christian.besimo@bluewin.ch