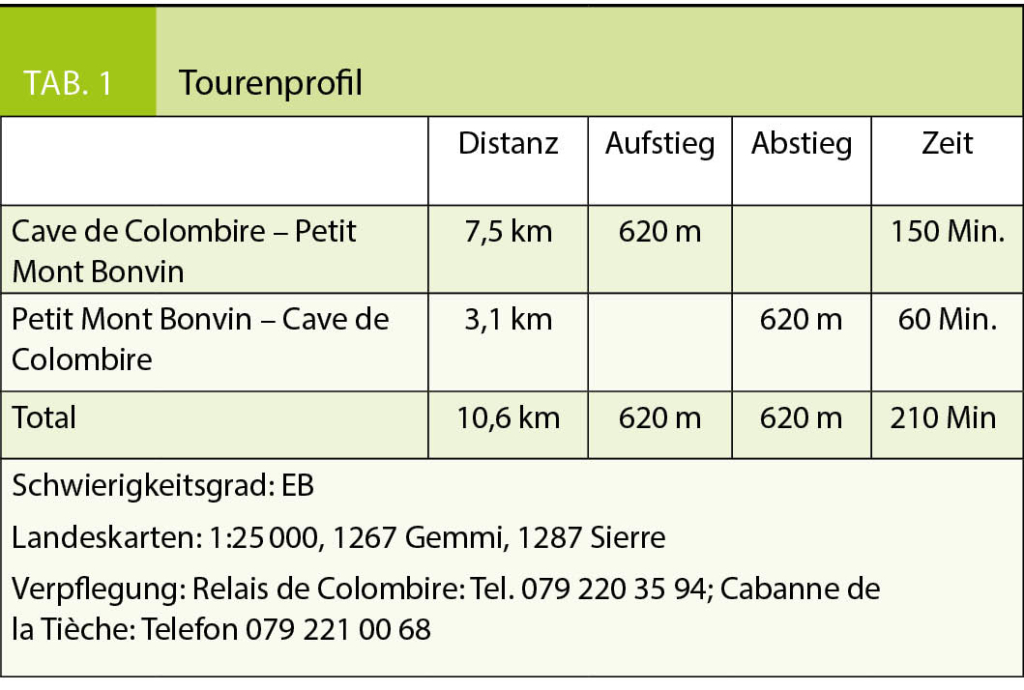
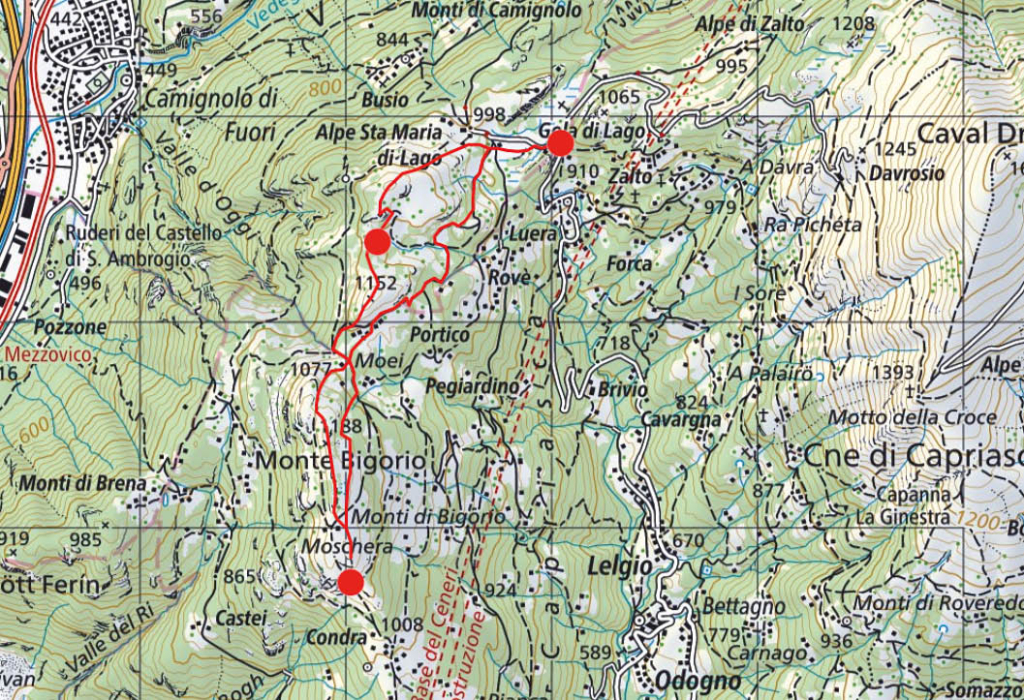
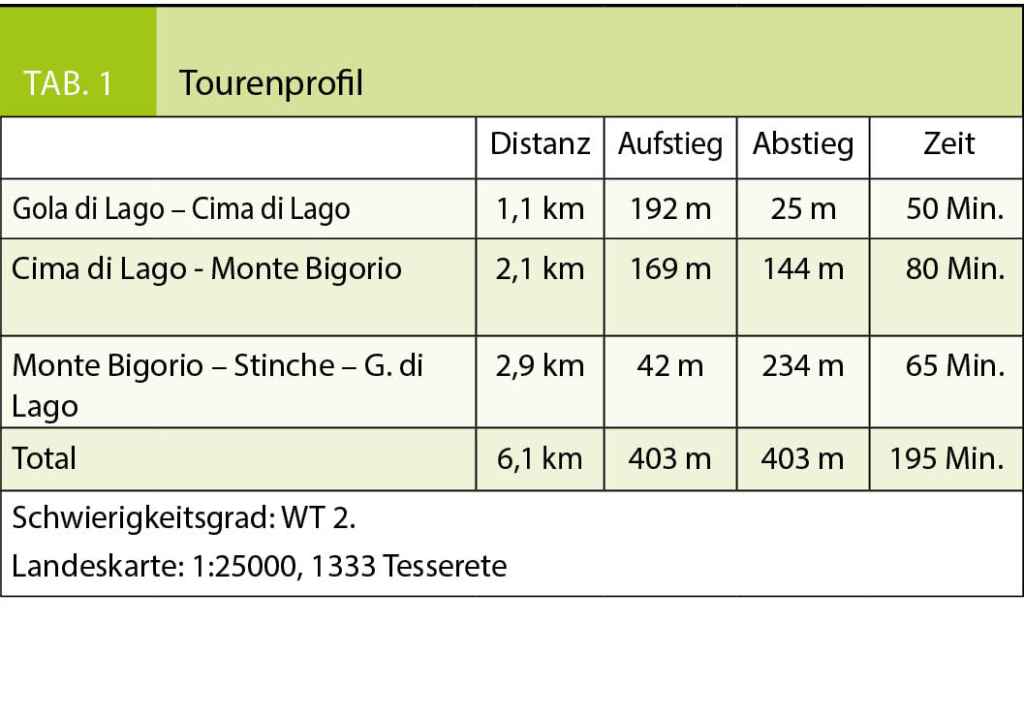
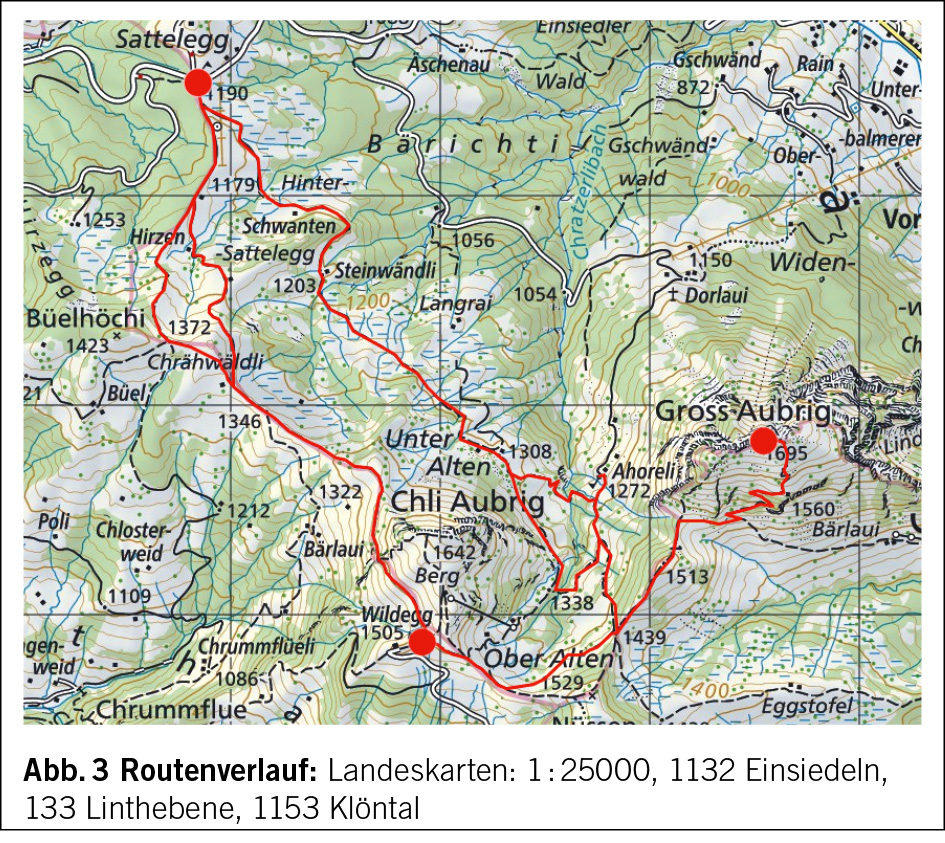
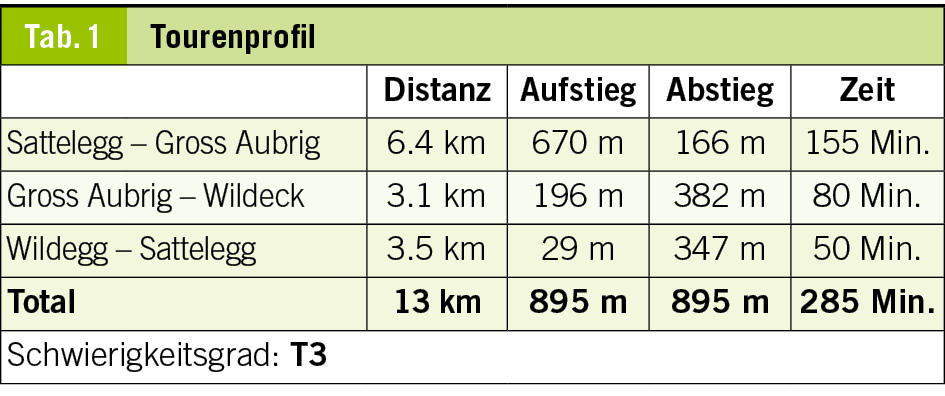
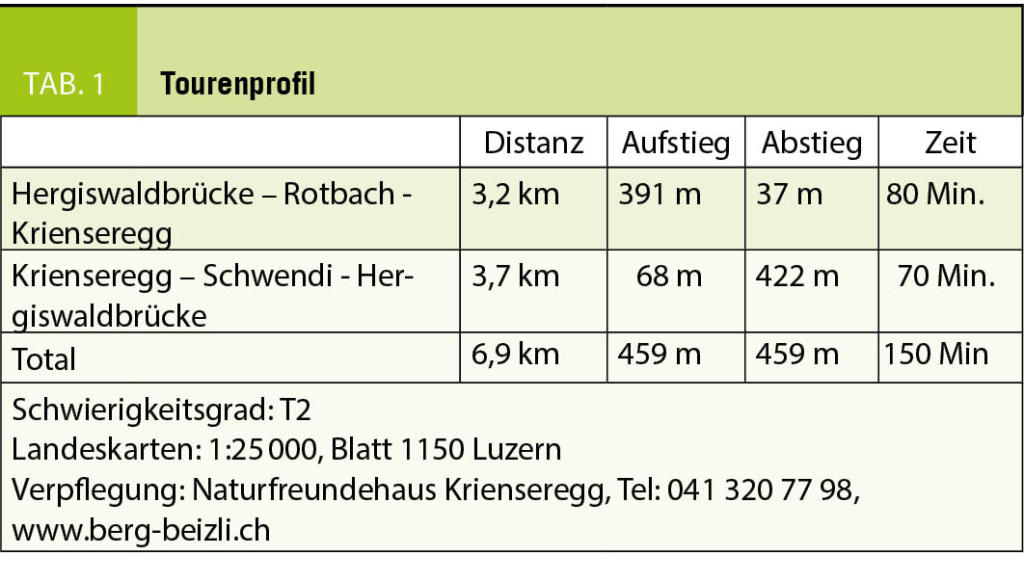
Diese Wanderung führt uns in ein Gebiet, das ich mit meinen Eltern schon als kleiner Junge erkundet hatte. Damals war Montana noch ein kleines Feriendorf und die Meinung über die im Bau befindlichen ersten grossen Ferienhäuser sehr gespalten, die in Form überdimensionierter Chalets in die Landschaft gesetzt wurden. Die Frauen auf den Maiensässen trugen noch ihre schwarze Arbeitstracht und strickten, die eine Nadel unter dem Arm eingeklemmt, während sie das Vieh hüteten. Die Alpweiden waren von grossen Herden der stämmigen, schwarzen Eringer Kühe bestossen, das Glockengeläut und Muhen der Tiere weit herum zu hören. Diese Bilder steigen auch heute wieder in mir auf und es ist mir, als würde ich das Rufen der Hirten und das Bellen der Herdenhunde wieder hören. Doch mittlerweile hat sich Vieles im Zeichen des Massentourismus verändert.
Wir folgen der Suone, wie die deutsche Bezeichnung dieser Wasserführungen lautet, bis zur Kreuzung mit der Fahrstrasse, die zur Cave de Merdechon hinaufführt. Dort liegt, gleich hinter der nächsten Bodenwelle versteckt, die ganzjährig bewirtete Cabanne de la Tièche, wo wir als erste Gäste des Tages bei heissem Kaffee den Blick über die Alpweiden von Montagne du Sex und Montagne du Plan bis hinauf zu den Faverges schweifen lassen, den Felskamm, der den Glacier de la Plaine Morte nach Süden begrenzt.
Wir verlassen später die Fahrstrasse an der Stelle, wo sie zur Tièche hinunter leitet, und queren auf einem schmalen Pfad zur Steilstufe im Norden hinüber, über die das Gletscherwasser in mehreren Fällen in die Tiefe stürzt. Eine abschüssige Passage ist mit Fixseilen und in die Felsen geschlagene Stufen gut gesichert. Danach erreichen wir den hohen Wasserfall, der über die Wand der Arête de Nusey herunterstürzt (Abb. 1). Über eine kleine Brücke gelangen wir zum Wandfuss und lassen uns die Dusche unter dem herabstürzenden Wasser nicht nehmen. Allerdings müssen wir uns mit dem Sprühwasser begnügen, da die Gewalt der Wassermassen der Hitze der letzten Wochen wegen zu gross ist.
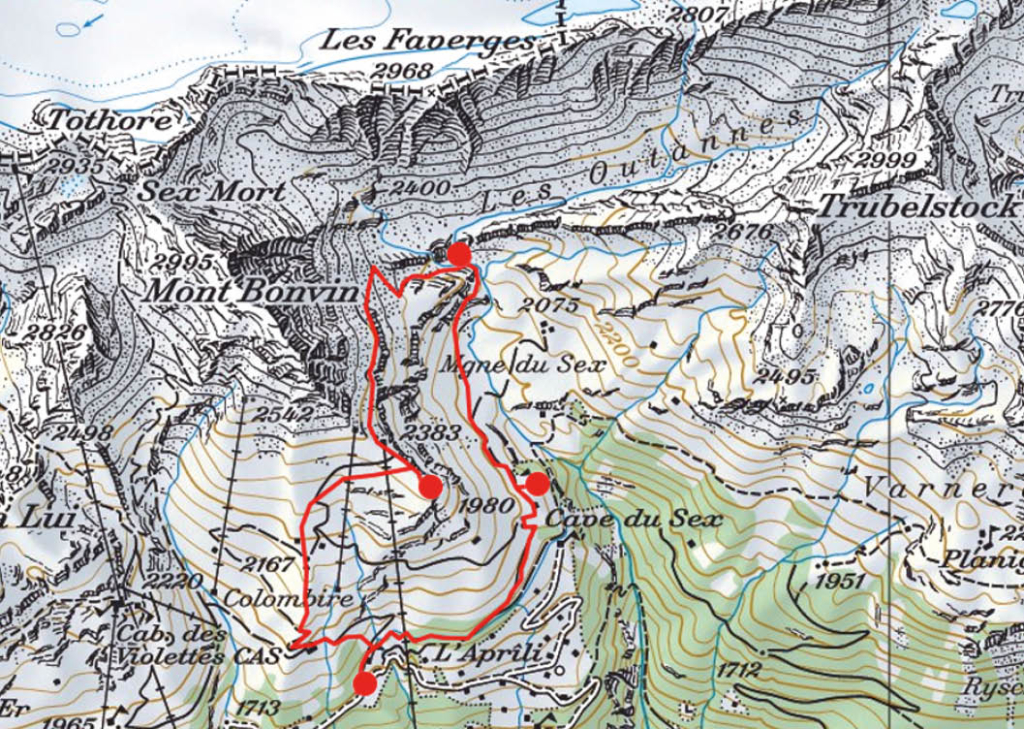
Der Weg wendet sich nun gegen Osten in Richtung des Mont Bonvin, dem grösseren Bruder des Kleineren, zu dem wir unterwegs sind. Oberhalb der Creux de la Tièche zweigt unser Pfad auf genau 2300 Metern Höhe gegen Süden ab. Über die schmale Weide der Alpage de Béveron gewinnen wir schliesslich den Felskopf des Petit Mont Bonvin (Abb. 2). Zum Gipfel gelangt man über eine gegen Norden ausstreichende Verschneidung. Hier ist bei feuchtem Untergrund Vorsicht geboten. Die Aussicht ist atemberaubend. Jenseits des Rhonetales schimmert die schier endlose Reihe der Walliser Viertausender, eine prachtvolle Rundsicht, zu der, getreu dem Namen des kleinen Berges, auf dem wir stehen, ein guter Tropfen Wein gehört (Abb. 3).
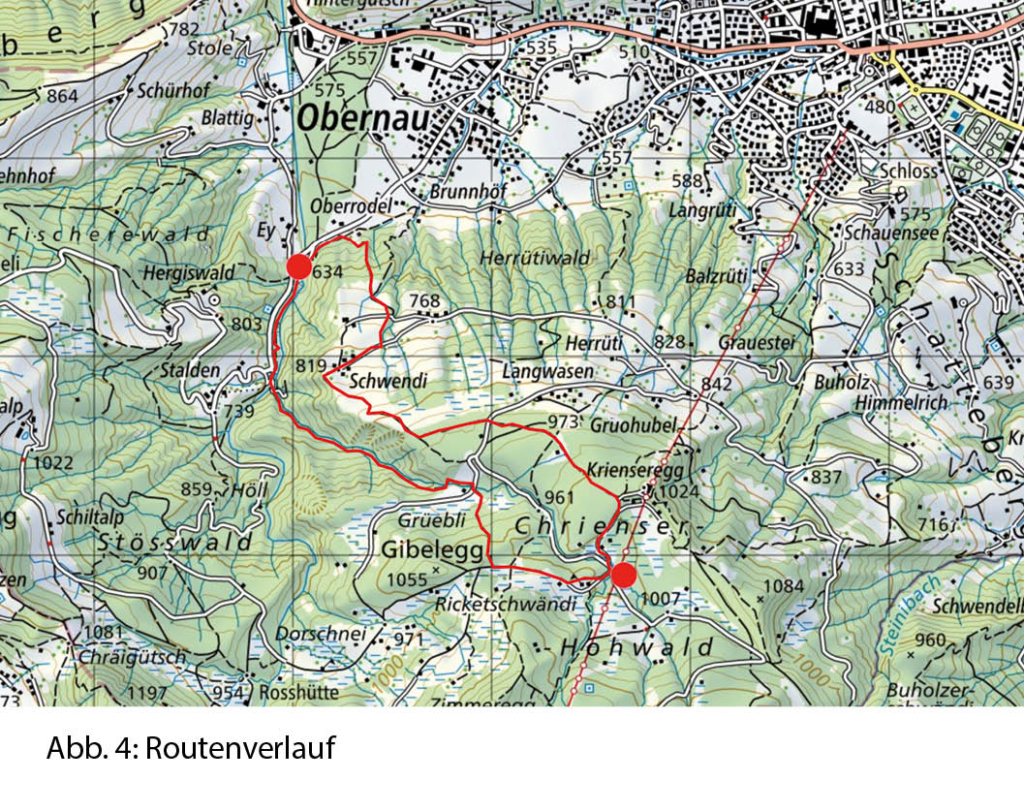
Der Abstieg über die weiten Alpweiden von Les Granzettes hinunter zum langen Stallgebäude von Prabaron lässt sich vom Gipfel aus gut planen. Unseren Gelenken zu liebe meiden wir die harten und steinigen Alpsträsschen. Den letzten Abschnitt unserer kleinen Rundwanderung kürzen wir über die stotzige Waldschneise ab, die gegen Osten zur Cave de Colombire hinunter leitet (Abb. 4). Hier hat sich mittlerweile die Masse der Spätaufsteher versammelt und begrüsst uns mit Lärm und Klamauk – wo ist nur das Geläut der Glocken, das Rufen der Hirten geblieben?
Aufgepasst
In dieser Rubrik werden Berg- und Schneeschuhwanderungen vorgestellt, die in der Regel wenig bekannt sind, zu aussergewöhnlichen Orten führen und die Genugtuung einer besonderen persönlichen Leistung bieten, sei es, dass man sich am Abend nach der Arbeit noch zu einer kleinen körperlichen Anstrengung überwindet, bzw. sich in ein oder zwei Tagen abseits breit getretener Wege unvergessliche Naturerlebnisse erschliesst. Zur besseren Beurteilbarkeit des Schwierigkeitsgrades der Tourenvorschläge wird jeweils eine Einschätzung anhand der SAC-Skala für Berg- (B, EB, BG) und für Schneeschuhwanderungen (WT 1–6) gegeben. Die schwierigste Wegstelle, unabhängig von ihrer Länge, bestimmt jeweils die Gesamtbewertung der Route. Letztendlich bleibt aber jeder selbst für die Beurteilung seiner Fähigkeiten und Eignung für die vorgestellte Wanderung verantwortlich. Die Gehzeiten sind Richtwerte und gelten für normal trainierte Wanderer. Sie müssen nicht zwingend mit den Angaben auf Wegweisern übereinstimmen.
Riedstrasse 9
6430 Schwyz
christian.besimo@bluewin.ch