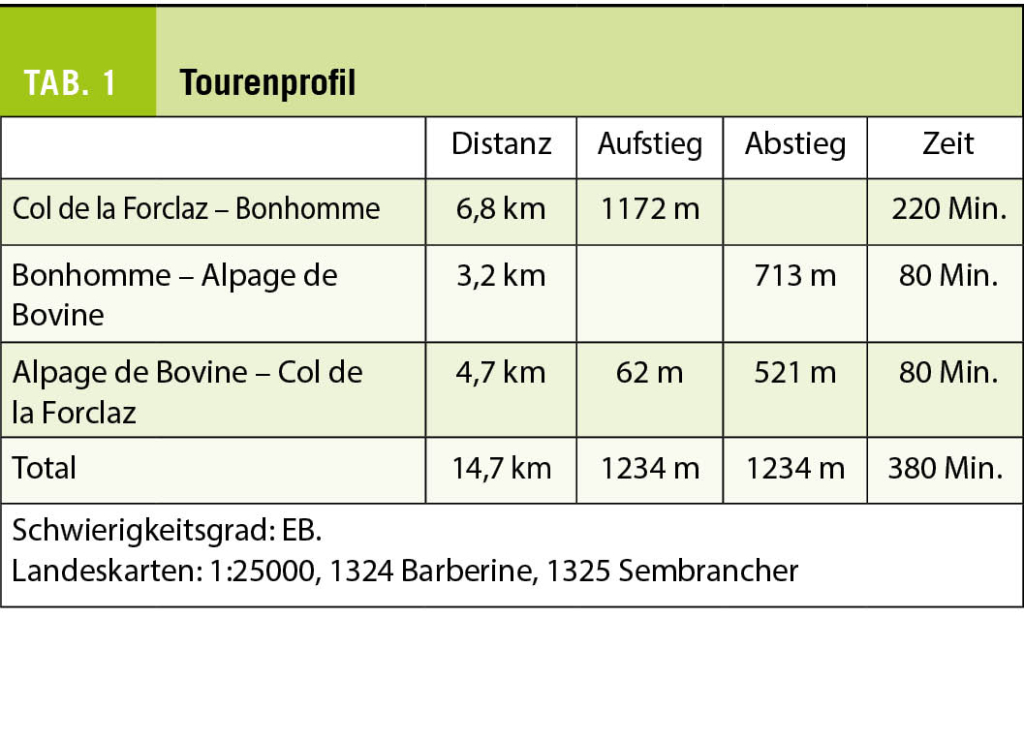
Diese aussichtsreiche Bergtour beginnt auf dem Col de la Forclaz im Unterwallis und führt auf den Bonhomme, einem Gipfel der Arête de la Lys, die neben anderen Gipfeln die Täler von Champex und Trient voneinander trennt. Der Name des Gipfels ist auf der Landeskarte 1:25000 nicht aufgeführt. Es handelt sich um den Geländepunkt 2700 Meter südöstlich der Pointe Ronde. Wie häufig in diesem Sommer herrscht schon am Morgen eine Gewitter versprechende Schwüle. Deshalb brechen wir schon zeitig auf und verlassen den Col de la Forclaz gegen Osten auf dem Weg nach Champex, der Teil des Rundweges um den Mont Blanc ist. Doch zu so früher Stunde ist die solchen Wegen folgende Masse von Touristen noch nicht unterwegs und haben wir den Aufstieg für uns alleine.
Zu Beginn verläuft der Weg fast eben aus und beginnt nur allmählich anzusteigen, bis er sich in mehreren steilen Kehren durch den Bergwald bis zur Alp La Giète hinaufwindet. Diese liegt im engen Kessel von La Lui unterhalb des Gratrückens, den wir später auf dem Weg zum Gipfel des Bonhomme begehen werden. Glockengeläute empfängt uns auf der Alplichtung und die Eringerkühe sprenkeln schwarz die kargen Weiden oberhalb der Alphütten.
Der Weg durch den immer steiler gegen Martigny abfallenden Wald nach der Alp wird wesentlich steiler und eröffnet eine atemberaubende Aussicht das Rhonetal aufwärts und hinaus in Richtung Genfersee. Dort, wo wir den Wald kurz vor der Alpage de Bovine verlassen, wenden wir uns, der Einkehr vorerst einmal entsagend, gegen Süden und folgen den stellenweise spärlichen Wegspuren hangaufwärts entlang des Gratrückens, der nach La Giète abfällt.
Auf dem Buckel, der die Höhenquote 2259 Meter trägt, orientieren wir uns erneut (Abb. 1). Der Gipfel scheint kein bisschen näher gekommen zu sein. Doch der Schein trügt etwas und man sollte sich keinesfalls entmutigen lassen. Am einfachsten benutzt man die Pfadspuren, die vom kleinen Sattel im Süden durch das Tälchen von Les Combés hinaufführt. Sobald das Gelände unterhalb der Kuppe mit der Höhenquote 2528,0 Meter steiler wird, weichen wir gegen Westen zum Grat aus und gelangen so zu diesem Geländepunkt oberhalb der Senke mit dem kleinen Lac de Bovine. Hier oben weidet, dem Ortsnamen entsprechend, eine Reihe von Rindern und scheint auch rege den See zu benutzen, wie die bräunliche Brühe vermuten lässt. Wir vermeiden Pfadspuren, die in den steilen Wiesenhang hineinführen und erreichen entlang dem Grat den Gipfel des Bonhomme.
Atemberaubend ist nun der Tiefblick in das Tal von Trient und auf den zerschrundenen, in den letzten Jahrzehnten stark zurückgegangenen Glacier du Trient. An den steilen Hängen der gegenüberliegenden Talseite kleben die Alphütten von Les Petoudes und Les Grands, wo die gleichnamige Schutzhütte der SAC-Sektion Les Diablerets liegt. Ein herrlicher Höhenweg, den wir bereits früher einmal beschrieben haben, verbindet diese Hütte mit jener auf dem Col de Balme.
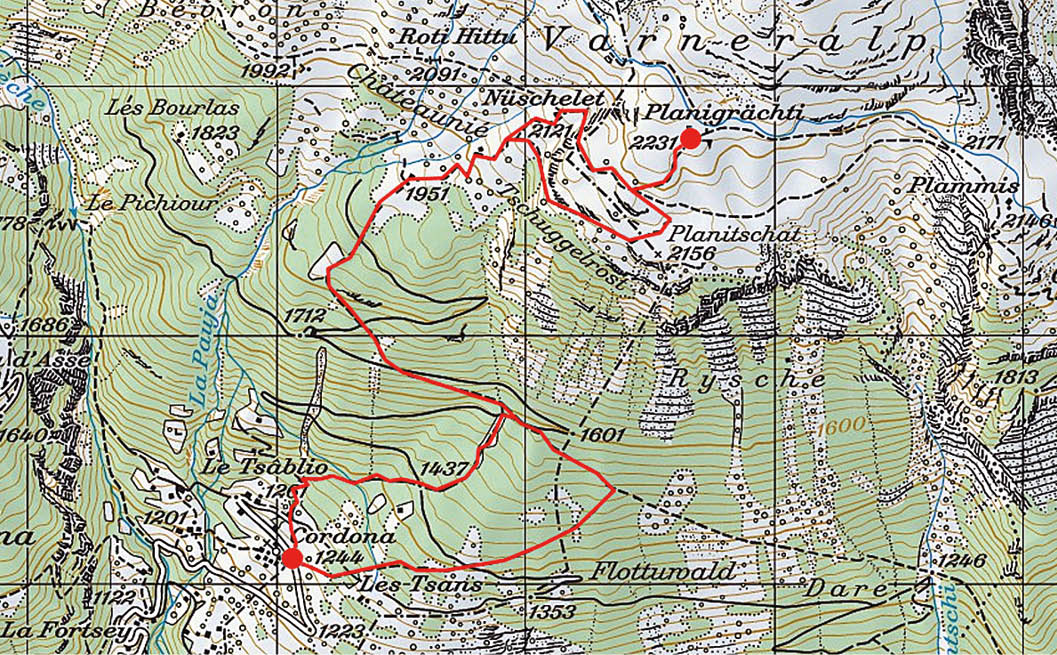
Nur schweren Herzens können wir uns von dieser herrlichen Rundsicht trennen, die von den Dents du Midi, über die Aiguille du Tour, Aiguille d‘Argentière, Aiguilles Dorées, bis hin zur Ruinette, dem Mont Blanc de Cheilon und zur Dent Blanche reicht. Auf der gegenüberliegenden Seite des Rhonetals dominieren die Dent de Morcle, Grand Chavalard, Haut de Cry, Les Diablerets und das Wildhorn (Abb. 3).
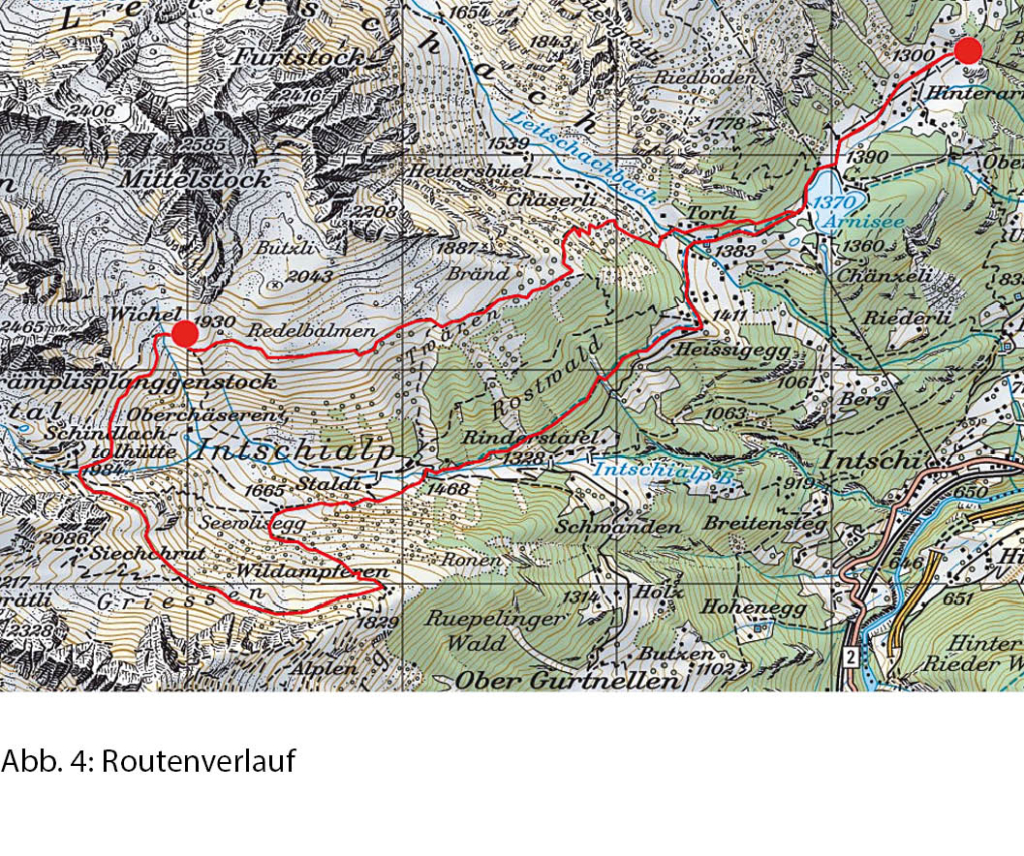
Bis in den kleinen Sattel vor der Kuppe 2259 Meter halten wir uns an die Aufstiegsroute. Wir queren deren Südosthang bis zum Kreuz auf 2098 Meter Höhe. Von da weg folgen wir vorerst dem Gratrücken gegen Nordosten bis zum nächsten Sattel und steigen dann direkt zu den Alphütten von Bovine ab, die zwischen Juni und September offen ist und Unterkunft sowie Verpflegung anbietet (Abb. 2).
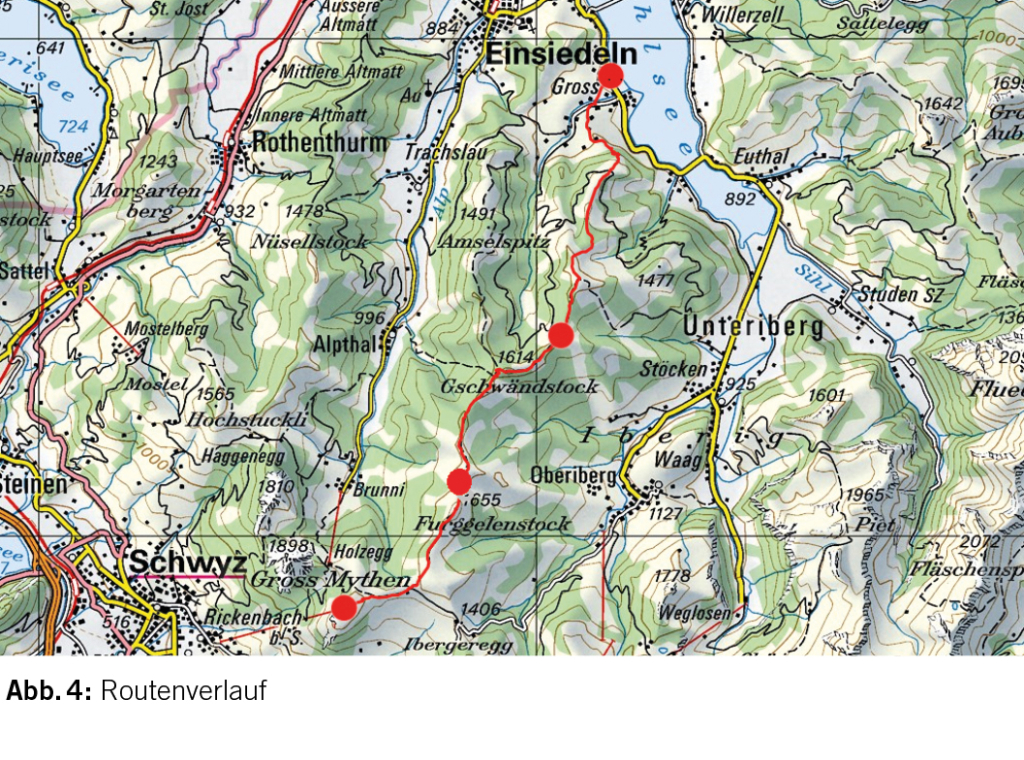
Hier erfrischen wir uns mit einem kalten Getränk, bevor wir auf gleichem Weg zum Col de la Forclaz zurückkehren (Abb. 4). Rasch aufziehende Gewitterwolken bewahren uns auch jetzt vor einer grösseren Völkerwanderung. Auf dem Bonhomme braucht man sich dafür kaum vor einer grösseren Menschenansammlung zu fürchten. In der Regel hat man diesen Gipfel für sich oder teilt ihn mit Gleichgesinnten.
Riedstrasse 9
6430 Schwyz
christian.besimo@bluewin.ch