La sarcopénie est un syndrome gériatrique multifactorielle, associé au syndrome de fragilité, à la perte d’ indépendance fonctionnelle et à un risque accru de complications sur le plan médical, d’ hospitalisation, et de mortalité. L’ identification précoce des patients à risque de sarcopénie ou déjà sarcopéniques permet de mettre en place des mesures visant à empêcher l’ installation ou en ralentir la progression. Il est donc important que les gériatres, mais également tous les médecins de premier recours puissent détecter ce syndrome, pour que les patients bénéficient d’ une prise en charge multidisciplinaire adaptée.
Sarcopenia is a multifactorial geriatric syndrome, strictly associated to the development of frailty, to the loss of functional independence, to an increasing risk of medical complications, hospitalisation and mortality. The early identification of patients at risk of developing the disease and of the sarcopenic ones leads to setting up therapeutical strategies to avoid or slow down its progression. Therefore, it’ s crucial that not only geriatricians, but also primary care physicians detect this syndrome, so that patients could benefit from the appropriate multidisciplinary approach.
Keywords: sarcopenia, diagnostic criteria, multidisciplinary approach, physical exercise, nutritional strategies
Introduction
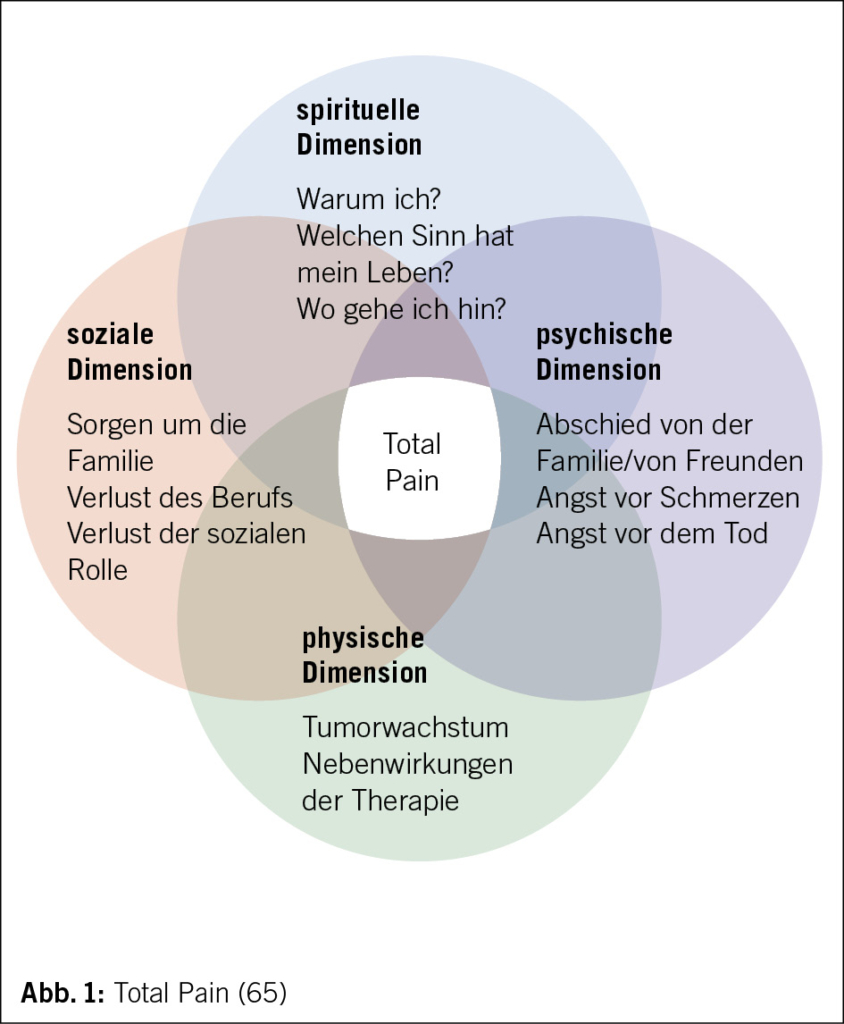
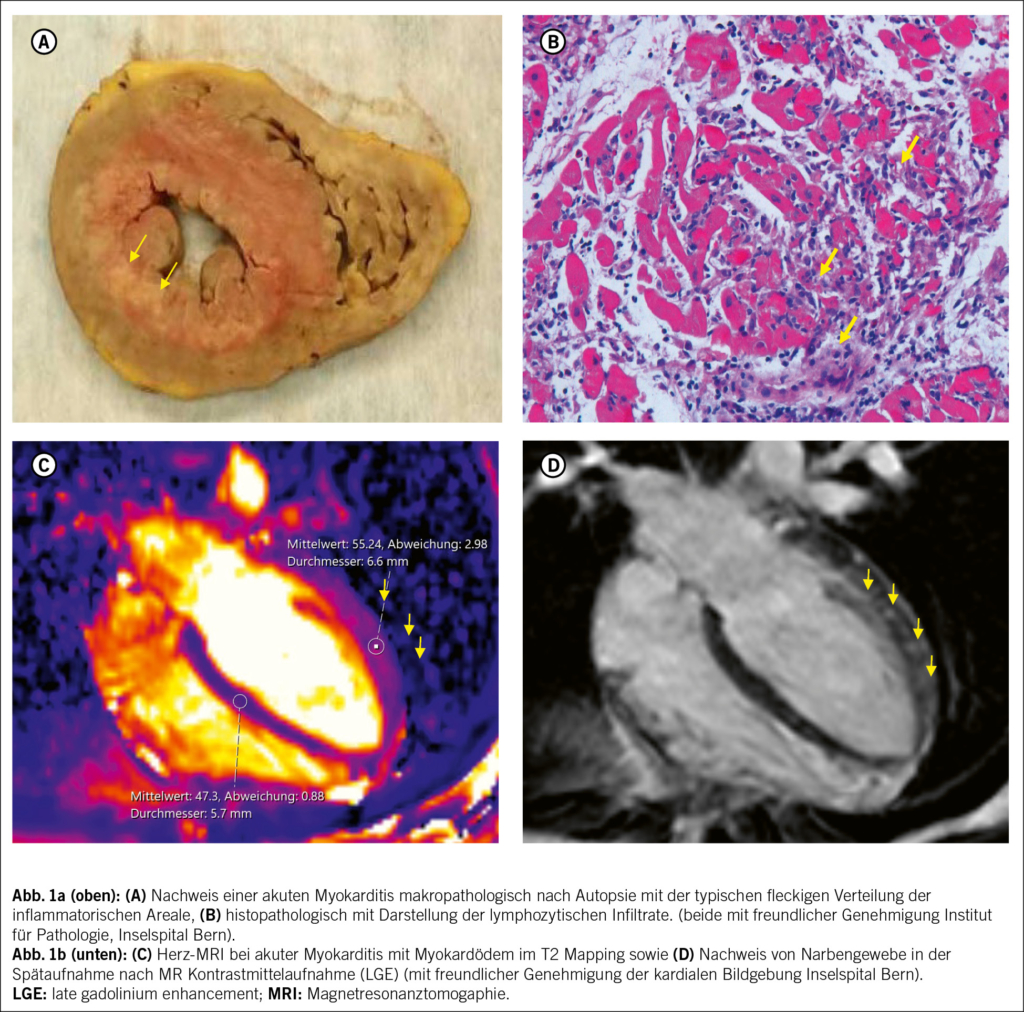
La sarcopénie est caractérisée par une perte progressive de la force et des performances physiques qui s’ associe à une diminution de masse musculaire (1, 2). Dans la population gériatrique, la sarcopénie est associée au développement d’ un phénotype fragile (3, 4) qui comprend minimum 3 des critères suivants: perte de poids involontaire, fatigue, faiblesse musculaire, baisse des performances physiques et réduction du niveau d’ activité (3, 5).
Plusieurs études ont démontré un impact dramatique de la sarcopénie en termes de déclin de la réserve fonctionnelle, qui comporte une diminution de la capacité de l’ organisme de faire face à un évènement aigu et de pouvoir en récupérer par la suite (6, 7). La sarcopénie augmente le risque de perte d’ indépendance dans les activités de la vie quotidienne (8, 9), de chutes (10, 11) et de mortalité globale (12). En conséquence, chez les patients sarcopéniques nous assistons à une probabilité accrue d’ hospitalisation, de complications, de prolongation du séjour hospitalier et de placement en institution, avec un retentissement très défavorable sur la qualité de vie des patients et sur les couts de la santé (13–15). De ce fait, reconnaitre et ralentir l’ apparition de la sarcopénie chez les personnes âgées représente un défi d’ importance primordiale pour les gériatres et les médecins de premier recours.
Epidémiologie
Les données concernant la prévalence de la sarcopénie sont très hétérogènes, ce qui est partiellement motivé par la variabilité des critères utilisés pour poser ce diagnostic et les méthodes d’ estimation de la masse maigre employées dans les différentes études. Toutefois, en 2019, l’ EWGSOP2 (European Working Group on Sarcopenia in Older People 2) a établi un consensus pour la définition de la sarcopénie ainsi que des critères diagnostiques clairs (1). Selon ces nouveaux critères, la prévalence de la sarcopénie varie entre 10 et 27 % de la population générale en âge gériatrique (16). Certaines catégories de patients, notamment les diabétiques (17), les patients souffrant de troubles neurocognitifs (18), les insuffisants rénaux chroniques (19) et hépatiques (20),ceux qui sont atteints d’ une maladie néoplasique (21) ont un taux de prévalence de sarcopénie beaucoup plus élevé, qui peut atteindre le 66 % chez les patients avec cancer œsophagien non reséqué (22). Dans la population institutionnalisée, le taux de prévalence de ce syndrome gériatrique est bien plus important et cette condition peut intéresser jusqu’ au 51 % des hommes résidant dans des établissement médico-sociaux (23).
Pathogenèse
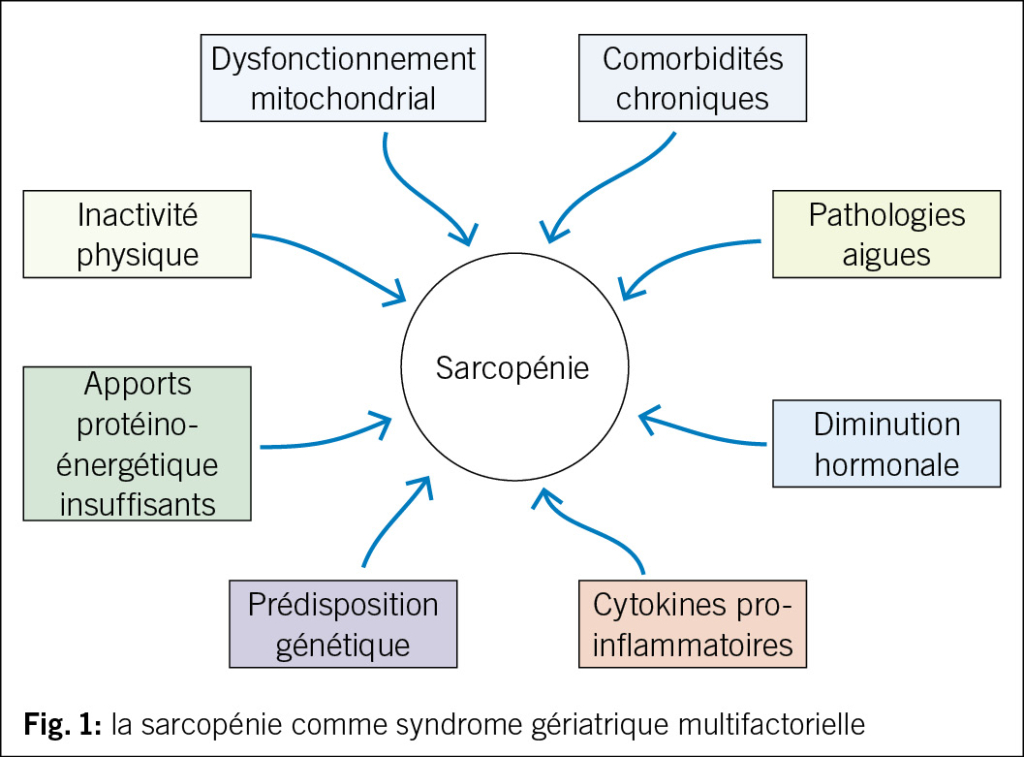
Le vieillissement est physiologiquement associé à une diminution de la masse musculaire, qui est estimé du 8 % tous les 10 ans après les 40 ans et du 15 % tous les 10 ans après les 70 ans (24). Comme déjà mentionné, des maladies systémiques sévères comme les cancers ou les insuffisances sévères d’ organe peuvent contribuer à l’ installation de la sarcopénie. Dans ce contexte la sarcopénie est définie comme secondaire et constitue une composante du syndrome anorexie-cachexie, typique des maladies en phase terminale, qui favorisent le catabolisme cellulaire et par conséquence une perte pondérale ainsi que de masse maigre (25). Cependant, dans la plupart des cas, l’ identification d’ une étiologie claire à la base de la sarcopénie est impossible, car sa pathogenèse est très complexe et implique la concurrence de plusieurs facteurs intrinsèques et extrinsèques (Fig. 1). Les facteurs intrinsèques plus importants sont la diminution des hormones anabolisants comme le testostérone, les œstrogènes, l’ IGF1 (26, 27), l’ augmentation de l’ activité de cytokines pro-inflammatoires (28) et le dysfonctionnement mitochondrial, qui provoque l’ apoptose de fibre musculaire à la suite d’ un stress oxydatif à cause de l’ accumulation des radicaux libres (29). Des évidences suggèrent également qu’ il existe une prédisposition génétique à la sarcopénie (30). Parmi les facteurs extrinsèques, l’ inactivité physique et la dénutrition protéino-énergétique jouent un rôle central dans le développement de la sarcopénie (31, 32). La sarcopénie est d’ habitude une condition chronique. Toutefois, après une hospitalisation ou un alitement de quelques jours, la synthèse de protéines musculaires est diminué du 30 % chez les personnes âgées, avec une perte d’ un kg de masse musculaire en trois jours: chaque événement aigu peut donc précipiter la situation et amener au développement d’ une sarcopénie avérée dans les individus à risque (33).
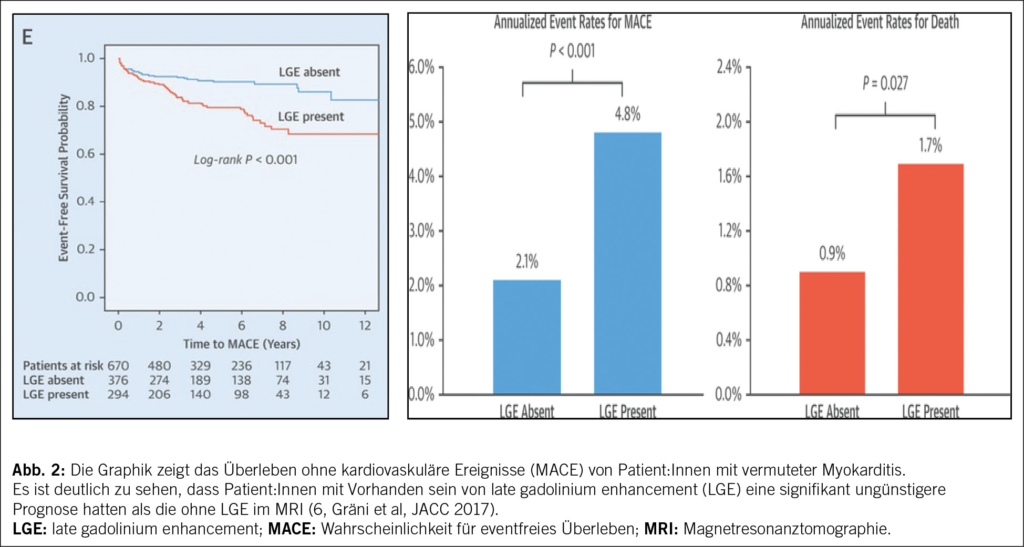
Critères diagnostiques
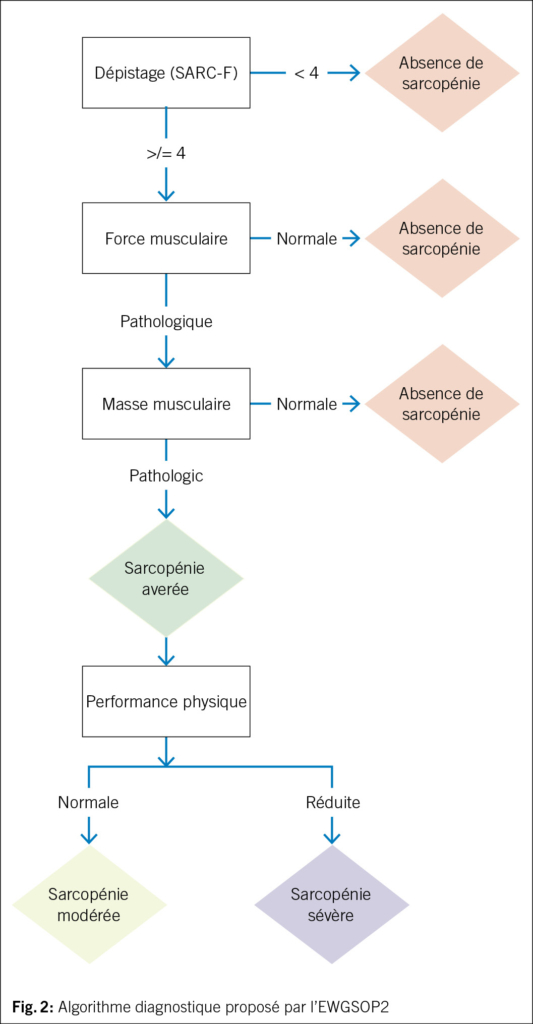
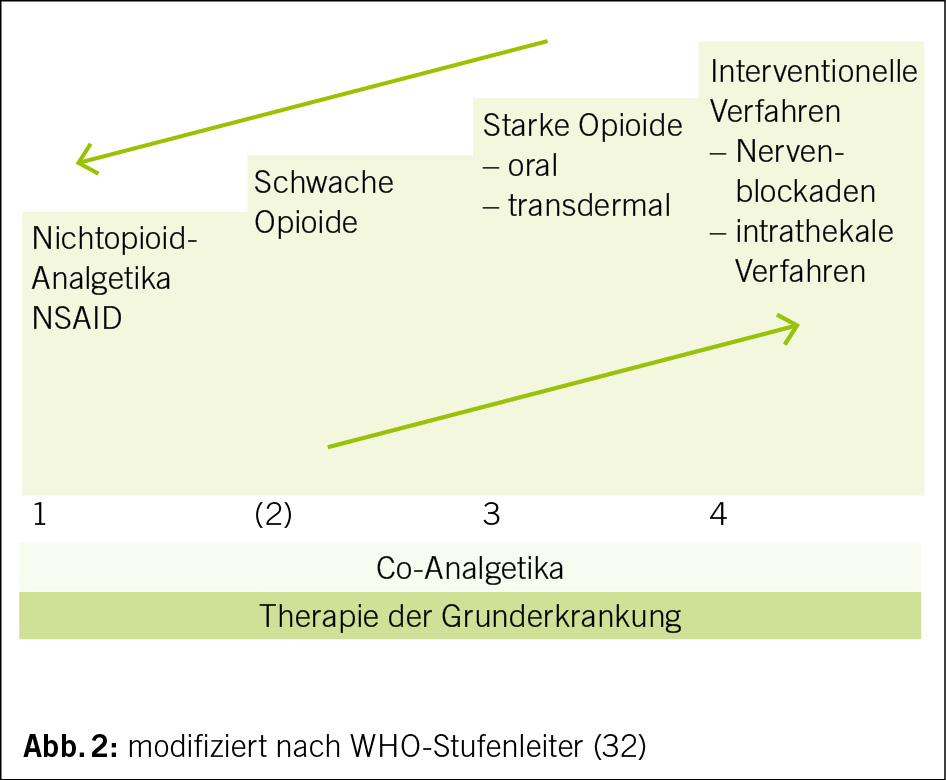
Selon l’ EWGSOP2, la sarcopénie est retenue probable en présence d’ une diminution de la force musculaire et est confirmé par la mise en évidence d’ une diminution quantitative et/ou qualitative de la masse musculaire. Le degré de sévérité de la sarcopénie est défini sur la base de son impact en termes de diminution des performance physiques (1) (Fig. 2). Plus en détail, le dépistage est effectué grâce à l’ outil SARC-F: il s’ agit d’ un bref questionnaire d’ autoévaluation administré aux patients, qui investigue le nombre de chutes durant les derniers 12 mois, ainsi que la présence d’ une perte de force et de difficultés à la marche, à se lever d’ une chaise, à monter les escaliers. Un score égal ou supérieur à 4 suggère une possible sarcopénie (1, 34).
Chez les patients positifs au dépistage, la force musculaire peut être estimée:
• sur la base de l’ évaluation de la force de préhension de la main dominante, en employant un dynamomètre Jamar. Les résultats sont considérés pathologiques si la force de préhension est inférieur à 27 kg chez les hommes et 16 kg chez les femmes (1, 35). La force de préhension est corrélée à la force des autres groupes musculaires du corps et est facile à mesurer et dans le milieu hospitalier et dans le milieu communautaire (36).
• en alternative, il est possible d’ employer le test du lever de chaise, en demandant aux patients de se lever d’ une chaise à cinq reprises, sans l’ aide de bras. L’ évaluateur note le temps que la personne prend à effectuer les cinq répétitions (1, 37).
En cas de déficit de force avéré, une évaluation quantitative de la masse musculaire est nécessaire
• L’ IRM et le CT sont considérés comme le «gold standard» pour l’ évaluation directe de la masse musculaire, toutefois ils ne peuvent pas être utiliser régulièrement dans la pratique clinique en raison de leur cout trop onéreux et de la nécessité d’ un personnel hautement spécialisé pour l’ interprétation des résultats (38). De surcroit, l’ absence d’ une valeur seuil clair pour la définition de sarcopénie limite davantage l’ emploie de ces deux méthodes.
• La densitométrie sur le corps entier (DXA = Dual-energy X-ray absorptiometry) représente également une bonne méthode d’ évaluation, car elle est non invasive et plus économique que l’ IRM ou le CT. Toutefois, les différentes machines pour mesurer la DXA donnent des résultats qui ne sont pas complétement superposables et il est donc important d’ utiliser les mêmes instruments pour toutes les mesures (38, 39).
• La bio-impédancemétrie (BIA = Bioelectrical Impedance Analysis) mesure la résistance des tissus biologiques par l’ envoi d’ un courant sinusoïdal de faible intensité, du coup ne permet pas de mesure directe de la masse musculaire, en revanche peut estimer indirectement la masse musculaire sur la base de la conductivité électrique des tissus, en utilisant un algorithme (40). L’ équipement pour la BIA est peu couteux et facilement transportable, en conséquence permet d’ obtenir des mesures au lit du malade. Comme pour la DXA, il existe une certaine variabilité entre un instrument et l’ autre et les valeurs seuil sont différentes selon la population prise en examen (41). De surcroît, un état d’ hyper ou hypo-hydratation peut fausser le résultat de cette analyse (38).
Du moment que la masse musculaire est corrélée à la dimension corporelle, les résultats de la BIA et de la DXA doivent être ajustés en tenant compte de la taille ou du BMI. Les valeurs seuil pour définir la sarcopénie sont donc < 7.0 kg/m2 pour les hommes et < 5.5 kg/m2 pour les femmes (1). En cas de sarcopénie avérée, le consensus propose d’ évaluer la performance physique peut être par le biais d’ une réduction de la vitesse de marche sur 4 mètres (≤0.8 m/s), par le Time-Up and Go Test (TUG) (≥20 s) par la Short Physical Performance Battery (SPPB) (≤8 points), ou par le test de vitesse de marche sur 400 mètres (≥6 minutes). Si les performances physiques sont diminuées, nous parlons de sarcopénie sévère (1).
Traitement
La pratique d’ une activité physique visant à l’ augmentation de la force et de l’ endurance musculaire est considérée comme le traitement de première ligne de la sarcopénie (3, 42): l’ activité physique proposée doit être structurée sur la base des préférences et des objectifs de chaque patient et doit être centrée sur le maintien de l’ indépendance fonctionnelle (43). Aux fins de choisir le programme d’ exercice le plus adapté, la prescription de séances de physiothérapie est envisageable. Du moment que les patients gériatriques ont souvent une faible adhérence aux programmes d’ activité physique, la participation à des séances de groupe pourrait constituer une option efficace pour améliorer la compliance (44).
Une prise en charge nutritionnelle appropriée est également primordiale: couvrir les besoins caloriques des patients est toutefois insuffisant pour éviter l’ atrophie musculaire. Il est fondamental de pouvoir assurer également des apports adéquats en protéines (45). Physiologiquement, avec l’ âge, la synthèse des protéines myofibrillaires à niveau musculaire est réduite, ce qui fait que des apports de 0.8 g/kg/j de protéines, correspondant à la dose habituellement recommandée chez les adultes, pourraient être insuffisants pour préserver la masse musculaire. Selon une métanalyse récente des apports protéiques supérieurs ou égaux à 1 g/kg/j auraient un effet protecteur majeur sur la fonte musculaire par rapport à des apports inferieurs (46). Ce seuil doit être dépassé en cas de situation de catabolisme accru ou de dénutrition. Des études ont analysé le rôle de la supplémentation en vitamine D3 , en acides aminés à chaine ramifiée (notamment leucine, valine et isoleucine) ou en protéines de lactosérum pour empêcher le développement de la sarcopénie (47, 48). Selon une review récente de la littérature, la combinaison de la supplémentation en vitamine D avec des acides aminés à chaine ramifiée a un impact positif sur la masse musculaire, la force et la performance physique (49). L’ association de la supplémentation nutritionnel avec l’ augmentation de l’ activité physique est supérieure en efficacité à ces deux interventions singulièrement dans l’ amélioration de la force des membres inférieurs et de la vitesse de marche (33, 49–51).
Bien qu’ une diminution des taux de testostérone soit souvent observée chez les patients sarcopéniques, à l’ heure actuelle, il y a très peu d’ évidence qui support le recours ni à cette hormone anabolisante, ni aux modulateurs sélectifs du récepteur des androgènes dans le traitement de ce syndrome, notamment pour ce qui concerne l’ amélioration de la performance physique (52–54). Les trials cliniques qui ont pris en examen l’ action de la greline, une substance qui stimule la sécrétion de l’ hormone de la croissance, ont été également non concluant (55).
Récemment, plusieurs études se sont intéressées aux mécanismes moléculaires qui règlent la prolifération et la différentiation des myocytes. La myostatine est un membre de la famille des transforming growth factors β, exprimée à niveau des cellules musculaires, qui a une action inhibitrice sur leur croissance et leur différentiation, via l’ interaction avec le récepteur de l’ activine 2B (ACVR2B). En conséquence, des anticorps monoclonaux, qui bloquent respectivement la myostatine (p.e. le landogrozumab) ou le récepteur ACVR2B de l’ activine (p.e. le bimagrumab) ont fait l’ objet de l’ intérêt des chercheurs durant les dernières années et des études des phases 2 conduites sur la population gériatrique ont montré quelques résultats encourageants en termes d’ augmentation de la masse maigre (56–58). Des études de phase 3 sur large échelle seront toutefois nécessaires avant de permettre l’ immission de ces molécules sur le marché pour le traitement de la sarcopénie.
Copyright
Aerzteverlag medinfo AG
Service de soins palliatifs et de support CHUV
Av. Pierre-Decker 5
1011 Lausanne
Service de gériatrie et réadaptation gériatrique CHUV
Ch. de Mont-Paisible 16
1011 Lausanne
Les auteurs n’ ont pas déclaré de conflit d’ intérêts en rapport avec cet article.
1. Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyère O, Cederholm T, et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 1 janv 2019;48(1):16‑31.
2. Chen LK, Liu LK, Woo J, Assantachai P, Auyeung TW, Bahyah KS, et al. Sarcopenia in Asia: consensus report of the Asian Working Group for Sarcopenia. J Am Med Dir Assoc. févr 2014;15(2):95‑101.
3. Nascimento CM, Ingles M, Salvador-Pascual A, Cominetti MR, Gomez-Cabrera MC, Viña J. Sarcopenia, frailty and their prevention by exercise. Free Radic Biol Med. 20 févr 2019;132:42‑9.
4. Cattaneo F, Buondonno I, Cravero D, Sassi F, D’ Amelio P. Musculoskeletal Diseases Role in the Frailty Syndrome: A Case–Control Study. Int J Environ Res Public Health. 20 sept 2022;19(19):11897.
5. Fried LP, Tangen CM, Walston J, Newman AB, Hirsch C, Gottdiener J, et al. Frailty in older adults: evidence for a phenotype. J Gerontol A Biol Sci Med Sci. mars 2001;56(3):M146-156.
6. Sarcopenia and adverse health-related outcomes: An umbrella review of meta-analyses of observational studies – PubMed [Internet]. [cité 8 déc 2023]. Disponible sur: https://pubmed.ncbi.nlm.nih.gov/32924316/
7. Yuan S, Larsson SC. Epidemiology of sarcopenia: Prevalence, risk factors, and consequences. Metabolism. juill 2023;144:155533.
8. Dos Santos L, Cyrino ES, Antunes M, Santos DA, Sardinha LB. Sarcopenia and physical independence in older adults: the independent and synergic role of muscle mass and muscle function. J Cachexia Sarcopenia Muscle. avr 2017;8(2):245‑50.
9. Tanimoto Y, Watanabe M, Sun W, Sugiura Y, Tsuda Y, Kimura M, et al. Association between sarcopenia and higher-level functional capacity in daily living in community-dwelling elderly subjects in Japan. Arch Gerontol Geriatr. 2012;55(2):e9-13.
10. Schaap LA, van Schoor NM, Lips P, Visser M. Associations of Sarcopenia Definitions, and Their Components, With the Incidence of Recurrent Falling and Fractures: The Longitudinal Aging Study Amsterdam. J Gerontol A Biol Sci Med Sci. 10 août 2018;73(9):1199‑204.
11. Cervera-Díaz MDC, López-Gómez JJ, García-Virto V, Aguado-Hernández HJ, De Luis-Román DA. Prevalence of sarcopenia in patients older than 75 years admitted for hip fracture. Endocrinol Diabetes Nutr. 2023;70(6):396‑407.
12. Xu J, Wan CS, Ktoris K, Reijnierse EM, Maier AB. Sarcopenia Is Associated with Mortality in Adults: A Systematic Review and Meta-Analysis. Gerontology. 2022;68(4):361‑76.
13. Beaudart C, Rizzoli R, Bruyère O, Reginster JY, Biver E. Sarcopenia: burden and challenges for public health. Arch Public Health Arch Belg Sante Publique. 2014;72(1):45.
14. Beaudart C, Zaaria M, Pasleau F, Reginster JY, Bruyère O. Health Outcomes of Sarcopenia: A Systematic Review and Meta-Analysis. PloS One. 2017;12(1):e0169548.
15. Roquebert Q, Sicsic J, Santos-Eggimann B, Sirven N, Rapp T. FRAILTY, SARCOPENIA AND LONG TERM CARE UTILIZATION IN OLDER POPULATIONS: A SYSTEMATIC REVIEW. J Frailty Aging. 2021;10(3):272‑80.
16. Petermann-Rocha F, Balntzi V, Gray SR, Lara J, Ho FK, Pell JP, et al. Global prevalence of sarcopenia and severe sarcopenia: a systematic review and meta-analysis. J Cachexia Sarcopenia Muscle. févr 2022;13(1):86‑99.
17. Feng L, Gao Q, Hu K, Wu M, Wang Z, Chen F, et al. Prevalence and Risk Factors of Sarcopenia in Patients With Diabetes: A Meta-analysis. J Clin Endocrinol Metab. 19 avr 2022;107(5):1470‑83.
18. Pacifico J, Geerlings MAJ, Reijnierse EM, Phassouliotis C, Lim WK, Maier AB. Prevalence of sarcopenia as a comorbid disease: A systematic review and meta-analysis. Exp Gerontol. 1 mars 2020;131:110801.
19. Wathanavasin W, Banjongjit A, Avihingsanon Y, Praditpornsilpa K, Tungsanga K, Eiam-Ong S, et al. Prevalence of Sarcopenia and Its Impact on Cardiovascular Events and Mortality among Dialysis Patients: A Systematic Review and Meta-Analysis. Nutrients. 30 sept 2022;14(19):4077.
20. Tantai X, Liu Y, Yeo YH, Praktiknjo M, Mauro E, Hamaguchi Y, et al. Effect of sarcopenia on survival in patients with cirrhosis: A meta-analysis. J Hepatol. 1 mars 2022;76(3):588‑99.
21. Shachar SS, Williams GR, Muss HB, Nishijima TF. Prognostic value of sarcopenia in adults with solid tumours: A meta-analysis and systematic review. Eur J Cancer Oxf Engl 1990. avr 2016;57:58‑67.
22. Jogiat UM, Bédard ELR, Sasewich H, Turner SR, Eurich DT, Filafilo H, et al. Sarcopenia reduces overall survival in unresectable oesophageal cancer: a systematic review and meta‐analysis. J Cachexia Sarcopenia Muscle. déc 2022;13(6):2630‑6.
23. Differences in the Prevalence of Sarcopenia in Community-Dwelling, Nursing Home and Hospitalized Individuals. A Systematic Review and Meta-Analysis – ScienceDirect [Internet]. [cité 14 févr 2025]. Disponible sur: https://www.sciencedirect.com/science/article/pii/S1279770723011004?via %3Dihub
24. Nishikawa H, Fukunishi S, Asai A, Yokohama K, Nishiguchi S, Higuchi K. Pathophysiology and mechanisms of primary sarcopenia (Review). Int J Mol Med. 1 août 2021;48(2):1‑8.
25. Meza-Valderrama D, Marco E, Dávalos-Yerovi V, Muns MD, Tejero-Sánchez M, Duarte E, et al. Sarcopenia, Malnutrition, and Cachexia: Adapting Definitions and Terminology of Nutritional Disorders in Older People with Cancer. Nutrients. 26 févr 2021;13(3):761.
26. Priego T, Martín AI, González-Hedström D, Granado M, López-Calderón A. Role of hormones in sarcopenia. Vitam Horm. 2021;115:535‑70.
27. Joseph C, Kenny AM, Taxel P, Lorenzo JA, Duque G, Kuchel GA. Role of endocrine-immune dysregulation in osteoporosis, sarcopenia, frailty and fracture risk. Mol Aspects Med. juin 2005;26(3):181‑201.
28. Jimenez-Gutierrez GE, Martínez-Gómez LE, Martínez-Armenta C, Pineda C, Martínez-Nava GA, Lopez-Reyes A. Molecular Mechanisms of Inflammation in Sarcopenia: Diagnosis and Therapeutic Update. Cells. 1 août 2022;11(15):2359.
29. Marzetti E, Calvani R, Cesari M, Buford TW, Lorenzi M, Behnke BJ, et al. Mitochondrial dysfunction and sarcopenia of aging: from signaling pathways to clinical trials. Int J Biochem Cell Biol. oct 2013;45(10):2288‑301.
30. Genetic Associations with Aging Muscle: A Systematic Review – PMC [Internet]. [cité 14 févr 2025]. Disponible sur: https://pmc.ncbi.nlm.nih.gov/articles/PMC7016601/
31. Cruz-Jentoft AJ, Sayer AA. Sarcopenia. Lancet Lond Engl. 29 juin 2019;393(10191):2636‑46.
32. Dhillon RJS, Hasni S. Pathogenesis and Management of Sarcopenia. Clin Geriatr Med. févr 2017;33(1):17‑26.
33. Giacosa A, Barrile GC, Mansueto F, Rondanelli M. The nutritional support to prevent sarcopenia in the elderly. Front Nutr. 9 mai 2024;11:1379814.
34. Malmstrom TK, Miller DK, Simonsick EM, Ferrucci L, Morley JE. SARC-F: a symptom score to predict persons with sarcopenia at risk for poor functional outcomes. J Cachexia Sarcopenia Muscle. mars 2016;7(1):28‑36.
35. Roberts HC, Denison HJ, Martin HJ, Patel HP, Syddall H, Cooper C, et al. A review of the measurement of grip strength in clinical and epidemiological studies: towards a standardised approach. Age Ageing. juill 2011;40(4):423‑9.
36. Ibrahim K, May C, Patel HP, Baxter M, Sayer AA, Roberts H. A feasibility study of implementing grip strength measurement into routine hospital practice (GRImP): study protocol. Pilot Feasibility Stud. 2016;2:27.
37. Jones CJ, Rikli RE, Beam WC. A 30-s chair-stand test as a measure of lower body strength in community-residing older adults. Res Q Exerc Sport. juin 1999;70(2):113‑9.
38. Albano D, Messina C, Vitale J, Sconfienza LM. Imaging of sarcopenia: old evidence and new insights. Eur Radiol. avr 2020;30(4):2199‑208.
39. Messina C, Bandirali M, Sconfienza LM, D’ Alonzo NK, Di Leo G, Papini GDE, et al. Prevalence and type of errors in dual-energy x-ray absorptiometry. Eur Radiol. mai 2015;25(5):1504‑11.
40. Kyle UG, Genton L, Hans D, Pichard C. Validation of a bioelectrical impedance analysis equation to predict appendicular skeletal muscle mass (ASMM). Clin Nutr Edinb Scotl. déc 2003;22(6):537‑43.
41. Sergi G, De Rui M, Veronese N, Bolzetta F, Berton L, Carraro S, et al. Assessing appendicular skeletal muscle mass with bioelectrical impedance analysis in free-living Caucasian older adults. Clin Nutr Edinb Scotl. août 2015;34(4):667‑73.
42. Yoshimura Y, Wakabayashi H, Yamada M, Kim H, Harada A, Arai H. Interventions for Treating Sarcopenia: A Systematic Review and Meta-Analysis of Randomized Controlled Studies. J Am Med Dir Assoc. 1 juin 2017;18(6):553.e1-553.e16.
43. Lee BC, Kim KI, Cho KH, Moon CW. Effects of resistance training and nutritional support on osteosarcopenia in older, community-dwelling postmenopausal Korean females (ERTO-K study): a study protocol. BMC Geriatr. 17 janv 2024;24(1):68.
44. Lu L, Mao L, Feng Y, Ainsworth BE, Liu Y, Chen N. Effects of different exercise training modes on muscle strength and physical performance in older people with sarcopenia: a systematic review and meta-analysis. BMC Geriatr. 15 déc 2021;21(1):708.
45. Cannataro R, Carbone L, Petro JL, Cione E, Vargas S, Angulo H, et al. Sarcopenia: Etiology, Nutritional Approaches, and miRNAs. Int J Mol Sci. 8 sept 2021;22(18):9724.
46. Kim JE, O’ Connor LE, Sands LP, Slebodnik MB, Campbell WW. Effects of dietary protein intake on body composition changes after weight loss in older adults: a systematic review and meta-analysis. Nutr Rev. mars 2016;74(3):210‑24.
47. Bauer JM, Verlaan S, Bautmans I, Brandt K, Donini LM, Maggio M, et al. Effects of a vitamin D and leucine-enriched whey protein nutritional supplement on measures of sarcopenia in older adults, the PROVIDE study: a randomized, double-blind, placebo-controlled trial. J Am Med Dir Assoc. 1 sept 2015;16(9):740‑7.
48. Bo Y, Liu C, Ji Z, Yang R, An Q, Zhang X, et al. A high whey protein, vitamin D and E supplement preserves muscle mass, strength, and quality of life in sarcopenic older adults: A double-blind randomized controlled trial. Clin Nutr Edinb Scotl. févr 2019;38(1):159‑64.
49. Cochet C, Belloni G, Buondonno I, Chiara F, D’ Amelio P. The Role of Nutrition in the Treatment of Sarcopenia in Old Patients: From Restoration of Mitochondrial Activity to Improvement of Muscle Performance, a Systematic Review. Nutrients. 24 août 2023;15(17):3703.
50. Dent E, Morley JE, Cruz-Jentoft AJ, Arai H, Kritchevsky SB, Guralnik J, et al. International Clinical Practice Guidelines for Sarcopenia (ICFSR): Screening, Diagnosis and Management. J Nutr Health Aging. 2018;22(10):1148‑61.
51. Rondanelli M, Klersy C, Terracol G, Talluri J, Maugeri R, Guido D, et al. Whey protein, amino acids, and vitamin D supplementation with physical activity increases fat-free mass and strength, functionality, and quality of life and decreases inflammation in sarcopenic elderly. Am J Clin Nutr. mars 2016;103(3):830‑40.
52. Papanicolaou DA, Ather SN, Zhu H, Zhou Y, Lutkiewicz J, Scott BB, et al. A phase IIA randomized, placebo-controlled clinical trial to study the efficacy and safety of the selective androgen receptor modulator (SARM), MK-0773 in female participants with sarcopenia. J Nutr Health Aging. 2013;17(6):533‑43.
53. Snyder PJ, Bhasin S, Cunningham GR, Matsumoto AM, Stephens-Shields AJ, Cauley JA, et al. Effects of Testosterone Treatment in Older Men. N Engl J Med. 18 févr 2016;374(7):611‑24.
54. Travison TG, Basaria S, Storer TW, Jette AM, Miciek R, Farwell WR, et al. Clinical Meaningfulness of the Changes in Muscle Performance and Physical Function Associated With Testosterone Administration in Older Men With Mobility Limitation. J Gerontol A Biol Sci Med Sci. oct 2011;66A(10):1090‑9.
55. Kwak JY, Kwon KS. Pharmacological Interventions for Treatment of Sarcopenia: Current Status of Drug Development for Sarcopenia. Ann Geriatr Med Res. sept 2019;23(3):98‑104.
56. Becker C, Lord SR, Studenski SA, Warden SJ, Fielding RA, Recknor CP, et al. Myostatin antibody (LY2495655) in older weak fallers: a proof-of-concept, randomised, phase 2 trial. Lancet Diabetes Endocrinol. déc 2015;3(12):948‑57.
57. Woodhouse L, Gandhi R, Warden SJ, Poiraudeau S, Myers SL, Benson CT, et al. A Phase 2 Randomized Study Investigating the Efficacy and Safety of Myostatin Antibody LY2495655 versus Placebo in Patients Undergoing Elective Total Hip Arthroplasty. J Frailty Aging. 2016;5(1):62‑70.
58. Rooks D, Praestgaard J, Hariry S, Laurent D, Petricoul O, Perry RG, et al. Treatment of Sarcopenia with Bimagrumab: Results from a Phase II, Randomized, Controlled, Proof-of-Concept Study. J Am Geriatr Soc. sept 2017;65(9):1988‑95.