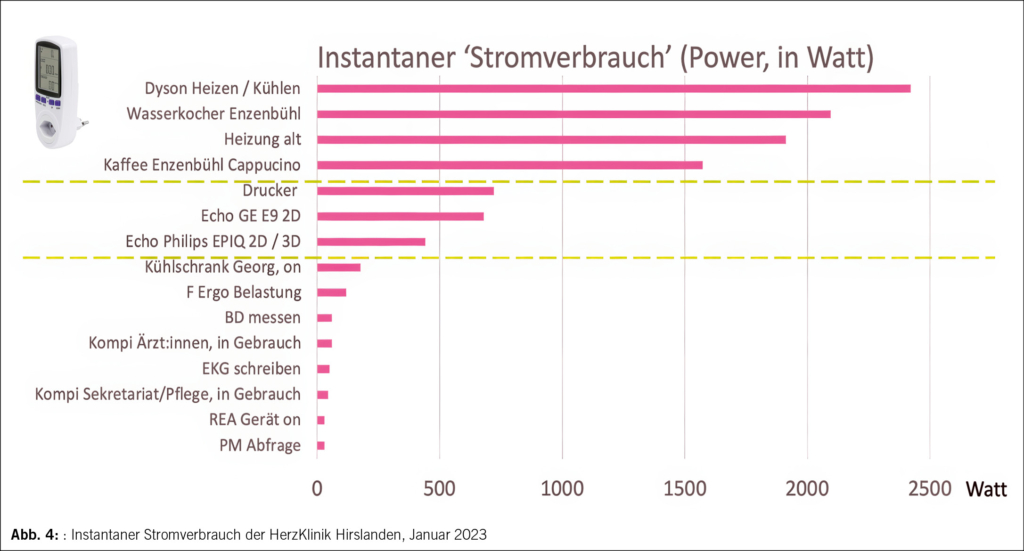
Die COPD ist in Industrieländern die vierthäufigste Todesursache und häufig unterdiagnostiziert. Die Erkrankung ist durch irreversible Atemwegsschäden mit variabler Pathophysiologie (z.B. Obstruktion und/oder Emphysem) geprägt. Während pharmakologische Therapien nur begrenzten Einfluss auf die Mortalität haben, sind sechs nicht-pharmakologische Interventionen evidenzbasiert wirksam: Rauchstopp, pulmonale Rehabilitation, Langzeit-Sauerstofftherapie, nicht-invasive Beatmung, Lungenvolumenreduktion und Lungentransplantation. Die Indikationsstellung für invasive Verfahren erfolgt interdisziplinär und erfordert eine sorgfältige Patientenselektion in Zentrumsspitälern.
COPD is the fourth most common cause of death in industrialised countries and is often underdiagnosed. The disease is characterised by irreversible airway damage with variable pathophysiology (e.g. obstruction and/or emphysema). While pharmacological therapies have only a limited impact on mortality, six non-pharmacological interventions have evidence-based efficacy: smoking cessation, pulmonary rehabilitation, long-term oxygen therapy, non-invasive ventilation, lung volume reduction and lung transplantation. Indications for invasive procedures are determined on an interdisciplinary basis and require careful patient selection in centre hospitals.
Key words: Rauchstopp, Pulmonale Rehabilitation, Langzeit-Sauerstofftherapie, Nicht-invasive Beatmung, Lungenvolumenreduktion, Lungentransplantation
Einführung
Die chronisch obstruktive Lungenerkrankung (COPD) betrifft weltweit schätzungsweise 384 Millionen Menschen, mit einer Lebenszeitprävalenz von etwa 10 % (1). In den Industrieländern stellt sie derzeit die vierthäufigste Todesursache dar – nach kardiovaskulären Erkrankungen, malignen Tumoren und COVID-19. Epidemiologische Daten legen nahe, dass mehr als die Hälfte aller COPD-Patienten nicht diagnostiziert ist.
Die Pathophysiologie der COPD ist heterogen, geprägt durch das Zusammenspiel genetischer Prädisposition und exogener Noxen. In der Schweiz ist Tabakrauch der Hauptauslöser, jedoch sind 3–11 % der Betroffenen Nieraucher, was auf zusätzliche Risikofaktoren wie Genetik, Umweltverschmutzung, berufliche Exposition oder sonstige biologische Faktoren zu erklären ist (1).
Die klinischen Phänotypen reichen von einer ausgeprägten bronchialen Obstruktion infolge einer luminalen Verengung bis hin zur irreversiblen Destruktion der endständigen Lungenbläschen (Emphysem), wobei fliessende Übergänge zwischen diesen Formen bestehen. Gemeinsames Merkmal aller Phänotypen ist eine irreversible Schädigung der Atemwege, die durch altersbedingte Prozesse weiter voranschreiten kann.
Die krankheitsbedingte Umgestaltung der Lungenstruktur («Remodeling») führt in vielen Fällen zu einer Überblähung, welche insbesondere das Zwerchfell – den wichtigsten Atemmuskel – in seiner Funktion einschränkt. Dies resultiert in einer ineffizienten Kontraktion und einer erhöhten Atemarbeit. Zur Aufrechterhaltung einer ausreichenden Oxygenation und/oder Ventilation greifen Patienten häufig auf kompensatorische Mechanismen zurück, wie beispielsweise die Kussmaul-Atmung zur Generierung eines auto-generierten endexpiratorischen Drucks (auto-PEEP).
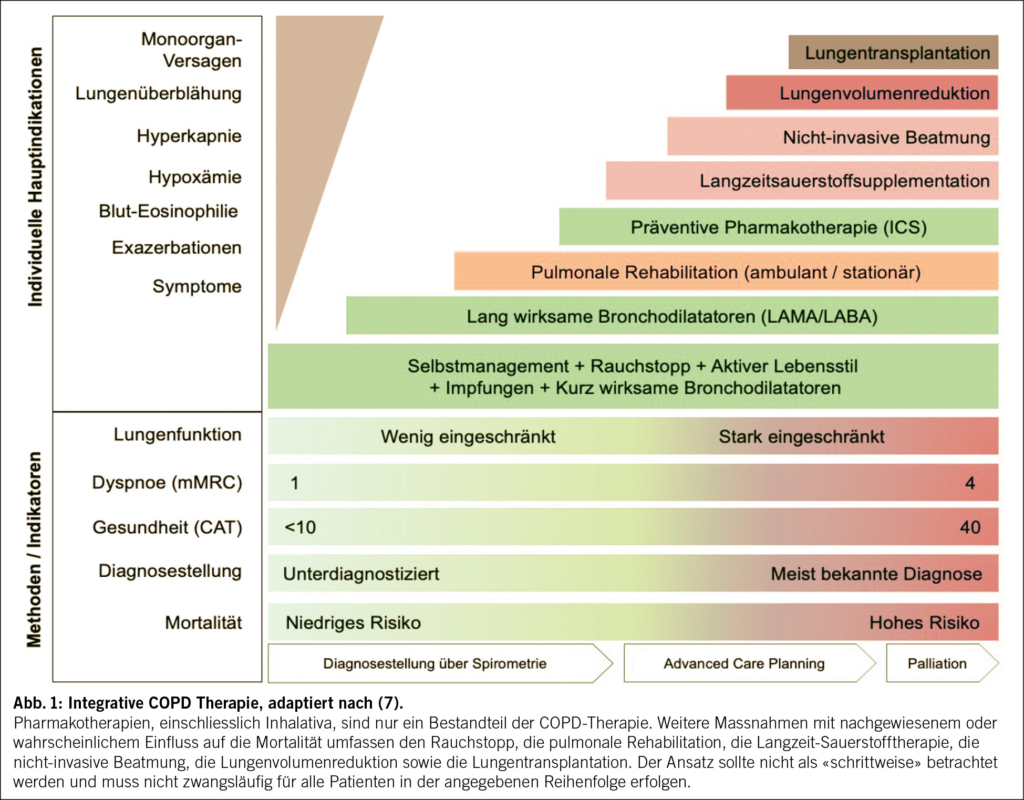
Im Gegensatz zur pharmakologischen Therapie der COPD, bei der eine Mortalitätsreduktion lediglich für den Einsatz inhalativer Kortikosteroide (ICS) in spezifischen Subgruppen diskutiert wird (Stichwort: Eosinophilie, Exazerbationen), existieren sechs evidenzbasierte und breit etablierte nicht-pharmakologische Interventionen, die nachweislich die Mortalität senken können (Abb. 1) (1).
Rauchstopp
Tabakrauch ist der wichtigste Risikofaktor für die Entstehung einer COPD in der Schweiz, die bei etwa 25–30 % der Raucher auftritt. Ein frühzeitiger Rauchstopp ist daher essenziell, um das Fortschreiten der Erkrankung zu verlangsamen. Studien zeigen, dass Ex-Raucher eine deutlich geringere Abnahme des FEV₁ aufweisen als weiterrauchende Patienten, was mit einer reduzierten Mortalität einhergeht. Entscheidend ist dabei die vollständige Abstinenz, da eine blosse Reduktion des Zigarettenkonsums ohne vollständigen Verzicht keinen vergleichbaren Nutzen bringt (2).
Trotz der bekannten Vorteile bleibt die Erfolgsrate der Raucherentwöhnung gering. Viele COPD-Patienten rauchen weiterhin, was vor allem auf die suchterzeugende Wirkung von Nikotin zurückzuführen ist. Neben der körperlichen Abhängigkeit spielen auch psychologische und soziale Faktoren eine Rolle. Eine regelmässige ärztliche Thematisierung des Rauchstopps kann die Motivation erhöhen und die Erfolgsquote verbessern.
Zur Unterstützung des Rauchstopps sind häufig pharmakologische Therapien erforderlich. Dazu gehören die Nikotinersatztherapie, Bupropion und Vareniclin, die nachweislich die Abstinenzraten erhöhen. Der Einsatz von E-Zigaretten zur Raucherentwöhnung bleibt umstritten: Während einige Studien positive Effekte nahelegen, fehlen belastbare Langzeitdaten zur Sicherheit und Wirksamkeit. Da Rückfälle häufig sind, sollte die Raucherentwöhnung als langfristiger Prozess betrachtet werden.
Pulmonale Rehabilitation
Die pulmonale Rehabilitation ist ein zentraler Bestandteil der COPD-Therapie, da das Ausmass der körperlichen Aktivität den wichtigsten Prädiktor für Exazerbationen und die Überlebensrate darstellt – noch vor dem FEV₁. Neben der Verbesserung der körperlichen Leistungsfähigkeit und der Lebensqualität, reduziert sie nachweislich das Risiko für Hospitalisierungen.
In der Schweiz haben alle COPD-Patienten ab Risikoklasse B einmal jährlich Anspruch auf eine ambulante pulmonale Rehabilitation. Ein fortgesetzter Tabakkonsum stellt dabei keine Kontraindikation dar – im Gegenteil: Die Rehabilitation kann effektiv mit einem Rauchstopp-Programm kombiniert werden.
Absolute Kontraindikationen sind vor allem instabile kardiale Erkrankungen sowie schwerwiegende orthopädische oder neurologische Einschränkungen, die eine Teilnahme unmöglich machen. Eine Übersicht geeigneter Rehabilitationszentren ist unter pneumo.ch/pulmonale-rehabilitation verfügbar.
Langzeit-Sauerstofftherapie
Die Langzeit-Sauerstofftherapie (je nach Setting: Druckgas, Sauerstoffkonzentrator oder Flüssigsauerstoff) ist seit Jahrzehnten ein zentraler Bestandteil der Therapie im Endstadium der COPD. Ihr Ziel ist es, Symptome zu lindern, die Funktion des Herz-Kreislaufsystems (inkl. pulmonale Hypertonie) zu verbessern und die Lebenserwartung der Patienten zu erhöhen (3, 4).
Die Indikation zur Langzeit-Sauerstofftherapie besteht bei Patienten mit einem arteriellen Sauerstoffpartialdruck (PaO₂) von ≤ 7.3 kPa oder zwischen 7.3 und 8.0 kPa, sofern begleitende Komorbiditäten wie pulmonale Hypertonie, ein Hämatokritwert von > 55 % oder periphere Ödeme vorliegen. In diesen Fällen sollte die Sauerstoffgabe idealerweise rund um die Uhr erfolgen.
Zusätzlich kann eine Sauerstofftherapie bei Patienten mit signifikanter Belastungsdesaturation erwogen werden, um kurzfristige Sauerstoffabfälle zu verhindern und den Bewegungsradius zu erhöhen. In solchen Fällen ist jedoch eine individuelle Anpassung erforderlich, da die Evidenzlage hierzu uneinheitlich ist.
Nicht-invasive Beatmung
Die nicht-invasive Beatmung (NIV) ist primär für eine kleine Gruppe von COPD-Patienten mit chronischer Hyperkapnie und gegebenenfalls bereits etablierter Sauerstofftherapie vorgesehen. In diesen Fällen zeigt sie positive Effekte auf Symptomatik, Rehospitalisationen und Lebenserwartung (5).
Darüber hinaus könnten auch Patienten, die während einer akuten Exazerbation eine kontinuierliche NIV benötigen, nach der Entlassung von einer nächtlichen NIV profitieren.
Bei stabilen ambulanten Patienten mit chronischer Hyperkapnie sollte die Indikation für eine NIV individuell geprüft werden. Insbesondere bestehende Komorbiditäten – wie eine obstruktive Schlafapnoe – spielen eine entscheidende Rolle. Die Einleitung und Anpassung der Therapie sollten idealerweise in einem spezialisierten Beatmungszentrum erfolgen.
Lungenvolumenreduktion
Nach Ausschöpfung nicht-invasiver Therapiemassnahmen hat sich die Lungenvolumenreduktion (LVR) als wirksame Behandlungsoption für ausgewählte COPD-Patienten etabliert, was durch mehr als 20 randomisierte Studien belegt ist (6). Ziel des Verfahrens ist die Entfernung oder der Kollaps emphysematöser, überblähter Lungenareale, die eine unterdurchschnittliche Ventilation und Perfusion aufweisen. Durch die Reduktion der Überblähung verbessert sich die Mechanik des Zwerchfells und der Brustwand, die elastischen Rückstellkräfte werden wiederhergestellt, und die Atemarbeit nimmt ab.
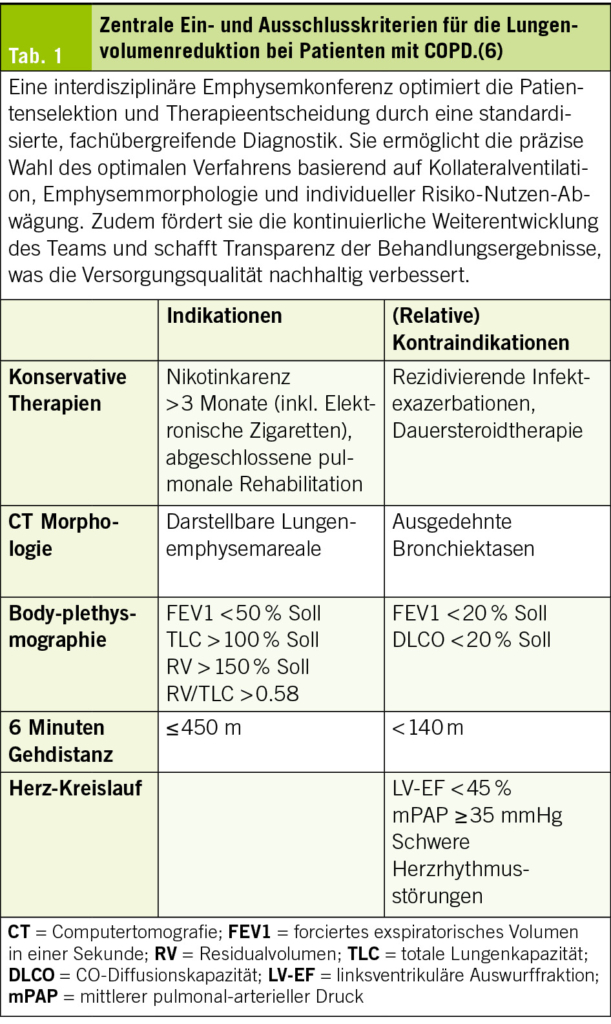
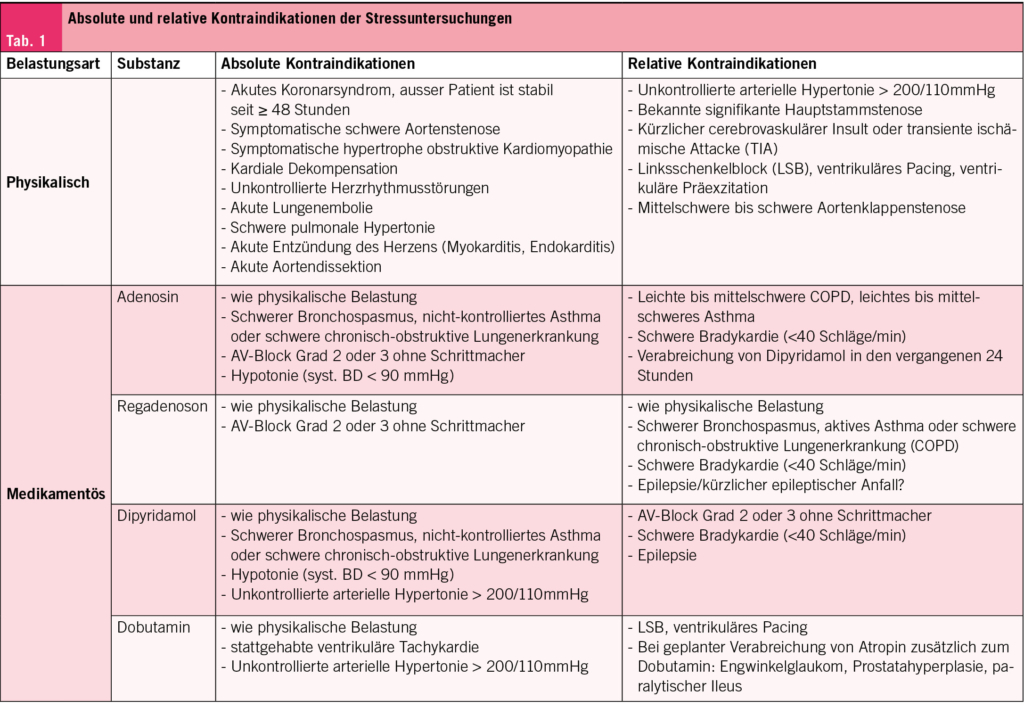
Für die Lungenvolumenreduktion stehen sowohl minimal-invasive bronchoskopische Verfahren – wie Ventile, Coils oder Dampf – als auch die chirurgische Resektion mittels thorakoskopischer Technik zur Verfügung. Aktuell gibt es keine eindeutigen Hinweise auf eine Überlegenheit einer dieser Methoden, weshalb die Wahl des Verfahrens individuell getroffen werden muss. Die Patientenselektion erfolgt interdisziplinär an sogenannten Emphysemboards, in denen Pneumologen und Thoraxchirurgen gemeinsam die Indikation stellen (Tab. 1). Da nur sorgfältig ausgewählte Patienten nachweislich von der Therapie profitieren, sollte die Zuweisung idealerweise an spezialisierte Zentren erfolgen, die in beiden Verfahren (bronchoskopisch, chirurgisch) Erfahrung haben.
Vor der Durchführung sind potenzielle Kontraindikationen wie eine relevante koronare Herzkrankheit oder eine pulmonale Hypertonie auszuschliessen. Zudem sind eine Lungenperfusionsszintigraphie zur Identifikation der Zielzonen sowie eine Fissurenanalyse erforderlich, die entweder softwaregestützt mittels hochauflösendem CT oder durch bronchoskopische Dichtigkeitsmessungen erfolgt. Gelegentlich kann eine LVR mit der Entfernung eines zufällig entdeckten malignitätssuspekten Rundherds kombiniert werden, sofern dieser sich in der Zielzone befindet.
Primäres Ziel der LVR ist die Verbesserung der Symptomatik, insbesondere eine Steigerung der körperlichen Leistungsfähigkeit und der Lebensqualität, mit potenziell positivem Einfluss auf die Lebenserwartung. Darüber hinaus kann die Methode als Überbrückungsmassnahme («Bridge-to-Transplant») für Patienten mit langen Wartezeiten auf eine Lungentransplantation in Betracht gezogen werden.
Lungentransplantation
Seit der Einführung der überaus effektiven pharmakologischen Therapie mit Potentiatoren und Korrektoren des CFTR (cystic fibrosis transmembrane conductance regulator)-Proteins für Patienten mit cystischer Fibrose ist die COPD in den meisten Lungentransplantationszentren zur häufigsten Indikation für eine uni- oder bilaterale Lungentransplantation geworden. Die Indikationsstellung ist jedoch komplex und erfordert eine interdisziplinäre Beurteilung im Rahmen eines sogenannten Lungenkolloquiums. Um eine fundierte Entscheidung treffen zu können, erfolgen die notwendigen Abklärungen in der Regel stationär und unter sorgfältiger Abwägung aller relevanten Faktoren.
Besondere Herausforderungen ergeben sich aus den zahlreichen Komorbiditäten, die häufig durch langjährigen Tabakrauchkonsum bedingt sind. Die eigentliche Schwierigkeit dieser Therapieoption liegt nicht nur in der Indikationsstellung selbst, sondern insbesondere darin, die durch Rauchen verursachten Begleiterkrankungen mit den strengen Auswahlkriterien für eine Lungentransplantation in Einklang zu bringen. So dürfen keine relevanten kardiovaskulären oder metabolischen Erkrankungen vorliegen, die den Erfolg der Transplantation beeinträchtigen könnten. Eine starre Altersgrenze existiert zwar nicht, vielmehr spielt das biologische Alter der Patienten eine wesentliche Rolle in der individuellen Beurteilung.
Die Wartezeit auf der Lungentransplantationsliste ist nicht genau vorhersehbar, da sie von verschiedenen Faktoren abhängt. Ein zentraler Aspekt ist dabei die Blutgruppe des Empfängers, die massgeblich die Verfügbarkeit eines passenden Organs bestimmt.
Copyright
Aerzteverlag medinfo AG
Oberarzt
Klinik für Pneumologie
Universitätsspital Zürich
thomas.gaisl@usz.ch
Oberärztin meV
Klinik für Pneumologie
Universitätsspital Zürich
carolin.steinack@usz.ch
Department of Pneumology
University Hospital Zurich
Die Autorenschaft hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Diseaese, G.I.f.C.O.L. 2025 Report: Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. 2025.
2. Lokke, A., et al., Developing COPD: a 25 year follow up study of the general population. Thorax, 2006. 61(11): p. 935-9.
3. Continuous or nocturnal oxygen therapy in hypoxemic chronic obstructive lung disease: a clinical trial. Nocturnal Oxygen Therapy Trial Group. Ann Intern Med, 1980. 93(3): p. 391-8.
4. Long term domiciliary oxygen therapy in chronic hypoxic cor pulmonale complicating chronic bronchitis and emphysema. Report of the Medical Research Council Working Party. Lancet, 1981. 1(8222): p. 681-6.
5. Murphy, P.B., et al., Effect of Home Noninvasive Ventilation With Oxygen Therapy vs Oxygen Therapy Alone on Hospital Readmission or Death After an Acute COPD Exacerbation: A Randomized Clinical Trial. JAMA, 2017. 317(21): p. 2177-2186.
6. Caviezel, C., et al., (Surgical or bronchoscopic lung volume reduction for emphysema therapy). Zentralbl Chir, 2023. 148(S 01): p. S51-S70.
7. Bourbeau, J., et al., 2023 Canadian Thoracic Society Guideline on Pharmacotherapy in Patients with Stable COPD. Canadian Journal of Respiratory, Critical Care, and Sleep Medicine, 2023. 7(4): p. 173-191