Einleitung
Kardiovaskuläre Erkrankungen stellen in der Schweiz die häufigste nicht übertragbare Erkrankung dar und sind zudem auch die häufigste Todesursache. Die individuelle Krankheitslast durch körperliche Beeinträchtigungen und frühzeitigen Tod ist ebenso erheblich wie die gesundheitsökonomischen Belastungen. So summierten sich die direkten und indirekten Kosten in der Schweiz im Jahr 2021 geschätzt etwa auf 27.8 Mrd CHF, somit 4 % des Bruttoinlandsprodukts (1).
Dabei sind die präventiven und therapeutischen Massnahmen sowohl interventioneller als auch medikamentöser Art so umfangreich und wirksam wie in keinem anderen Krankheitsgebiet. Ausser Alter und Geschlecht lassen sich nahezu alle weiteren kardiovaskulären Risikofaktoren derart beeinflussen, dass es zu einer starken und signifikanten Reduzierung des kardiovaskulären Risikos kommt (2). Neben einem allfälligen Rauchstopp und körperlicher Aktivität ist vor allem die leitliniengerechte Einstellung von Blutdruck, Lipiden und einem eventuellen Diabetes von entscheidender Bedeutung. Studien zeigen hier aber sowohl auf europäischer Ebene wie auch in der Schweiz erhebliches Verbesserungspotential (3–8). Wichtig für die Akzeptanz und Adhärenz von primär- und sekundärpräventiven Massnahmen, sowohl medikamentöser wie auch nichtmedikamentöser Art, ist sicher auch das Wissen der Patienten über die einzelnen Risikofaktoren. Zwar existieren in vielen Ländern nationale Gesundheitssurveys etwa zur Prävalenz von kardiovaskulären Erkrankungen, aber erstaunlicherweise finden sich relativ wenig Studien, die gezielt das Wissen von Menschen zu kardiovaskulären Risikofaktoren und deren Beeinflussbarkeit untersucht haben. Vorhandene Studien deuten darauf hin, dass das Rauchen, der Blutdruck und ein eventuell vorhandener Diabetes mellitus als Risikofaktoren wahrgenommen werden, dass aber insbesondere die Lipide, respektive das Cholesterin, als Risikofaktor eher zu wenig wahrgenommen oder unterschätzt werden – nicht zuletzt auch aufgrund kontroverser Medienberichte (9, 10).
Das Ziel der vorliegenden Arbeit war es daher zu untersuchen, welche Faktoren in der Allgemeinbevölkerung als Risikofaktoren wahrgenommen werden und wie die Einschätzung über deren Beeinflussbarkeit ausfällt. Dies sind zentrale Erkenntnisse, um künftige Präventionskampagnen effektiver zu gestalten, aber auch um die individuelle Arzt-Patienten-Kommunikation gezielter auf unterschätzte Risiken und Interventionsmassnahmen abzustellen und die Adhärenz zu erhöhen.
Methodik
Via die Zeitschrift «Doktor Stutz», eine etablierte Schweizer Zeitschrift, die sich an medizinische Laien richtet, wurde ein Link zu einem Online-Survey versandt. Zudem war der Link via die Online-Ausgabe der Zeitschrift erreichbar. Der Fragebogen war von 28.11.24 bis 8.1.25 verfügbar. Die Umfrage war vollständig anonymisiert, eine Identifikation der Teilnehmer nicht möglich, daher kam das Schweizer Humanforschungsgesetz (HFG) nicht zur Anwendung und ein Ethikvotum war nicht notwendig. Der Survey erfasste neben soziodemographischen Angaben auch Informationen zum individuellen Gesundheitszustand und kardiovaskulären Vorerkrankungen. Abgefragt wurden zudem Aussagen zu kardiovaskulären Erkrankungen im Allgemeinen, denen mit «ja», «eher ja», «eher nein» und «nein» zugestimmt, respektive widersprochen werden konnte, zudem gab es die Antwortmöglichkeit «ich weiss es nicht».
In einer weiteren Frage wurde erhoben, ob die Teilnehmenden ihre eigenen Werte für Blutdruck, Blutzucker, Cholesterin und den Body Mass Index (BMI) «sehr genau», «ungefähr» oder «gar nicht» kennen.
Der Frage nach den Risikofaktoren für kardiovaskuläre Erkrankungen wurde ein aufsteigender Zahlenwert zugeordnet, je nach der Einschätzung des potentiellen Einflusses auf das kardiovaskuläre Risiko durch die Befragten, von 1 für «gar nicht» bis 5 für «sehr stark». Diese Gewichtung seitens der Befragten wurde mit der Anzahl der jeweiligen Antworten multipliziert und aufaddiert um so eine Gesamtgewichtung der einzelnen Risikofaktoren zu erreichen. Zudem erfolgte die Berechnung des Mittelwerts, des Medians und des Interquartilsabstandes (IQR).
Ergebnisse
Insgesamt wurden 3166 Antworten erfasst, in 2671 Fällen wurde der Fragebogen vollständig ausgefüllt. Frauen waren mit 79.5 % (2.149) deutlich überrepräsentiert gegenüber Männern mit 20.5 % (554). 3108 Teilnehmende beantworteten die Frage zum Gesundheitszustand. 1025 (32.9 %) Personen gaben an, an einer Herz-Kreislauf-Erkrankung zu leiden, 2059 (66.2 %) verneinten dies. Mit 61.2 % (1902) war die Mehrheit der Teilnehmenden zwischen 59 und 79 Jahren alt, 513 (16.5 %) Personen waren zwischen 39 und 58 Jahren, 266 (8.6 %) über 79 Jahre und 24 (0.8 %) unter 39 Jahren alt. Hinsichtlich des Bildungsstands gab die Mehrheit (1542, 49.6 %) an, die obligatorische Schulpflicht absolviert zu haben, 1435 (46.2 %) Personen verfügten über eine höhere Berufsausbildung (eidgenössische Berufs-/Fachprüfung), 302 (9.7 %) Personen über einen Fachholschulabschluss und 174 (5.6 %) über einen Universitäts- oder ETH-Abschluss.
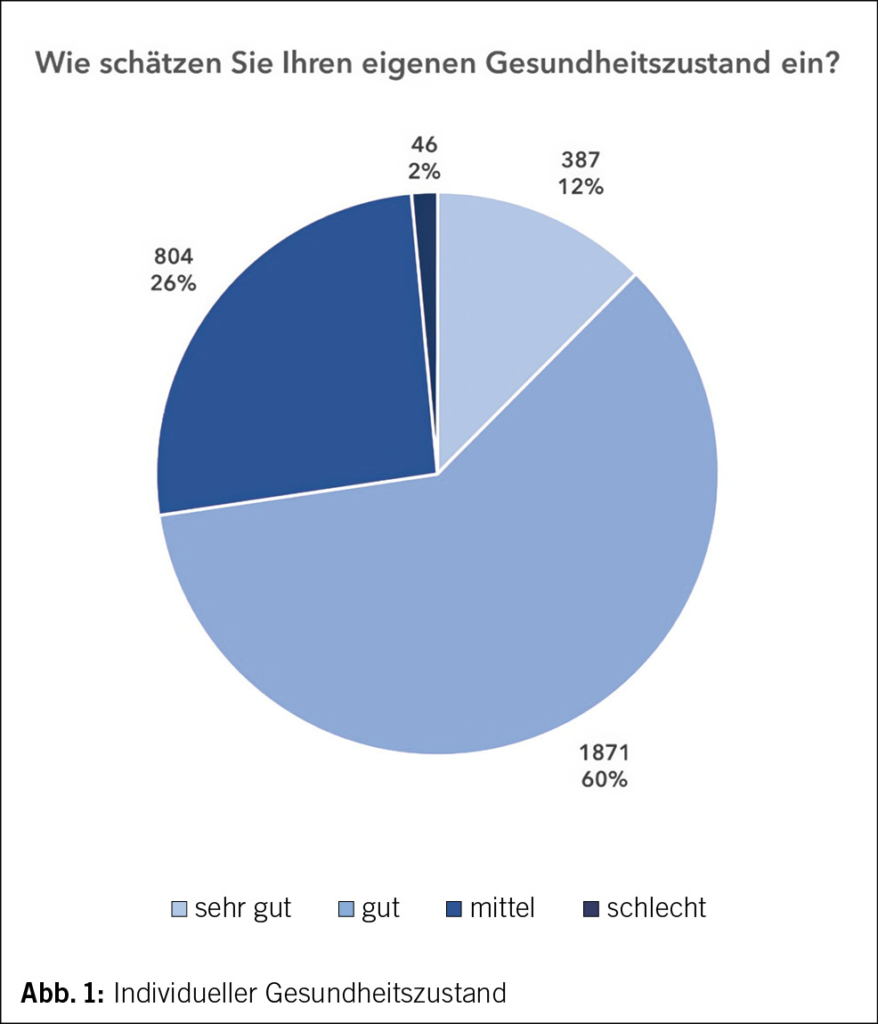
Die Mehrheit 1871 (60.2 %) schätzte den persönlichen Gesundheitszustand als gut ein, 804 (25.8 %) als mittel, 387 (12.4 %) als sehr gut und nur 46 (1.5 %) als schlecht (Abb. 1).
Aussagen zu Herz-Kreislauf-Erkrankungen
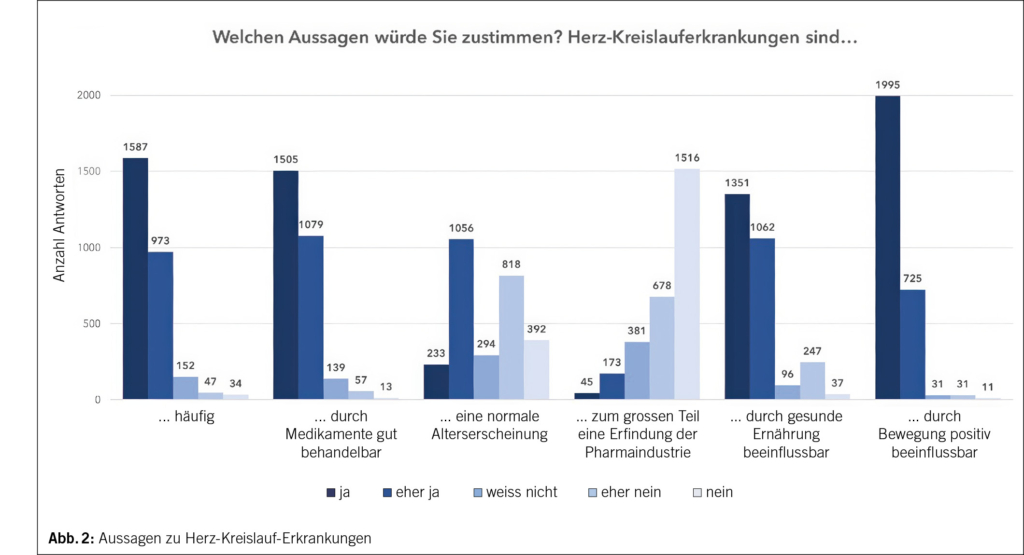
Diese Frage wurde von 2793 Teilnehmenden beantwortet. 2560 (91.6 %) Personen stimmten der Aussage zu, dass Herz-Kreislauf-Erkrankungen häufig sind (ja: 1587, eher ja: 973) und nur ganz wenige negierten dies vollständig (34, 1.2 %). Ähnlich wurde die Frage zur medikamentösen Behandlungsmöglichkeit eingeschätzt, die Mehrheit stimmte der Aussage voll 1505 (53.9 %) oder überwiegend 1079 (38.6 %) zu, dass kardiovaskuläre Erkrankungen gut medikamentös behandelbar sind. 70 (2.5 %) Befragte negierten dies. Bei der Frage, ob es sich bei Herz-Kreislauf-Erkrankungen um eine normale Alterserscheinung handelt, waren 1289 (46.1 %) Personen der Meinung dies träfe (eher) zu, während nahezu ähnlich viele 1210 (43.3 %) dies völlig oder eher verneinten. Der positiven Beeinflussbarkeit durch Bewegung (2720; 97.3 %) oder gesunde Ernährung (2413; 86.4 %) wurde überwiegend zugestimmt. 78.5 % (2194 Personen) lehnten die Aussage ab, kardiovaskuläre Erkrankungen wären überwiegend eine Erfindung der Pharmaindustrie (Abb. 2).
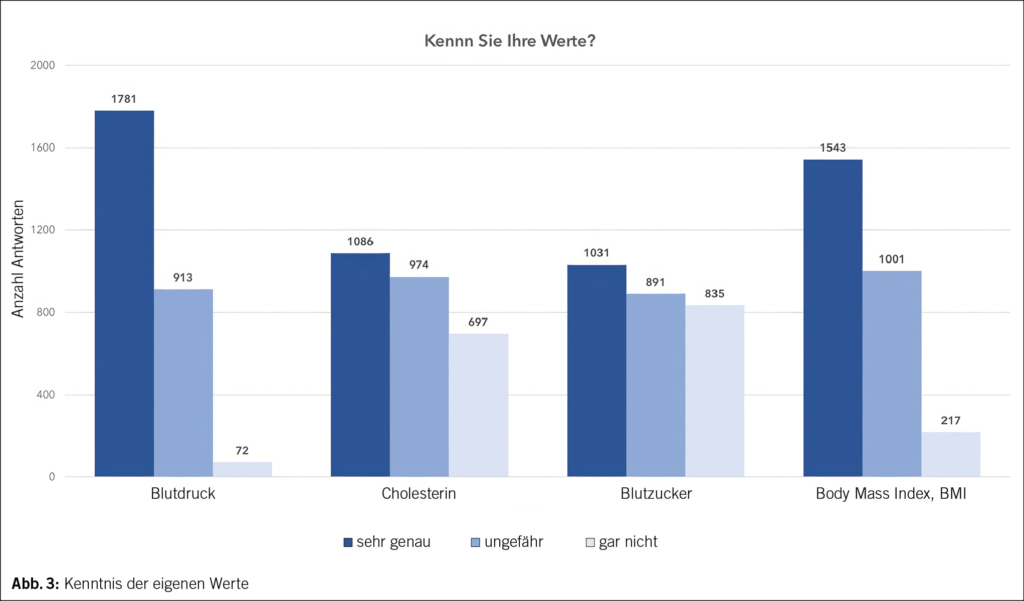
Kenntnis der eigenen Werte
2766 Befragte machten Angaben hierzu. Der eigene Blutdruck war den meisten Befragten bekannt: 1781 (64.3 %) gaben an, ihn sehr genau zu kennen, 913 (33 %) kennen ihn immerhin ungefähr. Der zweitgeläufigste Wert war der Body Mass Index, den 1543 (55.7 %) sehr genau kannten. Nur 217 (7.8 %) war er völlig unbekannt. Den Blutzucker kannten 1031 (37.2 %) respektive 891 (32.2 %) Personen sehr genau oder zumindest ungefähr. Beim Cholesterin gaben 1086 (39.2 %) an, den Wert sehr genau zu kennen, während 697 (25.2 %) Personen angaben, ihnen sei ihr Cholesterinwert gar nicht bekannt (Abb. 3).
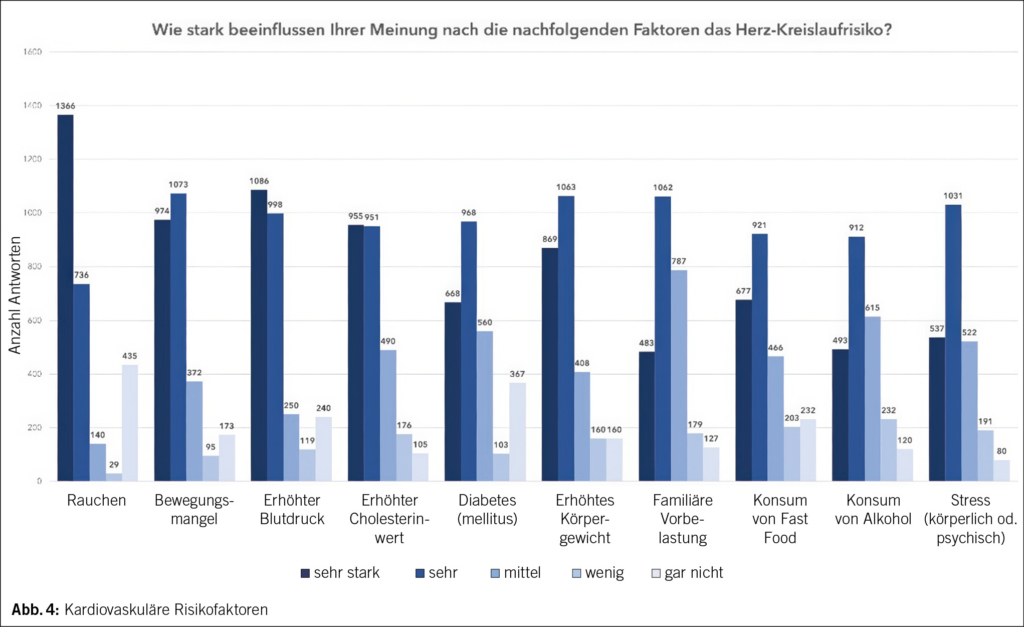
Risikofaktoren für Herz- und Kreislauf-Erkrankungen
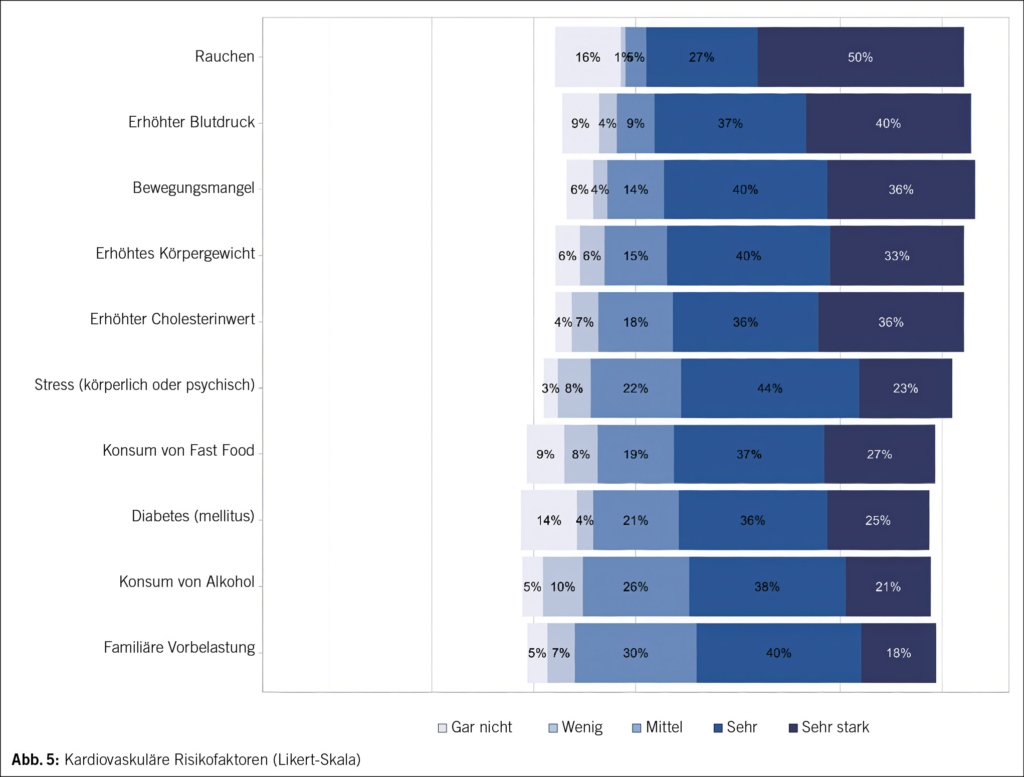
2706 Befragte gaben ihre Einschätzung zu den kardiovaskulären Risikofaktoren ab. Mit einem aufaddierten Gesamtwert von 10 687, respektive einem Mittelwert von 3.97 war Rauchen der am stärksten gewichtete Risikofaktor (Abb. 4). Mit 1366 Befragten (50.5 %) werteten knapp über 50 % diesen Faktor als sehr starken Risikofaktor, allerdings waren auch 16.1 % (435 Personen) der Meinung, Rauchen sei überhaupt kein Risikofaktor. Cholesterin und Blutdruck wurden nahezu gleichauf als starke Risikofaktoren eingestuft, mit Summenwerten von 10 706, respektive 10 650 und Durchschnittswerten von 3.97 und 3.95 (Median jeweils 4, IQR 4–5). Mit einem Summenwert von 10 641 (Durchschnitt 3.95) folgte Bewegungsmangel (Median 4, IQR 4–5), hier waren 1073 (39.7 %) der Befragten der Meinung, dies sei ein sehr starker Risikofaktor. Geringer gewichtet wurde ein Diabetes mellitus als kardiovaskulärer Risikofaktor mit einem Summenwert von 9465 und einem Durchschnittswert von 3.51 (Median 4, IQR 3–5). Immerhin 367 (13.6 %) Befragte werteten Diabetes überhaupt nicht als Risikofaktor. In der weiteren Rangfolge folgte eine familiäre Vorbelastung (9509, 3.52), Konsum von Fast Food (9105, 3.39), Stress (8861, 3.28), Konsum von Alkohol (8542, 3.16) und erhöhtes Körpergewicht (8301, 3.08). In Abb. 5 werden die Angaben in einer Likert-Skala abgebildet, die die Abweichung von einer neutralen Einschätzung des jeweiligen Risikofaktors darstellt.
Diskussion
Die vorliegende Umfrage ist nach unserem Wissen die erste Erhebung in der Schweiz unter medizinischen Laien, die Einschätzungen zum kardiovaskulären Risiko im Allgemeinen, Kenntnisse über individuelle Risikofaktoren und die grundsätzliche Beeinflussbarkeit dieser Risikofaktoren erfasst. Die Ergebnisse zeigen eine erfreulich gute Orientierung über die Risikofaktoren, aber auch einige Ansatzpunkte für eine vertiefte Aufklärung in der Primär- und Sekundärprävention von kardiovaskulären Erkrankungen.
Die Ergebnisse unseres Surveys sind im Kontext des befragten Samples zu betrachten. Dieses reflektiert hinsichtlich der Altersverteilung die typische Leserschaft eines Gesundheitsmagazins, so waren über 60 % der Teilnehmenden zwischen 59 und 79 Jahren alt, einem Alter, in dem das Interesse an Gesundheitsthemen und insbesondere hochprävalenten kardiovaskulären Erkrankungen in den Vordergrund rückt. Studien zeigen, dass der Bildungsstand, nicht aber das Einkommen, Einfluss auf kardiovaskuläre Risikofaktoren und hier insbesondere wohl via Ernährung auf den Cholesterinspiegel hat (9). Auch wenn der Bildungsstand unseres Samples keine Verzerrung zu Akademikern (15.3 %) hin erkennen lässt, so ist doch davon auszugehen, dass bei den meisten Teilnehmenden bereits eine Auseinandersetzung mit dem Thema stattgefunden hat und die Teilnehmer diesbezüglich als gebildeter gelten müssen. Die selbstdeklarierte Prävalenz der Herz-Kreislauf-Erkrankung liegt mit 33.9 % im zu erwartenden Bereich, so leiden laut Schweizer Gesundheitssurvey 27.6 % der 55–64-jährigen und 45.8 % der 65–74-jährigen an einer Herz-Kreislauf-Erkrankung (11). Zu berücksichtigen ist auch, dass der Frauenanteil mit fast 80 % bei den Teilnehmenden stark überwog, was deren höheres Interesse an Gesundheitsthemen widerspiegeln dürfte.
Zwiegespalten waren die Teilnehmenden bei der Frage, ob kardiovaskuläre Erkrankungen eine natürliche Alterserscheinung darstellen. Dies mag daran liegen, dass ein hoher Prozentsatz der Überzeugung war, man könne diese Erkrankungen durch einen aktiven Lebensstil (97.3 %) und gesundheitsbewusste Ernährung (86.4 %) positiv beeinflussen. Auch diese hohe Selbstwirksamkeitseinschätzung dürfte ein Spezifikum des befragten Samples sein. Adhärenz-Probleme sind im ärztlichen Alltag häufig, daher hatten wir eine skeptische Haltung gegenüber medikamentösen Therapien, respektive gegenüber der Pharmaindustrie erwartet. In unserem Survey zeigt sich allerdings eine grosse Mehrheit von der medikamentösen Beeinflussbarkeit der Herz-Kreislauf-Erkrankungen überzeugt.
Besser denn erwartet, aber immer noch ungenügend, ist auch die Orientierung der Befragten über die eigenen Werte: 64.3 % kannten ihren Blutdruck nach eigener Angabe «sehr genau». In einer Studie von Oliveiria et al. unter Hypertonikern gaben beispielsweise 91 % an, dass ihnen bewusst sei, dass eine Blutdrucktherapie für sie wichtig ist, aber nur 41 % kannten ihren eigenen Blutdruck (12). In einer älteren Studie von Murdoch et al. befragte man Patienten, die eine Cholesterinmessung erhalten hatten, zu ihrem Lipidstatus und Cholesterinwerten, nur 19 % konnten ihren Wert genau erinnern, dies war insbesondere der Fall, wenn er mit Diätempfehlungen verbunden war (13). Dieses Ergebnis passt zu den qualitativen Ergebnissen von Goldman et al., die zeigen, dass insbesondere konkrete Behandlungsempfehlungen für Patienten wichtig sind (14).
Zum Kenntnisstand der Bevölkerung bezüglich kardiovaskulärer Risikofaktoren existieren erstaunlicherweise nur wenige Studien jüngeren Datums aus Westeuropa, und wenn beziehen sie sich meist auf Personengruppen, die beispielsweise ein höheres Risiko mitbringen, wie Menschen mit familiärer Hypercholsterinämie oder einem Schwangerschaftsbluthochdruck (15).
Bisherige Studien, etwa an US Veteranen, haben ein deutliches Verbesserungspotential hinsichtlich des Kenntnisstands kardiovaskulärer Risikofaktoren auch unter betroffenen Patienten gezeigt (16). Aber auch Studien mit jüngeren Personen, meist selbst mit einem hohen kardiovaskulären Risiko behaftet, zeigten eher geringe Kenntnisse über die Risikofaktoren (15, 17, 18).
Im Widerspruch zu der von uns gefundenen guten Orientierung über Risikofaktoren und eigene Werte mag die Aussage aus unserem Surevy erscheinen, dass 435 (13.5 %) Befragte das Rauchen nicht oder nur als geringen (29; 1.1 %) Risikofaktor bewerteten. In einer ähnlichen Befragung aus den Arabischen Emiraten beispielsweise werteten 91 % Rauchen als Risikofaktor und nur 9 % negierten dies, in einer Studie in Äthopien beurteilten nur 12 % Rauchen nicht als Risikofaktor (18, 19).
Die in der Literatur beschriebene und durch die Medien gelegentlich weiter angetriebene Skepsis und damit einhergehenden Adhärenz-Probleme in Bezug auf die Statine (10, 20), bilden sich in unseren Ergebnissen nicht ab, so wurde Cholesterin als Risikofaktor hoch gewertet. Insgesamt stehen unsere Ergebnisse fast etwas im Widerspruch zu Daten, die zeigen, dass ein relevanter Prozentsatz der kardiovaskulären Risikopatienten nicht die von den Leitlinien geforderten Grenzwerte für Blutdruck und insbesondere das LDL-Cholesterin erreicht – in der Schweiz wie auch in ganz Europa (5, 7, 21, 22).
Limitationen
Unsere Ergebnisse weisen teilweise eine bessere Orientierung über Risikofaktoren aus als sonst in der Literatur widergespiegelt, zudem ist insbesondere die Skepsis hinsichtlich medikamentöser Behandlungsmöglichkeiten geringer ausgeprägt. Ursächlich hierfür dürfte ein selection bias sein – ein Gesundheitsmagazin, über das die Befragung kommuniziert wurde, adressiert per se eine eher gesundheitsbewusstere und besser informierte Population mit besonderem Interessen an dem Thema. Von daher sind unsere Ergebnisse sicherlich nicht auf die Schweizer Bevölkerung generell übertragbar. Eine Stärke des Surveys ist jedoch seine vergleichsweise grosse Zahl an Teilnehmenden und die Tatsache, dass sie genau jene Altersgruppe adressierte, die das höchste kardiovaskuläre Risiko aufweist.
Schlussfolgerungen
Unsere Ergebnisse deuten darauf hin, dass das Wissen um die Bedeutung kardiovaskulärer Risikofaktoren in für die kardiovaskuläre Prävention relevanten Bevölkerungsgruppen grösser ist als angenommen. Wissen allein garantiert noch keine Therapieadhärenz, ist aber dennoch eine entscheidende Voraussetzung. Vielleicht unterschätzen viele Ärzte die Bereitschaft der Patienten evidenzbasierte Therapien umzusetzen. Unsere Ergebnisse sind dahingehend ermutigend, als dass das vorhandene Grundwissen ergänzt um eine umfassende Aufklärung, beispielsweise mittels Risikoscores (14), die Voraussetzung schaffen sollte, höhere Zielerreichungsgrade umzusetzen, als dies derzeit noch der Fall ist.