Die akute Lungenembolie zählt zu den häufigsten Ursachen für kardiovaskuläre Morbidität und Mortalität. Je nach Thrombuslast kann die Obstruktion im pulmonalen Kreislauf von leichter Rechtsherzbelastung bis hin zum Rechtsherzversagen und kardiogenen Schock führen. Eine rasche diagnostische Abklärung und Risikostratifizierung ist essenziell, um ehestmöglich eine adäquate Therapie einleiten zu können. Diese kann von einer Antikoagulation im ambulanten Setting bis hin zu kreislaufstabilisierenden Massnahmen und notfallmässiger Reperfusion durch ein multidisziplinäres, spezialisiertes Lungenembolie-Team reichen.
Epidemiologische Aspekte und Pathophysiologie der akuten Lungenembolie
Die akute Lungenembolie (LE) zählt zu den häufigsten Ursachen für kardiovaskuläre Morbidität mit einer jährlichen Inzidenz von 1 in 1000 Personen und einer Mortalität von bis zu 30 % in Hochrisikopopulationen (1-5). Die Ursache für die hohen Mortalitätsraten liegt hierbei in der akuten rechtsventrikulären Belastung mit resultierender Rechtsherzinsuffizienz bis hin zum kardiogenen Schock und Kreislaufstillstand (6).
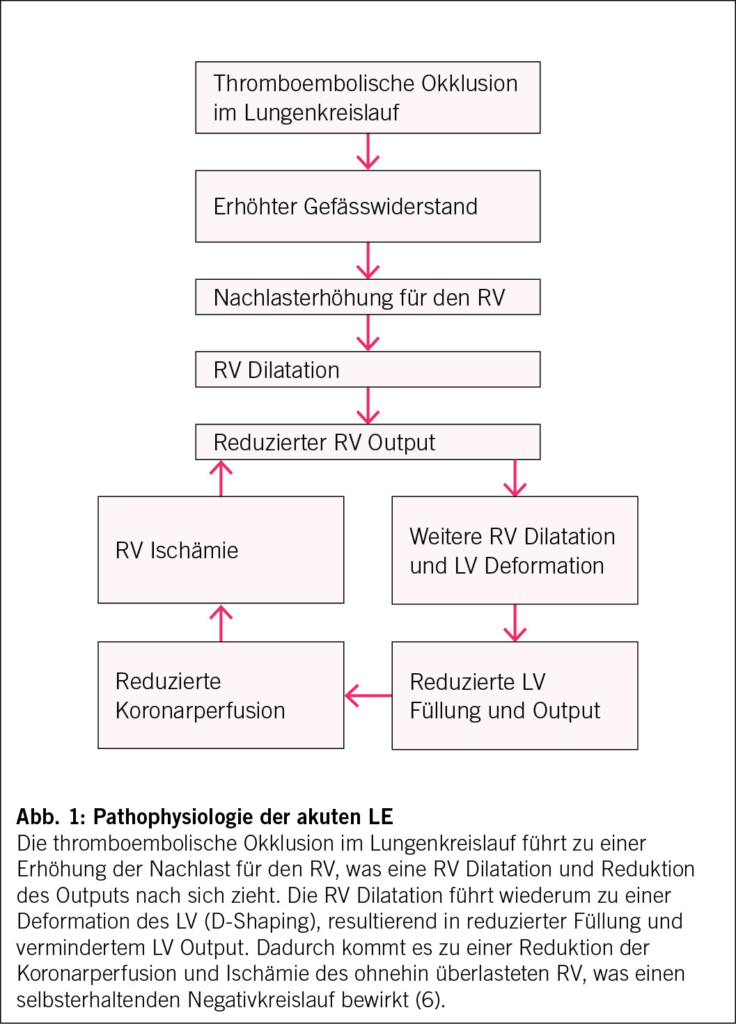
Anatomisch ist der rechte Ventrikel (RV) muskelschwach, dünnwandig und dehnbar und ist durch eine Crescendo-Form an den dickwandigen starken linken Ventrikel (LV) angepasst (7). Dem RV nachgeschaltet befindet sich mit dem pulmonalen Kreislauf ein Niedrigdrucksystem, woraus sich eine deutlich geringere Nachlast ergibt, als dies für den LV mit dem nachgeschalteten Körperkreislauf der Fall ist. Ein physiologisch erhöhtes Herzzeitvolumen (z. B. unter körperlicher Belastung) kompensiert der pulmonale Kreislauf durch eine Rekrutierung der Mikrozirkulation. Die Anpassungsmechanismen des RV an eine akute Nachlasterhöhung sind jedoch deutlich schlechter ausgeprägt als beim LV. Durch seine Dehnbarkeit, kann er zwar grosse Blutvolumina fassen, jedoch ist das Schlagvolumen gegen einen erhöhten Widerstand stark eingeschränkt. Dies resultiert in einer paradoxen Verschiebung des interventrikulären Septums in Richtung des LV («D-Shaping» des LV Cavums), mit dadurch verminderter Füllung des LV, resultierender Output-Reduktion und reduzierter Perfusion der Koronararterien (Abb. 1). Dadurch, sowie durch den erhöhten Wandstress kommt es zu verminderter Perfusion des RV (8). Zusätzlich kommt es durch die RV-Erweiterung zu einer Erweiterung des Trikuspidalklappen-Annulus und als Konsequenz zu einer Trikuspidalinsuffizienz, wodurch der rechtsventrikuläre Vorwärtsfluss zusätzlich negativ beeinflusst wird (7).
Diagnostik und Risikostratifizierung der akuten Lungenembolie
Die akute LE kann sich mit einem variablen klinischen Erscheinungsbild in Hinblick auf Symptomintensität und Dauer präsentieren. Zu den häufigen Symptomen zählen Dyspnoe, Thoraxschmerzen, Präsynkopen oder Synkopen, sowie Husten und Hämoptysen. Weitere objektivierbare Faktoren im Notfallsetting umfassen eine Hypoxie, Hypokapnie, sowie typische EKG-Veränderungen (Zeichen einer Rechtsherzbelastung, SIQIIITIII Typ, Rechtsschenkelblock) (9).
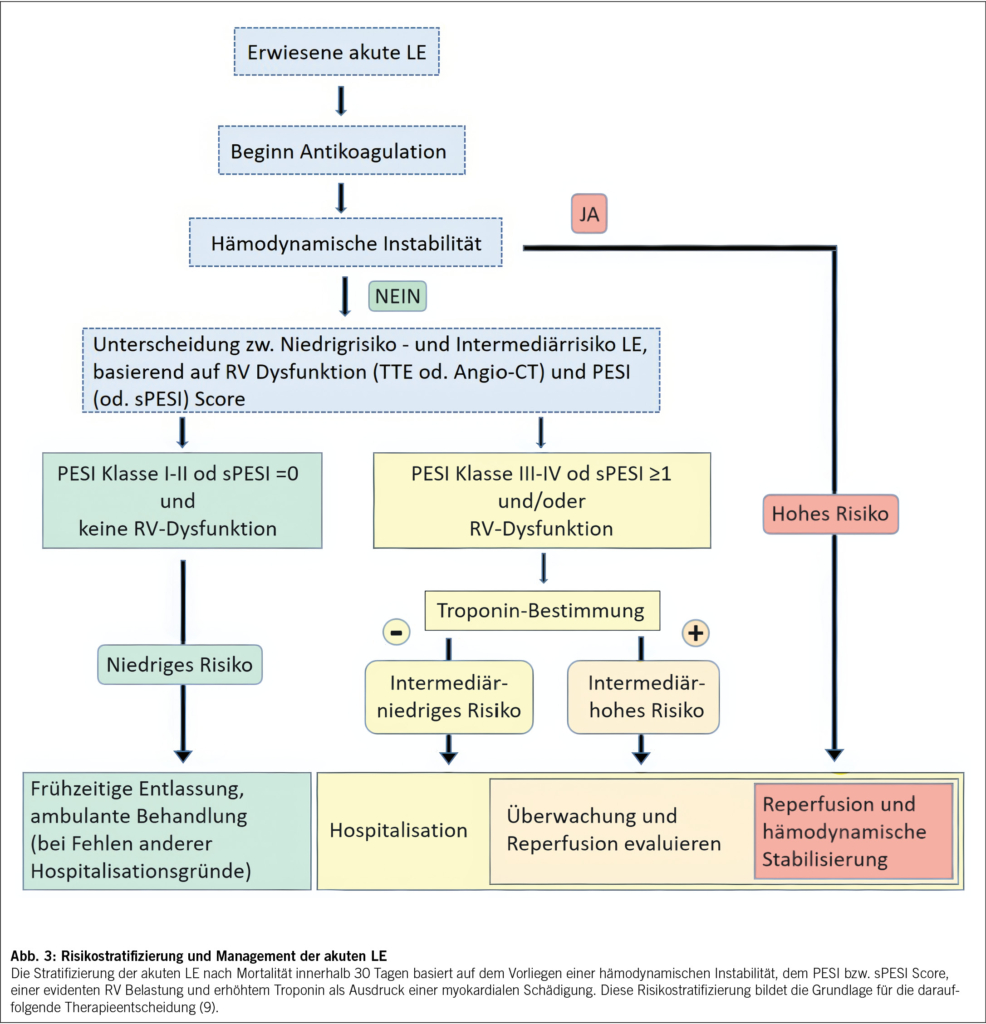
Bei klinischem Verdacht auf eine akute LE ist das weitere Vorgehen massgeblich von der hämodynamischen Stabilität des Patienten abhängig (Abb. 2). Basierend auf der medizinischen Vorgeschichte und der klinischen Präsentation kann bei hämodynamischer Stabilität die Vortestwahrscheinlichkeit für das Vorliegen einer LE erhoben werden. Zur verbesserten Quantifizierung stehen hierzu Tools wie der Wells Score oder der Geneva Score zur Verfügung. Bei geringer oder intermediärer Vortestwahrscheinlichkeit kann die Bestimmung des D-Dimers eine LE bereits weitestgehend ausschliessen (9). Bei hoher Wahrscheinlichkeit oder altersadaptiert erhöhtem D-Dimer sollte eine weitere Abklärung mittels pulmonaler Angio-Computertomographie (LE-CT) erfolgen, in welcher sowohl das Ausmass der LE selbst, als auch eine RV Dilatation (RV/LV ratio > 0.9) als Zeichen der Rechtsherzbelastung dargestellt werden können (10). Bei hämodynamisch instabilen Patienten kommt im primären Assessment der transthorakalen Echokardiographie eine besondere Rolle in der Beurteilung einer möglichen RV-Dilatation und Dysfunktion zu (11). Sollten diese vorliegen, kann bei umgehender Verfügbarkeit eines LE-CT dieses zur Bestätigung erfolgen, oder auch unmittelbar eine Reperfusionstherapie neben der hämodynamischen Stabilisierung erfolgen, um eine unnötige Verzögerung zu vermeiden (9).
Die akute LE mit ausgeprägter RV Belastung und hämodynamischer Instabilität wird gemäss Richtlinien der Europäischen Gesellschaft für Kardiologie (ESC – European Society of Cardiology) als Hochrisiko – LE klassifiziert (9) und ist mit einer Mortalität zwischen 14 % und 29.8 % assoziiert (5). Am anderen Ende der Risikoskala stehen Niedrigrisiko – LE Patienten, welche weder Zeichen einer Rechtsherzbelastung in der Bildgebung, noch erhöhte kardiale Biomarker aufweisen. Zwischen den beiden extremen Risikogruppen, unterscheidet man bei symptomatischen Patienten zwischen intermediär-niedrigem und intermediär-hohem Risiko, je nachdem ob positive kardiale Biomarker oder ein Bildbefund einer RV Dysfunktion vorliegen (intermediär-niedrig), oder auch beide Befunde positiv ausfallen (intermediär-hohes Risiko) (9). Neben dieser Ampeleinteilung wird zur weiteren, objektivierten Risikostratifizierung auch der Pulmonary Embolism Severity Index (PESI) eingesetzt. Eine rasche Risikostratifizierung ist massgebend für das weitere Management hinsichtlich Monitoring und Therapie. (Abb. 3)
Therapie der akuten Lungenembolie
Die Initialtherapie der akuten LE umfasst die Korrektur der Hypoxämie mittels O2-Gabe bei Patienten mit einer Sauerstoffsättigung < 90 %. Die Spontanatmung sollte unbedingt erhalten bleiben, und nur bei zunehmender respiratorischer Erschöpfung oder auch insuffizienter spontaner Ventilation sollte eine mechanische Beatmungsunterstützung in Erwägung gezogen werden. Dabei ist es jedoch wichtig zu berücksichtigen, dass eine Beatmung ohne gewährleistete pulmonale Reperfusion keine Korrektur der Hypoxämie erwirken kann (9). Tatsächlich kann eine orotracheale Intubation und Allgemeinnarkose zu einer weiteren hämodynamischen Verschlechterung durch eine medikamentöse oder auch mechanische Überlastung des RV führen (9, 12–14).
Eine sofortige Antikoagulation mit unfraktioniertem (UFH) oder niedermolekularem (LMWH) Heparin ist bereits bei Patienten mit intermediärer oder hoher Wahrscheinlichkeit für das Vorliegen einer LE indiziert, bis weitere Testresultate zur Verfügung stehen. Der Einsatz oraler Antikoagulanzien sollte erst nach Abschluss der Riskostratifizierung und finalem weiteren Therapieentscheid erfolgen. Dabei stellen direkte orale Antikoagulanzien (NOAK), aufgrund eines deutlich verbesserten Nutzen-Risiko Profils im Vergleich zu den traditionellen Vitamin-K-Antagonisten, die Therapie der Wahl für die weiterführende Antikoagulation nach stattgehabter LE dar (9). Die Dauer der Antikoagulation sollte dabei mindestens 3 Monate umfassen; je nach Ursache kann jedoch auch eine langfristige, dauerhafte medikamentöse Therapie zur Prophylaxe erneuter Thrombosen / Embolien empfohlen werden (15).
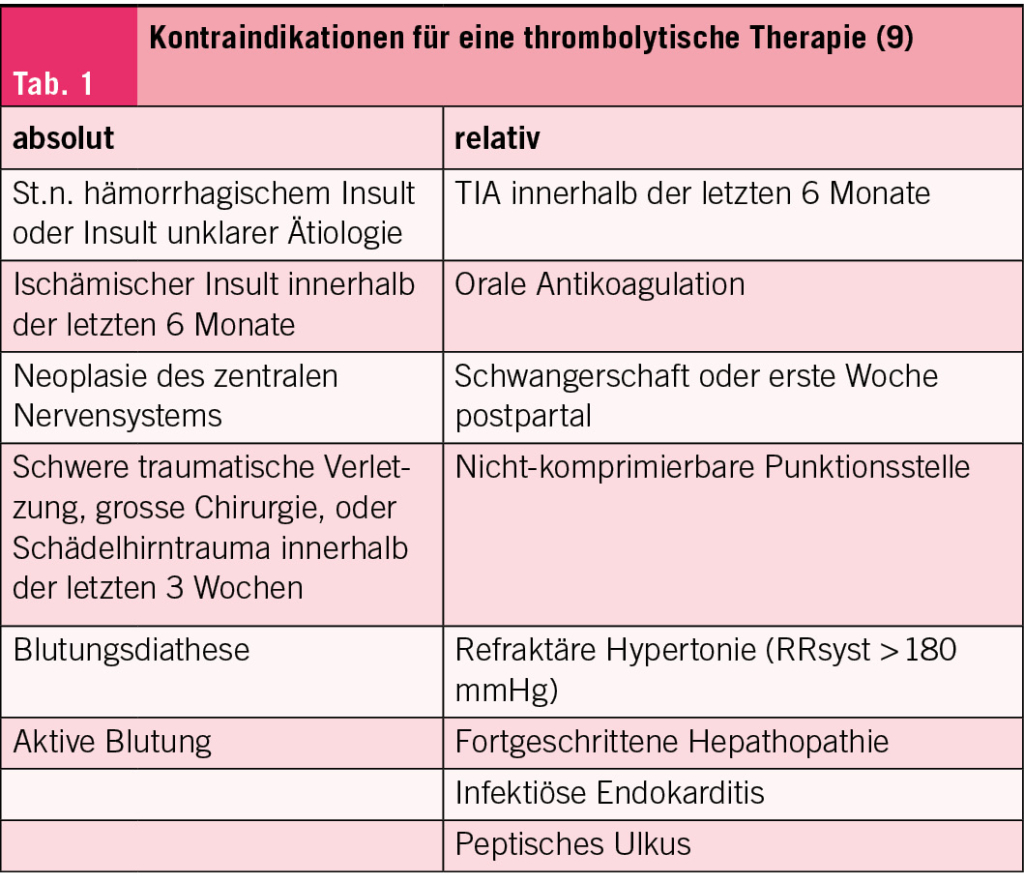
Eine systemische Thrombolyse, zusätzlich zur Antikoagulation, sollte nur bei ausgewählten Hochrisikopatienten, in welchen eine rasche Auflösung des thrombotischen Materials zur Entlastung des RV angestrebt wird, erwogen werden. Metaanalysen konnten dabei eine signifikante Reduktion der Mortalität und etwaiger LE Rezidive nach dem Einsatz einer systemischen Thrombolyse nachweisen, allerdings zum Preis eines deutlich erhöhten Blutungsrisikos (16, 17). Absolute und relative Kontraindikationen für eine Lysetherapie können Tab. 1 entnommen werden.
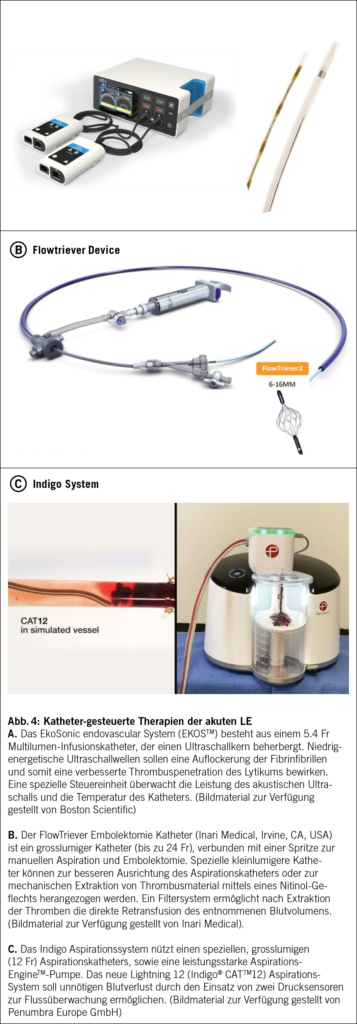
Die Langzeit-Überlegenheit der systemischen Thrombolyse im Hinblick auf funktionelles Outcome und Entwicklung einer chronisch thromboembolischen pulmonalen Hypertonie ist aktuell nicht gesichert. Neuere Methoden umfassen die Katheter-gesteuerte Lyse, sowie die chirurgische oder minimal-invasive Katheter-gestützte Embolektomie (9). Abb. 4 illustriert die aktuell meist-verwendeten Kathetersysteme, welche an spezialisierten Lungenemboliezentren zur minimal-invasiven Behandlung der akuten LE eingesetzt werden (18-20).
Management von schwangeren Patientinnen mit akuter Lungenembolie
Das Risiko für Thromboembolien ist in der Schwangerschaft bis zu fünffach erhöht. Pathomechanistisch sind hierbei alle Komponenten der Virchow’schen Trias involviert, durch Hyperkoagulabilität, reduzierten venösen Fluss bis hin zur Stase und endotheliale Schädigung aufgrund einer venösen Hypertension oder auch im Rahmen der Entbindung. Besondere Vorsicht ist im Rahmen der Schwangerschaft hinsichtlich des Einsatzes strahlungsintensiver Untersuchungsmethoden, sowie auch den gegebenen Therapielimitationen geboten, um einen raschen Behandlungserfolg bei möglichst geringem Risiko für Mutter und Kind zu gewährleisten (21).
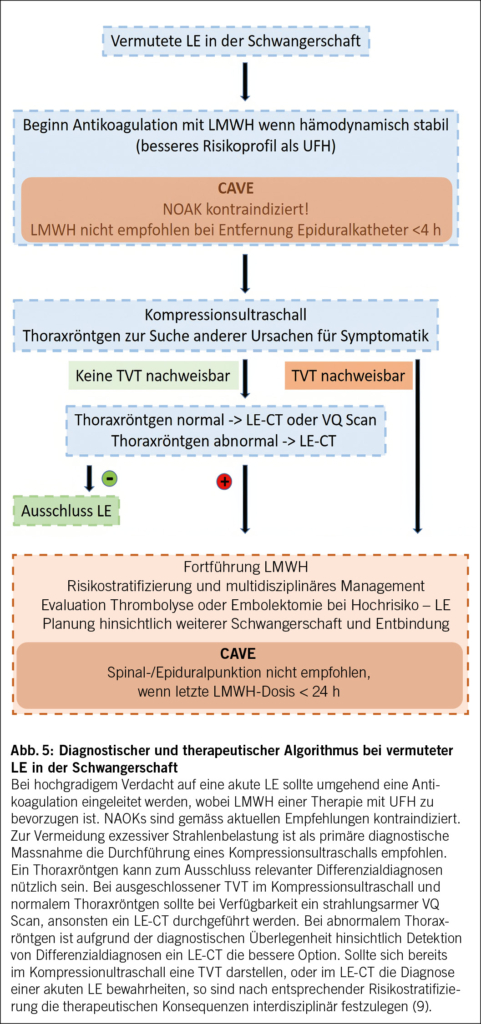
Der von der ESC empfohlene Diagnose- und Therapiealgorithmus ist in Abb. 5 zusammengefasst. Bei hämodynamisch stabilen Patientinnen sollte aufgrund der verlässlicheren Pharmakokinetik und Sicherheitsaspekten eine Antikoagulation mit LMWH ehestmöglich eingeleitet werden, wobei auch UFH eingesetzt werden kann (9). NOAKs sind hingegen in der Schwangerschaft kontraindiziert und auch Vitamin-K-Antagonisten mit teratogenen Effekten assoziiert. Vorsicht ist beim Einsatz von LMWH auch hinsichtlich spinaler und epiduraler Punktionen geboten, wobei die Antikoagulation nicht innerhalb der ersten 4 h nach Entfernung eines Epiduralkatheters begonnen und ein solcher auch nicht innerhalb 24 h Stunden nach letzter LMWH-Applikation eingelegt werden sollte (9).
Diagnostisches Mittel der Wahl ist ein Kompressionsultraschall zur Suche nach einer tiefen Venenthrombose (TVT) der unteren Extremität (9). Etwa 30 % offenbar isolierter LEs sind mit einer stummen TVT assoziiert (21), sodass der duplexsonographische Nachweis einer solchen bereits die Behandlung einer LE rechtfertigt. Bei negativem Resultat kann ein Thoraxröntgen zum Ausschluss anderer Ursachen für die Symptomatik dienen. Sollte dennoch der Verdacht auf eine LE bestehen und weitere Diagnostik indiziert sein, ist im Rahmen der Nutzen-Risiko-Abwägung die Durchführung eines LE-CT empfohlen. Alternativ kann insbesondere bei normalem Thoraxröntgenbefund ein weniger strahlungsintensiver Ventilations/Perfusions (VQ)-Scan durchgeführt werden, sofern verfügbar. Bei Nachweis einer LE ist die Fortführung des LMWH empfohlen. Bei Hochrisiko-LE Patientinnen und entsprechender hämodynamischer Instabilität muss die Notwendigkeit einer umgehenden thrombolytischen Therapie oder auch Embolektomie evaluiert werden. Nach überstandenem Primärereignis sollte die weitere Betreuung der Schwangerschaft wie auch die Entbindungsplanung an einem interdisziplinären Zentrum mit entsprechender Expertise in der Behandlung der Lungenembolie und möglicher Komplikationen erfolgen (9).
Abkürzungen
CT Computertomographie
ESC European Society of Cardiology
LE Lungenembolie
LMWH Niedermolekulares Heparin
LV Linker Ventrikel
NOAK Neue orale Antikoagulanzien
RV Rechter Ventrikel, rechtsventrikulär
(s)PESI (simplified) Pulmonary Embolism Severity Index
TTE Transthorakale Echokardiographie
TVT Tiefe Venenthrombose
UFH Unfraktioniertes Heparin
VQ Scan Lung Ventilation Perfusion Scan
Copyright
Aerzteverlag medinfo AG
Zentrum für Lungenembolie
Klinik und Poliklinik für Kardiologie
Universitätsspital, Inselspital Bern
Freiburgstrasse 20
3010 Bern
Zentrum für Lungenembolien
Klinik und Poliklinik für Kardiologie
Universitätsspital, Inselspital Bern
Freiburgstrasse 20
3010 Bern
stefan.stortecky@insel.ch
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Wendelboe, A.M. and G.E. Raskob, Global Burden of Thrombosis: Epidemiologic Aspects. Circ Res, 2016. 118(9): p. 1340-7.
2. Keller, K., et al., Trends in thrombolytic treatment and outcomes of acute pulmonary embolism in Germany. Eur Heart J, 2020. 41(4): p. 522-529.
3. Lehnert, P., et al., Acute Pulmonary Embolism in a National Danish Cohort: Increasing Incidence and Decreasing Mortality. Thromb Haemost, 2018. 118(3): p. 539-546.
4. Payne, J.G., et al., Current estimates of the incidence of acute venous thromboembolic disease in Canada: A meta-analysis. Thromb Res, 2021. 197: p. 8-12.
5. Becattini, C., et al., Acute pulmonary embolism: mortality prediction by the 2014 European Society of Cardiology risk stratification model. Eur Respir J, 2016. 48(3): p. 780-6.
6. Bryce, Y.C., et al., Pathophysiology of right ventricular failure in acute pulmonary embolism and chronic thromboembolic pulmonary hypertension: a pictorial essay for the interventional radiologist. Insights Imaging, 2019. 10(1): p. 18.
7. Bristow, M.R., et al., The pressure-overloaded right ventricle in pulmonary hypertension. Chest, 1998. 114(1 Suppl): p. 101s-106s.
8. van Wolferen, S.A., et al., Right coronary artery flow impairment in patients with pulmonary hypertension. Eur Heart J, 2008. 29(1): p. 120-7.
9. Konstantinides, S.V., et al., 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J, 2020. 41(4): p. 543-603.
10. Carrier, M., et al., Subsegmental pulmonary embolism diagnosed by computed tomography: incidence and clinical implications. A systematic review and meta-analysis of the management outcome studies. J Thromb Haemost, 2010. 8(8): p. 1716-22.
11. Kurzyna, M., et al., Disturbed right ventricular ejection pattern as a new Doppler echocardiographic sign of acute pulmonary embolism. Am J Cardiol, 2002. 90(5): p. 507-11.
12. Messika, J., et al., Severe pulmonary embolism managed with high-flow nasal cannula oxygen therapy. Eur J Emerg Med, 2017. 24(3): p. 230-232.
13. Lacroix, G., et al., High-flow oxygen, a therapeutic bridge while awaiting thrombolysis in pulmonary embolism? Am J Emerg Med, 2013. 31(2): p. 463.e1-2.
14. Page, R.L., 2nd, et al., Drugs That May Cause or Exacerbate Heart Failure: A Scientific Statement From the American Heart Association. Circulation, 2016. 134(6): p. e32-69.
15. van Es, N., et al., Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials. Blood, 2014. 124(12): p. 1968-75.
16. Marti, C., et al., Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J, 2015. 36(10): p. 605-14.
17. Zhang, R.S., et al., Efficacy and Safety of Anticoagulation, Catheter-Directed Thrombolysis, or Systemic Thrombolysis in Acute Pulmonary Embolism. JACC Cardiovasc Interv, 2023. 16(21): p. 2644-2651.
18. Draxler, D.F. and S. Stortecky, Interventional Reperfusion Strategies for Acute Pulmonary Embolism. Praxis (Bern 1994), 2021. 110(13): p. 743-751.
19. Pruszczyk, P., et al., Percutaneous treatment options for acute pulmonary embolism: a clinical consensus statement by the ESC Working Group on Pulmonary Circulation and Right Ventricular Function and the European Association of Percutaneous Cardiovascular Interventions. EuroIntervention, 2022. 18(8): p. e623-e638.
20. Finocchiaro, S., et al., Percutaneous interventions for pulmonary embolism. EuroIntervention, 2024. 20(7): p. e408-e424.
21. Devis, P. and M.G. Knuttinen, Deep venous thrombosis in pregnancy: incidence, pathogenesis and endovascular management. Cardiovasc Diagn Ther, 2017. 7(Suppl 3): p. S309-s319.