Anamnese und Befunde
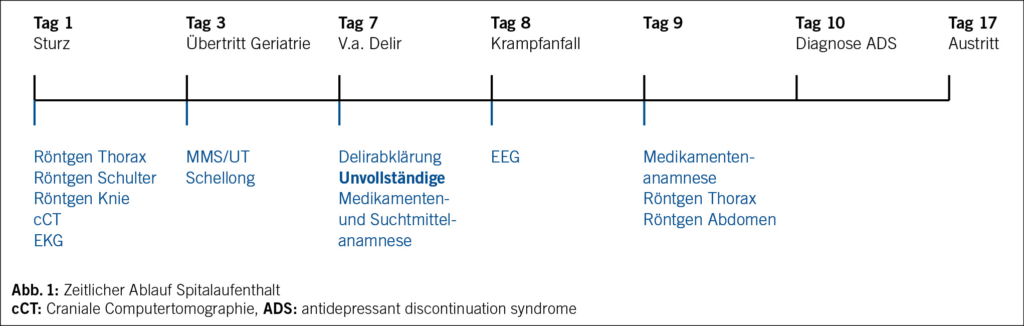
Ein 75-jähriger Patient stürzte auf der Treppe. Nach Ausschluss schwerer Verletzungen wurde der Patient zur geriatrischen Akutrehabilitation und Sturzabklärung aufgenommen. Auf der Notfallstation wurden ein leichtes Schädel-Hirn-Trauma, diverse Kontusionen sowie Elektrolytstörungen (Hyponatriämie 132 mmol/l, Hypokaliämie 2.8 mmol/l) diagnostiziert. Zudem zeigten sich erhöhte Creatin-Kinase- (509 U/l, Referenz < 200 U/l) und erhöhte Myoglobinwerte (189 µg/l, Referenz < 140 µg/l). Bekannte Vorerkrankungen waren eine Hepatitis-B-bedingte, kompensierte Leberzirrhose Child Pugh A, eine chronische Bronchitis, eine arterielle Hypertonie, ein Diabetes mellitus Typ 2 und rezidivierende Lumbago. Bei Übertritt in die Geriatrie fanden wir keine weiteren Verletzungen. Fremdanamnese und kognitive und psychiatrische Tests ergaben eine leichte Beeinträchtigung (MMS 25/30, UT 2/7), jedoch keine affektive Störung (Geriatric Depression Scale [GDS]). Der Medikationsplan zeigte eine Polypharmazie mit Tiotropium, Budesonid Nasenspray, Acetylcystein, Losartan, Hydrochlorothiazid, Torasemid, Metoprolol, Amlodipin, Gliclazid, Tenofovir, Zolpidem und Lorazepam.
Aufgrund der Anamnese, klinischer Untersuchung, repetitiv normwertiger Blutzuckerwerte, unauffälliger Schädel-CT und unauffälligem EKG erschien uns ein zentraler oder peripher Schwindel sowie kardiale, metabolische oder neurologische Ursachen trotz leichter orthostatischer Dysregulation in der Schellong-Untersuchung unwahrscheinlich. Die erhöhten Creatin-Kinase- und Myoglobinwerte schrieben wir den Kontusionen und der Nierenfunktionsstörung und den Elektrolytstörungen der diuretischen Therapie zu.
Die erste Woche des Krankenhausaufenthalts verlief ereignislos. In der Nacht zum 8. Tag war der Patient motorisch unruhig mit gesteigertem Antrieb und nestelndem Verhalten. Er war rasch reizbar, abschweifend, sprunghaft, zeitlich desorientiert und litt unter Schlaflosigkeit. Am folgenden Tag klagte er über Rückenschmerzen und stromschlagartigen Missempfindungen in den Oberschenkeln ohne Dermatombezug. Die Symptome blieben über den Tag stabil.
Erste differenzialdiagnostische Überlegungen
Wir stellten die Verdachtsdiagnose eines hyperaktiven Delirs, wofür die einzige Therapie die Ursachenbehebung darstellt. Daher sollten rasch eine strukturierte Ursachensuche mit Anamnese und Fremdanamnese, insbesondere zu Alkohol, Suchtmitteln und Medikamenten, sowie eine fokussierte neurologisch-psychiatrische körperliche Untersuchung erfolgen. Vervollständigt wird diese mit den notwendigsten apparativen Tests. Ziel ist das rasche Erkennen behebbarer Ursachen wie Entzugssyndrome, Fehlmedikationen, Harnverhalt, Obstipation oder metabolischen, kardialen und zentralnervösen Störungen. Eine Überdiagnostik ist häufig und sollte vermieden werden (1). Wir konnten keine erklärende Ursache finden. Aufgrund der starken Agitation verschrieben wir niedrig dosiert Quetiapin.
Weiterer Verlauf
Am folgenden Abend traten tonisch-klonische Krampfanfälle auf, die wir mit Midazolam durchbrachen. Ein EEG zeigte keine epilepsietypischen Potenziale. Zur Prophylaxe weiterer Krampfanfälle verordneten wir Clobazam. Die geplante Schädel-MRT mussten wir wegen des Verdachts auf Aspiration kleiner Magneten von der Magnettafel im Patientenzimmer absagen. Die Magnete waren in Thorax- und Abdomen-Röntgen nicht nachweisbar.
Die nun erst geführte Fremdanamnese ergab eine bisher unbekannte Einnahme von Amitriptylin (Saroten retard®, mindestens 150 mg täglich). Die Indikation und der Bezugsweg blieben trotz Nachfragen beim Gastroenterologen (gleichzeitig Hausarzt), Chiropraktiker und lange nicht konsultierten Psychiater unklar. Der behandelnde Psychologe war nicht erreichbar. Fremdanamnestisch wurde eine unipolare Depression vermutet.
Diagnose
Wir revidierten die Diagnose eines hyperaktiven Delirs. Retrospektiv war das Diagnosekriterium der Fluktuation der Symptome nicht erfüllt. Die anderen Kriterien, nämlich plötzlicher Beginn, Aufmerksamkeits-, Bewusstseins- und kognitiv-emotionale Störungen, waren vorhanden (1).
Wir diagnostizierten ein Antidepressiva-Entzugssyndrom (ADS) nach abruptem Absetzen von Amitriptylin. Die Krampfanfälle interpretierten wir als akute symptomatische Anfälle durch die hohe Amitriptylin-Dosis, den plötzlichen Stopp und das neu eingeführte Quetiapin. Zu diskutieren bleibt eine unzureichende Lorazepam-Dosierung und Abgabe. Aufgrund der Anfallsfreiheit, fehlender fokal-neurologischer Defizite, normalisierter Laborwerte und unauffälligem cCT am Eintrittstag verzichteten wir auf eine Schädel-MRT. Im weiteren Verlauf normalisierte sich das Verhalten, und es trat keine affektive Störung auf, sodass Amitriptylin nicht erneut verabreicht wurde. Wir konnten den Patienten nach Hause entlassen. Der zeitliche Ablauf ist in Abb. 1 dargestellt.
Kommentar
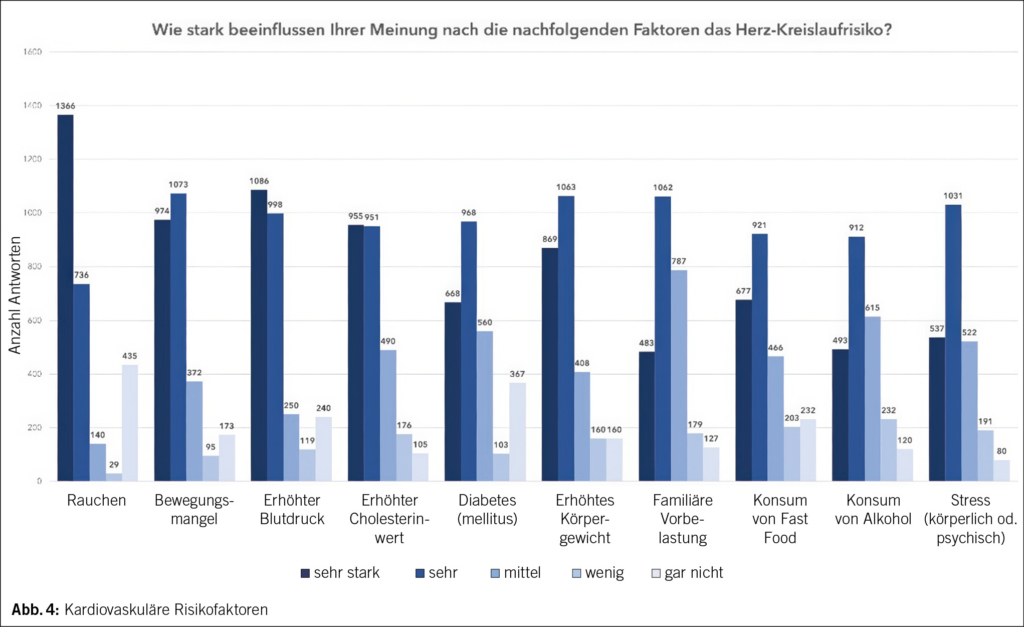
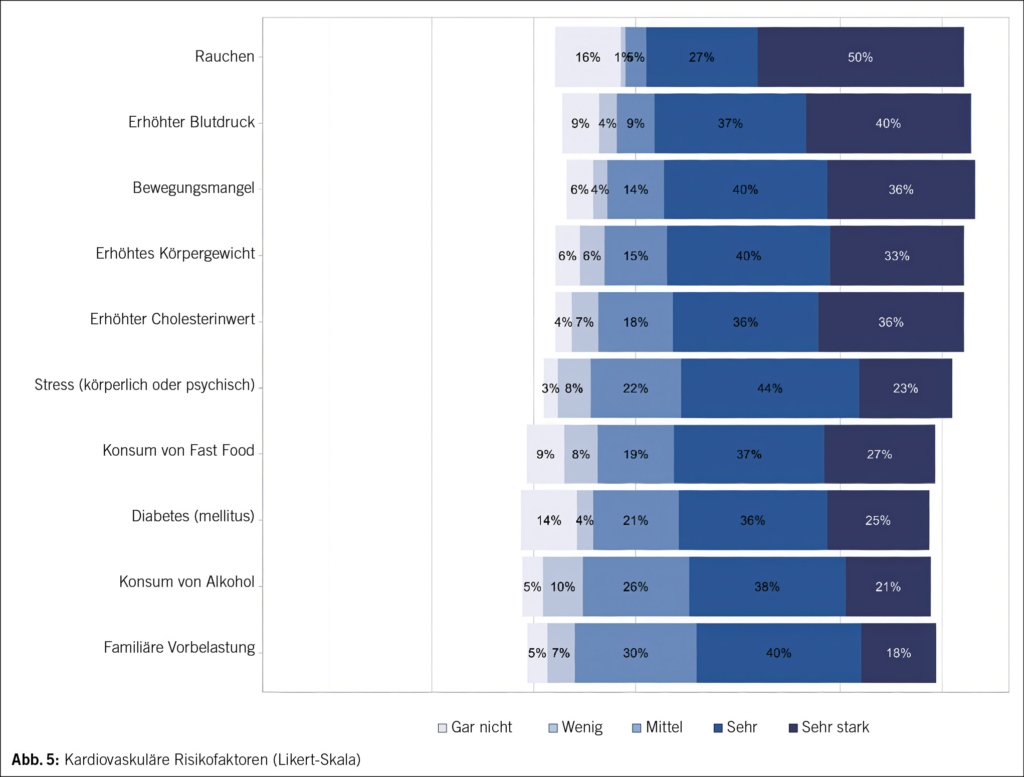
Ein ADS kann nach Absetzen der meisten Antidepressiva (AD) auftreten (2), mit dem grössten Risiko bei MAO-Hemmern, trizyklischen Antidepressiva (TZA), Paroxetin und Venlaflaxin (3, 4). Die Inzidenz liegt etwa bei 15 %, davon entwickeln ca. 3 % schwerwiegende Symptome (5). Häufigkeit, Schwere und Dauer eines ADS könnten allerdings unterschätzt werden (6). Begünstigende Faktoren sind in Tab. 1 zusammengefasst. Symptome treten meist innert der ersten 7 Tage nach Absetzen auf (3, 4).
Das Akronym «FINISH» (flu-like symptoms, insomina [with vivid dreams and nightmares], nausea, imbalance, sensory disturbances, hyperarousal) fasst die häufigsten Symptome zusammen (4). Der Patient beschrieb stromschlagartige Missempfindungen in den Beinen («body zaps»/»brain zaps»), die typischerweise mit dem Absetzen von SSRI assoziiert sind (3, 4). Eine Nennung im Zusammenhang mit dem Absetzen eines TZA konnten wir in der Literatur nicht finden. Das ADS ist meistens selbstlimitierend und dauert typischerweise ca. 2 Wochen (3, 6), kann jedoch auch Monate bis Jahre andauern (2, 6, 7).
Krampfanfälle werden in der Literatur nicht direkt mit einem ADS in Verbindung gebracht. Depression (8) und die Einnahme von Antidepressiva (AD) erhöhen jedoch das Risiko für Krampfanfälle, wobei unklar bleibt, welche AD das höchste Risiko bergen (9, 10). Ein erhöhtes Risiko besteht besonders kurz nach Beginn oder Absetzen der Medikation (10).
Ein ADS wird oft als Rezidiv der psychiatrischen Grunderkrankung oder als Therapieversagen fehlinterpretiert. Bei unipolaren Störungen kann dies fälschlicherweise zur Diagnose einer bipolaren Störung führen, wenn das ADS hypomanische oder manische Symptome zeigt (3). Diagnosekriterien des ADS nach DSM-5 sind in Tab. 2 zusammengefasst. Zur Unterscheidung zwischen ADS und Grunderkrankung ist die Beurteilung der Symptomverläufe nach Absetzen und Wiederaufnahme der Medikation hilfreich. Ein ADS tritt meist innerhalb von zwei Wochen auf, während eine depressive Episode eher nach 4–8 Wochen einsetzt (11). Zusätzlich zu den psychischen Symptomen sind körperliche Beschwerden (7) oder exzessives Träumen oder Albträume (4) häufig. Die Symptome zeigen typischerweise einen wellenförmigen Verlauf (7). Bei einem Rezidiv ähneln die Symptome der Grunderkrankung und gehen meist mit weniger körperlichen Beschwerden einher. Nach erneuter Einnahme der abgesetzten Medikamente klingt ein ADS typischerweise innerhalb weniger Tage ab (2, 3, 7).
Ein langsames Ausschleichen des AD über mindestens 4 Wochen oder über Monate kann das Risiko eines ADS möglicherweise reduzieren (4, 7, 11). Die Geschwindigkeit sollte individuell angepasst werden, basierend auf Wirkstoffklasse, Dosierung, Erfahrung des Patienten und Risikofaktoren (Tab. 1) (3). Fluoxetin birgt, aufgrund seiner langen Halbwertszeit, das geringste ADS-Risiko. Bei hohem ADS-Risiko können ein Wechsel zu Fluoxetin vor dem Absetzen eines SSRI oder Venlafaxin und anschliessendes Ausschleichen sinnvoll sein (4, 7). Ein ADS kann jedoch nach dem Ausschleichen von Fluoxetin auch verzögert auftreten (6, 7).
Eine Therapie ist aufgrund der häufig milden und selbstlimitierenden Symptome selten notwendig. Kurzfristig können symptomatisch Benzodiazepine oder nach TZA-Stopp Anticholinergika eingesetzt werden. Bei starken ADS-Symptomen kann das AD wieder gestartet werden (3, 4). Zur Vermeidung von Fehldiagnosen und Übertherapie sollten das ADS frühzeitig thematisiert und ein Therapieplan erstellt werden (2, 4).
Beim Absetzen eines AD in der Behandlung einer unipolaren Depression sollten ein Rezidiv als auch ein ADS frühzeitig erfasst und entsprechende Massnahmen ergriffen werden (12–14). Eine Idee, wie das Absetzen durchgeführt werden könnte, findet sich in Tab. 3.
Dieser Fallbericht betont die Wichtigkeit einer vollständigen Anamnese und Fremdanamnese für die Differenzialdiagnose sowie die Herausforderungen bei Multimorbidität und Polypharmazie. Durch eine frühzeitige und umfassende Anamnese hätten wir das ADS bei unserem Patienten möglicherweise verhindern können.
Eine korrekte Medikamentenanamnese und ein vollständiger Medikationsplan sind essenziell für die Patientensicherheit. Die Stiftung Patientensicherheit schätzt, dass jährlich 20 000 Spitalaufenthalte auf medikamentenbedingte Probleme zurückzuführen sind (15). Insbesondere an Schnittstellen (z. B. Wechsel von ambulant zu stationär) kommt es zu Medikamentenfehlern (15). Ein vollständiger Medikationsplan umfasst verschriebene, alternativmedizinische und nicht verschreibungspflichtige Medikamente sowie unerwünschte Arzneimittelwirkungen (UAW) und Allergien. Handschriftliche Pläne erhöhen das Risiko für Medikamentenfehler (16). Die Medikamentenanamnese ist am sichersten, wenn der Plan mit Patienten, Angehörigen und dem Behandlungsteam besprochen und mit der Patientengeschichte abgeglichen wird. Nach Schnittstellenereignissen ist eine zeitnahe Überprüfung sinnvoll. Medikationspläne sollten aktuell gehalten und den Patienten mitgegeben werden. Veraltete Versionen sollten vernichtet werden (17).
Die Polypharmazie, definiert als die Einnahme von fünf oder mehr Medikamenten, steigert das Risiko für unerwünschte Arzneimittelwirkungen (UAW) und erhöht die Wahrscheinlichkeit für das Vorliegen von potenziell inadäquater Medikation (PIM). Es sollte regelmässig geprüft werden, ob Medikamente indiziert sind, ihr Nutzen den Schaden überwiegt (18) und ein Deprescribing möglich ist. Deprescribing beschreibt einen systematischen Vorgang zur Medikamentenreduktion. Es erfordert regelmäßige Planbewertung und Identifikation von PIM gemeinsam mit dem Patienten (17). Entscheidungshilfen wie Beers-, Priscus- oder START-/STOP-Listen sowie Online-tools wie acbcalc.com oder medstopper.com unterstützen den Prozess.
Ob Polypharmazie ein eigenständiger Risikofaktor für ein ADS ist, bleibt unklar. Sie könnte jedoch durch vermehrte Medikamenteninteraktionen das Risiko erhöhen. Weitere gezielte Forschung ist erforderlich, um den Einfluss der Polypharmazie auf das Auftreten eines ADS eindeutig zu bestimmen (14).
Abkürzungen
MMS Mini-Mental-Status
UT Uhrentest
GDS Geriatrische Depressionsskala
EKG Elektrokardiogramm
EEG Elektroenzephalographie
MRT Magnetresonanztomographie
ADS antidepressant discontinuation syndrome
cCT Craniale Computertomographie
AD Antidepressivum
TZA Trizyklisches Antidepressivum
DSM-V diagnostic and statistical manual of mental disorders
UAW unerwünschte Arzneimittelwirkung
PIM potenziell inadäquate Medikation
DIA-S Depression-im-Alter-Skala
HAMD Hamilton Depressionsskala
BDI II Beck-Depressions-Inventar II
CSDD Cornell-Skala für Depression bei Demenz
Wann und wo sich der Fall zugetragen hat
2019, Kantonsspital Winterthur, Klinik für Akutgeriatrie
Historie
Manuskript eingegangen: 02.09.2024
Angenommen nach Revision: 23.12.2024
Medbase Wil
Friedtalweg 18
9500 Wil
benjamin.hutter@medbase.ch
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Maschke M, et al. Delir und Verwirrtheitszustände inklusive Alkoholentzugsdelir, S1-Leitlinie. Deutsche Gesellschaft für Neurologie (Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie; 2020. register.awmf.org/de/leitlinien/detail/030-006;letzter Zugriff: 11.06.2024.
2. Fornaro M, Cattaneo CI, De Berardis D, Ressico FV, Martinotti G, Vieta E. Antidepressant discontinuation syndrome: A state-of-the-art clinical review. European Neuropsychopharmacology. 2023;66:1–10.
3. Haddad PM, Anderson IM. Recognising and managing antidepressant discontinuation symptoms. Adv psychiatr treat. 2007;13(6):447–57.
4. Henssler J, Heinz A, Brandt L, Bschor T. Antidepressant Withdrawal and Rebound Phenomena. Deutsches Ärzteblatt international. 2019. www.aerzteblatt.de/10.3238/arztebl.2019.0355; letzter Zugriff 07.04.2024
5. Henssler J, Schmidt Y, Schmidt U, Schwarzer G, Bschor T, Baethge C. Incidence of antidepressant discontinuation symptoms: a systematic review and meta-analysis. The Lancet Psychiatry. 2024;11(7):526–35.
6. Davies J, Read J. A systematic review into the incidence, severity and duration of antidepressant withdrawal effects: Are guidelines evidence-based? Addictive Behaviors. 2019;97:111–21.
7. Horowitz MA, Taylor D. Distinguishing relapse from antidepressant withdrawal: clinical practice and antidepressant discontinuation studies. BJPsych advances. 2022;28(5):297–311.
8. Steinert T, Baier H, Fröscher W, Jandl M. Epileptische Anfälle unter der Behandlung mit Antidepressiva und Neuroleptika. Fortschr Neurol Psychiatr. 2011;79(03):138–43.
9. Hill T, Coupland C, Morriss R, Arthur A, Moore M, Hippisley-Cox J. Antidepressant use and risk of epilepsy and seizures in people aged 20 to 64 years: cohort study using a primary care database. BMC Psychiatry. 2015;15(1):315.
10. Coupland C, Dhiman P, Morriss R, Arthur A, Barton G, Hippisley-Cox J. Antidepressant use and risk of adverse outcomes in older people: population based cohort study. BMJ. 2011;343(aug02 1):d4551–d4551.
11. Lee EA, Wong CA, Barrio L, Godoy ER, Hackett D, Thompson N, et al. An Approach to Deprescribe Antidepressants for Depression in Older Adults: Consensus, Multidisciplinary Practice Recommendations. TPJ. 2023;27(2):1–8.
12. Van Leeuwen E, Van Driel ML, Horowitz MA, Kendrick T, Donald M, De Sutter AI, et al. Approaches for discontinuation versus continuation of long-term antidepressant use for depressive and anxiety disorders in adults. Cochrane Common Mental Disorders Group, Herausgeber. Cochrane Database of Systematic Reviews. 2021. doi.wiley.com/10.1002/14651858.CD013495.pub2; letzter Zugriff: 08.11.2024
13. Holsboer-Trachsler E, Hättenschwiler JA, Beck J, Brand S, Hemmeter UM, Keck ME, et al. Erhaltungstherapie und Rezidivprophylaxe unipolarer depressiver Störungen. Swiss Med Forum. 2016. doi.emh.ch/smf.2016.02705; letzter Zugriff: 19.08.2024
14. Hatzinger M, Hemmeter U, Hirsbrunner T, Holsboer-Trachsler E, Leyhe T, Mall JF, et al. Empfehlungen für Diagnostik und Therapie der Depression im Alter: Therapy Recommendations for Diagnosis and Treatment of Depression in Old Age. Praxis. 2018;107(3):127–44.
15. Bestmögliche Medikationsanamnese bei Spitaleintritt. 2017. www.youtube.com/watch?v=pIDKgPAfG4o; letzter Zugriff: 08.11.2024
16. FitzGerald RJ. Medication errors: the importance of an accurate drug history. Brit J Clinical Pharma. 2009;67(6):671–5.
17. Kühlein T, Van Der Wardt V, Viniol A. Das Absetzen von Medikamenten. CME. 2022;19(12):8–11.
18. Lee EA, Brettler JW, Kanter MH, Steinberg SG, Khang P, Distasio CC, et al. Refining the Definition of Polypharmacy and Its Link to Disability in Older Adults: Conceptualizing Necessary Polypharmacy, Unnecessary Polypharmacy, and Polypharmacy of Unclear Benefit. TPJ. 2020;24(1):18.212.
19. American Psychiatric Association, American Psychiatric Association, Herausgeber. Diagnostic and statistical manual of mental disorders: DSM-5. 5th ed. Washington, D.C: American Psychiatric Association; 2013. 947 S.