Mit der ersten Ausgabe des Jahres 2025 begrüssen wir Sie herzlich in ein Jahr voller Veränderungen und neuer Perspektiven, auch in der Onkologie. Neben den gewohnten wissenschaftlichen und klinischen Highlights freuen wir uns, Ihnen eine bedeutende Neuerung in dieser Zeitschrift vorstellen zu dürfen: Ab sofort wird die «info@ONCO-SUISSE» regelmässig eine Rubrik enthalten, die von SHOOT (Swiss Hematologists and Oncologists of Tomorrow) gestaltet wird. Diese Plattform bietet jungen Hämatolog/-innen und Onkolog/-innen die Möglichkeit, ihre Stimmen, Ideen und Visionen in den Fokus zu rücken und eine stärkere Präsenz in der Fachwelt zu erhalten.
Wir freuen uns, Sie durch dieses spannende Jahr zu begleiten – mit wichtigen Einblicken, aktuellen Entwicklungen und den Stimmen der nächsten Generation. Über die bisherigen Leistungen, Arbeiten und Ziele von SHOOT seit der Gründung werden Sie in der nächsten Ausgabe der Fachzeitschrift «info@ONCO-SUISSE» mehr erfahren.
Herzlichst Dr. med. Tämer El Saadany, Dr. med. Eveline Daetwyler (im Auftrag von SHOOT)
Positionspapier «SHOOT»
Wir freuen uns sehr, heute «Swiss Hematologists and Oncologists of Tomorrow» (SHOOT) vorstellen zu dürfen und ab jetzt Teil von «info@ONCO-SUISSE» zu sein.
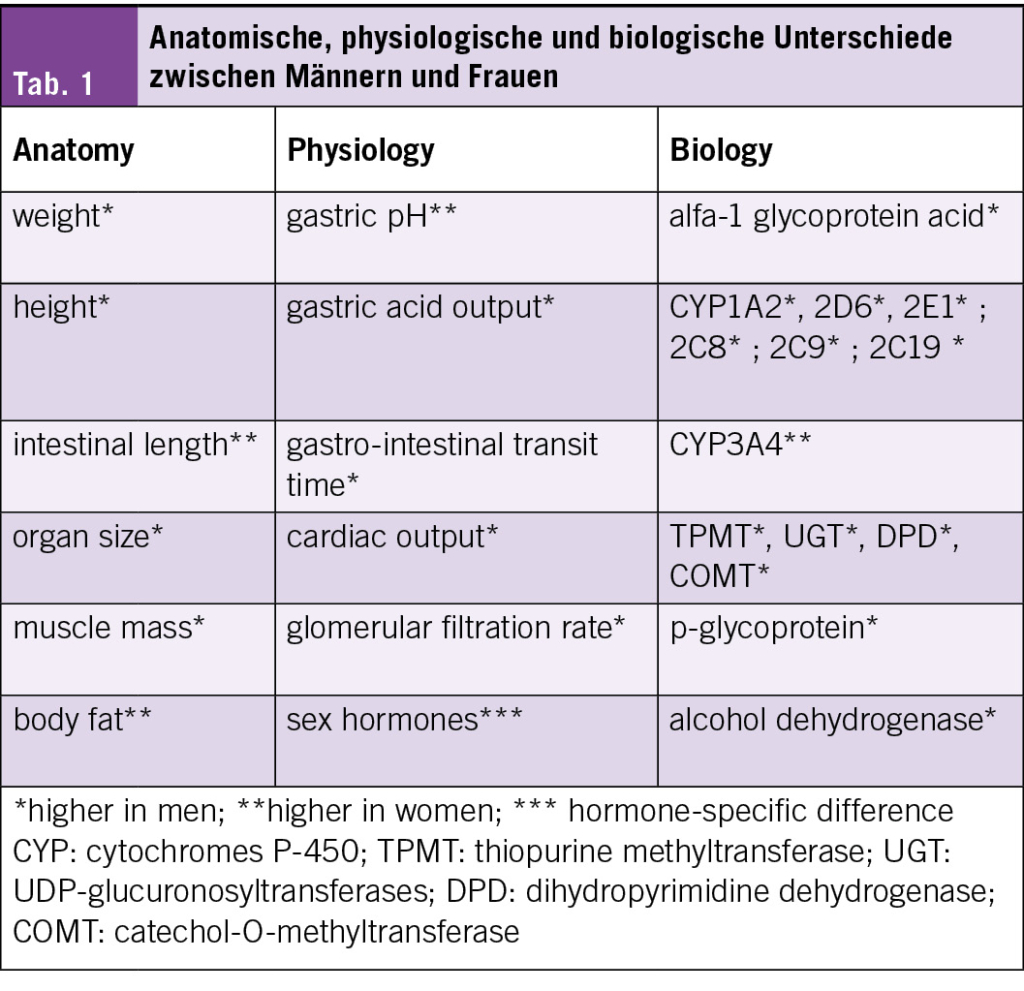
Kaum ein Fachgebiet der Medizin hat über die letzten Jahre eine solch rasante Entwicklung erlebt wie die beiden Fachbereiche Hämatologie und Onkologie. In immer kürzeren Abständen werden neue Therapieoptionen und -ansätze publiziert und angewendet. Gewisse Krankheiten haben sich von rasch tödlich verlaufenden zu chronischen Krankheiten entwickelt. Das Verständnis der Tumorentwicklung mit den entsprechenden molekularbiologischen Hintergründen und der Interaktion mit dem Immunsystem wird immer besser, und das führt zur Entwicklung von neuen und zielgerichteten Therapieoptionen. Auch in der Hämostaseologie halten neue Therapiekonzepte Einzug. In der Diagnostik kommen zudem immer genauere Methoden zur Anwendung, um die Krankheiten auf molekularer Ebene zu erfassen und einzuordnen.
Die demographische Entwicklung mit einer alternden Bevölkerung sowie die verbesserte Prognose von hämatologischen/onkologischen Erkrankungen mit entsprechend längeren Krankheitsverläufen führen zu einem steigenden Bedarf an Hämatolog/-innen und Onkolog/-innen. Der Anteil von Frauen in der Medizin hat in den letzten Jahren stark zugenommen, was (auch) zu neuen Arbeitszeitmodellen führt (z. B. neue/andere Familienmodelle, Zunahme von Teilzeittätigkeit).
Aktuelle Entwicklungen führen zu vielfältigen neuen Herausforderungen. Die demographische Entwicklung mit einer älter werdenden Bevölkerung führt zu einer zunehmenden Multimorbidität, die einer komplexen individualisierten Therapieplanung bedarf und in aktuellen Guidelines teilweise noch unzureichend abgebildet ist. Das zunehmende Wissen über molekularbiologische Grundlagen der Neoplasien führt zur Aufsplittung von Tumorentitäten in immer mehr Subentitäten mit eigenen Behandlungspfaden und tumoragnostischen Behandlungsoptionen. Zusammen mit den rasanten Fortschritten in der medikamentösen Tumortherapie wird das gesamte Feld für einzelne Versorger/-innen immer schwieriger, mit der Entwicklung Schritt zu halten. Hinzu kommt die Entwicklung von neuen Technologien wie künstlicher Intelligenz (KI) und Big Data, die auch vor der Hämatologie und Onkologie nicht Halt machen und die Entwicklung über die nächsten Jahrzehnte prägen werden. Auch die steigende Anzahl der Krebsüberlebenden mit den oft lebenslang bestehenden Therapiefolgen stellen eine Herausforderung für die zukünftige Versorgung dar.
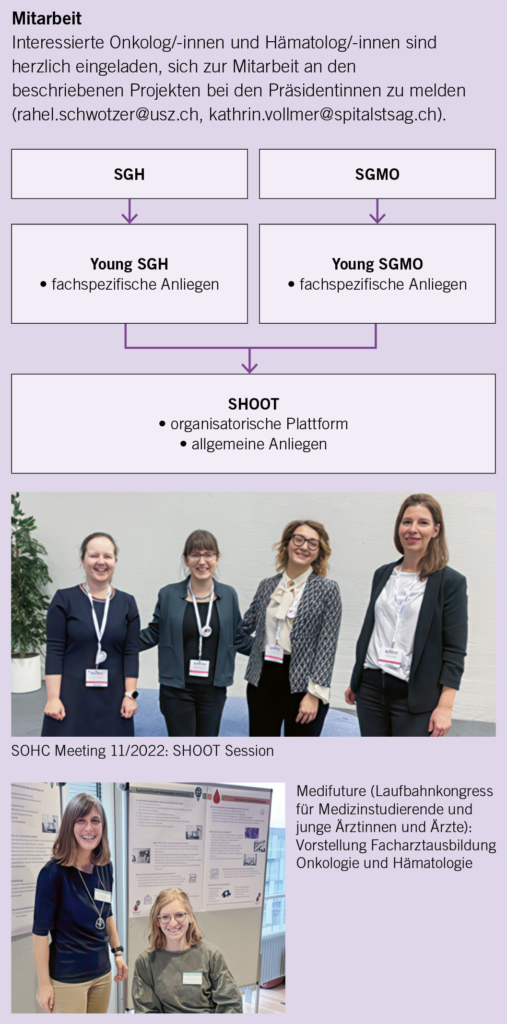
All diese Herausforderungen bieten aber auch Chancen zur aktiven Mitgestaltung des künftigen Berufsbildes und -feldes. In diesem Zusammenhang haben sich sowohl die SGMO wie auch die SGH zur Gründung einer eigenen Arbeitsgruppe entschlossen. Young SGMO und Young SGH sind Teil der jeweiligen Fachgesellschaften; sie organisieren sich seit dem Gründungsdatum am 5. August 2021 nun auf einer gemeinsamen Plattform als SHOOT. Diese Plattform dient dazu, organisatorische Synergien zu nutzen, gemeinsame Bedürfnisse zu adressieren und zukünftige Herausforderungen zu bewältigen.
Die Ziele der Organisationen bestehen in folgenden Bereichen:
1. Förderung und Vernetzung von jungen Hämatolog/-innen und Onkolog/-innen
Oberstes Ziel der Nachwuchsorganisationen ist die Förderung und Vernetzung der jungen Hämatolog/-innen und Onkolog/-innen. Ziel ist es auch, die aktuell bestehende Attraktivität des Berufsfeldes zu erhalten und weiterzuentwickeln, mit dem Ziel der Erreichung einer langfristigen und nachhaltigen Versorgungssicherheit.
2. Verbesserung der Vereinbarkeit von Beruf und Familie mit Förderung von Teilzeitmodellen
Der zunehmende Anteil von Frauen in der Medizin und auch die Auflösung von traditionellen Familienstrukturen erfordern heute flexiblere und andere Arbeitsmodelle für alle Geschlechter. Die Hämatologie und Onkologie mit ihrem überwiegend ambulanten Tätigkeitsfeld bieten hier vielfältige Möglichkeiten zur Mitgestaltung an. Eine anstehende Herausforderung ist hierbei auch die Förderung von Teilzeitmodellen, auch in der Forschungstätigkeit und auch in Führungspositionen.
3. Förderung von Resilienz und Burn-out Prävention
Der tägliche Umgang mit schwerstkranken Menschen sowie die ständige Präsenz von Tod und Leid gehören zu den grossen Herausforderungen in der Behandlung von onkologischen und hämatologischen Erkrankungen. Dies bedeutet eine Belastung sowohl für Berufseinsteiger/-innen, aber auch für erfahrene Kolleg/-innen. Zusammen mit der zunehmenden Bürokratisierung und Regulierung im Gesundheitswesen stellen dies Risikofaktoren für die psychische Gesundheit der Hämatolog/-innen und Onkolog/-innen dar. Dieser Herausforderung möchte SHOOT proaktiv begegnen und eine diesbezüglich erste und wichtige Anlaufstelle sein.
4. Erhaltung der hohen Qualität der Weiterbildung
Um den zukünftigen Herausforderungen gerecht zu werden, ist eine hochstehende Facharztweiterbildung essenziell. Ziel von SHOOT ist der Erhalt und die Neuschaffung von Ausbildungsplätzen sowie die stetige Weiterentwicklung der Facharztweiterbildung im Hinblick auf kommende Herausforderungen. Das erklärte Ziel besteht im aktiven Einbezug des Nachwuchses in der Gestaltung des Weiterbildungscurriculums.
5. Förderung der Forschungstätigkeit
Die Schweizer Krebsforschung ist auf einem international hohen Niveau. Ziel der SGMO und der SGH ist es, dieses Niveau langfristig halten zu können. Essenziell ist hierbei die Vernetzung der kommenden Generationen mit bestehenden Strukturen und Fördermöglichkeiten.
6. Aufklärung über verschiedene Karrieremodelle
Die Onkologie und Hämatologie bieten diverse Karrieremöglichkeiten sowohl im Rahmen einer selbstständigen wie auch einer angestellten Tätigkeit. Ziel von SHOOT ist die Aufklärung über verschiedene Tätigkeitsmodelle und Möglichkeiten zum Austausch mit entsprechenden Exponenten. SHOOT soll zudem beratende Anlaufstelle bei Fragen der Karriereplanung werden.
7. Förderung von Chancengleichheit
Ein weiterer Schwerpunkt von SHOOT besteht in der gezielten Förderung und Vernetzung der Frauen in der Onkologie und Hämatologie. Ziele sind die verbesserte Sichtbarkeit von Onkologinnen und Hämatologinnen, das Aufzeigen von Karrieremöglichkeiten bis hin zur gezielten Förderung von Frauen in Führungspositionen.
8. Kontinuierlicher Austausch mit internationalen Organisationen wie DGHO, ESMO und EHA
Nicht zuletzt ist das Ziel von SHOOT die Kooperation mit internationalen Organisationen wie ESMO, DGHO und EHA, zur Anstossung gemeinsamer Projekte und Aufklärung über Möglichkeiten für internationale Fortbildungen und Fellowships.
Zielgruppe von SHOOT sind Hämatolog/-innen und Onkolog/-innen in Ausbildung wie auch junge Fachärzt/-innen. Im Rahmen der sich verändernden Karrieremodelle wird auf ein oberes Alterslimit zur Teilnahme verzichtet.
Dr. med. Rahel Schwotzer
Klinik für Medizinische Onkologie und Hämatologie
Universitätsspital Zürich, Zürich
Dr. med. Kathrin Vollmer
Onkologie-/Hämatologiezentrum Thun-Spiez-Berner Oberland
Spital STS AG Thun, Thun
Weitere Informationen
https://www.ssh-ssmo-shoot.ch
Kantonsspital Graubünden
Onkologie / Hämatologie
Loestrasse 170
7000 Chur
HOCH Health Ostschweiz
Rorschacher Strasse 95
9007 St.Gallen