Das Altern beeinträchtigt die Koordination und erhöht das Risiko von Stürzen, was sich auf die Lebensqualität der älteren Menschen auswirkt. Fortschritte in den Neurowissenschaften legen nahe, dass ein aktiver Lebensstil und das Trainieren des Gleichgewichts wichtig sind, um dieses Risiko zu mindern. Die steigende Lebenserwartung in Verbindung mit der Beeinträchtigung der posturalen Kontrolle im Alter erklärt die hohe Prävalenz von Stürzen bei Senioren und rechtfertigt die Bedeutung von gezielten Rehabilitationsprogrammen. Die Zusammenarbeit zwischen Bewegungsphysiologen und Physiotherapeuten im Réseau Hospitalier Neuchâtelois (RHNe) führt zu neuen Ansätzen in der Rehabilitation innerhalb der Institution und mündet in der Einführung eines Koordinationstrainings in Form einer therapeutischen Gruppe. Eine interdisziplinäre Arbeit, die wissenschaftliches Fachwissen mit klinischer Anwendung verbindet mit dem Ziel, eine optimale Betreuung zu erreichen.
Aging affects coordination and increases the risk of falls, impacting quality of life. Advances in neuroscience suggest the importance of an active lifestyle and balance training to mitigate these effects. The increasing life expectancy and differences in postural control between the young and elderly highlight the high incidence of falls among seniors, justifying the need for tailored rehabilitation programs. Collaboration between exercise physiologists and physiotherapists at RHNe introduces novel rehabilitation approaches within the institution, leading to the establishment of a coordination training group. This interdisciplinary work combines scientific expertise and clinical application for improved care.
Key words: Aging, Coordination, Fall Prevention, Rehabilitation, Interprofessional Collaboration
Wissenschaft und Gleichgewicht: Die Mobilität von Senioren neu überdenken
Auch wenn einige Forschungsarbeiten in der Vergangenheit bereits auf die altersbedingten Funktionsverluste hingewiesen hatten (1), haben die Neurowissenschaften und die kognitive Forschung hauptsächlich der letzten Jahre unser Denken über das Altern verändert, vor allem in Bezug auf Gesundheit und Lebensqualität (2). Das Ausmass dieser Verluste, wie z.B. ein schlechteres Gedächtnis, ein erhöhtes Sturzrisiko oder eine langsamere Informationsverarbeitung, kann zwar von Person zu Person variieren, aber beim Vergleich von Senioren und jungen Erwachsenen zeigen sich die Unterschiede generell (3). Ein aktiver Lebensstil, der körperliche, kognitive und soziale Anreize bietet, scheint nicht nur für die Verringerung von Funktionsverlusten und die Verbesserung der Mobilität älterer Menschen Vorteile zu bringen, sondern auch für die Aufrechterhaltung guter kognitiver Fähigkeiten (4). Die Kontrolle des Gleichgewichts hat für die Aufrechterhaltung oder Wiedererlangung eines aktiven Lebensstils entscheidende Bedeutung, erfordern ja die verschiedenen Prozesse der motorischen Kontrolle schon bei alltäglichen Aktivitäten wie Gehen oder Radfahren eine kontinuierliche Integration von multisensorischen Informationen über den Körper im Raum (5).
Prävalenz von Stürzen bei Senioren
In den entwickelten Ländern beträgt die Lebenserwartung von 65-jährigen Personen etwa 17 Jahre für Männer und 21 Jahre für Frauen. Zudem ist belegt, dass der posturale Kontrollmechanismus zwischen jungen und alten Menschen erheblich variiert (6), was die Zunahme von Stürzen bei Senioren erklärt. Mindestens ein Drittel der über 65-Jährigen erleidet mindestens einen Sturz pro Jahr (7). Diese Rate steigt mit zunehmendem Alter rapide an und erreicht Werte von 56 % in den Altersgruppen von 90 bis 99 Jahren (8). In der Schweiz zeigen Statistiken, dass Stürze die Hauptursache für Todesfälle und Verletzungen durch nicht-berufliche Unfälle sind (9). Jährlich verletzen sich nicht weniger als 300 000 Menschen aufgrund von Stürzen, was mehr als die Hälfte aller Unfälle zuhause ausmacht (10).
Beeinträchtigung der posturalen Kontrolle
Ältere Menschen zeigen signifikante Unterschiede in ihrer posturalen Kontrolle bei der Ausführung einer Doppelaufgabe (Dual-Task, DT) (11). Dieser Unterschied ist umso ausgeprägter, je komplexer die Aufgabe ist (12): Es ist eine Verminderung der Leistung in Verbindung mit der konkurrierenden Aufgabe zu beobachten. In Verbindung mit dieser Verschlechterung der posturalen Kontrolle kann die Zunahme von Stürzen bei Personen über 65 Jahren durch eine Schwächung bestimmter altersbedingter neuromechanischer Fähigkeiten, wie z. B. der sensorischen Gewichtung, erklärt werden (13). Die nachlassende Kontrolle der sensorischen Gewichtung scheint eine wichtige Rolle bei der Zunahme von Stürzen bei Senioren zu spielen (14). Die Gründe für diese positive Korrelation zwischen der Beeinträchtigung der posturalen Kontrolle und dem steigenden Alter sind vielfältig: Die Sarkopenie, d.h. der unfreiwillige Verlust von Muskelmasse, ist eine kritische pathophysiologische Komponente der Gebrechlichkeit (15), die Verschlechterung der sensorischen Fähigkeiten wie Sehen, Hören und Tasten, eine verminderte körperliche Fitness, die zu einem Verlust der Muskelkraft (insbesondere der Explosivkraft) führt, eine längere Immobilisierung, die Nebenwirkungen, die sich aus der Einnahme bestimmter Medikamente ergeben, und schliesslich die Angst vor dem «Kontrollverlust» und vor der Gefahr zu stürzen (6). Ein Sturz im Alter kann schwerwiegende Folgen haben und die Lebensqualität einer Person drastisch beeinträchtigen. Daher ist es wichtig, die Ursachen und Risiken von Stürzen bei älteren Menschen zu untersuchen. Ein besseres Verständnis der Beeinträchtigung der posturalen Kontrolle ermöglicht, den potentiellen Verminderungen gewisser neuromechanischer Fähigkeiten vorzubeugen und so die Betreuung der älteren Menschen zu optimieren mit dem Ziel, ihr Sturzrisiko zu verringern.
Die Auswirkungen von Gleichgewichtstraining
Im Kampf gegen die Zunahme von Stürzen bei älteren Menschen scheint Gleichgewichtstraining insbesondere bei der Verbesserung gewisser Parameter der posturalen Kontrolle (16), aber auch auf struktureller Ebene (17) von Vorteil zu sein. Ausdauernde körperliche Aktivität kann die posturale Kontrolle verbessern (18). Mehrere Studien (19) empfehlen das Gleichgewichtstraining als wirksame Massnahme, um der natürlichen Beeinträchtigung bestimmter neuromechanischer und kognitiver Funktionen entgegenzuwirken (20). Die positiven Effekte, die aus dem Training und Verbessern des Gleichgewichtes resultieren, zeigten Verhaltensverbesserungen auf mehreren Ebenen, wie z. B.: geringere Inzidenz von Stürzen (mit oder ohne medizinische Folgen), bessere Rehabilitationsfähigkeiten, weniger Nackenschmerzen, verbesserte sensomotorische Funktionen der Halswirbelsäule und verbesserte plyometrische Leistungen. Diese Forschungsergebnisse unterstreichen die zahlreichen Vorteile, die sich aus dem Gleichgewichtstraining bei älteren Menschen ergeben. Daher ist die Einführung solcher Programme in der Rehabilitation von grosser Bedeutung.
Umsetzung: Erfahrungen in RHNe
Einrichtung einer Therapiegruppe «Koordination»
Die Notwendigkeit, ein Gleichgewichtstraining in die Rehabilitation zu integrieren, erscheint daher unerlässlich. Aus diesem Grund und im Rahmen eines institutionellen Projekts zur Verbesserung der Rehabilitationsprozesse wurde ein proaktiver Ansatz entwickelt und geschaffen, um die Lebensqualität unserer Patienten, insbesondere der älteren Rehabilitanden, durch die Gründung einer Therapiegruppe «Koordination» zu verbessern.
Ziele
Das Hauptziel dieser Koordinationsgruppe besteht darin, die motorische Koordination zu stärken; diese Kompetenz ist für ihre täglichen Aktivitäten und zur Vermeidung von Stürzen unerlässlich. Die praktische Arbeit kann sowohl im Sitzen als auch im Stehen durchgeführt werden und ist auf vier Ziele ausgerichtet:
1. Die Patienten für die lebenswichtige Bedeutung der Koordination für ihre täglichen Aktivitäten zu sensibilisieren
2. Die Koordination in allen Bereichen zu verbessern, was insbesondere eine wirksame Prävention vor Stürzen gewährleistet
3. Einfache und reproduzierbare Übungen für zu Hause anzubieten, was die Selbstständigkeit der Patienten und die Kontinuität der Pflege fördert
4. Die Fortschritte jedes Patienten zu beobachten und zu quantifizieren, um die Übungen so anzupassen, dass sie den persönlichen Bedürfnissen entsprechen.
Kriterien
Die Gruppe ist so konzipiert, dass sie ein breites Spek-trum an Patienten aufnehmen und ihnen ein mass-geschneidertes und individuelles Programm bieten kann. Jedoch soll die Wirksamkeit und Sicherheit der Sitzungen für alle Teilnehmer gewährleistet sein, weshalb bestimmte Ausschlusskriterien zur Anwendung kommen. Dieses Programm ist ideal für diejenigen, die sich aktiv an den Übungen beteiligen können, mit folgenden Ausnahmen:
1. Patienten mit schweren kognitiven Störungen und einem Mini-Mental State Examination (MMS)-Wert von weniger als 15
2. Patienten mit schwerer Taubheit oder Blindheit
3. Patienten mit Verhaltensstörungen, die die Gruppendynamik beeinträchtigen könnten
4. Patienten mit einer zu starken Abhängigkeit, was durch einen FIM-Wert (Functional Independence Measure)von weniger als 4 für Transfers und Fortbewegung angezeigt wird.
Häufigkeit und Ablauf der Sitzungen
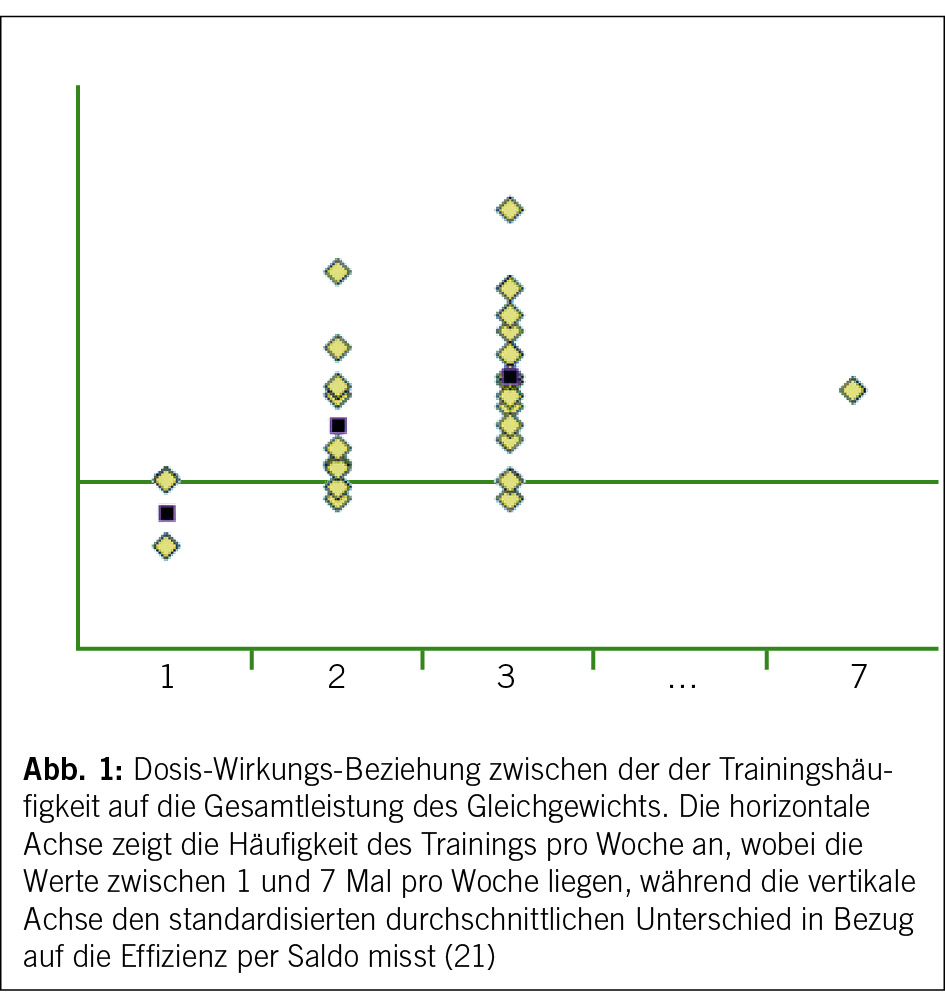
Die Sitzungen der Therapiegruppe «Koordination» finden dreimal pro Woche statt. Unser Ziel war es, die wissenschaftlichen Erkenntnisse so genau wie möglich in die klinische Praxis zu integrieren. Die Forschung legt nämlich eine substantielle Verbesserung der Leistungsfähigkeit des Gleichgewichts bei einer Frequenz von drei wöchentlichen Sitzungen nahe (21) (Abb. 1).
Die Sitzungen dauern 45 Minuten. Jede Gruppe besteht aus bis zu sechs Patienten, die von einem Bewegungsphysiologen oder einem Physiotherapeuten betreut werden. Die Teilnehmer der Gruppe sind dem Spital bekannte Patienten. Dies ermöglicht eine personalisierte Auswahl der Übungen und erlaubt, deren Anforderungen vorauswählen und so individuell auf die Bedürfnisse jedes Einzelnen einzugehen.
Auswahl der Übungen
Die Übungen werden aus einer Reihe von gezielten Übungen ausgewählt, welche sich um fünf Schlüsselthemen drehen: Orientierung, Reaktion, Differenzierung, Rhythmus und Gleichgewicht (ORDER). Jedes dieser Themen bietet sechs Schwierigkeitsgrade, vom einfachsten bis zum komplexesten. Diese Abstufung ermöglicht einen hohen Grad an Personalisierung. Einfache Übungen, wie das Stehen auf einer instabilen Oberfläche, oder komplexere Übungen, wie die Ausführung einer Doppelaufgabe (DT), ermöglichen es, den Schwierigkeitsgrad fein auf die Fähigkeiten des Patienten abzustimmen (Abb. 2) und auch seinen Fortschritten anzupassen. Diese Anpassungsfähigkeit sorgt nicht nur für maximale Sicherheit beim Üben, sondern erhält auch das Engagement der Patienten auf hohem Niveau, was ein Schlüsselfaktor für den Erfolg eines jeden Rehabilitationsprogramms ist.

Positives Feedback
Empirische Rückmeldungen deuten auf eine gute Adhärenz der Patienten hin und betonen, dass bestimmte Aspekte der Koordination, die lange Zeit vernachlässigt wurden, wie Rhythmus oder Reaktion, wieder antrainiert werden konnten. Die Patienten erhöhten die Anzahl ihrer täglichen Bewegungen und gaben an, die Vielfalt der Bewegung zu schätzen. Physiotherapeuten, die Einzelsitzungen als Teil ihrer spezifischen Rehabilitationspfads des Patienten anboten, gaben auch positive Rückmeldungen ab über den Trainingserfolg für ihre Patienten aus der Gruppe.
Neue Kooperationen: Komplementarität von Physiologe und Physiotherapeut
Die Gründung einer Koordinationsgruppe innerhalb unseres Netzwerks ergab sich aus der bereichernden Zusammenarbeit zwischen dem Bewegungsphysiologen und dem Physiotherapeuten. Dies hat eine innovative Perspektive auf das Training und die Therapie unserer Patienten eröffnet.
Der Bewegungs- oder Sportphysiologe liefert eine solide wissenschaftliche Grundlage, die die gesundheitlichen Vorteile körperlicher Aktivität hervorhebt. Sein fundiertes Wissen in den Bereichen Gleichgewicht, Ausdauer, der Biomechanik der Bewegung und der Kraft ermöglicht die Einführung innovativer Praktiken. Insbesondere für den letztgenannten Bereich und im Rahmen eines Rehabilitationszentrums bringt er wissenschaftliche Präzision in die Kraftarbeit ein. Er passt die Arbeitsbelastung individuell an die relative Maximalkraft jedes Patienten an und nutzt das gesamte Spektrum des Trainings aus, dh. gegen Widerstand, Maximalkraft, Explosivkraft.
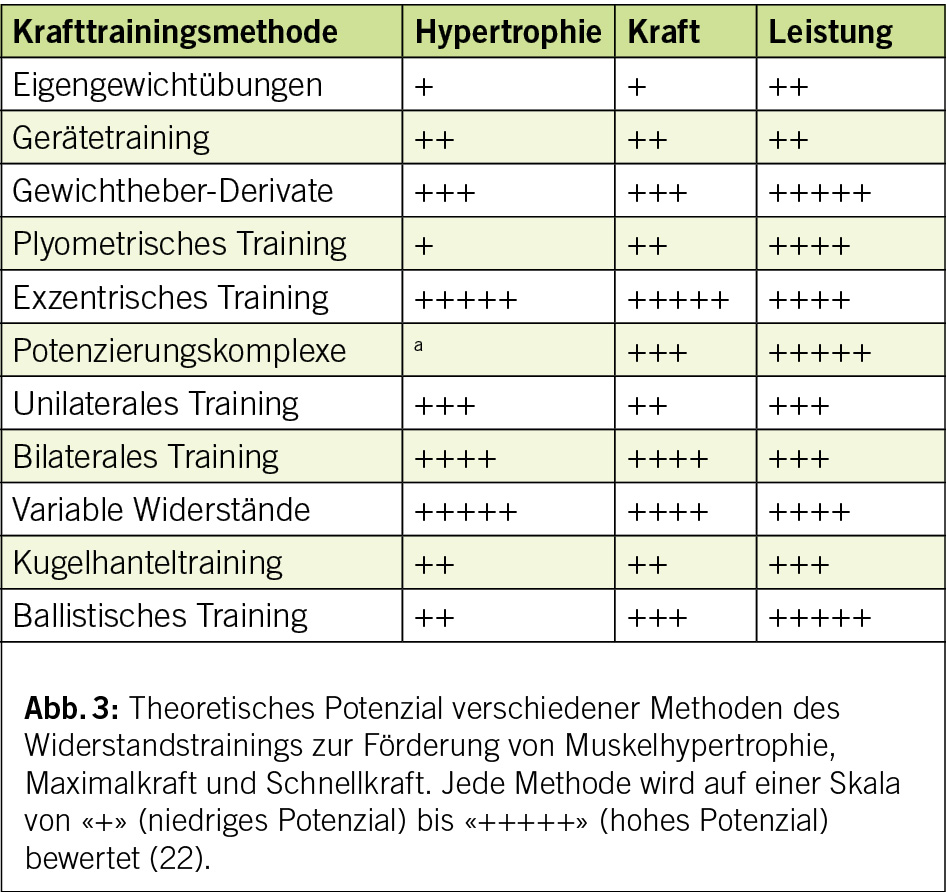
Um den für die Patienten fixierten Therapiezielen am besten gerecht zu werden, erarbeitet der Bewegungs- oder Sportphysiologe adaptierte Protokolle, die sich auf gesicherte Daten und wirksamen und abwechslungsreichen Methoden abstützen, wie das exzentrische (22) oder Maximalkraft-Training. Die letztere Form erfordert weniger Wiederholungen, aber mit mehr Gewicht, um den Zuwachs an Kraft zu maximieren (Abb. 3).
Wenn z. B. das gewünschte Ziel ist, Kraft zu gewinnen, empfehlen gängige Protokolle 10-20 Wiederholungen mit Gewichten unter 75 % der Maximalkapazität, gefolgt von kurzen Pausen.
Für eine optimale Verbesserung der Kraft empfiehlt die Fachliteratur jedoch seit langem kraftintensivere Uebungen (> 75 %), die aber auf 8 Wiederholungen limitiert und von längeren Pausen (2–4 Min) gefolgt sind (23).
Durch diese wissenschaftliche Expertise erfährt die Verschreibungspraxis von Übungen einen neuen Ansatz, der sich von konventionellen Praktiken entfernt und ausgeprägtere physiologische Adaptationen empfiehlt. Dieser Ansatz trägt auch dazu bei, die Zurückhaltung von Physiotherapeuten bei der Anwendung von Kraftübungen, insbesondere mit höheren Intensitäten, bei als fragil geltenden Patienten zu zerstreuen.
Parallel dazu bringt der Physiotherapeut eine ergänzende Dimension ein, nämlich einen klinischeren und funktionelleren Blickwinkel einnimmt, der direkt auf die Bedürfnisse der Patienten ausgerichtet ist. Dieses Fachwissen ermöglicht es, die Durchführbarkeit der vorgeschlagenen Übungen abzuschätzen und so ihre Anpassung und Sicherheit für jeden Einzelnen zu gewährleisten. Darüber hinaus fördert die Zusammenarbeit zwischen diesen beiden Professionen einen ganzheitlichen Ansatz, bei dem wissenschaftliche Theorie auf klinische Praxis trifft, was einen optimalen Nutzen für den Patienten ergibt.
Diese Komplementarität hat zu einer neuen Sichtweise auf die Anwendung der Bewegungswissenschaften bei einer als gebrechlich geltenden Bevölkerung geführt. Sie ermöglicht, über traditionelle therapeutische Ansätze hinauszugehen, Befürchtungen zu beseitigen und etablierte Praktiken in Frage zu stellen.
Copyright Aerzteverlag medinfo AG
Übersetzung aus la gazette médicale 05-06/2024
Réseau Hospitalier Neuchâtelois
Coordinateur Médecine du Sport /
Physiologiste du Sport
Swiss Olympic Sport Medical Base
Route de Landeyeux
2046 Fontaines
Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Lyketsos CG, Chen LS, Anthony JC. Cognitive Decline in Adulthood: An 11.5-Year Follow-Up of the Baltimore Epidemiologic Catchment Area Study. Am J Psychia- try. janv 1999;156(1):58-65.
2. Park DC, Reuter-Lorenz P. The Adaptive Brain: Aging and Neurocognitive Scaf- folding. Annu Rev Psychol. 1 janv 2009;60(1):173-96.
3. Hultsch DF, Hertzog C. Use It or Lose It: Engaged Lifestyle as a Buffer of Cogni- tive Decline in Aging?
4. Bherer L. Cognitive plasticity in older adults: effects of cognitive training and phy- sical exercise. Ann N Y Acad Sci. mars 2015;1337(1):1-6.
5. Day BL, Fitzpatrick RC. Virtual head rotation reveals a process of route reconst- ruction from human vestibular signals. J Physiol. sept 2005;567(2):591-7.
6. Granacher U, Bridenbaugh SA, Muehlbauer T, Wehrle A, Kressig RW. Age- Related Effects on Postural Control under Multi-Task Conditions. Gerontology. 2011;57(3):247-55.
7. Lord SR, Ward JA, Williams P, Anstey KJ. An epidemiological study of falls in older community dwelling women: the Randwick falls and fractures study. Aust J Public Health. sept 1993;17(3):240-5.
8. Blake AJ, Morgan K, Bendall MJ, Dallosso H, Ebrahim SBJ, Arie THD, et al. FALLS BY ELDERLY PEOPLE AT HOME: PREVALENCE AND ASSOCIATED FAC- TORS. Age Ageing. 1988;17(6):365-72.
9. Ewert U, Stürmer YA, Niemann S. Soziale Ungleichheit und Nichtberufsunfälle in der Schweiz. 2016;
10. Bächli M, Derrer P. Unfallschwerpunkte im Bereich Haus und Freizeit.
11. Berger L, Bernard-Demanze L. Age-related effects of a memorizing spatial task in the adults and elderly postural control. Gait Posture. févr 2011;33(2):300-2.
12. Doumas M, Rapp MA, Krampe RTh. Working Memory and Postural Control: Adult Age Differences in Potential for Improvement, Task Priority, and Dual Tas- king. J Gerontol B Psychol Sci Soc Sci. 1 mars 2009;64B(2):193-201.
13. Krampe RTh, Doumas M, Lavrysen A, Rapp M. The costs of taking it slowly: Fast and slow movement timing in older age. Psychol Aging. 2010;25(4):980-90.
14. Rubenstein LZ. Falls in older people: epidemiology, risk factors and strategies for prevention. Age Ageing. 1 sept 2006;35(suppl_2):ii37-41.
15. Lopez P, Pinto RS, Radaelli R, Rech A, Grazioli R, Izquierdo M, et al. Benefits of resistance training in physically frail elderly: a systematic review. Aging Clin Exp Res. août 2018;30(8):889-99.
16. Penzer F, Duchateau J, Baudry S. Effects of short-term training combining strength and balance exercises on maximal strength and upright standing steadi- ness in elderly adults. Exp Gerontol. janv 2015;61:38-46.
17. Taubert M, Mehnert J, Pleger B, Villringer A. Rapid and specific gray matter changes in M1 induced by balance training. NeuroImage. juin 2016;133:399-407.
18. Seidel O, Carius D, Kenville R, Ragert P. Motor learning in a complex balance task and associated neuroplasticity: a comparison between endurance athletes and nonathletes. J Neurophysiol. 1 sept 2017;118(3):1849-60.
19. Taube W. Neuronale Mechanismen der posturalen Kontrolle und der Einfluss von Gleichgewichtstraining.
20. Liu-Ambrose T, Donaldson MG. Exercise and cognition in older adults: is there a role for resistance training programmes? Br J Sports Med. 19 nov 2008;43(1):25-7.
21. Lesinski M, Hortobágyi T, Muehlbauer T, Gollhofer A, Granacher U. Effects of Balance Training on Balance Performance in Healthy Older Adults: A Systematic Review and Meta-analysis. Sports Med. déc 2015;45(12):1721-38.
22. Suchomel TJ, Nimphius S, Bellon CR, Stone MH. The Importance of Muscular Strength: Training Considerations. Sports Med. avr 2018;48(4):765-85.
23. Benedict T. Manipulating Resistance Training Program Variables to Optimize Maximum Strength in Men: A Review. J Strength Cond Res. 1999;13(3):289.