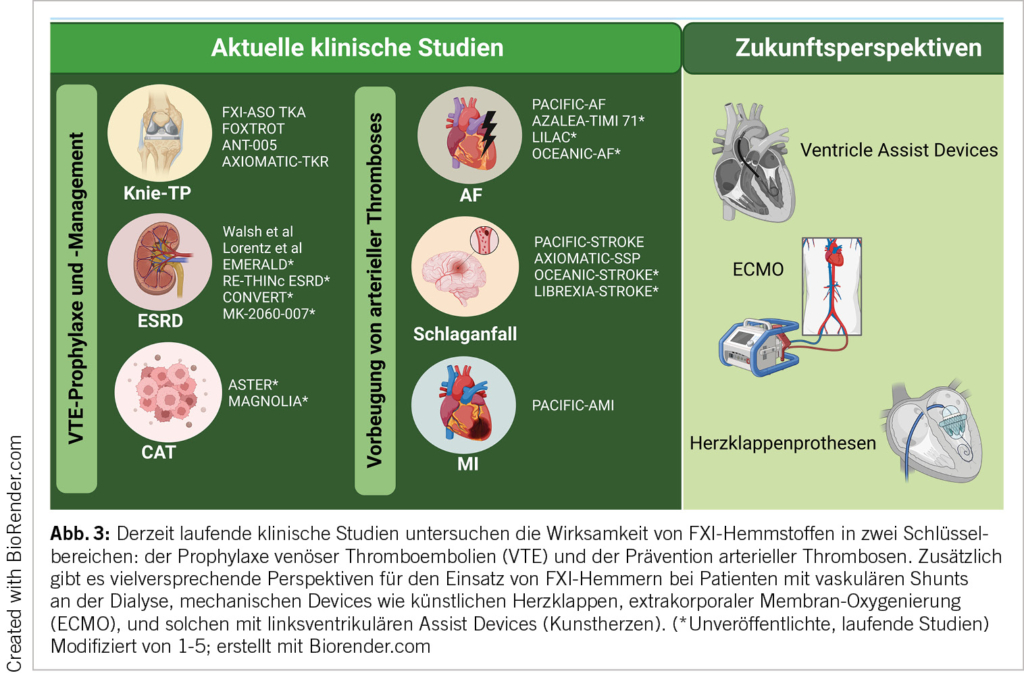
Der Normaldruckhydrozephalus (NPH) ist eine wichtige Diagnose, da er zu den behandelbaren Demenzen und Gangstörungen gehört. Die klassische Trias muss nicht immer vollständig erfüllt sein. Die Diagnostik erfolgt mit einer Bildgebung, wo sich erweiterte innere Liquorräume zeigen, die über das Ausmass einer generalisierten Atrophie hinausgehen. Mit einem Liquorablass von mind. 30-50ml mit standardisierter Testung von Gangbild und kognitiven Funktionen kann die Diagnose erhärtet und der Therapieeffekt abgeschätzt werden.
Normal pressure hydrocephalus (NPH) is an important diagnosis because it is one of the treatable dementias and gait disorders. The classic triad does not always have to be completely fulfilled. The diagnosis is made with imaging, which shows enlarged internal CSF spaces that go beyond the extent of generalised atrophy. With a CSF drain of at least 30-50 ml with standardised testing of gait and cognitive functions, the diagnosis can be confirmed and the therapeutic effect assessed.
Key Words: Normal pressure hydrocephalus (NPH), treatable dementias, gait disorders, CSF spaces, CSF drain
Fallbericht
Eine 77-jährige Patientin war lange aufgrund von Rücken- und Beinschmerzen bei degenerativen Veränderungen der Wirbelsäule bei Schmerzmedizinern und Rheumatologen in konservativer Behandlung. Im weiteren Verlauf entwickelte die Patientin eine Gangataxie, die primär auf die Wirbelsäulenveränderungen mit Affektion neuraler Strukturen zurückgeführt wurde. Einige Monate später traten jedoch auch kognitive Störungen mit Einschränkungen des Kurzzeitgedächtnisses hinzu. Anamnestisch wurde auch eine intermittierende Urininkontinenz berichtet, was somit das klassische Bild einer Hakim-Trias vervollständigte. Sodann erfolgte die Vorstellung bei einem neurologischen Kollegen, welcher die bildgebende Diagnostik veranlasste. Das MRI zeigte eine typische Erweiterung aller vier Ventrikel und zusätzliche Zeichen einer beginnenden Liquordiapedese der Vorderhörner in der FLAIR- und T2-Sequenz. Nach zweimaliger Liquor-Punktion und Liquorablassversuch von ca. 35-40 ml Liquor zeigte die Patientin jedoch keine klare Besserung der Symptomatik und es wurden Zweifel an der Diagnose des NPH erhoben. Sieben Monate später wurde die Patientin aufgrund zunehmender Vigilanz-Schwankungen und Zunahme der Gangataxie erneut zugewiesen. Die cerebrale Bildgebung zeigte eine Zunahme der inneren Liquorräume. In der Folge wurde die Indikation zur Einlage einer lumbalen Drainage im Rahmen einer stationären Abklärung gestellt. Ein Tag nach Implantation der lumbalen Drainage (mit einem Fluss von 5-10 ml/Stunde) zeigte die Patientin eine signifikante Besserung des Gangbildes und der Kognition. Nach Entfernung der kontinuierlichen Lumbaldrainge kam es wieder zu einer Verschlechterung der Symptomatik. Damit wurde die Indikation für die VP-Shunt-Einlage gestellt. Der peri- und postoperative Verlauf gestaltete sich komplikationslos und die Patientin konnte im Verlauf bei deutlicher Besserung der Symptomatik, mit selbständigem und sicherem Gang, entlassen werden.
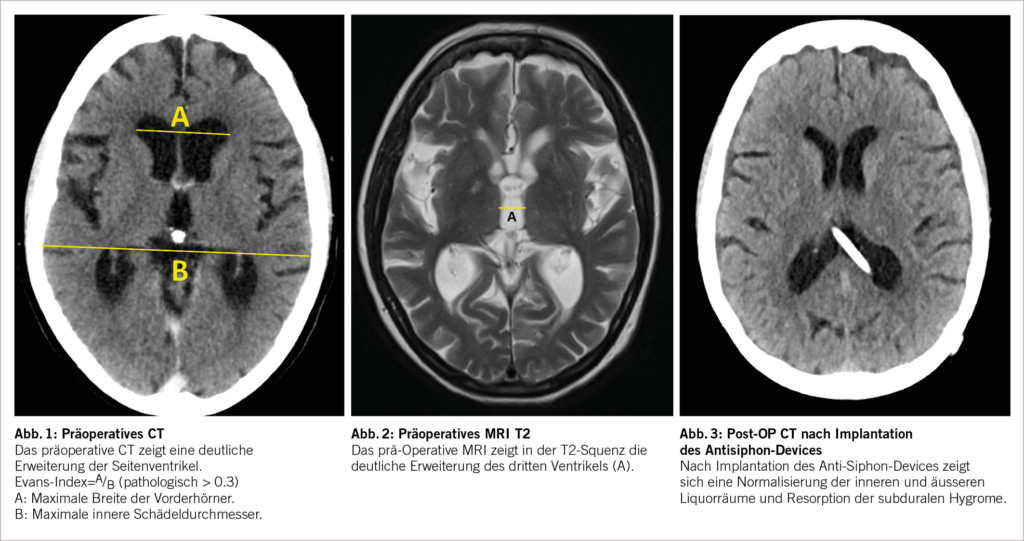
Bei der ersten postoperativen Kontrolle nach 6 Wochen gab die Patientin zwar eine Besserung der Hakim-Trias an, beklagte jedoch starke positionsabhängige Kopfschmerzen. Das Schädel-CT zeigte typische radiologische Zeichen einer Überdrainage mit sehr schmalen Seitenventrikeln und subduralen Hygromen. Nach Umstellungen des Shunt-Ventil-Druckes auf höhere Drücke verschlechterte sich die Gangataxie weiter und es konnte keine Besserung der positionsabhängigen Überdrainage erreicht werden. Somit wurde die Indikation zur Implantation eines positionsabhängigen Antisiphon-Gravitationsventils gestellt und in Lokalanästhesie infraklavikulär im distalen Shunt-Schlauch zwischengeschaltet. Die Patientin zeigte bereits nach 2-3 Tagen eine komplette Regredienz der Kopfschmerzsymptomatik bei gleichzeitiger Normalisierung des Gangbildes. Nach 6 Wochen hatte die inzwischen klinisch unauffällige Patientin auch im Schädel-CT eine komplette Resorption der subduralen Hygrome sowie eine Normalisierung der inneren Liquorräume. Ein Jahr postoperativ zeigte die Patientin weiterhin einen sehr erfreulichen Verlauf mit völliger Selbstständigkeit im Alltag, wobei weiterhin leichte kognitive Einschränkungen vorhanden waren.
Klinische Präsentation & Differentialdiagnostik
Die klassische Hakim-Trias beinhaltet eine Gangstörung, eine dementielle Entwicklung sowie eine Blasenfunktionsstörung (1, 2). Die Symptome können auch sequentiell auftreten, wie in dem beschriebenen Fall, oder müssen nicht zwingend vollständig vorliegen.
Gangstörung
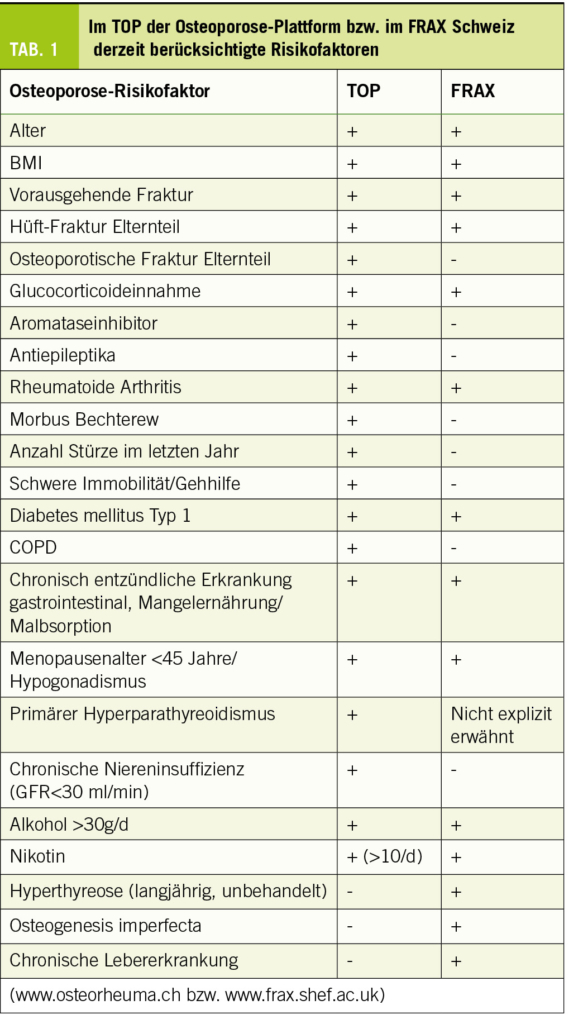
Die Gangstörung ist sicherlich führend, wobei sich meist eine Verlangsamung zeigt, mit breitbasigem, kleinschrittigem Gangbild. Das Gangbild ähnelt dem «lower body parkinsonism», wie wir es von den vaskulären Parkinsonformen kennen (3). Die Differentialdiagnose zu einem Parkinson-Syndrom ist somit naheliegend, wobei die NPH-Patienten meist eine gesteigerte Mitbewegung der Arme zeigen (4). Generell ist eine Beteiligung des Oberkörpers für einen NPH äusserst untypisch. Wenn sich ein deutlicher Rigor an den Armen oder sogar ein Ruhetremor zeigt, muss eher an ein Parkinson-Syndrom gedacht und probatorisch mit L-Dopa behandelt werden. In der späteren Phase können auch Instabilität und Stürze auftreten, mit einer Retropulsionstendenz, wobei wiederum eine Progressive supranukleäre Blickparese (PSP) davon abzugrenzen ist (5).
Dementielle Entwicklung
Praktisch alle Patienten weisen auch kognitive Defizite auf, wobei sicherlich auch hier die Verlangsamung als Zeichen einer subkortikalen Demenz im Vordergrund steht. Daneben können sich auch frontale Zeichen finden, bis hin zur Disinhibition. Nichtsdestotrotz können die kognitiven Störungen sehr heterogen sein und machen es deswegen nicht selten schwierig, die richtigen Tests sowohl für den Liquorablass, als auch für den postoperativen Verlauf (Outcome) zu wählen. Folgende Hauptbereiche sind meist beteiligt: globale Funktion, exekutive Funktionen, Kurzzeitgedächtnis und Lernen, psychomotorische Geschwindigkeit und räumliche Wahrnehmung (6). Es ist naheliegend, dass sich entsprechend nicht der Minimentalstatus (MMSE), sondern eher der MoCA-Test anbietet, nicht zuletzt, weil Letzterer auch in unterschiedlichen Varianten vorliegt, sodass kurzfristige Lerneffekte vermieden werden können (1).
Blasenfunktionsstörung
Die Urininkontinenz wird bei weniger als 50% der Patienten beobachtet, vor allem im späteren Verlauf. Als frühes Zeichen findet sich eine autonome Blasenentleerungsstörung mit Detrusorüberaktivität, d.h. Drang-, respektive Urgesymptomatik (7).
Pathophysiologie
Zugrunde liegt wahrscheinlich eine Liquorresorptionsstörung, welche idiopathisch, aber auch symptomatisch – z.B. nach Trauma, SAB oder Meningitis – auftreten kann. Nicht selten verstreichen hierbei mehrere Jahre zwischen dem auslösenden Agens und der klinischen Entwicklung. Leichte oder transiente Druckerhöhungen, resp. das Auftreten von Scherkräften führen allmählich zur Ausweitung der Liquorräume und zur Liquordiapedese durch die Ventrikelwände. Mit der Ausweitung kann sich der Druck wieder normalisieren. Eine schwedische Studie fand erhöhte Neurofilament-Leichtketten und niedrigere Amyloid-Vorläufer- und Tau-Proteine (8). Die Autoren interpretieren ihre Daten als Hinweis für einen reduzierten periventrikulären Metabolismus, keine wesentliche kortikale Degeneration, jedoch periventrikuläre axonale Degeneration. Die Liquorbiomarker unterschieden sich charakteristisch von älteren gesunden Kontrollen und Patienten mit Alzheimer-Demenz.
Diagnostik
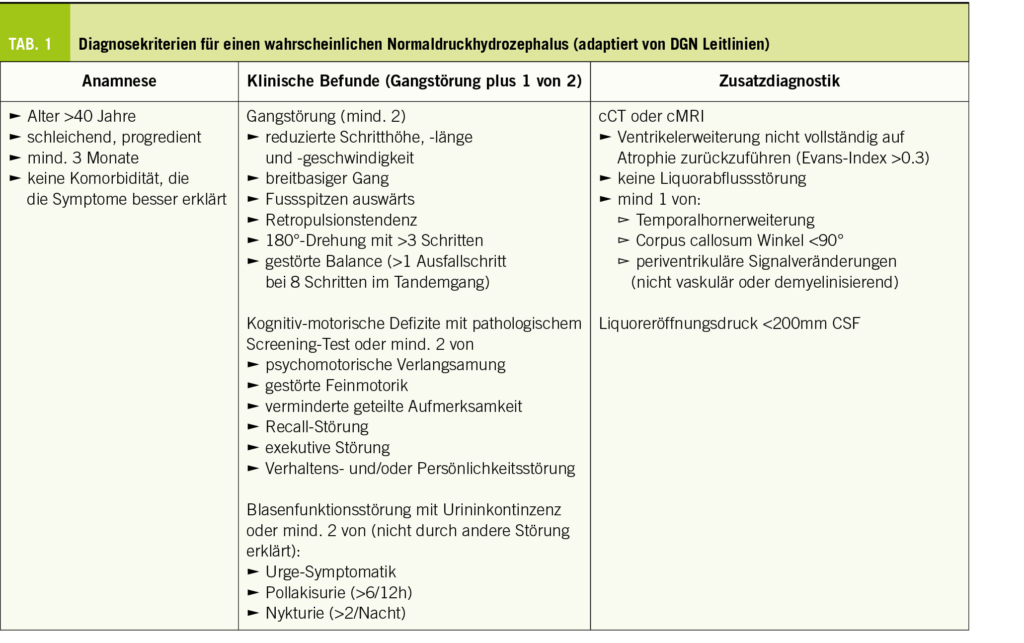
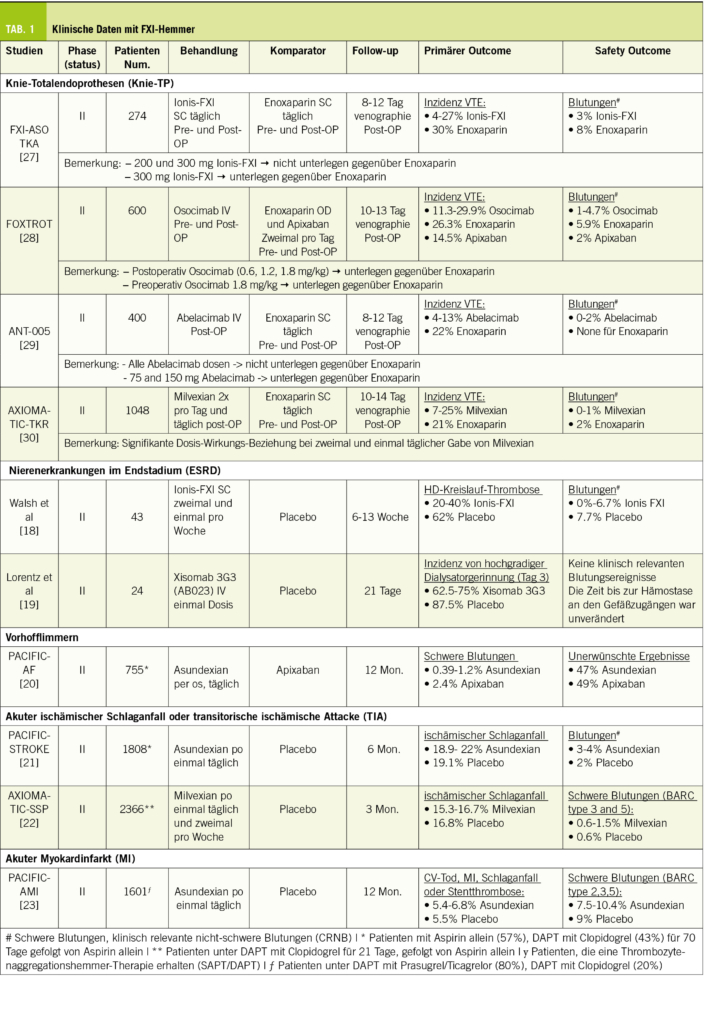
Im Vordergrund der Diagnostik steht natürlich wie immer die passende Anamnese und die klinische Untersuchung. Als entscheidende Zusatzdiagnostik folgt dann eine zerebrale Bildgebung und bei entsprechendem Verdacht auf einen NPH ein Liquorablassversuch (Tab. 1).
Bildgebung
Neben den klinischen Kriterien müssen auch die radiologischen Befunde zur Vervollständigung der Diagnostik des NPH hinzugezogen werden. Obwohl in einem CT die Erweiterung der Ventrikel und eine Hirnatrophie gut darstellbar sind, wird empfohlen, für die Diagnostik des NPH möglichst immer ein MRI des Schädels zu veranlassen, um insbesondere sonstige Parenchymläsionen und die Liquorkommunikation im Ventrikelsystem besser dazustellen. Eindeutige radiologische Unterscheidungskriterien zwischen einem idiopathischen und sekundären NPH gibt es nicht. Da jedoch die Patienten mit einem idiopathischen NPH in der Regel älter sind, zeigen sich dort häufiger Zeichen einer Hirnatrophie.
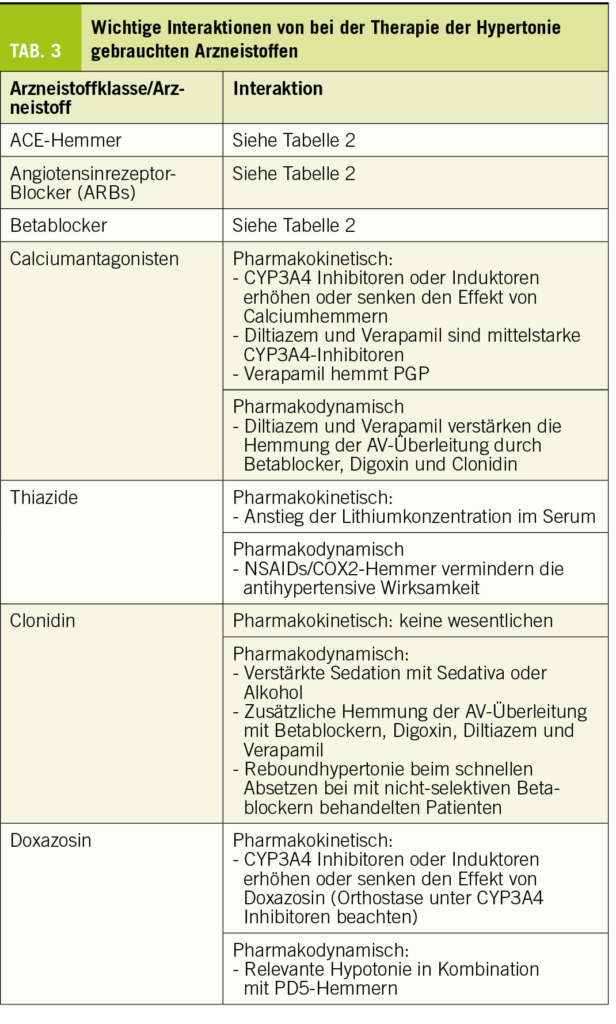
Typischerweise ist beim NPH eine überproportionale Erweiterung der Seitenventrikel mit Ballonierung der Frontalhörner, Temoralhörner und des dritten Ventrikels zu beobachten (Abb. 1-3). Als quantitative Kriterien haben sich einerseits ein erhöhter Evans-Index >0.3 (Verhältnis zwischen maximaler Weite der Vorderhörner und dem maximalen inneren Schädeldurchmesser auf einem axialen Schnittbild, vgl. Abb. 1) sowie der Corpus-callosum-Winkel etabliert (1, 9, 10). Zur genauen Berechnung des Corpus-Callosum-Winkels bedarf es einer 3-D-Rekonstruktion, was aufgrund der Praktikabilität im Alltag eher sekundär ist und idealerweise von radiologischen Kollegen bei der Fragestellung berechnet wird. Dabei wird auf einer koronaren Schicht auf die Commissura posterior zentriert und exakt zur AC-PC Orthogonal-Linie und Fissura longitudinalis cerebri ausgerichtet. Auf dieser Schichtebene wird dann der Winkel zwischen der medialen Wand des Seitenventrikels gemessen (Normalwerte 100-120°, NPH 50-80°, Cut Off 90°). Das Sulcus cinguli-Zeichen ist eine neuere MR-Beschreibung, wobei sich der posteriore Anteil enger als der anteriore darstellt (11).
Liquorablass (Miller Fisher-Test)
Der Liquorablass kann in der Regel unproblematisch in der neurologischen Praxis durchgeführt werden. Wichtig ist hierbei, dass neben allfälliger Liquordiagnostik (Ausschluss Meningitis, Blutungsresiduen, pathologische Tumorzellen des ZNS, ggf. Demenzdiagnostik) und der Druckmessung, v.a. ausreichend Liquor (mind. 30-50ml) abgelassen und genügend lange bis zur Reevaluation gewartet wird. Effekte vor einer Stunde sind nicht zu erwartet, wenn sich noch keine Veränderungen zeigen, sollte zwischen 24 und 48 Stunden nochmals nachuntersucht werden.
Als relativ kurzdauernde, pragmatische Verlaufsparameter bietet sich ein vorgegebener Gehtest mit maximaler Geschwindigkeit an. In einer kürzlichen Studie erwies sich der TUG (Timed Up & Go) als bester Test für Geschwindigkeit, Gleichgewicht und Ausdauer (12). Aber auch Flurlängenmessungen auf Zeit, mit Dokumentation der Schrittzahl, bieten sich an. Im Weiteren soll auch die kognitive Veränderung vor und nach dem Ablass dokumentiert werden (z.B. MoCA-Test oder als pragmatische Lösung auch Frauen-, resp. Männernamen in einer Minute aufzählen).
Letztlich sollte zwingend der Patient, resp. die Angehörigen über den subjektiven Eindruck gefragt werden, insbesondere was die Blasenstörung angeht.
Der Liquorablass kann bereits länger anhaltende therapeutische Wirkung haben.
Lumbale Liquordrainage zur Diagnostik
Bei Situationen, wo die einmalige Lumbalpunktion mit Liquorablass keine eindeutige Diagnostik zulässt, stellt die Einlage einer lumbalen Drainage in einem stationären Setting eine zusätzliche diagnostische Möglichkeit dar (13). Das Gangbild zeigt manchmal erst nach 24 Stunden eine eindeutige Besserung. Insbesondere die Beurteilung der kognitiven Leistung ist nach 2-3 tägiger Liquordrainge gegenüber einer einmaligen Liquorpunktion überlegen (14). Ein weiterer Vorteil ist, dass der postpunktielle Kopfschmerz nach Ablassen von einer relativ grossen Liquormenge von 30-40 ml in relativ kurzer Zeit bei der Einmal-Punktion im Vergleich zur langsamen kontinuierlichen Drainage seltener ist. Die Einlage der lumbalen Drainage erfolgt im Rahmen eines stationären Aufenthalts. Hierbei wird unter sterilen Bedingungen ein lumbaler Spinalkatheter ca. 15 cm intrathekal eingelegt und an ein externes Ableitungssystem mit einem Auffangrohr zur Messung der Liquormenge angeschlossen. Die Menge der Liquordrainage wird über die Höhe des Auffangrohres im Verhältnis zum Gehörgang eingestellt und wird 2-stündlich dokumentiert, um eine Überdrainage zu vermeiden (max. 5-10 ml/h). Somit wird ca. 120-240 ml/24 h drainiert. Bei Mobilisation des Patienten für den Toilettengang, Essen oder Gangprüfung kann die Drainage abgeklemmt werden. Somit sind die Patienten nicht an eine strikte Bettruhe gebunden. Eine Thromboseprophylaxe erfolgt in der Regel mit niedermolekularem Heparin (z.B. 1x täglich Fragmin 5000 I.E.).
Gangprüfung und kognitive Testung werden nach jeweils 24 und 48 Stunden gemäss standardisiertem Protokoll durchgeführt. Danach wird die lumbale Drainage entfernt und nach 4-stündiger Bettruhe können die Patienten nach Hause. Weitere diagnostische Tests, wie der Infusionstest, die kontinuierliche Liquordruckmessung und hämodynamische Tests, haben sich aufgrund der Praktikabilität und fehlendem Vorteil der Vorhersage hinsichtlich des Erfolges einer Shunt-Operation bis heute nicht durchgesetzt.
Operative Therapie & Prognose
Während Mumenthaler und Mattle vor 25 Jahren noch darauf hinwiesen, dass die Diagnose eher zu häufig gestellt wurde und entsprechend zu viele Patienten einen Shunt erhielten, spricht die aktuelle Leitlinie der DGN eine deutlich andere Sprache (15, 1). Die ventrikuloperitoneale Drainage (VP-Shunt) stellt heute den Goldstandard zur operativen Behandlung des idiopathischen NPH dar. Es gibt allerdings für besondere klinische Konstellationen folgende alternative OP-Techniken: die endoskopische Dritt-Ventrikulostomie, der ventrikulo-atriale Shunt (Herzvorhof) oder sehr selten auch ein lumboperitonealer Shunt. Der lumboperitonale Shunt wird aufgrund von signifikant höheren Komplikationsraten (ca. 30% LP versus ca. 10% bei VP) nur in Ausnahmefällen eingesetzt (16). Zur Vermeidung von Implantat-assoziierten Komplikationen wurde die «implantatlose» endoskopische Ventrikulostomie des dritten Ventrikels (ETV) bei der Behandlung des idiopathischen NPH untersucht (17, 18). Bei dieser Methode wird über einen endoskopischen Zugang eine Verbindung zwischen dem dritten Ventrikel und der präpontinen Zisterne zur internen Umleitung des Liquorflusses hergestellt. Die ETV führte bei ca. 2/3 der Patienten zu einer initialen klinischen Besserung. Klinische Studien zeigen jedoch eine signifikante Überlegenheit der VP-Shunt-Gruppe, sodass die ETV bei idiopathischem NPH nicht primär indiziert ist (19, 20). Bei Patienten mit vielen intraperitonealen Voroperationen, Infekten des Peritonealraumes oder Dauerimplantation einer abdominellen Ableitung (z.B. PEG-Sonde, Zystofix, Anus-Präter) wird eine VP-Shunt-Einlage nicht empfohlen. Hier kann alternativ eine ETV versucht werden. Falls sich die Symptomatik nicht verbessert, besteht die Option einer ventrikulo-atrialen (VA) Drainage bei gesunder Herzfunktion.
Etwa 10-15% der Patienten zeigen eine positionsabhängige Überdrainage nach der VP-Shunt-Einlage. In einigen Kliniken wird bei jeder NPH-OP ein Gravitationsventil (Anti-Siphon-Device) implantiert. Da jedoch auch ein grosser Teil der Patienten ohne dieses Zusatzventil gute Resultate zeigt, wird eine sekundäre Implantation eines solchen Ventils erst bei klinischer Manifestation einer positionsabhängigen Überdrainage bevorzugt.
Prognose und Komplikationen
Das Resultat der postoperativen Verbesserung der Symptomatik hängt entscheidend von der Patientenselektion und präoperativ korrekten Abklärung ab. Weiterhin ist die postoperative, interdisziplinäre Betreuung der Shunt-Patienten essentiell. Dadurch kann gewährleistet werden, dass die für den Patienten individuell angepasste Ventil-Druck-Einstellung gefunden wird. Hinreichende Erfahrung im Umgang mit Komplikationen und korrekte Diagnostik der potentiellen Shunt-Dysfunktionen sind ergänzend wichtig. Die Erfolgsraten der Shunt-Operationen variieren in der neusten Literatur zwischen 75-90% (16, 21). Während die perioperative Mortalitätsrate mit nahezu 0% angegeben ist, beträgt das Risiko einer Nebenwirkung oder Komplikation ca. 11% und das Risiko für bleibende neurologische Defizite bei ca. 6% (16). Pujari et al. 2008 zeigten bei einem Follow-up bis 7 Jahre eine Verbesserung des Gangbildes, der Kognition und der Inkontinenz bei jeweils 87%, 84% und 80% der Patienten (22). Bei knapp einem Viertel der Patienten sind im Langzeit-Verlauf Revisionsoperationen notwendig (16, 21, 23, 24).
Historisches
Salomón Hakim Dow (1922-2011) war ein kolumbianischer Neurochirurg mit libanesischen Wurzeln (25). Nach seinem PhD in Harvard beschrieb er zusammen mit dem Neurologen und Neuropathologen Raymond Delacy Adams (1911-2008) seine Beobachtungen. Als er einen 16-jährigen Jungen mit schwerem Schädelhirntrauma nach Verkehrsunfall nach einem Monat wiedersah, vermutete er einen Hydrozephalus als Ursache der persistierenden Somnolenz. Der Liquordruck war jedoch bei 15cm CSF. Trotzdem liess er 15ml CSF ab, worauf der Patient aufklarte. Im Pneumoencephalogramm stellte er einen inneren Hydrozephalus fest. Weil sich der Zustand des Jungen am kommenden Tag wieder verschlechterte, entschloss er sich im Verlauf, einen Ventrikelshunt einzulegen. Der Junge verbesserte sich fortan so gut, dass er nach vier weiteren Monaten wieder in die Regelschule zurückkehren konnte.
Mit zwei weiteren Fällen beschrieben die beiden erstmalig die Trias aus «mental dullness, inattentiveness, psychomotor retardation, unsteadiness of gait, and incontinence of urine», also mentale Trägheit, Gangataxie und Urininkontinenz (2). Im selben Jahr folgte dann auch die Beschreibung des atraumatischen, resp. idiopathischen Normaldruckhydrozephalus bei drei über 60-jährigen Patienten (26).
Copyright bei Aerzteverlag medinfo AG
Neurochirurgie Fathi AG
Schachen 22
5000 Aarau
Facharzt Neurologie
Neurologie am Untertor
Erachfeldstrasse 2
8180 Bülach
www.neurologie-untertor.ch
andreas.gantenbein@zurzachcare.ch
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Paulus W et al. S1-Leitlinie Normaldruckhydrozephalus 2018. In: Deutsche Gesellschaft für Neurologie, Hrsg. Leitlinien für Diagnostik und Therapie in der Neurologie. Online: www.dgn.org/leitlinien (abgerufen am 22.05.2022).
2. Hakim S et al. The special clinical problem of symptomatic hydrocephalus with normal cerebrospinal fluid pressure. Observations on cerebrospinal fluid hydrodynamics. J Neurol Sci 1965; 2(4):307-27.
3. Oertel JMK et al. There is more to NPH than lower body Parkinsonism. Acta Neurochir (Wien) 2021;163(10):2673-4.
4. Schniepp R et al. Walking assessment after lumbar puncture in normal-pressure hydrocephalus: a delayed improvement over 3 days. J Neurosurg 2017; 126(1):148-57.
5. Selge C et al. Subjective body vertical: a promising diagnostic tool in idiopathic normal pressure hydrocephalus? J Neurol 2016; 263(9):1819-27.
6. McGovern RA et al. Predicting Cognitive Improvement in Normal Pressure Hydrocephalus Patients Using Preoperative Neuropsychological Testing and Cerebrospinal Fluid Biomarkers. Neurosurgery 2019; 85(4):E662-9.
7. Sakakibara R et al. Mechanism of bladder dysfunction in idiopathic normal pressure hydrocephalus. Neurourol Urodyn 2008; 27(6):507-10.
8. Jeppsson A et al. Idiopathic normal-pressure hydrocephalus: pathophysiology and diagnosis by CSF biomarkers. Neurology 2013; 80(15):1385-92.
9. Evans WA Jr. An encephalographic ratio for estimating ventricular enlargement and cerebral atrophy. Arch Neurol Psychiatry. 1942;47(6):931-7.
10. Ishii K et al. Clinical impact of the callosal angle in the diagnosis of idiopathic normal pressure hydrocephalus. Eur Radiol 2008;18:2678-83.
11. Adachi M et al. Upper midbrain profile sign and cingulate sulcus sign: MRI findings on sagittal images in idiopathic normal-pressure hydrocephalus, Alzheimer’s disease, and progressive supranuclear palsy. Radiat Med. 2006; 24(8):568-72.
12. Davis A et al. Standardized regression-based clinical change score cutoffs for normal pressure hydrocephalus. BMC Neurol. 2020; 20(1):140.
13. Williams MA et al. Diagnosis and Treatment of Idiopathic Normal Pressure Hydrocephalus. Continuum. 2016;22:579-99.
14. Chaudhry P et al. Characteristics and reversibility of dementia in Normal Pressure Hydrocephalus. Behav Neurol. 2007;18:149-58.
15. Mumenthaler M et al. Hydrozepahlus malresorptivus. In: Neurologie, 10. Auflage, Thieme 1997, S. 151-2.
16. Halperin JJ et al. Practice guideline: Idiopathic normal pressure hydrocephalus: Response to shunting and predictors of response: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology. Neurology 2015; 85:2063-71.
17. Gangemi M et al. Endoscopic thirdventriculostomy in idiopathic normal pressure hydrocephalus: an Italian multicenter study. Neurosurgery. 2008;63:62-7.
18. Hailong F et al. Endoscopic third ventriculostomy in the management of communicating hydrocephalus: a preliminary study. J Neurosurg. 2008;109:923-30.
19. Pinto FC et al. Role of endoscopic third ventriculostomy and ventriculoperitoneal shunt in idiopathic normal pressure hydrocephalus: preliminary results of a randomized clinical trial. Neurosurgery 2013;72:845-53.
20. Tudor KI et al. Endoscopic third ventriculostomy (ETV) for idiopathic normal pressure hydrocephalus (iNPH). Cochrane Database Syst Rev. 2015:CD010033.
21. McGirt MJ et al. Diagnosis, treatment, and analysis of long-term outcomes in idiopathic normal-pressure hydrocephalus. Neurosurgery. 2008;62 Suppl 2:670-7.
22. Pujari S et al. Normal pressure hydrocephalus: long-term outcome after shunt surgery. J Neurol Neurosurg Psychiatry. 2008 Nov;79(11):1282-6.
23. Mori K. Management of idiopathic normal-pressure hydrocephalus: a multiinstitutional study conducted in Japan. J Neurosurg. 2001;95:970-3.
24. Zemack G et al. Seven years of clinical experience with the programmable Codman Hakim valve: a retrospective study of 583 patients. Journal of neurosurgery. 2000;92:941-8.
25. https://www.hydroassoc.org/dr-salomon-hakim-a-giant-in-the-field-of-hydrocephalus (abgerufen am 22.05.2022)
26. Adams RD et al. Symptomatic occult Hydrocephalus with „normal“ cerebrospinal-fluid pressure. A treatable syndrome. N Engl J Med 1965; 273:117-26.