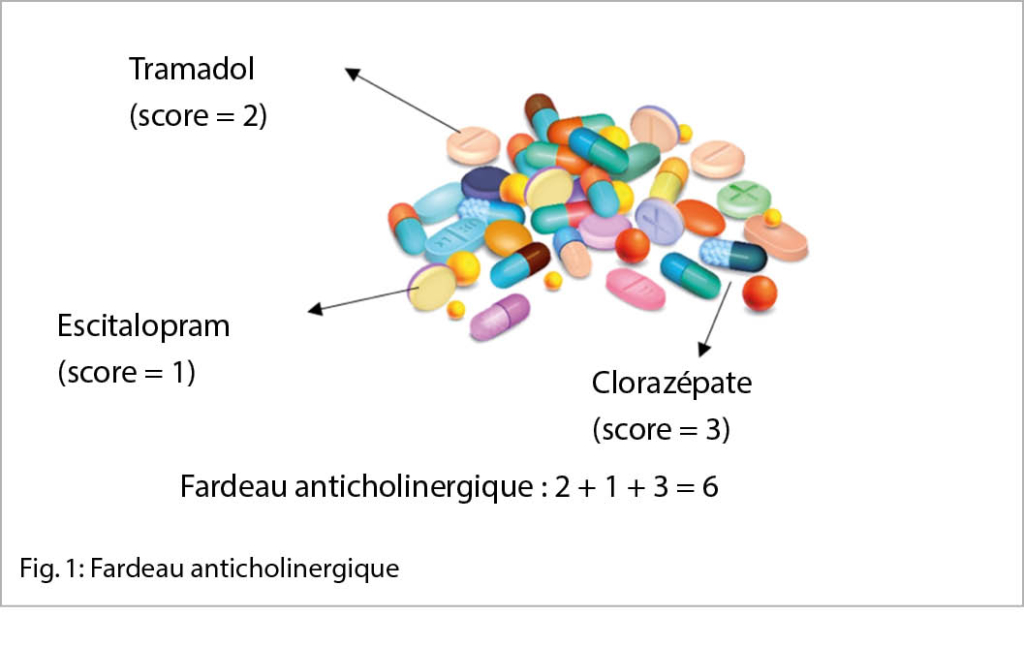
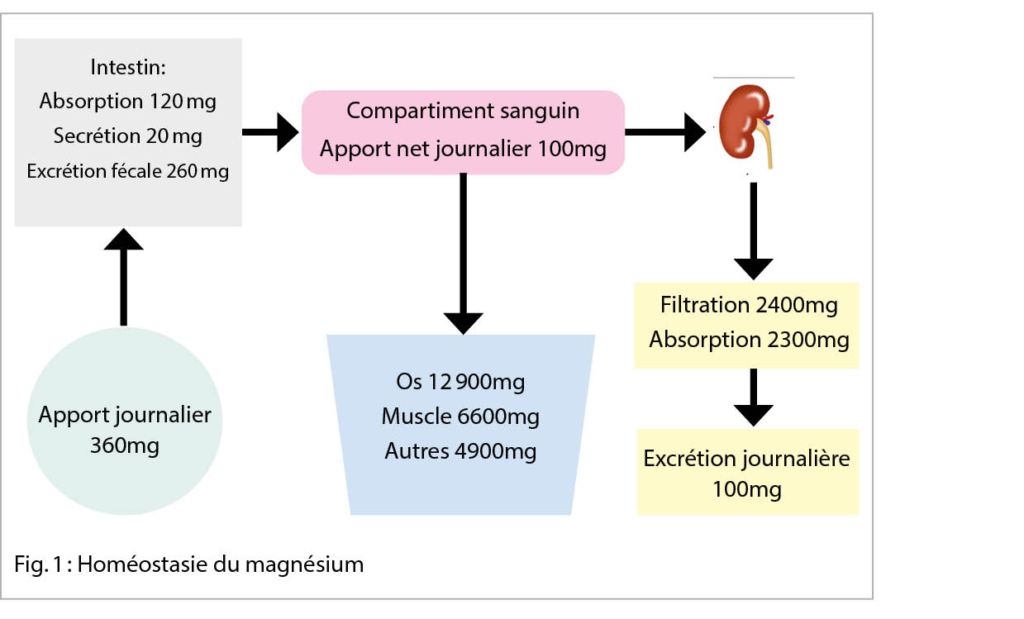
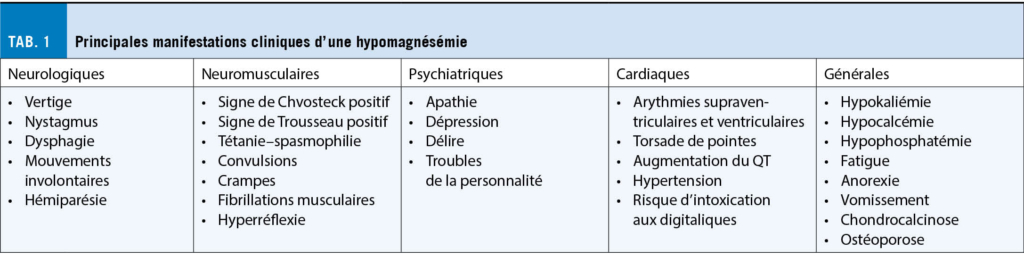
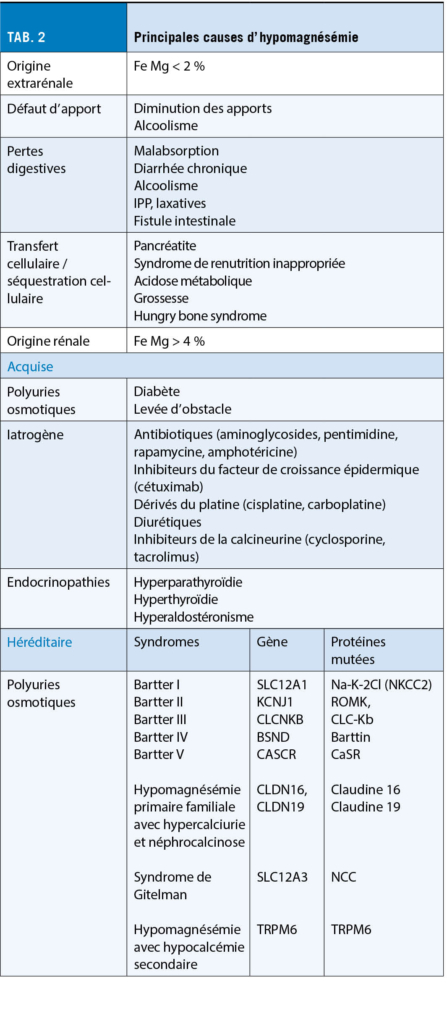
La pandémie de la Covid-19 a entrainé une augmentation de la prévalence des troubles psychiatriques dans le monde. Après la phase aigüe, en outre, certains individus souffrent du syndrome post-Covid-19 marqué par des symptômes neuropsychiatriques invalidants au quotidien. La peur liée à la Covid-19, au-delà du confinement, semble avoir participé à l’ apparition de ces complications. Le dépistage des troubles psychiatriques, la réduction de la peur et la promotion de l’ activité physique permettraient de lutter contre les complications psychologiques liées à la Covid-19.
The Covid-19 pandemic has led to an increase in the prevalence of psychiatric disorders worldwide. In addition, after the acute phase, some individuals suffer from post-Covid-19 syndrome marked by disabling neuropsychiatric symptoms on a daily basis. The fear associated with Covid-19, beyond the confinement, seems to have contributed to the development of these complications. Screening for psychiatric disorders, reducing fear, and promoting physical activity would help combat the psychological complications associated with Covid-19.
Key Words: Syndrome post-Covid-19 , Peur , Asthénie , Dépistage
Introduction
La maladie due au coronavirus-2019 (Covid-19) s’est rapidement propagée dans le monde et la pandémie qui en a découlé a constitué une grave menace pour la santé physique mais aussi, et de manière moins prévisible, la santé mentale. L’ infection per se (notamment via l’ entité nouvellement décrite de syndrome post-Covid-19 ou Covid long), mais aussi les mesures sanitaires restrictives qui en ont découlé (telles que le confinement et les différentes mesures de distanciation sociale), ont été à l’ origine de problématiques psychologiques et psychiatriques conséquentes.
Contexte épidémiologique
Plusieurs études relèvent la majoration de symptômes anxiodépressifs de faible intensité et du sommeil suite à la pandémie (1–4). Une méta-analyse se focalisant sur la phase précoce de la pandémie retrouve ainsi une prévalence des symptômes anxiodépressifs et des troubles du sommeil dans la population générale avoisinant les 30-40%, soit environ un tiers de la population. Ces pourcentages sont largement supérieurs – environ le double – que les taux de prévalence habituellement retrouvés dans la population générale hors périodes d’ épidémie ou de catastrophe naturelle (3).
D’ autre part, au-delà de ces symptômes, de nombreux troubles du comportement et signes de souffrance psychique ont vu leur prévalence augmenter et leur pronostic s’ aggraver dans le contexte de la pandémie. Les idées suicidaires, les tentatives de suicide et les actes autodommageables (notamment les automutilations) ont ainsi augmenté de façon alarmante (5, 6). Par exemple, une méta-analyse publiée en 2021, qui inclue des études localisées principalement en Asie, en Amérique du Nord et en Europe de l’ Ouest, a rapporté un taux de suicide avoisinant les 5% dans la population générale du début de la pandémie jusqu’ à fin 2020 (6). Les symptômes obsessionnels compulsifs se sont aussi majorés, en particulier chez les personnes atteintes de troubles obsessionnels compulsifs liés à la contamination. De plus, de nombreux individus ont présenté de symptômes inauguraux de type obsessionnel-compulsif centrés sur la Covid-19 (7). On retrouve aussi dans la littérature scientifique une augmentation des décès liés aux abus de substances après le début de la Covid-19, de même qu’ une augmentation des troubles du comportement alimentaire (8, 9). Chez les personnes âgées atteintes de troubles neurocognitifs, une aggravation des symptômes psycho-comportementaux a aussi été constaté, en particulier pendant les périodes de confinement (10).
Les professionnels de la santé ont été particulièrement touché par les conséquences psychologiques de la pandémie de la Covid-19. Les infirmiers, médecins, et autres professionnels de santé, directement ou indirectement impactés par la crise sanitaire, ont présenté une augmentation de plusieurs troubles psychiatriques, notamment les troubles anxiodépressifs, le burnout (ou syndrome d’ épuisement professionnel), et l’ état de stress post-traumatique (ce dernier étant particulièrement présent pour le personnel des soins intensifs) (2, 11–15). On considère que le burnout au cours de la pandémie a ainsi touché plus de la moitié des soignants. Ce taux très important est bien supérieur aux taux habituels des études sur le burn-out chez les professionnels de santé hors contexte de pandémie, qui avoisinent normalement les 30% (14). De même, il existe une augmentation de la prévalence de l’ état de stress post-trauma-tique parmi les professionnels de santé en première ligne pendant la pandémie, avec une méta-analyse retrouvant un taux conséquent de plus de 13 % pendant la période de la pandémie s’ étalant jusqu’ à mars 2021 (12).
Mis à part les patients et les professionnels de santé, la Covid-19 a touché l’ équilibre psychique des proches et des familles des personnes atteintes, notamment celles qui ont effectué des séjours prolongés aux soins intensifs luttant pour leur survie. Des symptômes d’ état de stress post-traumatique ont été ainsi décrits chez des proches avec faible niveau d’ éducation développant de la méfiance face aux soins administrés dans un contexte médical aussi mouvant (16).
Syndrome Post-Covid-19
La Covid-19 peut générer, après la phase aigüe, des symptômes neuropsychiatriques persistants et pouvant être invalidants au quotidien. Cette association de symptômes neuropsychiatriques a été nommé « syndrome post-Covid-19 » ou encore « Covid long ». Il n’ y a pas encore de consensus clair quant aux critères diagnostiques, pronostiques et thérapeutiques de cette entité. Les recommandations du NICE (National Institute for Health and Care Excellence) font référence au syndrome post-Covid-19 en cas de persistance de symptômes 12 semaines après le début de l’ infection, et ne pouvant pas être expliqués par un diagnostic alternatif (17). L’ Organisation Mondiale de la Santé (OMS) a récemment proposé le qualificatif de «affection post-Covid-19 », qu’ elle définit comme une maladie qui survient chez les personnes qui ont des antécédents d’infection probable ou confirmée par le SARS-CoV-2, survenant habituellement dans les trois mois suivant l’infection, et avec des symptômes qui durent au moins deux mois. Bien que l’ entité Covid long est désormais reconnue comme un syndrome à part entier, les facteurs favorisants et la prise en charge de cette dernière restent encore peu connus (18).
Les principaux symptômes neuropsychiatriques fréquemment retrouvés dans le syndrome post-Covid-19 sont l’ asthénie, les troubles cognitifs, les troubles du sommeil et les symptômes anxiodépressifs (18–20). Une méta-analyse récente a cherché à quantifier plus précisément la prévalence de ces symptômes neuropsychiatriques post-Covid. En se basant sur les critères temporels du NICE, elle a distingué la période entre 3 et 6 mois et celle après 6 mois post-infection. La fatigue, les troubles cognitifs (notamment troubles de mémoire et de l’attention) et les troubles du sommeil étaient les symptômes du syndrome post-Covid-19 les plus présents, et étaient identifiés chez près d’un tiers des patients trois mois après le début de l’ infection. L’ étude relevait que ces symptômes persistaient et étaient encore plus fréquents à long terme (six mois ou plus après l’infection) qu’ à moyen terme (trois à six mois après l’ infection). A contrario, l’anosmie, la dysgueusie et les céphalées, qui sont des manifestations neurologiques courantes lors de la Covid-19, n’étaient pas des symptômes majeurs du syndrome post-Covid-19 (19). Par ailleurs, si les symptômes post-Covid-19 tels que la fatigue et les troubles cognitifs affectent à la fois les patients hospitalisés et non hospitalisés, il n’ est notamment pas encore clair jusqu’ à quel degré la gravité et la durée de l’ infection à son stade aigu sont corrélés à l’ apparition et/ou la sévérité du syndrome post-Covid-19 chez les survivants (18).
Enfin, plus généralement, la fatigue, qu’ elle soit ou non corrélée au syndrome post-Covid-19, est un symptôme récurrent dans le contexte de pandémie, avec un impact économique et social important (20–22). Ainsi, plus de 50 % des patients sortis des soins hospitaliers ont signalé des symptômes de fatigue au cours des deux premiers mois suivant la récupération, et 10% des patients qui n’ ont pas été hospitalisés ont signalé de la fatigue au cours du premier mois après leur guérison (22).
Peur liée au Covid-19
La peur du virus et de ses conséquences semble avoir directement impacté un nombre de personnes pendant la pandémie sanitaire (23). Une méta-analyse s’ est intéressée précisément à l’ association entre la peur de la Covid-19 et une variété de facteurs liés à la santé mentale. Plus précisément, l’ étude s’ est intéressée au lien potentiel entre la peur de la Covid-19 et la dépression, l’anxiété, le stress et les problèmes de sommeil. Il a été retrouvé une association modérée entre le degré de peur du Covid-19 chez un individu et les complications psychologiques qui en découlent. De plus, la peur de la Covid-19 a été associée avec le sexe féminin, la présence d’ un trouble anxieux et la préoccupation excessive par rapport à la santé physique (24).
Plusieurs questionnaires validés permettent d’ évaluer l’impact psychologique de la Covid-19. La FCV-19S (Fear of Covid-19 Scale) est un outil psychométrique permettant d’ estimer, à l’ aide de 7 items, la peur ressentie par le patient en lien à la pandémie de la Covid-19.
Il s’ agit d’ un hétéro-questionnaire simple et rapide (moins de 5 minutes) ayant montré sa fiabilité et sa validité dans l’ évaluation et la quantification du degré de peur du patient (25). Une autre échelle, la C19P-S (Covid-19 phobia scale), consiste en un auto-questionnaire comprenant 20 items et évaluant plus spécifiquement les manifestations de la phobie en lien à la Covid‐19. Il s’ agit d’ une échelle aux propriétés psychométriques robustes qui cible de façon spécifique quatre domaines dans lesquels peut se manifester la phobie de la Covid-19 : psychologique, somatique, économique et social (26). A l’ aide de ces outils, une évaluation plus systématique de la peur en lien à la Covid-19 pourrait permettre une meilleure prévention et prise en charge des complications psychologiques en lien à l’ infection (23, 25, 26).
Perspectives de prise en charge
Plus de deux ans après le début de la pandémie, le constat des complications psychologiques liées à la Covid-19 est éloquent. Après le choc de la première vague, mais aussi des seconde, troisième, et même quatrième vagues dans certains pays, l’ infection et les mesures sanitaires restrictives qui ont suivi ont épuisé les populations et augmenté la prévalence de nombreuses pathologies psychiatriques. Un des moyens qui semble avoir contribué à limiter cette augmentation est le recours à la télémédecine. En effet, l’ accent est de plus en plus mis dans la littérature scientifique sur l’ efficacité des nouvelles méthodes de prise en charge à distance, surtout lors des périodes de confinement ou l’ accès aux soins est fortement impacté. Ainsi donc, la mise en œuvre de la télémédecine a permis une meilleure continuité des soins pendant la pandémie de Covid-19 et a été très utile dans les situations d’urgence (27).
D’ autre part, la dédramatisation des risques par une explication claire et systématique de l’ infection et des mesures sanitaires pourrait permettre de diminuer la peur liée au Covid-19, et donc de diminuer le risque de développer les complications psychologiques qui en découlent (24). L’ activité physique et la pleine conscience ont aussi prouvé leur utilité comme moyens pour lutter contre les complications psychologiques liées à la Covid-19 (28, 29). Les études suggèrent qu’une activité physique plus élevée en cette période de pandémie est associée à un bien-être et à une qualité de vie supérieurs, ainsi qu’à une diminution des symptômes dépressifs et de l’ anxiété, et ce indépendamment de l’ âge. De plus, le sport permettrait d’ améliorer les défenses immunitaires pour lutter contre l’ infection. Ainsi donc, la promotion de l’ activité et de la pleine conscience par les politiques de santé publique apparait primordiale, surtout en période de confinement (28).
Chez les soignants, qui sont particulièrement exposés au risque d’ infection, la bonne utilisation des gestes barrières permettrait de réduire voire prévenir les conséquences psychologiques. Par ailleurs, un dépistage de l’ état de stress post-traumatique et du syndrome d’ épuisement professionnel dans cette population apparait tout spécialement indiqué (12, 14, 30, 31). En médecine de premier recours, l’ utilisation d’ outils psychométriques tels que le MBI (Maslach Burn Out Inventory) et le PCL-5 (Post-Traumatic Stress Disorder Checklist for DSM-5) peuvent aider à ce dépistage (32, 33). De façon plus générale, l’ usage des outils de dépistages des maladies psychiatriques en majoration depuis la pandémie est conseillé (34).
Enfin, les études ont montré que les interventions psychologiques avaient un bénéfice statistiquement significatif dans la gestion de la dépression et de l’anxiété pendant la pandémie. Des programmes s’appuyant sur une base psychothérapeutique éprouvée (telle que la thérapie cognitivo-comportementale) doivent être spécifiquement conçus pour lutter contre la peur de la Covid-19 et des symptômes anxiodépressifs associés (30, 31, 35).
Copyright Aerzteverlag medinfo
Chemin de Champ-Dollon 20
1241 Puplinge
tmhi@hcuge.ch
Service des mesures institutionnelles
Direction médicale et qualité
Hôpitaux universitaires de Genève
Avenue Rosemont 12b
1208 Genève
panteleimon.giannakopoulos@hcuge.ch
Les auteurs déclarent n’ avoir aucun conflit d’ intérêt en rapport avec cet article.
1. Jahrami HA, Alhaj OA, Humood AM, Alenezi AF, Fekih-Romdhane F,
AlRasheed MM, et al. Sleep disturbances during the COVID-19 pandemic:
A systematic review, meta-analysis, and meta-regression. Sleep Medicine
Reviews. avr 2022;62:101591.
2. Sahebi A, Nejati-Zarnaqi B, Moayedi S, Yousefi K, Torres M, Golitaleb M. The
prevalence of anxiety and depression among healthcare workers during the
COVID-19 pandemic: An umbrella review of meta-analyses. Progress in Neuro-Psychopharmacology and Biological Psychiatry. avr 2021;107:110247.
3. Wu T, Jia X, Shi H, Niu J, Yin X, Xie J, et al. Prevalence of mental health problems during the COVID-19 pandemic: A systematic review and meta-analysis. Journal of Affective Disorders. févr 2021;281:91‑8.
4. Rogers JP, Chesney E, Oliver D, Pollak TA, McGuire P, Fusar-Poli P, et al.
Psychiatric and neuropsychiatric presentations associated with severe
coronavirus infections: a systematic review and meta-analysis with comparison to the COVID-19 pandemic. The Lancet Psychiatry. juill 2020;7(7):611‑27.
5. Farooq S, Tunmore J, Wajid Ali M, Ayub M. Suicide, self-harm and suicidal ideation during COVID-19: A systematic review. Psychiatry Research.
déc 2021;306:114228.
6. Dubé JP, Smith MM, Sherry SB, Hewitt PL, Stewart SH. Suicide behaviors during the COVID-19 pandemic: A meta-analysis of 54 studies. Psychiatry Research. juill 2021;301:113998.
7. Guzick AG, Candelari A, Wiese AD, Schneider SC, Goodman WK, Storch EA.
Obsessive–Compulsive Disorder During the COVID-19 Pandemic: a Systematic Review. Curr Psychiatry Rep. nov 2021;23(11):71.
8. Devoe D, Han A, Anderson A, Katzman DK, Patten SB, Soumbasis A, et al.
The impact of the COVID-19 pandemic on eating disorders: A systematic review. Intl J Eating Disorders. 5 avr 2022;eat.23704.
9. Imtiaz S, Nafeh F, Russell C, Ali F, Elton-Marshall T, Rehm J. The impact of the novel coronavirus disease (COVID-19) pandemic on drug overdose-related deaths in the United States and Canada: a systematic review of observational studies and analysis of public health surveillance data. Subst Abuse Treat Prev Policy. déc 2021;16(1):87.
10. Soysal P, Smith L, Trott M, Alexopoulos P, Barbagallo M, Tan SG, et al. The
Effects of COVID-19 lockdown on neuropsychiatric symptoms in patients with
dementia or mild cognitive impairment: A systematic review and meta-analysis. Psychogeriatrics. 6 févr 2022;psyg.12810.
11. Xiong N, Fritzsche K, Pan Y, Löhlein J, Leonhart R. The psychological impact of COVID-19 on Chinese healthcare workers: a systematic review and meta-analysis. Soc Psychiatry Psychiatr Epidemiol [Internet]. 24 mars 2022 [cité 24 avr 2022]; Disponible sur: https://link.springer.com/10.1007/s00127-022-02264-4
12. Sahebi A, Yousefi A, Abdi K, Jamshidbeigi Y, Moayedi S, Torres M, et al. The
Prevalence of Post-traumatic Stress Disorder Among Health Care Workers
During the COVID-19 Pandemic: An Umbrella Review and Meta-Analysis. Front Psychiatry. 15 nov 2021;12:764738.
13. Sahebi A, Abdi K, Moayedi S, Torres M, Golitaleb M. The prevalence of insomnia among health care workers amid the COVID-19 pandemic: An umbrella review of meta-analyses. Journal of Psychosomatic Research. oct 2021;149:110597.
14. Ghahramani S, Lankarani KB, Yousefi M, Heydari K, Shahabi S, Azmand S. A Systematic Review and Meta-Analysis of Burnout Among Healthcare Workers
During COVID-19. Front Psychiatry. 10 nov 2021;12:758849.
15. Hall CE, Milward J, Spoiala C, Bhogal JK, Weston D, Potts HWW, et al. The
mental health of staff working on intensive care units over the COVID-19 winter surge of 2020 in England: a cross sectional survey. British Journal of Anaesthesia. mars 2022;S0007091222001404.
16. Amass T, Van Scoy LJ, Hua M, Ambler M, Armstrong P, Baldwin MR, et al.
Stress-Related Disorders of Family Members of Patients Admitted to the Intensive Care Unit With COVID-19. JAMA Intern Med [Internet]. 25 avr 2022 [cité 1 mai 2022]; Disponible sur: https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2791664
17. Venkatesan P. NICE guideline on long COVID. The Lancet Respiratory Medicine. févr 2021;9(2):129.
18. Badenoch JB, Rengasamy ER, Watson C, Jansen K, Chakraborty S, Sundaram RD, et al. Persistent neuropsychiatric symptoms after COVID-19: a systematic
review and meta-analysis. Brain Communications. 4 janv 2022;4(1):fcab297.
19. Premraj L, Kannapadi NV, Briggs J, Seal SM, Battaglini D, Fanning J, et al. Mid and long-term neurological and neuropsychiatric manifestations of post-COVID-19 syndrome: A meta-analysis. Journal of the Neurological Sciences. mars 2022;434:120162.
20. Ceban F, Ling S, Lui LMW, Lee Y, Gill H, Teopiz KM, et al. Fatigue and cognitive impairment in Post-COVID-19 Syndrome: A systematic review and meta-analysis. Brain, Behavior, and Immunity. mars 2022;101:93‑135.
21. Ruiz FJ, Sáiz PA, García-Portilla MP, González-Blanco L, García-Álvarez L, Madera PZ, et al. Does COVID-19 psychological fatigue exist? Results of three online cross-sectional studies conducted in Spain from April 2020 to March 2021.
J Glob Health. 2 avr 2022;12:05001.
22. Rao S, Benzouak T, Gunpat S, Burns RJ, Tahir TA, Jolles S, et al. Fatigue
Symptoms Associated With COVID-19 in Convalescent or Recovered COVID-19 Patients; a Systematic Review and Meta-Analysis. Annals of Behavioral Medicine. 1 mars 2022;56(3):219‑34.
23. Nürnberger P, von Lewinski D, Rothenhäusler HB, Braun C, Reinbacher P,
Kolesnik E, et al. A biopsychosocial model of severe fear of COVID-19. Prazeres F, éditeur. PLoS ONE. 28 févr 2022;17(2):e0264357.
24. Alimoradi Z, Ohayon MM, Griffiths MD, Lin CY, Pakpour AH. Fear of
COVID-19 and its association with mental health-related factors: systematic review and meta-analysis. BJPsych open. mars 2022;8(2):e73.
25. Alimoradi Z, Lin CY, Ullah I, Griffiths MD, Pakpour AH. Item Response Theory Analysis of the Fear of COVID-19 Scale (FCV-19S): A Systematic Review. PRBM. mars 2022;Volume 15:581‑96.
26. Özdemir Ş, Baloğlu M, Şahin R. The Japanese adaptation and validation of the COVID-19 Phobia Scale (C19P-S). Journal Community Psychology. 29 mars 2022;jcop.22850.
27. Appleton R, Williams J, Vera San Juan N, Needle JJ, Schlief M, Jordan H, et al. Implementation, Adoption, and Perceptions of Telemental Health During
the COVID-19 Pandemic: Systematic Review. J Med Internet Res. 9 déc 2021;23(12):e31746.
28. Marconcin P, Werneck AO, Peralta M, Ihle A, Gouveia ÉR, Ferrari G, et al. The association between physical activity and mental health during the first year of the COVID-19 pandemic: a systematic review. BMC Public Health. déc 2022;22(1):209.
29. Bursky M, Kosuri M, Walsh Carson K, Babad S, Iskhakova A, Nikulina V. The
Utility of Meditation and Mindfulness-Based Interventions in the Time of
COVID-19: A Theoretical Proposition and Systematic Review of the Relevant
Prison, Quarantine and Lockdown Literature. Psychol Rep. 10 déc 2021;003329412110487.
30. Bertuzzi V, Semonella M, Bruno D, Manna C, Edbrook-Childs J, Giusti EM, et al. Psychological Support Interventions for Healthcare Providers and Informal
Caregivers during the COVID-19 Pandemic: A Systematic Review of the Literature. IJERPH. 28 juin 2021;18(13):6939.
31. Shatri H, Putranto R, Faisal E, Fitrianti F, Adhiatma K, Zulmiyusrini P, et al.
Psychotherapy for Healthcare Provider During COVID-19 Pandemic: An Evidence Based Clinical Review. Acta Med Indones. avr 2021;53(2):225‑32.
32. Blevins CA, Weathers FW, Davis MT, Witte TK, Domino JL. The Posttraumatic Stress Disorder Checklist for DSM-5 (PCL-5): Development and Initial Psychometric Evaluation: Posttraumatic Stress Disorder Checklist for DSM-5. JOURNAL OF TRAUMATIC STRESS. déc 2015;28(6):489‑98.
33. Powers S, Gose KF. Reliability and Construct Validity of the Maslach Burnout Inventory in a Sample of University Students. Educational and Psychological Measurement. mars 1986;46(1):251‑5.
34. Voitsidis P, Kerasidou MD, Nikopoulou AV, Tsalikidis P, Parlapani E, Holeva V, et al. A systematic review of questionnaires assessing the psychological impact of COVID-19. Psychiatry Research. nov 2021;305:114183.
35. Doherty A, Benedetto V, Harris C, Boland P, Christian DL, Hill J, et al. The
effectiveness of psychological support interventions for those exposed to mass infectious disease outbreaks: a systematic review. BMC Psychiatry. déc 2021;21(1):592.