La pneumonie acquise en communauté est définie comme étant une pneumonie survenant à l’ extérieur de l’ hôpital chez un patient qui n’ est pas immunodéprimé. Il ne faut pas sous-estimer le taux de létalité allant jusqu’ à 10 % chez les patients hospitalisés en raison d’ une progression grave. Pour de nombreuses personnes âgées malades, la polymorbidité est un facteur de complication. Si, et tant qu’ un objectif thérapeutique curatif existe, la sévérité et le spectre bactérien attendu ainsi que la présence ou non d’ une polymorbidité détermine la thérapie à suivre.
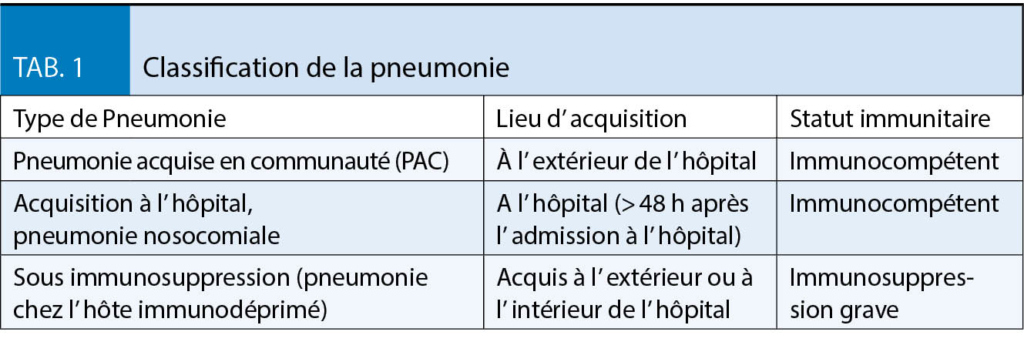
La pneumonie est classée selon les critères du tableau 1. La pneumonie acquise en communauté (PAC) est définie comme une pneumonie déterminée par le lieu de survenue (en dehors de l’ hôpital) et l’ immunité du patient (compétence immunitaire). Elle contraste avec la pneumonie nosocomiale, qui est définie comme une pneumonie qui survient > 48 heures après l’ admission à l’ hôpital ou chez les patients ayant déjà été hospitalisés au maximum il y a trois mois. En cas de pneumonie chez l’ immunodéprimé sévère, des germes opportunistes sont à prévoir.
Les patients polymorbides sont des patients atteints de maladies pulmonaires chroniques comme la BPCO, la mucoviscidose et les maladies pulmonaires interstitielles ainsi que le diabète sucré, une hépatopathie et les maladies tumorales sans neutropénie (1).
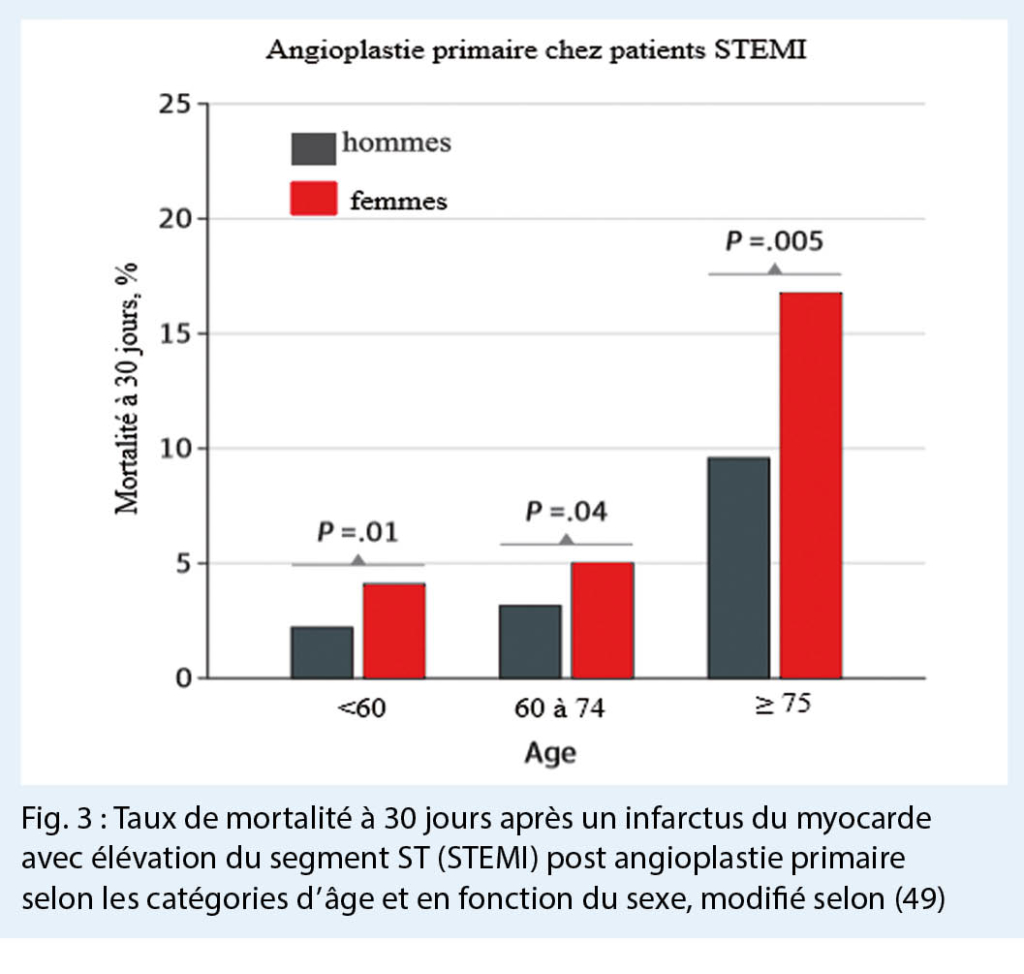
L’ incidence de la PAC augmente avec l’ âge. La pneumonie chez les personnes âgées (≥ 65 ans) est associée à une mortalité accrue. La pneumonie contractée dans les EMS représente le sous-groupe le plus important de la PAC. La létalité la plus élevée se produit chez les patients alités depuis un certain temps.
La PAC des personnes de moins de 65 ans, sans maladie sous-jacente est généralement plus légère et le pronostic est nettement meilleur. Elles sont en général dues à d’ autres types de germes pathogènes.
Classification de PAC
La PAC est divisée en groupes (1a, 1b et 2) qui définissent les critères d’ hospitalisation ainsi que la portée du diagnostic microbiologique et les stratégies thérapeutiques, y compris la thérapie antimicrobienne initiale. Les groupes 1a, 1b et 2 se distinguent par les critères de l’ état de santé général et de la gravité de la PAC. L’ appartenance au groupe 1a résulte d’ un bon état de santé général, défini comme un repos au lit < 50 % de la journée. Le groupe 1b à un mauvais état général, défini comme un repos au lit > 50 % de la journée. L’ appartenance au groupe 2 résulte d’ une comorbidité sévère avec un pronostic défavorable. Souvent, la palliation est l’ objectif thérapeutique prédominant dans ce dernier groupe. Les formes particulières de PAC sont la pneumonie d’ aspiration acquise en communauté, celle contractée dans le cadre d’ un voyage à l’ étranger, causée par une épidémie (p. ex. pneumonie grippale) ou par un foyer (p. ex. Legionella). La pneumonie par aspiration est associée à une modification du spectre pathogène. Elle nécessite une clarification des causes sous-jacentes. Dans le cas d’ une pneumonie à la suite d’ un voyage tropical, les causes rares doivent être recherchées et écartées. En période d’ épidémie de grippe, il faut aussi penser à la pneumonie grippale.
Diagnostic d’ une pneumonie suspectée
Les symptômes cliniques de la pneumonie comprennent :
1. symptômes respiratoires tels que la toux avec ou sans expectorations, dyspnée, et éventuellement douleurs thoraciques respiratoires.
2. symptômes généraux tels que la fièvre ou hypothermie, sensation générale de maladie («malaise»), symptômes «grippaux» tels que myalgie, arthralgie, céphalées, palpitations, troubles circulatoires, diarrhées.
3. symptômes neurologiques, en général un état confusionnel aigu qui est la forme de présentation la plus fréquente chez les résidents de long séjour comme par exemple un changement brutal de l’ état cognitif, des troubles attentionnels ou une désorientation.
L’ examen clinique comprend l’ évaluation de l’ état général, y compris l’ état fonctionnel (indépendance dans les activités de la vie quotidienne) et la mobilité, en particulier l’ importance d’ un éventuel alitement préexistant qui indique un moins bon pronostic. Il comprend en outre une évaluation des comorbidités potentiellement instables (pronostic moins bon). Puis, les résultats suivants sont examinés en détail : augmentation de la fréquence respiratoire, tachycardie, hypotension artérielle possible, matité à la percussion lors de foyers consolidés et/ou d’ épanchement pleural parapneumonique, râles crépitants fins auscultatoire et souffle tubaire dans les cas de bronchopneumonie lobaire. Ces symptômes ne sont pas spécifiques pour distinguer une PAC d’ autres infections des voies respiratoires inférieures. Toutefois, l’ examen clinique a une valeur prédictive négative élevée (4). Avec l’ âge, les patients atteints de pneumonie deviennent de plus en plus oligosymptomatiques (5). Ainsi, la présence de fièvre ou de toux avec expectorations est significativement plus rare. Plus fréquemment, des symptômes tels qu’ un état confusionnel ou des diarrhées (bronchopneumonie de la base) peuvent être les seuls signes présents.
Une radiographie du thorax doit être faite lors d’ examens complémentaires. L’ échographie thoracique peut être utilisée pour la détection des infiltrations pulmonaires lorsque la radiologie n’ est pas disponible en temps opportun. Les résultats radiologiques servent à déterminer l’ étendue des pathologies ainsi que les maladies concomitantes (ex. insuffisance cardiaque) et les complications (épanchement pleural, abcès). En outre, l’ examen radiologique fournit une aide pour le diagnostic différentiel (tuberculose pulmonaire, carcinome bronchique) ainsi qu’ une première indication pour déterminer si un contrôle est indiqué dans l’ évolution de la maladie. Cependant, la sensibilité, la spécificité ainsi que la fiabilité de la détection d’ un infiltrat dans l’ image radiographique du thorax sont limitées.
Des infiltrats se forment parfois au cours de la maladie. Dans une étude, 21 % des patients qui ont été diagnostiqués avec une pneumonie n’ avaient aucun infiltrat radiologique initialement (6). De plus, dans le cas d’ une pneumonie légère à modérée, l’ évaluation des infiltrats dépend considérablement de l’ investigateur concerné. En effet, la mortalité augmente chez les patients hospitalisés atteints d’ une pneumonie confirmée qui n’ avaient initialement pas de corrélation radiologique.
Les paramètres d’ inflammation peuvent aider dans cette situation. Le CRP en tant que paramètre unique n’ est pas spécifique et peut augmenter avec un retard. La procalcitonine (PCT) est un biomarqueur sérique qui augmente en réponse aux infections bactériennes. Étant donné que l’ exactitude diagnostique de la procalcitonine est seulement modérée, elle n’ est pas utilisée de façon systématique pour faciliter le diagnostic de la PAC. Cependant, il est recommandé d’ obtenir un taux de procalcitonine au moment du diagnostic de PAC, et en série par la suite, pour aider à déterminer la durée appropriée des antibiotiques.
Mesure de la saturation en O2 périphérique, analyse éventuelle des gaz du sang artériel (hypoxémie indique un mauvais pronostic).
Examen microbiologique d’ un patient atteint de pneumonie ?
Un diagnostic microbiologique n’ est normalement pas nécessaire pour les patients atteints d’ une pneumonie légère. En effet, ils peuvent être traités en ambulatoire.
Tous les patients des groupes 1a et 1b hospitalisés pour une pneumonie modérée à grave doivent recevoir un diagnostic de l’ agent pathogène. Il s’ agit notamment de :
1. au moins deux hémocultures, aérobie et anaérobie, respectivement.
2. test d’ antigène urinaire pour les légionelles.
3. test d’ antigène urinaire pour pneumocoques pour la détection de la pneumonie par pneumocoques.
4. l’ expectoration adéquate doit être traitée dans les 2 à 4 heures pour la coloration de Gram ainsi que pour la culture. Si cela est impossible, un examen des expectorations ne devrait pas être fait.
5. le diagnostic moléculaire pour la détection simultanée de plusieurs bactéries (par exemple S. pneumoniae, M. pneumoniae,
C. pneumoniae, L. pneumophila) ou agents pathogènes viraux (par exemple influenza A/B, parainfluenza, rhinovirus, adénovirus), c’est-à-dire les tests dits multiplex ne devraient pas être utilisés systématiquement.
6. une recherche sur frottis nasal par amplification de l’ acide nucléaire pour la grippe A/B doit être effectuée s’ il y a des indices d’ une épidémie de grippe (saison, épidémie et pandémie).
Dans l’ ensemble, les hémocultures ne sont positives que chez environ 10 % des patients hospitalisés pour une PAC. Dans le cas d’ une pneumonie à pneumocoques, ces taux sont un peu plus élevés, selon diverses études, dans une fourchette de 27 à 38 % (15, 16). En outre, la pneumonie bactérienne peut être associée à un pronostic plus défavorable, de sorte qu’ une hémoculture positive peut être une raison pour intensifier la surveillance. L’ hémoculture est également plus fréquemment positive chez les patients âgés et dans les cas de pneumonie causée par des entérobactéries. En outre, la détection des agents pathogènes dans les hémocultures constitue la preuve étiologique la plus sûre.
Le test d’ antigène urinaire pour Legionella détecte l’ infection à Legionella par Legionella pneumophila des sérogroupes communs avec une sensibilité d’ environ 75 % et une spécificité de 99-100 %. Si d’ autres espèces ou sérogroupes sont également attendus en raison de la situation épidémiologique, un test d’ amplification de l’ acide nucléique à partir de matériel respiratoire doit être effectué et des preuves culturelles doivent être fournies.
Le test d’ antigène urinaire pour les pneumocoques détecte une infection par ces micro-organismes avec une sensibilité de 67-82% et une spécificité d’ environ 97 %. Les facteurs de risque pour un résultat faussement positif (en particulier la BPCO) doivent cependant être considérés. Le test peut donc servir de base à la focalisation de la thérapie.
Bien que la valeur de l’ examen microscopique et la culture des expectorations aient été plus souvent évaluées de façon critique, d’ autres études montrent que, si tous les critères de qualité (prédominance de granulocytes, peu ou pas d’ épithéliums pavimenteux) sont respectés, les résultats de l’ examen peuvent servir de guide pour la thérapie ciblée. En effet, Streptococcus pneumoniae, Haemophilus influenzae et Staphylococcus aureus sont notamment bien identifiés.
Diagnostic différentiel de la pneumonie
Chez tous les patients atteints d’ une PAC, un diagnostic différentiel ou additionnel doit être envisagé. Particulièrement en cas de surhydratation (maladie rénale), d’ aspiration et d’ infiltrats non infectieux (embolie pulmonaire, maladie pulmonaire interstitielle, cancer du poumon) ainsi que de BPCO et d’ emphysème pulmonaire.
La présentation clinique non spécifique, avec souvent aussi des patients oligosymptomatiques, rendent nécessaire d’ établir une distinction diagnostique différentielle avec d’ autres maladies dont les symptômes se chevauchent.
Estimation de la sévérité de la PAC
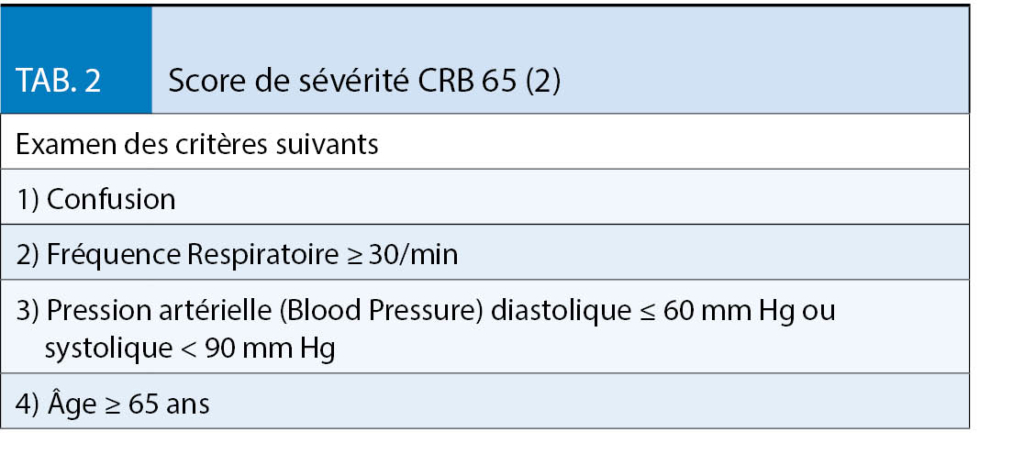
L’ indice CRB 65 (tabl. 2) s’ est imposé comme un score simple ayant une bonne prédiction du risque de létalité. Avec un score de 0, la létalité est de 0%, avec 1 : 3,3 %, avec 2 : 10% et avec 3 / 4 : 20,3 % (2). Il est formé par la détermination de trois simples paramètres cliniques et d’ un paramètre anamnestique. Il peut également être facilement appliqué sur une base ambulatoire. Le score est calculé en ajoutant un point pour chacun des critères énumérés au tabl. 2. A partir d’ un score de 1, une hospitalisation doit être envisagée. L’indice CRB-65 a été validé dans de nombreuses études et plusieurs méta-analyses actuelles.
Traitement de la PAC
Traitement antimicrobien initial
Les patients de moins de 65 ans atteints de pneumonie légère sans comorbidité devraient recevoir une monothérapie avec un macrolide (azithromycine, clarithromycine) comme traitement initial de choix.
Les patients atteints de pneumonie légère et de comorbidités définies doivent recevoir un traitement initial par un aminopénicilline / β-lactamine. Alternativement, une fluoroquinolone (Moxifloxacine, Lévofloxacine) peut être utilisée pour les allergies ou intolérances à la pénicilline. Dans les cas graves de BPCO et/ou de bronchectasie, un traitement par l’ amoxicilline/ciprofloxacine ou la lévofloxacine peut être administré.
Les patients atteints d’ une pneumonie modérée devraient recevoir comme traitement antimicrobien initial une aminopénicilline ou une céphalosporine de classe 2 ou 3a (cefpodoxime, céfuroxime) ainsi qu’ un macrolide. Si aucun agent pathogène bactérien atypique n’ est détecté pendant la stabilisation clinique, le traitement aux macrolides doit être interrompu après 3 jours. Par ailleurs, les patients atteints d’une PAC peuvent être traités avec une fluoroquinolone (moxifloxacine, lévofloxacine).
Chez les patients hospitalisés atteints d’ une pneumonie modérée, un traitement antimicrobien doit être administré par voie parentérale au cours des premiers jours. Les patients atteints d’ une pneumonie grave doivent d’ abord recevoir une thérapie combinée intraveineuse à large spectre à base de ß-lactamine (pipéracilline/tazobactam, céfotaxime ou ceftriaxone) ainsi qu’ un macrolide. En cas de stabilisation clinique et de détection manquante d’ un agent pathogène bactérien atypique, le traitement aux macrolides doit être interrompu après 3 jours. La monothérapie avec une fluoroquinolone (Moxifloxacine, Lévofloxacine) est une alternative possible, mais uniquement pour les patients sans choc septique.
En cas de pandémie de grippe ou d’ activité grippale saisonnière élevée, l’ oseltamivir (inhibiteur de la neuraminidase) peut être administrée précocement en plus du traitement antibactérien surtout chez les patients hospitalisés atteints de pneumonie modérée ou grave. Si la détection par PCR de l’ influenza demeure négative, il faut interrompre le traitement d’ oseltamivir.
Thérapie contrôlée par des biomarqueurs
L’ indication d’ un traitement et le contrôle de sa durée à l’ aide du biomarqueurs procalcitonine (PCT) a fait l’ objet de plusieurs études, en particulier d’ une étude Cochrane. Une condition préalable à une telle stratégie est que le PCT soit déterminé séquentiellement dans le cadre d’ un protocole. De plus, des recommandations d’ arrêt non ambiguës doivent être définies en fonction de seuils prédéterminés. Dans toutes les études, le clinicien était également ouvert à une «abrogation», c’ est-à-dire l’ abrogation des recommandations d’ arrêt en fonction de son jugement clinique.
Toutes les études ont montré que le traitement antimicrobien guidé par PCT permettait de raccourcir la durée du traitement (13), tant chez les patients hospitalisés que chez les patients en soins intensifs, sans et avec septicémie grave. Il n’ y avait aucune différence en ce qui concerne l’ échec du traitement ou la mortalité. Ce résultat a été confirmé dans une méta-analyse, particulièrement chez les patients atteints de PAC (13, 14).
Examens de suivi
Laboratoire
La détermination d’ un paramètre inflammatoire (CRP ou PCT) doit être effectuée dans le sérum à l’ admission ainsi qu’ après 3-4 jours. A la suite du traitement, les valeurs d’ inflammation doivent diminuer normalement (7). En l’ absence d’ une diminution de la CRP (< 25-50 % de la valeur de référence) ou du PCT, l’ échec du traitement devrait être ciblé (8). Cependant, les paramètres de l’ inflammation doivent toujours être interprétés en tenant compte du tableau clinique et de l’ état du patient. S’ il y a des signes de dysfonctionnement d’ un organe, son fonctionnement doit être vérifié au cours de la maladie, habituellement en vérifiant les paramètres de laboratoire comme p. ex. créatinine, transaminases ou cholestase, lactate, BNP, troponine, électrolytes, etc..
Échographie de la plèvre
Chez les patients hospitalisés atteints d’ une PAC avec épanchement pleural, un suivi échographique doit être effectué pour détecter le développement d’ un épanchement compliqué ou d’ un empyème pleural. Si une telle suspicion existe, une ponction pleurale diagnostique doit être effectuée.
Examen radiologique
Une radiographie pulmonaire de suivi n’ est pas systématiquement indiquée s’ il y a une réponse clinique adéquate au traitement. Chez les patients ayant des facteurs de risque pour une maladie tumorale, chez les fumeurs actifs, les anciens fumeurs, chez les patients de plus de 65 ans ou des patients atteints de maladies concomitantes graves, une tomodensitométrie doit être effectuée pour exclure une tumeur ou des infiltrats pulmonaires non infectieux. Chez les patients plus âgés ayant des antécédents de tabagisme, il y a un risque accru de cancer du poumon, qui peut soit imiter la pneumonie, soit causer une pneumonie poststenotique. Chez les patients ≥ 65 années, une malignité pulmonaire nouvellement diagnostiquée est trouvée au cours d’ une moyenne de moins d’ un an avec une incidence de 9, 2 %, et seulement 27 % de ce nombre dans les 90 jours suivant la sortie de l’ hôpital (9). La normalisation de l’ image radiographique du thorax peut durer des semaines, voire des mois. Par conséquent, si le patient répond cliniquement, une radiographie thoracique de contrôle doit être effectuée au plus tôt 2 semaines après la fin de l’ antibiothérapie.
LungenZentrum Hirslanden
Witellikerstrasse 40
8032 Zürich
L’ auteur n’ a déclaré aucun conflit d’ intérêts en rapport avec cet article.