Les troubles anxieux sont parmi les maladies psychiatriques les plus courantes et sont associés à un niveau élevé de souffrance. Un trouble anxieux ne peut être traité avec succès que si on le reconnaît comme tel. Cet article portera sur la manière dont les troubles anxieux se manifestent et comment ils peuvent être classés sur le plan diagnostique. Les options de traitement psychothérapeutique et psychopharmacologique seront présentées dans un article ultérieur.
Un nombre limité d’ émotions de base qui sont universelles et indépendantes de la culture ont été décrites. Ekman (1) fait la distinction entre le dégoût, la peur (fear), la joie, la tristesse, la surprise et la colère. Ces émotions ont une fonction importante et nous donnent un retour d’ information consciemment perceptible quant à la satisfaction ou non d’ un besoin. Alors que les besoins satisfaits entraînent des sentiments agréables, les besoins non satisfaits déclenchent des sentiments désagréables.
L’ American Psychological Association (APA, www.apa.org) définit l’ anxiété comme une émotion qui s’ accompagne d’ un sentiment de tension et qui se caractérise par des pensées d’ inquiétude et de changement physique. L’ anxiété se manifeste dans des situations perçues comme menaçantes, c’ est-à-dire lorsque le besoin de sécurité n’ est pas suffisamment satisfait. L’ ampleur de la peur dépend alors de l’ évaluation du danger et de l’ estimation de ses capacités pour faire face à la situation (2). Le mot peur est lié au latin «angustus» = « étroit ». Une personne en proie à la peur se sent souvent acculée et ressent une oppression.
Si une réaction d’ anxiété est déclenchée, divers processus adaptatifs sont mis en route par le système nerveux sympathique et autonome. Celles-ci entraînent des réactions physiques (p.ex. palpitations, transpiration, respiration plus rapide et moins profonde), des symptômes psychologiques (p.ex. agitation, tension), ainsi que des changements mentaux (p.ex. cercles de pensée et catastrophisation) dans le but de mobiliser l’ énergie. Au niveau du comportement, un évitement, une agitation ou une frénésie peuvent se produire. Ces processus d’ adaptation permettent à notre corps et à notre esprit de se concentrer sur la situation dangereuse et de réagir de manière adéquate à la situation de menace (réaction « fight-flight » ou « fright » (3)).
La limite entre la peur appropriée et la peur pathologique ne peut pas toujours être clairement définie. En général, on peut dire que la peur pathologique survient dans des situations où il n’ y a pas de menace réelle. Elle semble alors infondée et inappropriée pour les personnes non touchées.
Epidémiologie
L’ Organisation mondiale de la santé (OMS) estime qu’ en 2015, environ 264 millions de personnes dans le monde souffraient d’ un trouble anxieux (y compris les troubles obsessionnels compulsifs et le syndrome de stress post-traumatique (SSPT), qui ne sont pas décrits dans cet article). Les femmes sont touchées environ deux fois plus souvent que les hommes. Le nombre d’ années vécues avec un handicap (Years Lived with Disability, YLD) dans la région européenne est de 1,2 million d’ années (4). On estime que 38,2 % de la population de l’ UE (UE-27 plus la Suisse, l’ Islande et la Norvège) souffrent d’ au moins une maladie mentale chaque année, ce qui correspond à 164,8 millions de personnes touchées. Les troubles anxieux sont parmi les maladies psychiatriques les plus courantes, touchant environ 69,1 millions de personnes (5). En 2010, 893 000 personnes en Suisse souffraient de troubles anxieux. Les troubles anxieux les plus courants étaient les phobies spécifiques (39,2 %), suivies des phobies sociales (17,2 %), du trouble d’ anxiété généralisée (TAG ; 15,1 %), de l’ agoraphobie (15 %) et du trouble panique (13,4 %). Environ 1,3 milliard d’ euros ont été investis dans le traitement de ces troubles (6).
Dans une revue systématique, une prévalence sur un an de 10,6 % et une prévalence au cours de la vie de 16,6 % sont indiquées pour les troubles anxieux (y compris les troubles obsessionnels compulsifs et le SSPT). Le TAG est le trouble anxieux dont la prévalence sur la vie entière est la plus élevée (6,2 %), suivi des phobies spécifiques (5,3 %), de l’ agoraphobie (3,8 %), des phobies sociales (3,6 %) et du trouble panique (1,2 %) (7).
Taxonomie
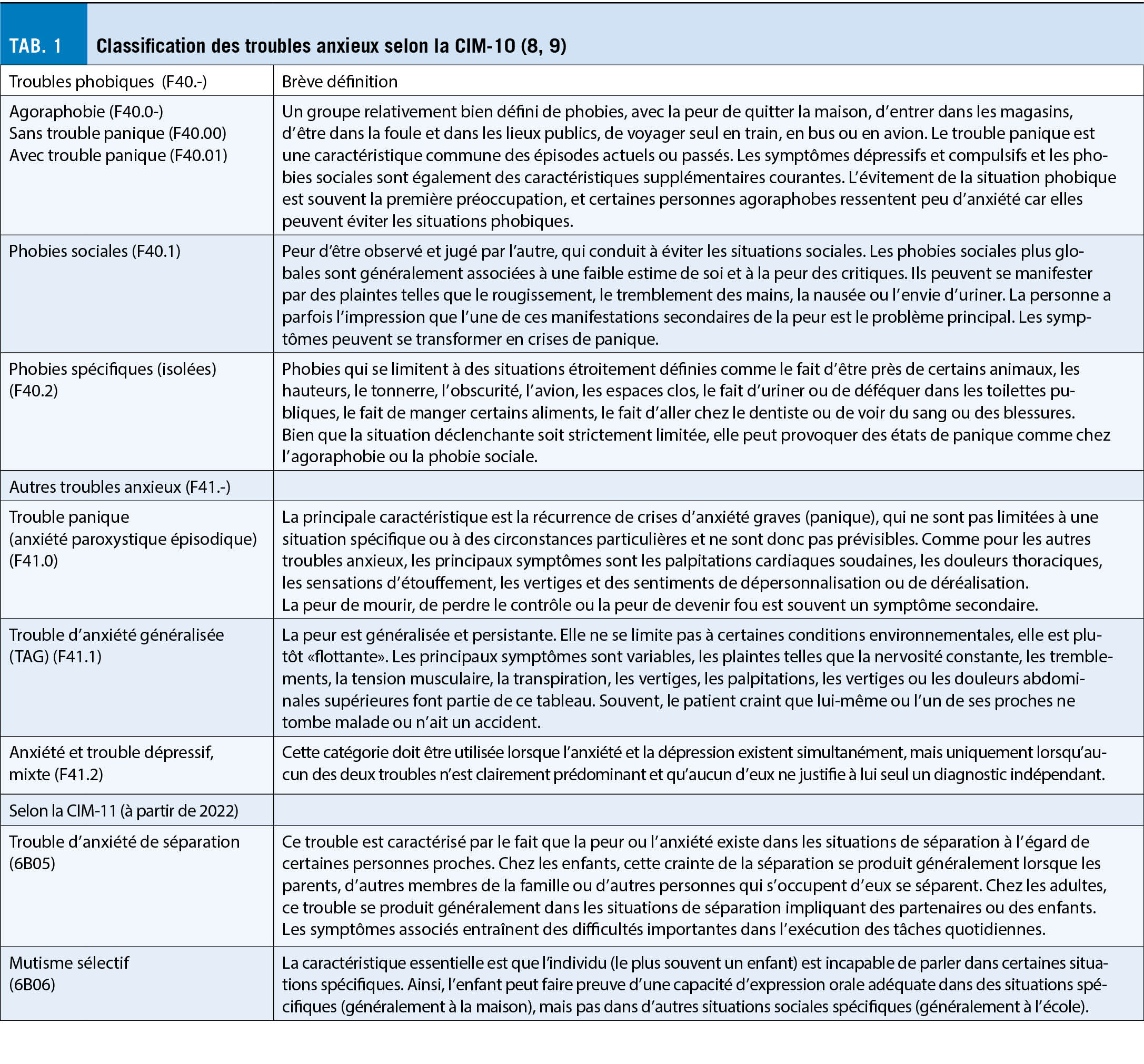
Les troubles anxieux sont diagnostiqués dans le cadre de soins ambulatoires et hospitaliers conformément à la 10ème version de la classification internationale des maladies et des problèmes de santé connexes (CIM-10) (8, 9). Pour un aperçu des classifications, voir le tableau 1.
Une distinction approximative est faite entre les troubles phobiques (F40.-) et les autres troubles anxieux (F41.-).
Dans les troubles phobiques, la peur se manifeste dans des situations clairement définies, de fait inoffensives. Cela déclenche soit un comportement d’ évitement ou alors la situation est endurée avec crainte. Les craintes du patient peuvent être liées à des symptômes individuels tels que des palpitations ou des sentiments de faiblesse. En outre, des peurs secondaires se manifestent souvent, comme la peur de mourir ou de perdre le contrôle, ou le sentiment de devenir fou. Dans le cas des troubles phobiques, on distingue l’ agoraphobie sans (F40.00) et avec (F40.01) trouble panique, les phobies sociales (F40.1) et les phobies spécifiques (isolées) (F40.2) (p.ex. des animaux, des hauteurs, etc.).
Pour les autres troubles anxieux, l’ anxiété est le principal symptôme, sans être liée à une situation environnementale spécifique. Ici, la principale distinction est faite entre le trouble panique (anxiété paroxystique épisodique ; F41.0), le TAG (F41.1) et le «trouble anxieux et dépressif, mixte» (F41.2).
Dans la CIM-11 à venir, qui devrait entrer en vigueur en 2022, la catégorie « troubles liés à l’ anxiété et à la peur » (anxiety and fear-related disorders) comprendra le mutisme sélectif (« selective mutism », 6B06) et le trouble d’ anxiété de séparation « separation anxiety disorder », 6B05) en plus des troubles d’ anxiété énumérés ci-dessus. Ainsi, l’ importance de ces troubles, qui ont été diagnostiqués en psychiatrie de l’ enfant et de l’ adolescent, pour l’ évolution ultérieure de la maladie à l’ âge adulte est prise en compte. Il a été constaté que 43,1 % d’ un échantillon de 38 993 adultes avaient plus de 18 ans lors de la première manifestation du trouble d’ angoisse de séparation (10).
Diagnostic et diagnostic différentiel des troubles anxieux
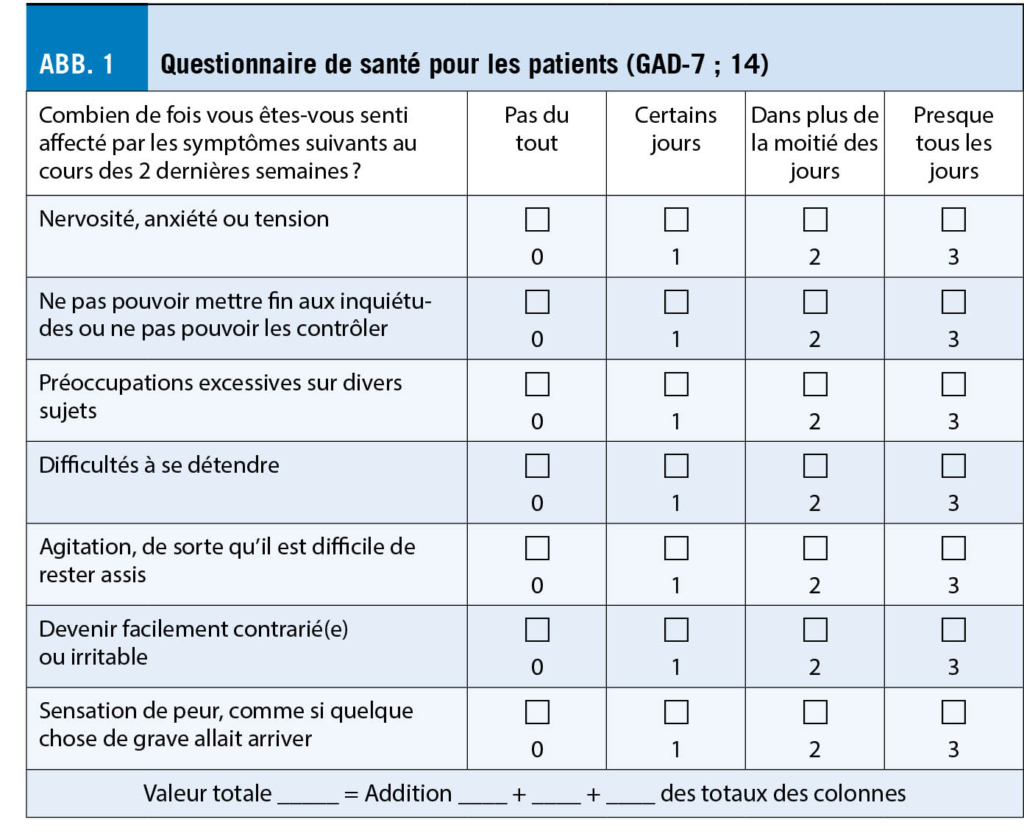
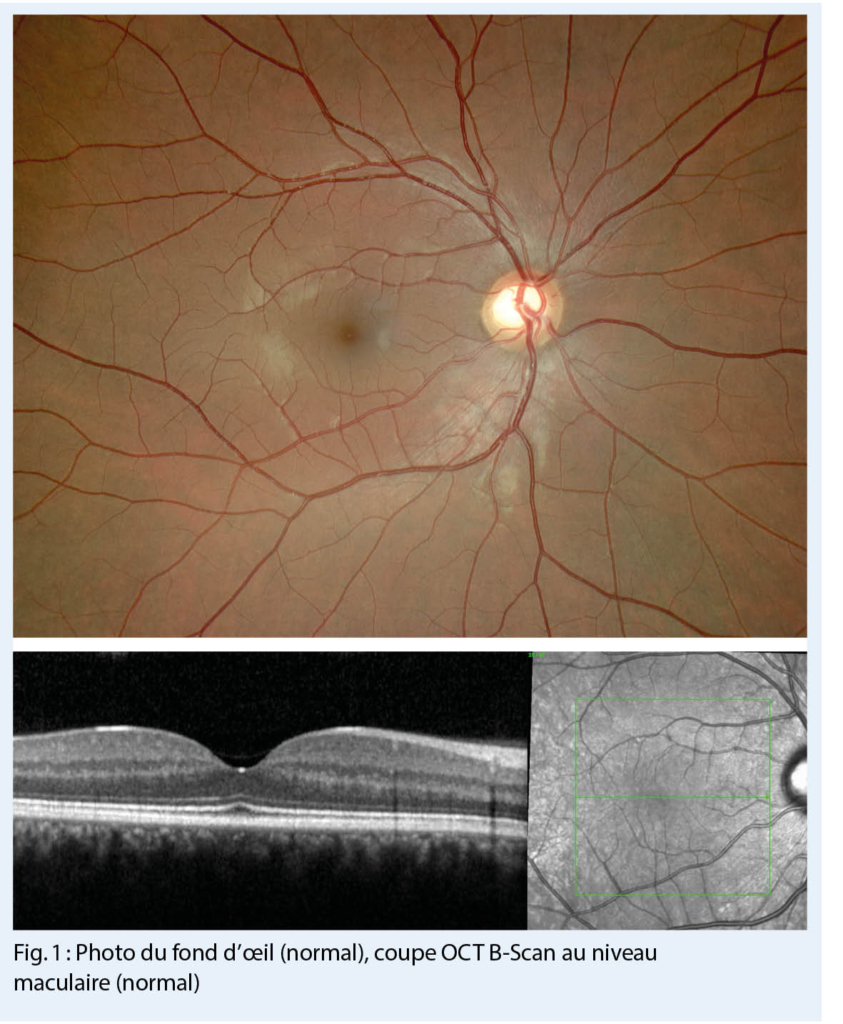
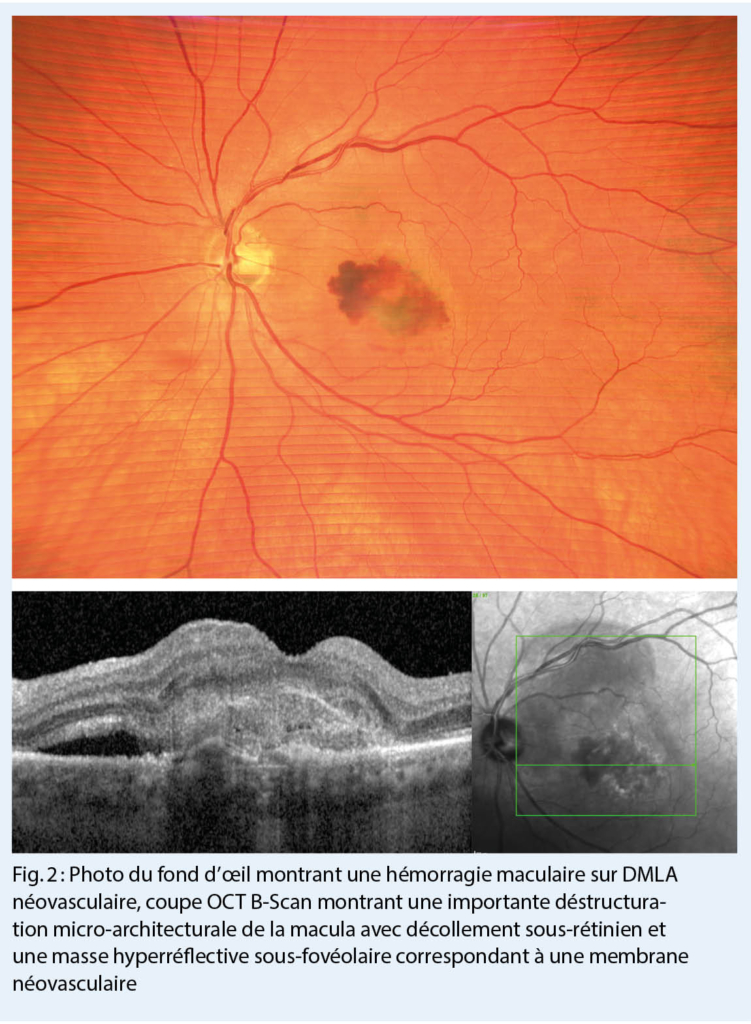
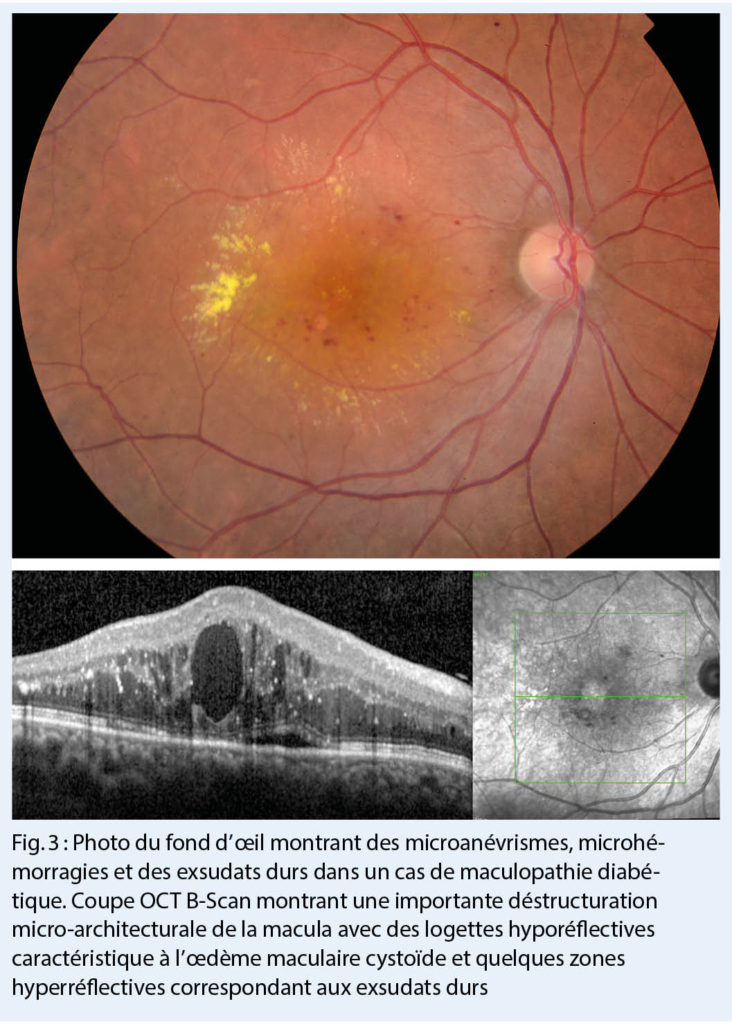
En pratique, il peut être difficile d’ identifier les troubles anxieux, car les patients font souvent état de douleurs, de troubles du sommeil ou d’ autres plaintes somatiques plutôt que de leurs angoisses (11, 12). Si l’ on soupçonne un trouble anxieux, des questions peuvent être posées dans le cadre des soins primaires (tab. 2) (13) ou des questionnaires de dépistage scientifiquement validés peuvent être utilisés, p.ex le questionnaire d’ évaluation des troubles anxieux généralisés (GAD-7 (14) ; fig. 1)). Le questionnaire GAD-7 (Generalized Anxiety Disorder Assessment) a été développé à l’ origine pour le TAG, mais il s’ est avéré sensible et spécifique pour d’ autres troubles anxieux (15). Dans le questionnaire GAD-7, un score total de 8 ou plus indique un possible trouble anxieux.
Si la suspicion d’ un trouble anxieux est confirmée, il convient d’ orienter le patient vers une institution spécialisée, où un diagnostic selon la CIM-10 (8, 9) est établi (tab. 1) et les options de traitement sont présentées et expliquées en détail au patient. Un trouble anxieux doit être traité par un médecin spécialiste / psychologue-psychothérapeute (13).
Pour l’ évaluation précise des troubles anxieux, les entretiens structurés et semi-structurés (p.ex. le Mini-International Neuropsychiatric Interview (M.I.N.I. ; DSM-IV ; CIM-10)) (16) peuvent être utilisés.
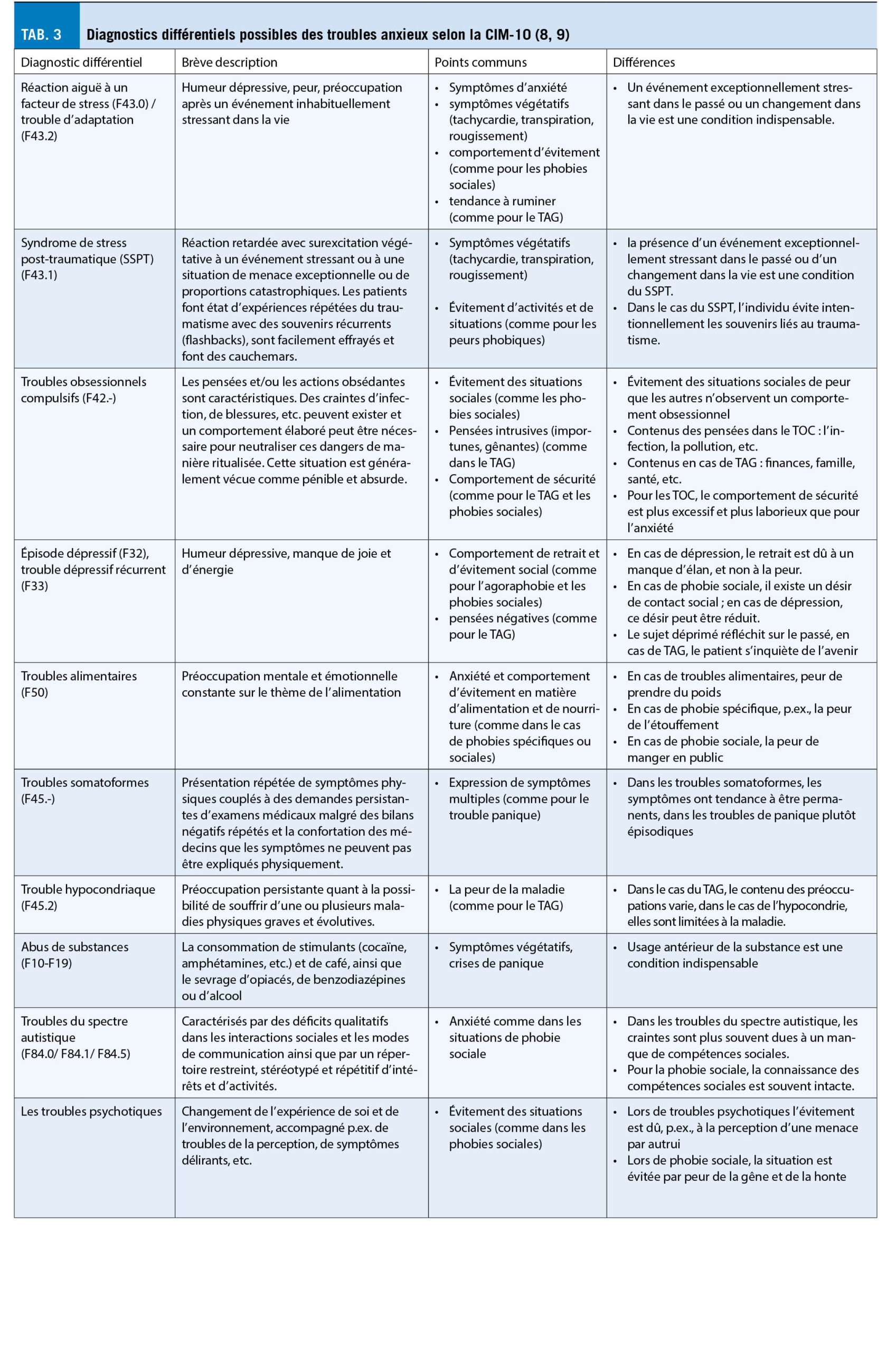
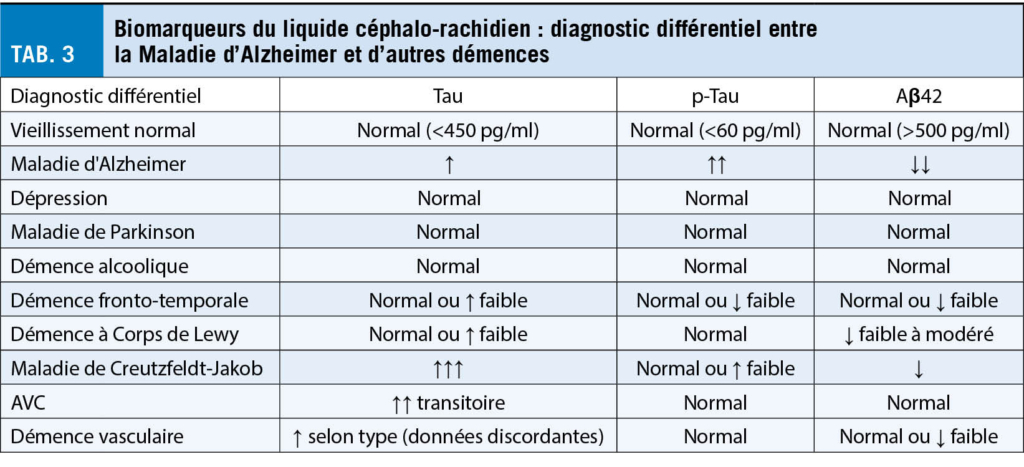
Les troubles anxieux doivent être distingués des autres troubles psychiatriques présentant des symptômes similaires par un diagnostic différentiel. Le tableau 3 donne un aperçu des principaux diagnostics différentiels psychiatriques. En plus des véritables troubles anxieux pouvant être diagnostiqués selon la CIM-10, il existe certaines causes non psychiatriques qui peuvent déclencher des « symptômes d’ anxiété » (tab. 4). En outre, La thérapie des troubles anxieux sera décrite dans un article à suivre.
Article traduit de « der informierte arzt » 11_2019
Copyright Aerzteverlag medinfo AG
Psychiatrie und Psychotherapie FMH
Sanatorium Kilchberg AG und eigene Praxen in Zürich
Selnaustrasse 6
8001 Zürich
l.krug@hin.ch
Eidgenössisch anerkannte Psychotherapeutin
Sanatorium Kilchberg AG und eigene Praxen in Zürich
Selnaustrasse 6
8001 Zürich
olivia.bolt@hin.ch
Les auteurs ont déclaré n’ avoir aucun conflit d’ intérêts en rapport avec cet article.
1. Ekman, P., Facial expression and emotion. Am Psychol, 1993. 48(4): p. 384-92.
2. Lazarus, R.S., Stress und Stressbewältigung – ein Paradigma, in Kritische Lebensereignisse, S.H. Fillipp, Editor. 1981, Urban & Schwarzenberg: München.
3. Cannon, W.B., Bodily changes in pain, hunger, fear, and rage. 1932, New York: Appleton-Century-Crofts.
4. World Health Organisation (WHO), Depression and other common mental disorders: Global health estimates. 2017.
5. Wittchen, H.U., et al., The size and burden of mental disorders and other disorders of the brain in Europe 2010. Eur Neuropsychopharmacol, 2011. 21(9): p. 655-79.
6. Maercker, A., et al., The costs of disorders of the brain in Switzerland: an update from the European Brain Council Study for 2010. Swiss Med Wkly, 2013. 143: p. w13751.
7. Somers, J.M., et al., Prevalence and incidence studies of anxiety disorders: a systematic review of the literature. Can J Psychiatry, 2006. 51(2): p. 100-13.
8. World Health Organisation (WHO), Tenth Revision of the International Classification of Diseases, Chapter V (F): Mental and Behavioural Disorders (including disorders of psychological development). Clinical Descriptions and Diagnostic Guidelines. 1991, Geneva: World Health Organisation.
9. DIMDI, Internationale statistische Klassifikation der Krankheiten und verwandter Gesundheitsprobleme, 10. Revision, German Modification (ICD-10-GM). 2020.
10. Silove, D., et al., Pediatric-Onset and Adult-Onset Separation Anxiety Disorder Across Countries in the World Mental Health Survey. Am J Psychiatry, 2015. 172(7): p. 647-56.
11. Knaster, P., et al., Psychiatric disorders as assessed with SCID in chronic pain patients: the anxiety disorders precede the onset of pain. Gen Hosp Psychiatry, 2012. 34(1): p. 46-52.
12. Wittchen, H.U., et al., Generalized anxiety and depression in primary care: pre-valence, recognition, and management. J Clin Psychiatry, 2002. 63 Suppl 8: p. 24-34.
13. Bandelow, B., et al., Deutsche S3-Leitlinie Behandlung von Angststörungen. 2014. www.awmf.org/leitlinien.html
14. Löwe, B., et al., Validation and standardization of the Generalized Anxiety Disorder Screener (GAD-7) in the general population. Med Care, 2008. 46(3): p. 266-74.
15. Plummer, F., et al., Screening for anxiety disorders with the GAD-7 and GAD-2:
a systematic review and diagnostic metaanalysis. Gen Hosp Psychiatry, 2016. 39: p. 24-31.
16. Sheehan, D.V., et al., The Mini-International Neuropsychiatric Interview (M.I.N.I.): the development and validation of a structured diagnostic psychiatric interview for DSM-IV and ICD-10. J Clin Psychiatry, 1998. 59 Suppl 20: p. 22-33;quiz 34-57.
17. Neu, P., Akutpsychiatrie: Das Notfall Manual. 3. Auflage, 2017, Stuttgart: Schattauer.