Hospital at Home ist ein in der Schweiz neues, jedoch international etabliertes Versorgungsangebot, das eine spitaläquivalente Behandlung zu Hause ermöglicht. Patient/-innen und ihre Angehörigen werden von einem interprofessionellen Team aus Pflegefachkräften, Ärztinnen und Ärzten betreut, das sie mehrmals täglich besucht und analog zu einem Spitalaufenthalt zu Hause behandelt.
Hospital at Home is a new but internationally established care program in Switzerland, which enables hospital-equivalent treatment at home. Patients and their relatives receive interprofessional care from a team of nurses and doctors who will visit several times a day and treat them at home in a similar way to a hospital stay.
Key Words: Hospital at Home, hospital-equivalent, health care innovation, value-based healthcare, Swiss hospital at home society
Hospital at Home ist als neues Versorgungsmodell in den letzten Jahren in der Schweiz verstärkt in den Fokus gerückt. Doch was steckt hinter dem Begriff Hospital at Home?
Internationale Definition von Hospital at Home:
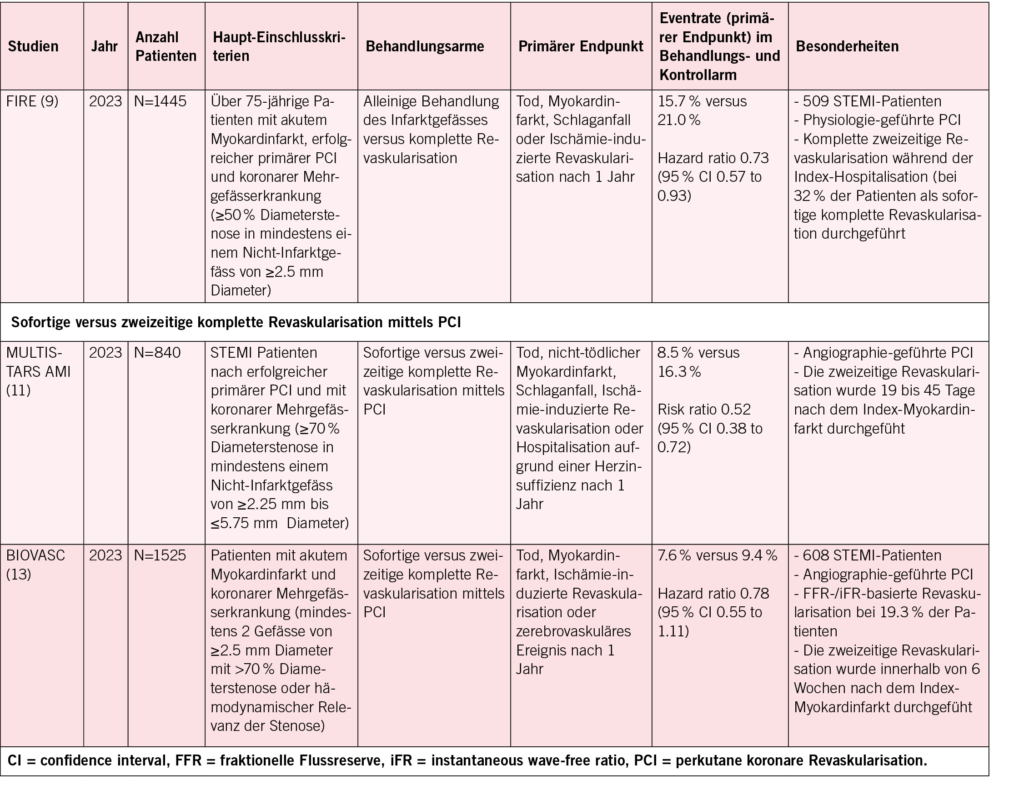
Die internationale Konsensdefinition für Hospital at Home wurde am World Hospital at Home Kongress 2023 in Barcelona durch das wissenschaftliche Komitee vorgestellt. (1)

«Hospital at Home ist eine akute klinische Dienstleistung, die Personal, Ausrüstung, Technologien, Medikamente und Fähigkeiten, die normalerweise in Spitälern zur Verfügung gestellt werden, übernimmt und diese Spitalversorgung für ausgewählte Menschen in ihrem Zuhause oder in Pflegeheimen erbringt. Hospital at Home ersetzt für diese Menschen den akut stationären Spitalaufenthalt.
Ziel ist es, das Leben kranker Menschen, die auf ein Spital angewiesen sind, zu verbessern, indem die Spitalkultur dahingehend verändert wird, dass eine Versorgung auf Spitalniveau zu Hause erfolgt.»
Was Hospital at Home nicht ist:
• Primäre häusliche Pflege
• Hausärztliche Grundversorgung
• Häusliche Krankenpflege (Spitex)
• Tagesstationäre Behandlung
• Ausschliesslich virtuelle Pflege oder Telemonitoring aus der Ferne
• Ein Programm zur Langzeitbetreuung chronischer Krankheiten
• Bisherige ambulante Versorgung z.B.: OPAT
(Outpatient Parenteral Antimicrobial Therapy)

Swiss Hospital at Home Society
Im November 2023 hat sich die Swiss Hospital at Home Society (SHaHS) als nationale Standesvertretung in der Schweiz gegründet. (2)
Im Rahmen dieser Gründung wurde deutlich, dass der Begriff Hospital at Home in der Schweiz sehr vielfältig benutzt wird. Deshalb haben wir neben der internationalen Definition, an der sich auch die Swiss Hospital at Home Society orientiert, eine differenzierte Kategorisierung der unterschiedlichen Angebote erstellt, welche sich in der Schweiz unter dem Begriff Hospital at Home subsumieren. (3)
Diese drei differenzierten Kategorien von Hospital at Home sollen Klarheit und Transparenz darüber schaffen, was hinter den jeweiligen Angeboten von Hospital at Home steht. Ein weiteres Ziel ist es, dass diese unterschiedlichen Kategorien als Grundlage für differenzierte Finanzierungsmodelle für Hospital at Home Angebote dienen.
Kategorie I: Akutmedizin zu Hause, mit pflegerischer und ärztlicher vor Ort Betreuung zu Hause. Diese Kategorie bietet eine spitaläquivalente, akutmedizinische Versorgung direkt im häuslichen Umfeld.
Kategorie II: Früherer Spitalaustritt, mit pflegerischer und ärztlicher Vor-Ort-Betreuung zu Hause, spitalergänzend. Hier ermöglicht Hospital at Home einen früheren Austritt aus dem Krankenhaus mit weiterer Betreuung zu Hause.
Kategorie III: Home Monitoring mit telemedizinischen Kontakten und/oder erweiterter Grundversorgung. Diese Kategorie konzentriert sich auf das Monitoring von Patient/-innen zu Hause, unterstützt durch telemedizinische Kontakte und erweiterte Grundversorgung.
Generell bietet Hospital at Home nicht nur die Möglichkeit, Spitaleinweisungen zu vermeiden und frühzeitige Entlassungen zu unterstützen, sondern stellt auch eine innovative Form der Gesundheitsversorgung dar, die sich nahtlos in das individuelle Leben der Patient/-innen integriert. Es handelt sich dabei um eine neue Form von interprofessioneller und gegebenenfalls intersektoraler Versorgung, die die Patient/-innen Bedürfnisse in den Fokus setzt.
Mit dieser Definition und Differenzierung des Begriffs wollen wir Klarheit und Transparenz bei den unterschiedlichen Hospital at Home Angeboten schaffen. Damit sollen Gesundheitsdienstleister, Kostenträger, Patient/-innen und die Gesundheitspolitik eine Orientierung haben, mit welcher Form von Hospital at Home sie es zu tun haben.
Gwen Gehrecke 2
Prof. Dr. Qian Zhou 3
KD Dr. med. Abraham Licht 4
Christian Ernst 5
Laura Treccani 6
Dr. med. Helene von Bremen 7
Prof. Dr. Sang-Il Kim 8
2 Vorständin Swiss Hospital at Home Society Pflegeexpertin, Innere Medizin/Visit – Spital Zollikerberg Zuhause Spital Zollikerberg
3 Leitende Ärztin Innere Medizin, Universitätsspital Basel
4 Vorstand Swiss Hospital at Home Society Gründer der Hospital@Home AG Chefarzt Notfallzentrum Klinik Hirslanden Zürich
5 Klinikleiter Klinik Innere Medizin und Mitglied der Spitalleitung Co-Projektleiter Visit – Spital Zollikerberg Zuhause Spital Zollikerberg
6 Vorständin Swiss Hospital at Home Society Gesundheitsökonomin Definition des Vorprojekts Hospital at Home des CHUV Universitätsspital
7 Vorständin Swiss Hospital at Home Society Assistenzärztin Innere Medizin Kantonsspital Baselland
8 Vorstand Swiss Hospital at Home Society Berner Fachhochschule Technik und Informatik
Präsident Swiss Hospital at Home Society
Leitender Arzt Innere Medizin/Hospital at Home Klinik Arlesheim
severin.poechtager@shahs.ch
Die Autorinnen und Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. https://whahc-community.kenes.com/mod/page/view.php?id=1042#:~:text=%22Hospit al%20a t%20Home%2F%20Hospital%20in,for%20acute%20inpatient%20hospital%20care.
2. https://shahs.ch/
3. https://shahs.ch/arbeitsbereich-gesundheitskonzept/