Häufigkeit und Ausmass von Übergewicht und Adipositas bei Kindern und Jugendlichen hat auch in der Schweiz über die letzten Jahrzehnte hinweg stark zugenommen. Der Haus- oder Kinderarzt ist in der Regel die erste Anlaufstelle für Familien. Er kann das Übergewicht rechtzeitig erkennen und frühzeitig eine geeignete Therapie einleiten. Die Ursachen des Übergewichts sind äusserst komplex und individuell unterschiedlich. Neben einer gestörten Energiebalance spielen genetische und soziale Faktoren eine wichtige Rolle. Die Wahrscheinlichkeit ist gross, dass sowohl das Übergewicht, als auch die Begleiterkrankungen bis ins Erwachsenenalter fortbestehen. Das Ziel der Behandlung von Kindern und Jugendlichen besteht darin, das Gewicht zu kontrollieren und die Fettmasse langfristig zu verringern und dabei sicherzustellen, dass Wachstum und Entwicklung normal ablaufen.
The frequency and extent of overweight and obesity in children and adolescents have also increased significantly in Switzerland over the last few decades. The family doctor or pediatrician is usually the first point of contact for families who can identify obesity in good time and initiate appropriate treatment at an early stage. The causes of obesity are extremely complex and vary from person to person. In addition to a disturbed energy balance, genetic and social factors play an important role. There is a high probability that both the obesity and the accompanying illnesses will persist into adulthood. The aim of treating children and adolescents is to control weight and reduce fat mass in the long term, while ensuring that growth and development proceed normally.
Key words: Childhood obesity, obesity in adolescents, adiposity comorbidities, weight management, childhood obesity treatment, bariatric.
Hintergrund
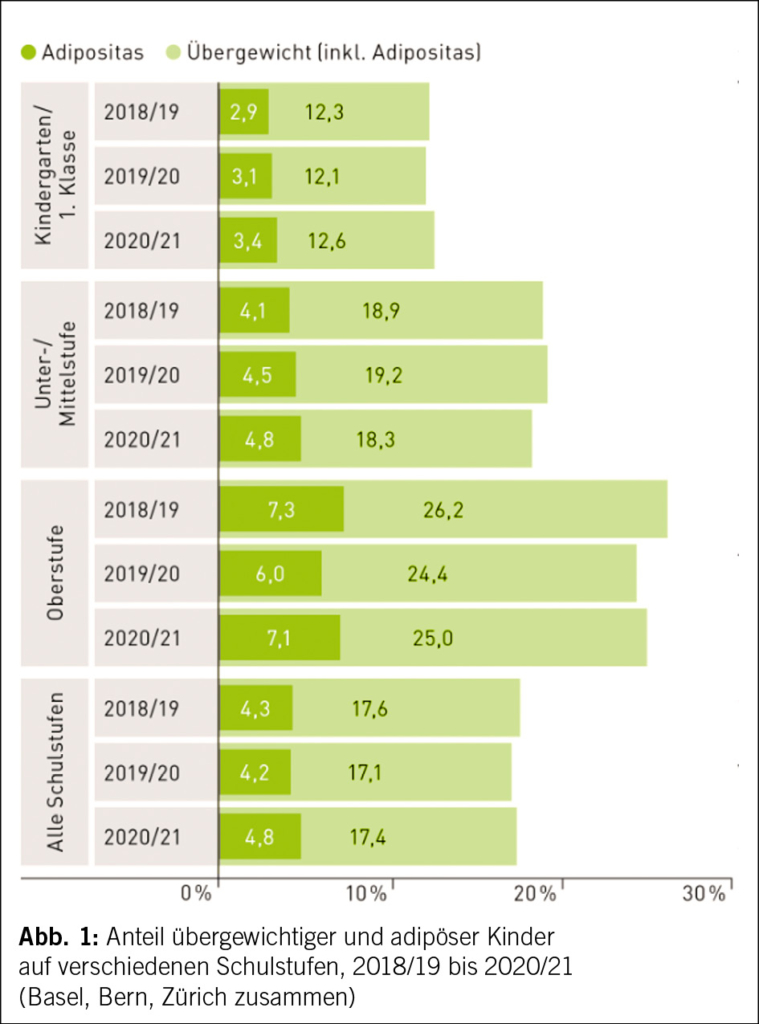
In der Schweiz ist rund jedes sechste Schulkind übergewichtig oder adipös. Seit dem Jahr 2005/06 wertet Gesundheitsförderung Schweiz die Angaben der schulärztlichen Dienste zum Body-Mass-Index (BMI) von Schülerinnen und Schülern aus den Städten Basel, Bern und Zürich für das jährliche BMI-Monitoring aus. Die Auswertung der neuesten Daten zeigt, dass im Schuljahr 2020/21 über alle Schulstufen betrachtet 17.4 % der Schülerinnen und Schüler übergewichtig, davon 4.8 % adipös gemessen am BMI waren. Der Vergleich mit früheren Jahren zeigt allerdings, dass der Anteil übergewichtiger Schulkinder in den letzten Jahren stabil bleibt.
Die Häufigkeit von Übergewicht nimmt laut der Daten von Gesundheitsförderung Schweiz bei Kindern und Jugendlichen mit dem Alter zu: so waren im Schuljahr 2020/21 ein Viertel der Jugendlichen in der Oberstufe übergewichtig oder adipös, während im Kindergarten nur jedes 8. Kind von Übergewicht betroffen war (1).
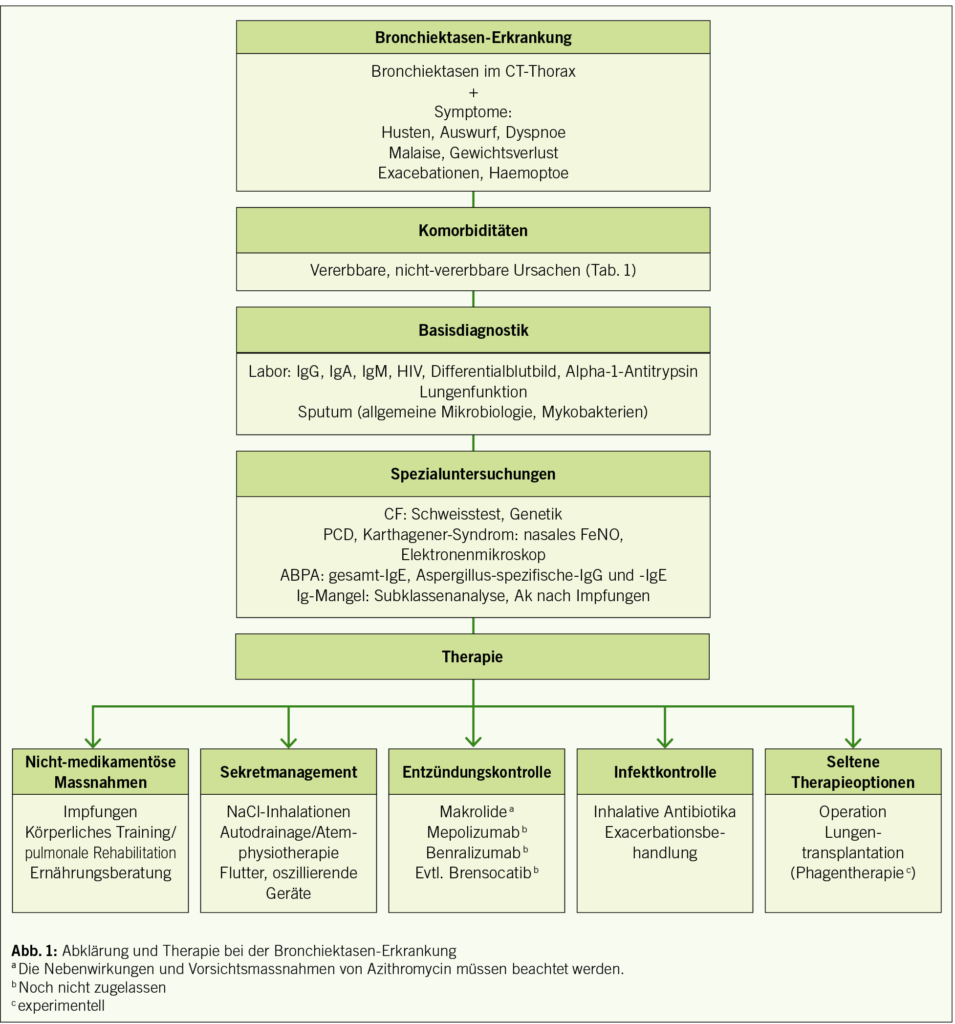
Bis vor einigen Jahren wurde Adipositas lediglich als Risikofaktor für Folgeerkrankungen verstanden, mittlerweile ist sie als chronische Krankheit anerkannt (Abb. 1).
Wer ist zu dick?
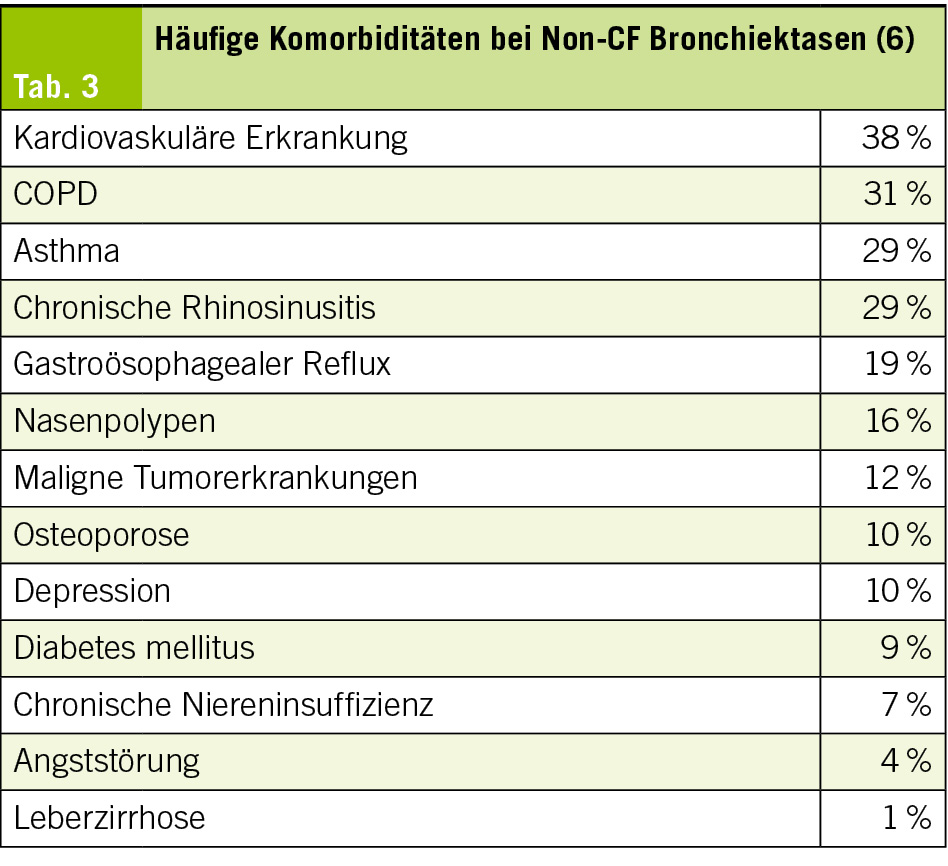
Eine Adipositas liegt vor, wenn der Körperfettanteil an der Gesamtkörpermasse pathologisch erhöht ist. Der BMI, definiert als Quotient aus dem gemessenen Körpergewicht in kg und dem Quadrat der in m gemessenen Körpergrösse, stellt ein akzeptables indirektes Mass für die Gesamt-Körper-Fett-Masse dar und wird auch bei Kindern zur Definition von Übergewicht und Adipositas empfohlen. Anders als bei Erwachsenen, bei denen die epidemiologische Definition von Übergewicht und Adipositas durch feste Grenzwerte bestimmt ist, die jeweils auf ein erhöhtes Gesundheitsrisiko hinweisen (Adipositas: BMI > 30 kg/m2, Übergewicht: BMI > 25 kg/m2), sind die Grenzwerte bei Kindern und Jugendlichen aufgrund ihrer körperlichen Entwicklung altersabhängig. Übergewicht besteht bei einem BMI oberhalb der 90. alters- und geschlechtsspezifischen Perzentile; die Adipositas im Kindes- und Jugendalter ist durch einen BMI oberhalb der 97. Perzentile definiert. In der Schweiz werden für die Definition der Adipositas im Kindes- und Jugendalter die deutschen Referenzkurven Kromeyer-Hauschild (2) verwendet. (Tab. 1) (Abb. 2)

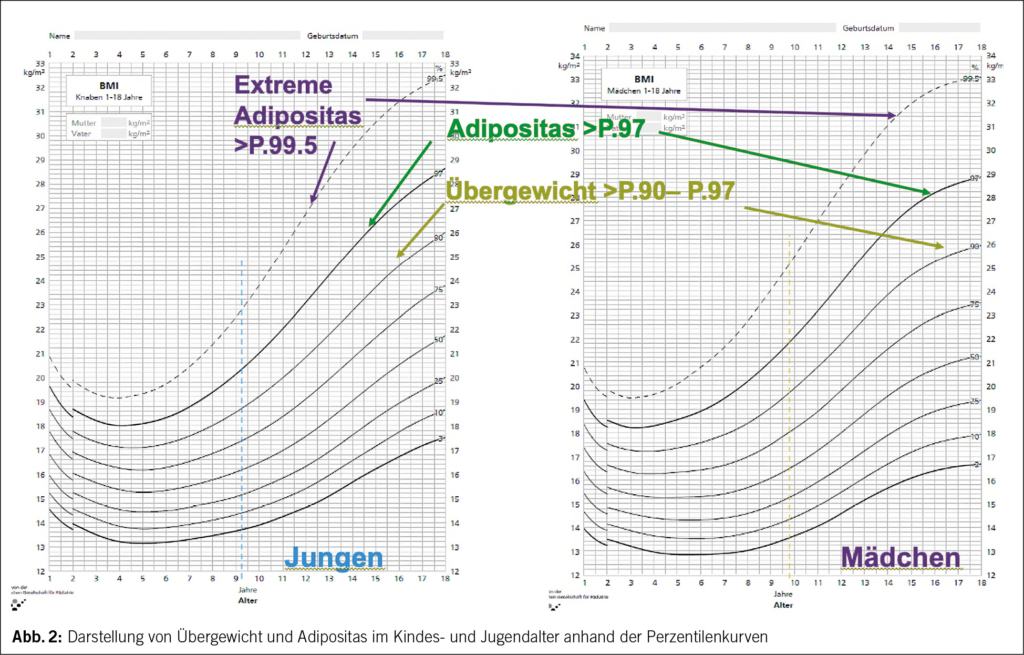
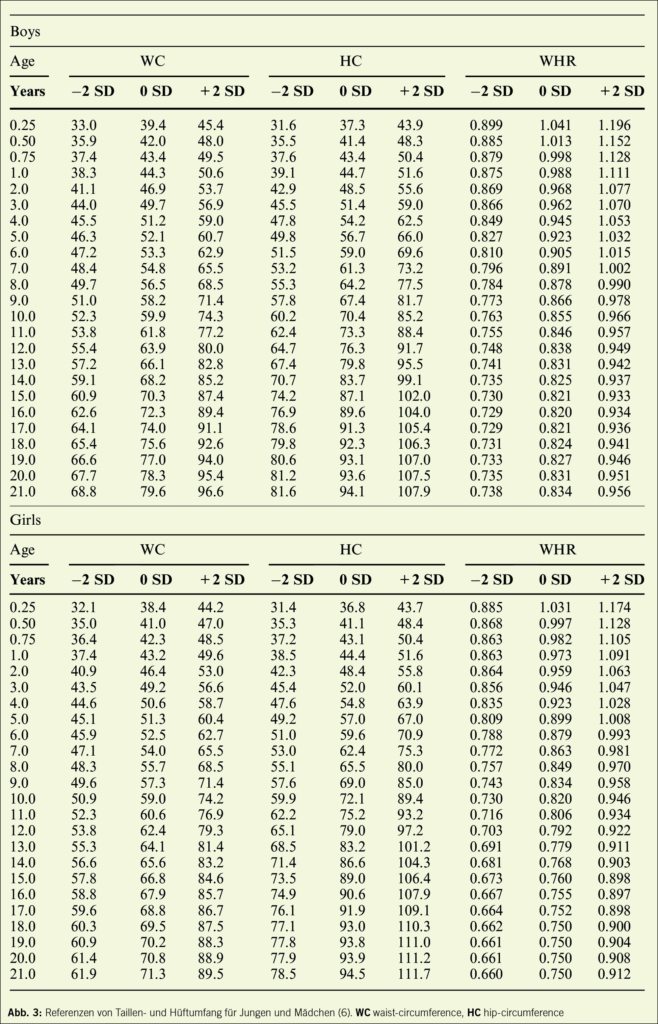
Da der BMI nicht nur die Fettmasse sondern die gesamte Körpermasse bestimmt, ist er v. a. im Kindes- und Jugendalter in bestimmten Situationen (puberale Mädchen, Sportler mit viel Muskelmasse, bei Klein- oder Grosswuchs und endokrinen Erkrankungen) nur wenig aussagekräftig. In diesen Fällen ist es angebracht, die Erhöhung der Fettmasse mit alternativen Methoden nachzuweisen, wie z. B. mittels DEXA oder Bioimpedanzanalyse (BIA) (4). Auch die Messung von Taillen- und Hüftumfang sowie die Messung der Hautfaltendicken (5) können zur Beurteilung des individuellen Gesundheitsrisikos verwendet werden (6) (Abb. 3).
Gewichtsassoziierte Komorbiditäten
Ein erhöhter Body-Mass-Index ist ein wichtiger Risikofaktor für nicht übertragbare Krankheiten wie Krebs, Typ-2-Diabetes mellitus, Schlafapnoe sowie Leber- und Herz-Kreislauf-Erkrankungen und geht auch im Kindes- und Jugendalter mit einem erhöhten Morbiditätsrisiko einher (5).
Viele Kinder und Jugendliche mit Adipositas weisen bereits ein oder mehrere kardio-metabolische Risikofaktoren auf, zum Beispiel eine Dyslipidämie, gestörte Glukosetoleranz beziehungsweise Typ-2-Diabetes oder eine Hyperurikämie. Die Anzahl der gewichtsassoziierten Komorbiditäten steigt mit dem Ausmass der Adipositas. Studien haben gezeigt, dass Blutdruck und Ruhepuls mit zunehmendem BMI signifikant ansteigen. Es kann zu einer Beschleunigung von Längenwachstum und Skelettreife kommen, die Pubertät kann vorzeitig einsetzen. Ein nicht unwesentlicher Teil der Betroffenen zeigt bereits deutliche Transaminasenerhöhungen sowie sonografisch eine Steatosis hepatis im Rahmen einer metabolisch-dysfunktionellen steatotischen Lebererkrankung (MASLD; früher nicht-alkoholische Fettlebererkrankung = NAFLD). Ein Genu valgum zeigt sich bei ungefähr 55 % der Kinder mit Adipositas und führt zu Knieschmerzen und begünstigt Arthrosebeschwerden (7).
Besonders schlimm aber ist für die betroffenen Kinder die Stigmatisierung. Sie werden oft gemobbt, haben wenig Selbstvertrauen, sind sozial schlechter integriert. Dies ist häufig mit psychischen Erkrankungen wie Depressionen, Angstzuständen, Schlafstörungen und Essstörungen verbunden (8).
Pathogenese der Adipositas
Die Ursache der Adipositas ist multifaktoriell. Neben der gestörten Balance zwischen Energieverbrauch und Energieaufnahme spielen genetische und soziale Faktoren eine wichtige Rolle. Es wird geschätzt, dass der Einfluss der genetischen Veranlagung auf das Körpergewicht ca. 40 %–70 % beträgt (9–11).
Ungünstiges Essverhalten mit ständiger Verfügbarkeit von Süßigkeiten, Fast Food und Softdrinks, mangelnde Bewegung und erhöhter Medienkonsum sind weitere Faktoren, die für den Energiestoffwechsel eine erhebliche Rolle spielen. Aber auch sozioökonomische und soziokulturelle Faktoren wie Migrationshintergrund, Sozialstatus sowie die Prägung durch das soziale und kulturelle Umfeld beeinflussen die Entstehung von Übergewicht und Adipositas. So haben z. B. Kinder, deren Eltern rauchen, ein um 30 Prozent erhöhtes Risiko übergewichtig zu werden (11, 12).
Manche Medikamente wie Glucocorticosteroide («Kortison») und bestimmte Antidepressiva können die Gewichtszunahme beeinflussen und zu Übergewicht führen. Endokrinologische Grunderkrankungen der hormonproduzierenden Drüsen, wie beispielsweise eine Schilddrüsenunterfunktion, Cushing Syndrom oder auch Erkrankungen der Hirnanhangdrüse sind bei circa einem Prozent der adipösen Kinder als Ursache zu nennen. An dieser Stelle sei auch auf einige seltene monogenetische Formen der Adipositas hingewiesen, wie z. B. Leptin-Defizienz, Leptin-Rezeptor Defekte oder Mutationen/Polymorphismen des Melanocorticoidsystems, welche durch eine rapide postpartale Gewichtszunahme mit ausgeprägter Hyperphagie charakterisiert sind und sich zum Teil bereits heute gezielt behandeln lassen. Ebenso wichtig ist das Erkennen einer Adipositas im Rahmen von syndromalen Erkrankungen, wie beispielweise das Prader-Willi oder Bardet-Biedl-Syndrom.
Verlauf
Übergewicht wächst sich leider nicht aus. Pädiatrische Adipositas- und populationsbasierte Studien zeigen, dass das Übergewicht sich in den seltensten Fällen spontan «auswächst» und die erfolgte Gewichtszunahme vom 7. Lebensjahr an bis ins Erwachsenenalter meist beibehalten wird. Je älter (> 11–12 J.) und je adipöser die Kinder sind, desto grösser ist die Wahrscheinlichkeit, als Erwachsene unter einer Adipositas zu leiden (66 bzw. 77 %). Epidemiologische Daten zeigen zudem, dass Kinder, welche zwischen dem 2. und dem 6. Lebensjahr schnell an Gewicht zunehmen, meist eine persistierende Adipositas entwickeln, so dass diese Alterspanne offensichtlich eine besonders vulnerable Lebensphase darstellt (13). Wenn mindestens ein Elternteil adipös ist, erhöht sich die Wahrscheinlichkeit eines übergewichtigen Kindes um ca. 30 % gegenüber einem Kind normalgewichtiger Eltern, bis ins Erwachsenenalter adipös zu bleiben (14).
Diagnostik von Grund- und Folgeerkrankungen der Adipositas
Um wirksame Massnahmen rechtzeitig einleiten zu können, ist es wichtig, das Übergewicht rechtzeitig zu erkennen und als gesundheitliches Problem ernst zu nehmen. Bei wertschätzender Grundhaltung sollte das Übergewicht im Rahmen von Vorsorgeuntersuchungen von Haus- oder Kinderärzten immer angesprochen werden. Oft erkennen die Eltern weder das eigene Übergewicht noch das des Kindes.
Die Indikationen für Diagnostik und Therapie sind dem Ausmass und Verlauf des Übergewichtes und den anamnestischen Risiken entsprechend gestaffelt. Eine gründliche medizinische Untersuchung und Blutentnahme zur Labordiagnostik ist bei allen Kindern mit einem BMI über P. 97 indiziert. Bei Übergewicht (BMI > P. 90 < P. 97) ist eine medizinische Diagnostik angeraten, wenn die Familienanamnese bei Verwandten 1. oder 2. Grades positiv für Adipositas oder Begleiterkrankungen (Typ-2-Diabetes, frühe atherosklerotische Erkrankungen, arterieller Hypertonus, Hypercholesterinämie) ist, eine gewichtsassoziierte Komorbidität vorliegt und/oder Risikofaktoren, wie Erhöhung von Gesamtcholesterin, Glucose oder Blutdruck u. a. beim Kind bekannt sind. Aber auch bei auffallend starkem BMI-Anstieg (z. B. > 3 kg/m2 pro Jahr) sollte eine umfassende Abklärung von kardiometabolischen Risikofaktoren oder gewichtsassoziierten Komorbiditäten erfolgen (Tab. 2) (15).

Therapie von Übergewicht und Adipositas bei Kindern und Jugendlichen
Das primäre Anliegen einer pädiatrischen Adipositastherapie ist nicht, das Körpergewicht zu senken, sondern eine langfristige Verbesserung des Gesundheitszustandes zu erreichen. Kinder im Wachstum weisen eine normale Gewichtszunahme von 3–4 kg pro Jahr auf. Ziel sollte sein, die Gewichtszunahme zu verlangsamen und unterhalb dieser Spanne zu halten, jedoch nicht das Gewicht zu reduzieren.
Eine Therapie ist immer indiziert bei Adipositas (BMI > 97. Perzentile, Taillenumfang oder Fettmasse über P. 97 respektive +2 SD) oder bei Übergewicht (BMI zwischen 90. und 97. Perzentile) und dem Vorliegen mindestens einer der folgenden Krankheiten, deren Prognose sich durch das Übergewicht verschlechtert oder die eine Folge des Übergewichts ist: Arterielle Hypertonie, Typ-2-Diabetes mellitus, gestörte Glukosetoleranz, endokrine Störungen, Syndrom der polyzystischen Ovarien, orthopädische Erkrankungen, metabolisch-dysfunktionelle steatotische Lebererkrankung, respiratorische Erkrankungen, Glomerulopathie oder Essstörungen in psychiatrischer Behandlung.
Strukturierte pädiatrischen Adipositastherapie
Seit Anfang 2014 können Kinder und Jugendliche gemäss der strukturierten pädiatrischen Adipositastherapie in der Schweiz umfassend behandelt werden (16). Wenn die Indikation für eine Therapie gegeben ist, können die behandelnden Ärztinnen und Ärzte aus der Pädiatrie oder der Hausarztmedizin 6 Monate lang neben den eigenen Konsultationen die multiprofessionelle strukturierte Individualtherapie (MSIT) verordnen (max. 6 mal Ernährungsberatung, 2 mal Physiotherapie). Wenn nach 6 Monaten der BMI o. a. Parameter oder die psychische/somatische Komorbidität zugenommen haben, soll der Patient an ein multiprofessionelles Gruppenprogramm (MGP) oder eine/n Adipositasspezialist/in für Kinder und Jugendliche überwiesen werden. Die Interventionen umfassen Massnahmen zur Verhaltensänderung in Bezug auf gesunde Ernährung, körperliche Bewegung, seelisches Wohlbefinden und Bildschirmarbeit. Die Programme beziehen Eltern und Kinder (getrennt und/oder gemeinsam) ein und können in Gruppen-, Einzel- oder Familiensitzungen durchgeführt werden.
Bariatrische Chirurgie
Als Therapie der ersten Wahl gelten konservative Behandlungen (Lebensstil-Interventionen), die multimodal und strukturiert durchgeführt werden müssen. Wenn jedoch die konservativen Therapiemöglichkeiten über 2 Jahre erfolglos ausgeschöpft sind, stellen operative Verfahren in zunehmendem Maße eine effektive Therapieoption auch für Jugendliche mit morbider Adipositas dar. Zu betonen ist, dass die bariatrischen Operationsverfahren nicht über eine mechanische Einschränkung der Nahrungszufuhr und Verminderung der Makronährstoffresorption wirken, sondern über komplexe neuroendokrine Wirkmechanismen, die Hunger- und Appetitregulation beeinflussen. Die Indikationsprüfung für eine bariatrische Operation muss nach den Richtlinien zur operativen Behandlung von Übergewicht der SMOB an einem SMOB anerkannten bariatrischen Referenzzentrum (www.smob.ch) in Zusammenarbeit mit einem zertifizierten pädiatrischen Adipositas-Referenzzentrum vorgenommen werden (Tab. 3).

Prospektive Studien haben bislang mittel- bis langfristige Ergebnisse nach bariatrischen Operationen untersucht. Eine Metaanalyse, die 29 Kohortenstudien mit kumulativ 4970 Patienten einschloss, zeigte eine durchschnittliche Reduktion des BMI um 13.1 kg/m2 sowie hohe Remissionsraten von vorbestehenden Komorbiditäten wie Typ-2-Diabetes mellitus (90 %), Dyslipidämie (77 %), arterielle Hypertension (81 %), Schlafapnoe (81 %), und Asthma (92.5 %) (18). Weitere Daten zeigen 8 Jahre nach Roux-en-Y Magenbypass Operation einen Gewichtsverlust von 29 %, entsprechend einer BMI-Reduktion von 16.9 kg/m2 (19). Nach einer Sleeve-Gastrektomie betrug die mittlere BMI-Reduktion nach 7 Jahren rund 16.3 kg/m2.
Neben den operationsassoziierten Risiken wie kardiorespiratorische Probleme, tiefe Beinvenenthrombose mit ggf. nachfolgender Lungenembolie, Anastomoseninsuffizienzen und Wundheilungsstörungen sind v. a. die längerfristigen Komplikationen wie gastrointestinale Beschwerden (Übelkeit, Erbrechen, Diarrhoe, GERD), Mikronährstoffmängel (Eisen, Vitamin B1, Vitamin B12, Vitamin D, Folsäure, Zink), Elektrolytverschiebungen mit Dehydratation bis hin zur Reduktion der Knochendichte zu beachten (20–22). Eine systematische Nachsorge ist daher obligat.
Medikamentöse Therapie
Wenn eine multiprofessionelle Therapie nicht ausreichend wirksam ist, steht für Kinder und Jugendliche mit Adipositas ab 12 Jahren eine medikamentöse Therapie mit den Glucagon-like Peptid-1 (GLP-1) Rezeptorantagonisten Liraglutid (Saxenda®) und Semaglutid (Wegovy®) zur Gewichtsreduktion zur Verfügung. Das Medikament kann bei einem Körpergewicht ≥ 60 kg und einer Adipositas gemäss den dafür international akzeptierten Grenzwerten (entspricht einem BMI ≥ 30 kg/m2 bei Erwachsenen) in Ergänzung zu gesunder Ernährung und verstärkter körperlicher Aktivität eingesetzt werden.
GLP-1-Rezeptoragonisten wirken auf verschiedenen Wegen in den zentralnervösen Zentren der Hunger- und Appetitregulation. Das Hungergefühl wird reduziert, das Sättigungsempfinden erhöht sowie das Verlangen nach Nahrung reduziert. Wie die Zulassungsstudien zeigten, reduziert eine Behandlung mit Liraglutid nach 56 Wochen das Körpergewicht um durchschnittlich 5 % (23), während Semaglutid das Körpergewicht um durchschnittlich rund 16 % nach 68 Behandlungswochen reduziert (24). Die häufigsten Nebenwirkungen von Liraglutid sind gastrointestinale Beschwerden wie Übelkeit, Erbrechen, Durchfall, Bauchschmerzen und Obstipation, weshalb etwa 10 % der behandelten Jugendlichen die Therapie nicht tolerieren und daher beenden müssen.
Prävention von Übergewicht und Adipositas durch den Hausarzt
Aktuelle Studien fokussieren zunehmend auf die Wichtigkeit und Effektivität der früh einsetzenden Förderung eines gesunden Körpergewichts im Kindes- und Jugendalter. Die Vermittlung einer gesundheitsförderlichen Lebensweise sollte so früh wie möglich im Leben ansetzen und die Familien, Kinder und Jugendlichen in ihren Lebenswelten erreichen. Hausärztliche sowie pädiatrische Praxen sind in der Regel erste Ansprechpartner der Familien im Hinblick auf die Betreuung von gesundheitlichen Problemen und spielen daher im Kontext von Übergewichts- und Adipositas-Prävention eine entscheidende Rolle. Im engen und wiederkehrenden Kontakt mit Kindern und Familie sollte die Förderung eines körperlich aktiven Lebensstils sowie die Verbesserung der Auswahl an energiearmen und gleichzeitig nährstoffdichten Nahrungsmitteln (zum Beispiel Obst, Gemüse und Salat) und die Anpassung der Portionsgrössen immer thematisiert werden.
Copyright Aerzteverlag medinfo AG
Fachärztin für Kinder- und Jugendmedizin
Päd. Endokrinologie und Diabetologie
Interdisziplinärer Schwerpunkt Psychosomatische und
Psychosoziale Medizin (SAPPM)
Stoffwechselzentrum St. Gallen
friendlyDocs AG
Lerchentalstrasse 21
9016 St. Gallen
Stoffwechselzentrum St. Gallen, friendlyDocs AG
Lerchentalstrasse 21
9016 St. Gallen
stoffwechselzentrum@friendlydocs.ch
Bernd Schultes ist Vize-Präsident der SMOB. Er erhält Vortragshonorare und Beratungshonorare von Novo Nordisk und Eli Lilly, sowie finanzielle Forschungsunterstützung durch Novo Nordisk.
1. Gesundheit fördern und Krankheiten vorbeugen | Gesundheitsförderung Schweiz [Internet]. [cited 2024 Sep 19]. Available from: https://gesundheitsfoerderung.ch/
2. AGA – Adipositas Gesellschaft [Internet]. [cited 2024 Sep 19]. Available from: https://adipositas-gesellschaft.de/aga/
3. Cole TJ, Bellizzi MC, Flegal KM, Dietz WH. Establishing a standard definition for child overweight and obesity worldwide: international survey. BMJ. 2000 May 6;320(7244):1240–3.
4. Boot AM, Bouquet J, de Ridder MA, Krenning EP, de Muinck Keizer-Schrama SM. Determinants of body composition measured by dual-energy X-ray absorptiometry in Dutch children and adolescents. Am J Clin Nutr. 1997 Aug;66(2):232–8.
5. 050-002l_S3_Therapie-Praevention-Adipositas-Kinder-Jugendliche_2019-11.pdf [Internet]. [cited 2024 Sep 19]. Available from: https://register.awmf.org/assets/guidelines/050-002l_S3_Therapie-Praevention-Adipositas-Kinder-Jugendliche_2019-11.pdf
6. Fredriks AM, van Buuren S, Fekkes M, Verloove-Vanhorick SP, Wit JM. Are age references for waist circumference, hip circumference and waist-hip ratio in Dutch children useful in clinical practice? Eur J Pediatr. 2005 Apr;164(4):216–22.
7. I’Allemand D, Wiegand S, Reinehr T, Müller J, Wabitsch M, Widhalm K, et al. Cardiovascular risk in 26,008 European overweight children as established by a multicenter database. Obesity (Silver Spring). 2008 Jul;16(7):1672–9.
8. Puhl RM, King KM. Weight discrimination and bullying. Best Pract Res Clin Endocrinol Metab. 2013 Apr;27(2):117–27.
9. Stunkard AJ, Foch TT, Hrubec Z. A twin study of human obesity. JAMA. 1986 Jul 4;256(1):51–4.
10. Silventoinen K, Jelenkovic A, Sund R, Yokoyama Y, Hur YM, Cozen W, et al. Differences in genetic and environmental variation in adult BMI by sex, age, time period, and region: an individual-based pooled analysis of 40 twin cohorts. Am J Clin Nutr. 2017 Aug;106(2):457–66.
11. Jaakkola JM, Rovio SP, Pahkala K, Viikari J, Rönnemaa T, Jula A, et al. Childhood exposure to parental smoking and life-course overweight and central obesity. Ann Med. 2021 Dec;53(1):208–16.
12. Styne DM, Arslanian SA, Connor EL, Farooqi IS, Murad MH, Silverstein JH, et al. Pediatric Obesity-Assessment, Treatment, and Prevention: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2017 Mar 1;102(3):709–57.
13. Geserick M, Vogel M, Gausche R, Lipek T, Spielau U, Keller E, et al. Acceleration of BMI in Early Childhood and Risk of Sustained Obesity. N Engl J Med. 2018 Oct 4;379(14):1303–12.
14. Simmonds M, Llewellyn A, Owen CG, Woolacott N. Predicting adult obesity from childhood obesity: a systematic review and meta-analysis. Obes Rev. 2016 Feb;17(2):95–107.
15. l’Allemand D. Definition, diagnostisches Vorgehen und Therapie-Indikationen bei Übergewicht im Kindes- und Jugendalter [Internet]. pädiatrie schweiz. 2006 [cited 2024 Sep 19]. Available from: https://www.paediatrieschweiz.ch/definition-diagnostisches-vorgehen-und-therapie-indikationen-bei-uebergewicht-im-kindes-und-jugendalter/
16. Übergewichtige Kinder können jetzt umfassend behandelt werden. Schweiz Ärzteztg [Internet]. 2014 Oct 28 [cited 2024 Sep 19];95(44). Available from: https://doi.emh.ch/saez.2014.03089
17. Richtlinien zur operativen Behandlung von Übergewicht – SMOB : Swiss Society for the Study of Morbid Obesity and Metabolic Disorders [Internet]. [cited 2024 Sep 19]. Available from: https://www.smob.ch/richtlinien-zur-operativen-behandlung-von-uebergewicht/
18. Wu Z, Gao Z, Qiao Y, Chen F, Guan B, Wu L, et al. Long-Term Results of Bariatric Surgery in Adolescents with at Least 5 Years of Follow-up: a Systematic Review and Meta-Analysis. Obes Surg. 2023 Jun;33(6):1730–45.
19. Inge TH, Jenkins TM, Xanthakos SA, Dixon JB, Daniels SR, Zeller MH, et al. Long-term outcomes of bariatric surgery in adolescents with severe obesity (FABS-5+): a prospective follow-up analysis. Lancet Diabetes Endocrinol. 2017 Mar;5(3):165–73.
20. Mitra AT, Das B, Sarraf KM, Ford-Adams M, Fehervari M, Ashrafian H. Bone health following paediatric and adolescent bariatric surgery: a systematic review and meta-analysis. EClinicalMedicine. 2024 Mar;69:102462.
21. Zolfaghari F, Khorshidi Y, Moslehi N, Golzarand M, Asghari G. Nutrient Deficiency After Bariatric Surgery in Adolescents: A Systematic Review and Meta-Analysis. Obes Surg. 2024 Jan;34(1):206–17.
22. Beamish AJ, Ryan Harper E, Järvholm K, Janson A, Olbers T. Long-term Outcomes Following Adolescent Metabolic and Bariatric Surgery. J Clin Endocrinol Metab. 2023 Aug 18;108(9):2184–92.
23. Kelly AS, Auerbach P, Barrientos-Perez M, Gies I, Hale PM, Marcus C, et al. A Randomized, Controlled Trial of Liraglutide for Adolescents with Obesity. N Engl J Med. 2020 May 28;382(22):2117–28.
24. Weghuber D, Barrett T, Barrientos-Pérez M, Gies I, Hesse D, Jeppesen OK, et al. Once-Weekly Semaglutide in Adolescents with Obesity. N Engl J Med. 2022 Dec 15;387(24):2245–57.