Sarkome sind bösartige Tumore des Binde- und Stützgewebes, machen lediglich ca. 1% aller Krebsformen aus, und gehören so zu den seltenen Erkrankungen. Molekular werden fast 200 verschiedene biologische Entitäten unterschieden, und die Behandlung erfolgt ausgesprochen transdisziplinär. Die Weiterentwicklung von neuen Therapieformen für Sarkom Patienten gestaltet sich als sehr schwierig, da es einerseits keine prospektiven, longitudinalen Datenerfassungen -und schon gar nicht in Echtzeit und durch den Patienten definierte Parameter- gibt, und weil diese in der Regel auch nicht transdisziplinär erfasst werden. Zudem müssen immer neue Herausforderungen gemeistert werden.
Abstract: Sarcomas are malignant tumors of the connective and supporting tissues, account for only about 1% of all cancers, and thus belong to the rare diseases. Molecularly, nearly 200 different biological entities are distinguished, and treatment is distinctly transdisciplinary. The further development of new forms of therapy for sarcoma patients is very difficult, because on the one hand there is no prospective, longitudinal data collection – and certainly not in real time and patient-defined parameters – and because these are usually not collected in a transdisciplinary manner. In addition, new challenges must always be mastered.
Key Words: Sarcoma, MDT, real-time/real-world data, predictive outcome analysis
Seit Januar 2020 müssen alle Krebsdiagnosen per Gesetz gemeldet werden, wofür aber keine einheitliche digitalisierte Lösung zur Erfassung von strukturierten Daten besteht. Zudem führte die Schweiz im April 2021 ein Gesetz zur Qualität und Wirtschaftlichkeit in der Medizin ein, obwohl die eigentliche Qualität noch nicht wirklich definiert ist. Darüber hinaus müssen wir uns immer grösseren Herausforderungen in unserem Gesundheitswesen stellen, wo die Kostenexplosion ungebremst zunimmt, und immer neue Sparmassnahmen definiert werden, ohne aber die effektiven Kosten abbilden zu können und dadurch der Spielraum der Akteure an der Front immer weiter eingeengt wird («Silo-Mentalität»).
Swiss Sarcoma Network (SSN)
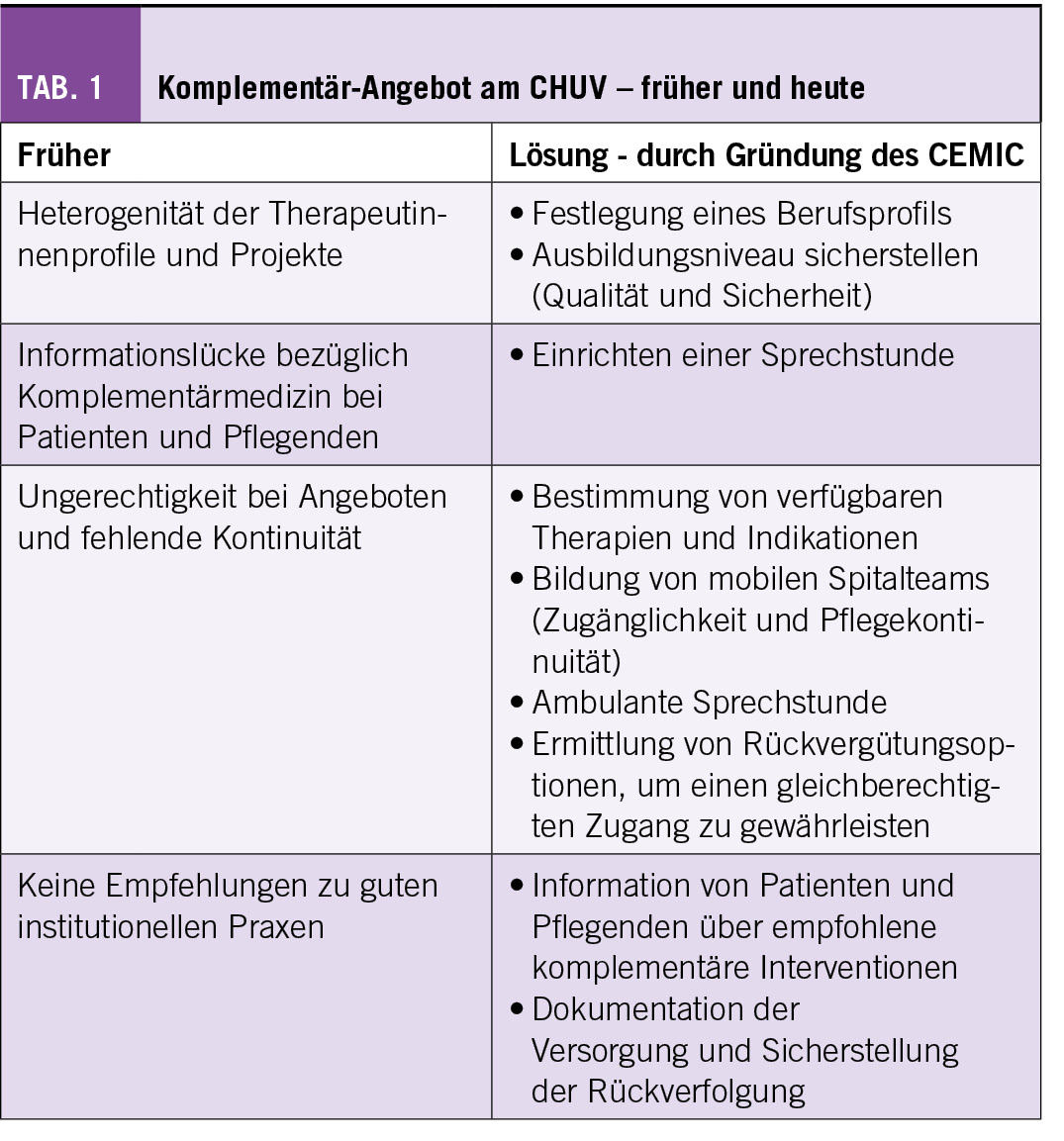
Das SSN wurde vor 3 Jahren als Verein gegründet. Mitglieder sind die Institutionen, welche sich verpflichten, alle transdisziplinären Patienten prospektiv im wöchentlichen multidisziplinären Sarkom-Tumorboard (MDT-SB) vorzustellen und die Daten im Register zu teilen. Das definierte Ziel beabsichtigt die transparente Erfassung der Qualität der Behandlung von Sarkom Patienten. Grundsätzlich steht das SSN allen Institutionen offen, die zu dieser transparenten Qualitätserfassung bereit sind.
Um dies zu erreichen, werden die Prinzipien der value-based health care (VBHC) verfolgt. Strukturierte, klinisch-metrische Daten werden longitudinal über den gesamten Behandlungsablauf für jeden einzelnen Patienten erfasst.
Zur Beschreibung des Aufbaus sowie der Zielsetzung des SSN können die Qualitätsdimensionen nach Donabedian angewandt werden: Prozessqualität, Strukturqualität und Ergebnisqualität. Prozessqualität erfasst das SSN zum Beispiel dadurch, dass der Zeitpunkt dokumentiert wird, an welchem diagnostische Untersuchungen und therapeutische Schritte durchgeführt werden, um so zeitliche Prozesse abzubilden. Weitere Parameter der Prozessqualität, wie z.B. das Einhalten der Leitlinien während Sarkomboard Entscheiden, werden ebenfalls dokumentiert. Strukturqualität stellt das SSN allein schon durch seinen Aufbau sicher: Das SSN besteht organisatorisch aus drei Hauptpfeilern: nebst dem wöchentlich stattfindenden MDT-SB ist das SwissSarcomaRegistry zu erwähnen, sowie die Forschung und Fort- und Weiterbildung. Letztere wird unter www.sarcoma.academy zusammengefasst. Hierbei werden monatlich internationale Webinars organisiert, in denen abwechslungsweise ein Hauptthema durch einen weltweit anerkannten Sarkomexperten vorgestellt wird, und Fallbesprechungen stattfinden mit einem internationalen Expertenpanel. Mittlerweile loggen sich jeweils Teilnehmer aus allen fünf Kontinenten ein.
Das SSN ist international eingebettet, einerseits durch das International Advisory Board bestehend aus 4 Exponenten, die das Netzwerk im Aufbau direkt beraten und für konkrete Patientenfragen aus dem MDT-SB direkt zur Verfügung stehen. Andererseits ist das SSN Mitglied von SELNET, einem Horizon2020 geförderten internationalen Sarkom-Netzwerk Programm. Dies integriert das SSN in die international vernetzte Grundlagen- und translationale Forschung. Im SwissSarcomaRegistry sind aktuell die Daten von knapp 4000 Patienten erfasst, was mit dem erwähnten Set-up exzellente Möglichkeiten für die Versorgungsforschung erlaubt.
Ergebnisqualität als letzte Kategorie der Donabedian Kriterien wird durch regelmässige systematische Erhebungen von Patienten berichteten Ergebnissen (PROMs) sowie Patienten berichteten Erfahrungen (PREMs) direkt vom Patienten, sowie durch Bestimmung von «harten» Qualitsindikatoren, wie z.B. Rezidivrate oder Überleben, sichergestellt. Da strukturierte Daten erfasst werden, wird es ebenfalls möglich sein, jedem diagnostischen und therapeutischen Schritt ein entsprechendes «Preisschild« zuzuordnen, wodurch die effektiven Kosten einer Sarkombehandlung ermittelt werden können.
Definition von Qualitätsindikatoren (QI) der Sarkombehandlung
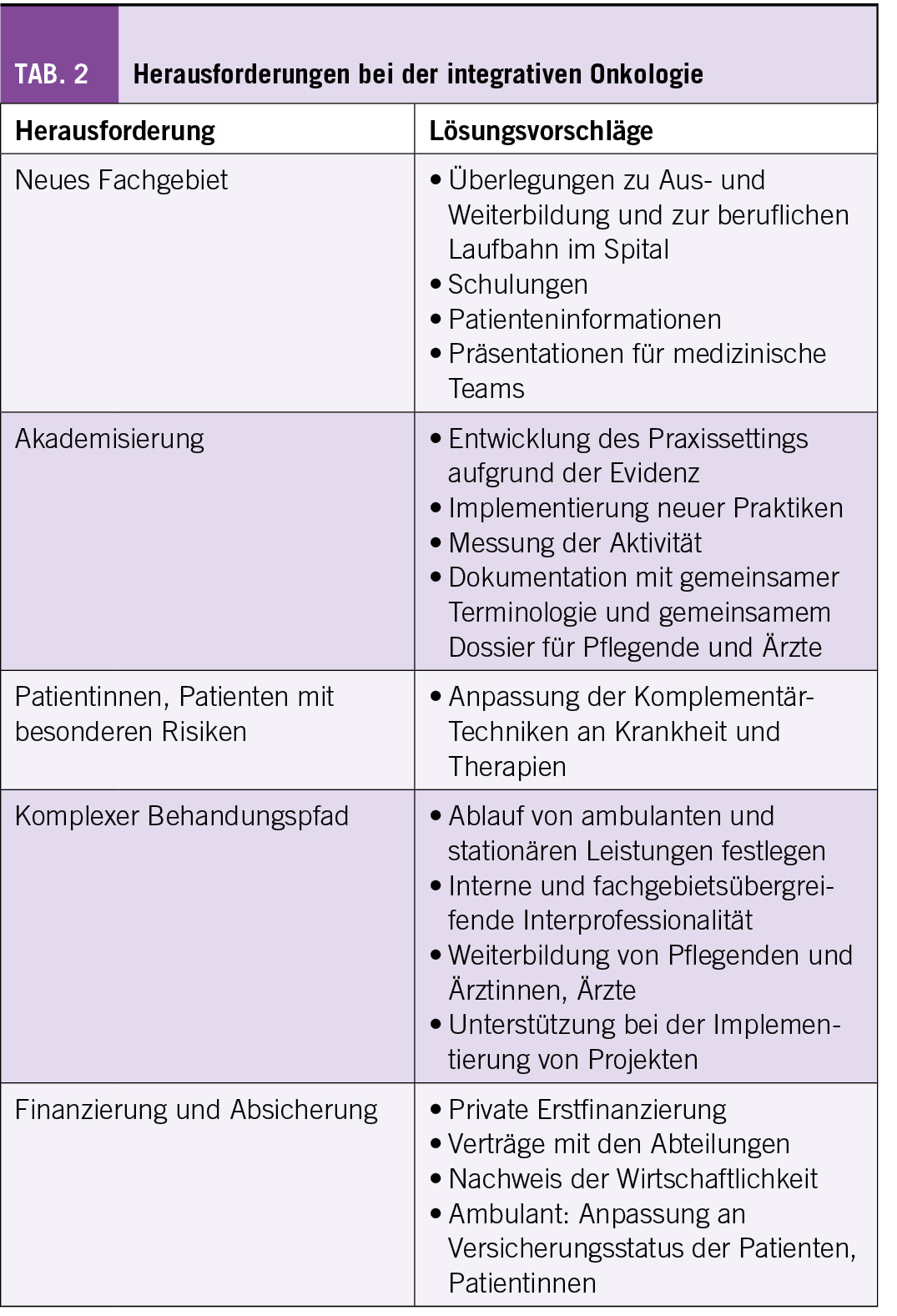
Um die Qualität der Sarkom Behandlung überhaupt erfassen zu können, muss diese zuerst definiert werden. Das Internationale Advisory Board des SSN mit vier weltweit anerkannten Sarkomexperten (Jean-Yves Blay, Lyon; Axel LeCesne, Paris; Javier Martin-Broto, Madrid; Alessandro Gronchi, Milan) definierte zu diesem Zweck Qualitätsindikatoren für die Abklärung und Behandlung von Patienten mit Sarkom. Diese können in 6 Kategorien eingeteilt werden (Tab. 1):
Real-time and real-world (RTWD) Datenerfassung
Selbstverständlich kann eine solche Fülle von klinischen Parametern und komplexen Daten nicht mit herkömmlichen Methoden abgebildet und erfasst werden. Zudem stellt die «Datenexplosion» in der Medizin ein zunehmend ernstes Problem dar, dem wir uns stellen müssen. Die Herausforderung kann zusammengefasst werden mit den 5V’s of big data, nämlich: Geschwindigkeit,
Volumen, Variabilität, Korrektheit und Wertigkeit. Die zukünftige Herausforderung besteht darin, Daten nicht nur zu berichten, sondern durch analytische Verfahren neues Wissen zu generieren, welches in Zukunft einen Krankheitsverlauf oder sinnvolle Therapieentscheidungen für jeden einzelnen Patienten voraussagen kann. Dadurch kann eine deskriptive Analyse in eine prädiktive und präskriptive Analyse weiterentwickelt werden. Die Möglichkeiten der digitalen Transformation werden uns dies ermöglichen. Um in einem ersten Schritt RTWD zu generieren, entschloss sich das SSN, das SwissSarcomaRegistry mit dem MDT-SB zu koppeln. Somit kann der Moment, an dem sich alle Vertreter der Fachdisziplinen einmal wöchentlich austauschen und offene Fragen zur Abklärung und Behandlung der Sarkompatienten diskutieren, im Register festgehalten werden. Weiterhin erfolgt die Eingabe von Daten somit zeitgleich zum klinischen Ablauf und interdisziplinär.
IT Platform und interaktive Frontside-Website
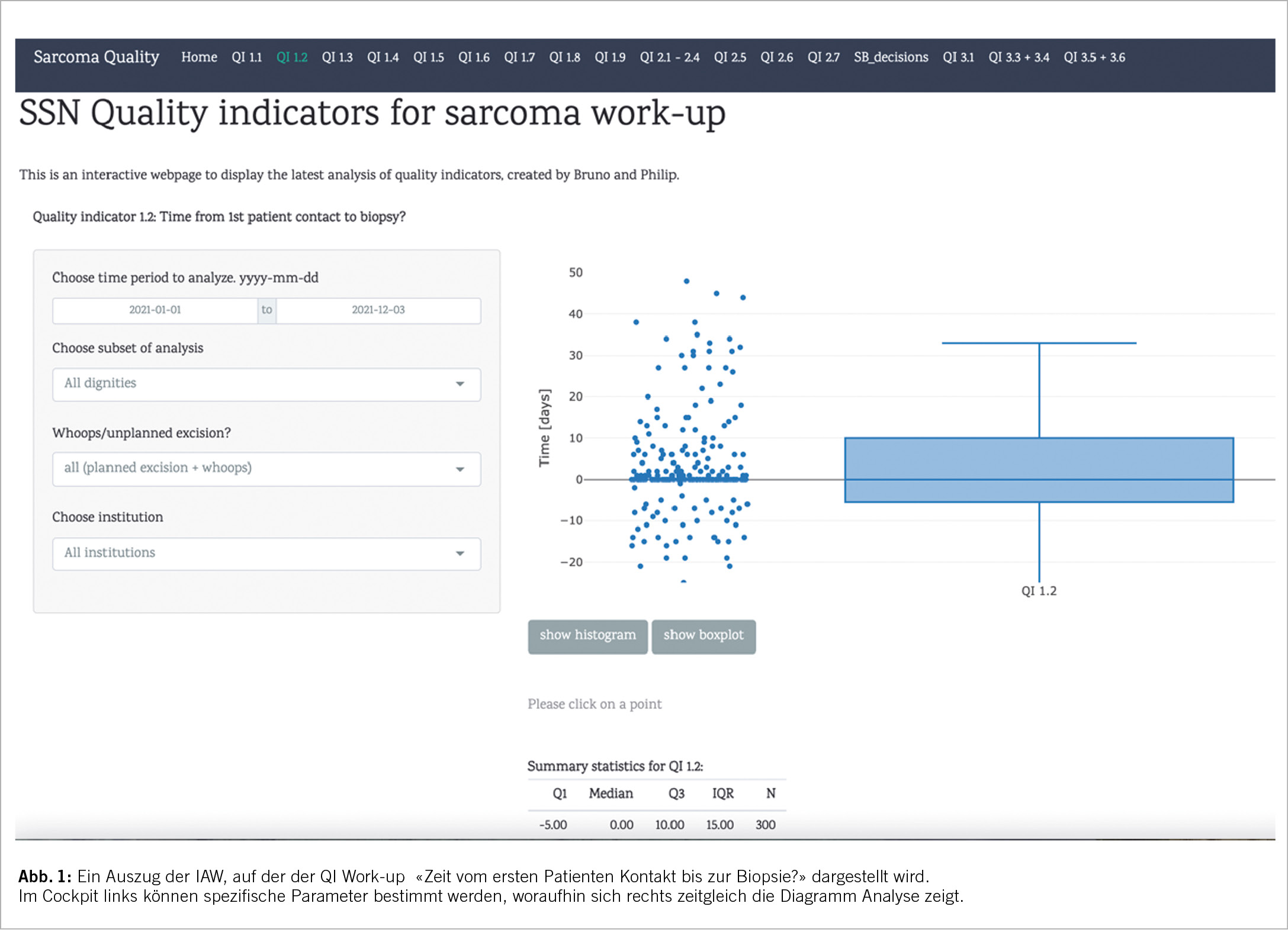
Eine integrierte IT-Plattform zur Erfassung von strukturierten Daten bildet die Grundvoraussetzung, um RTWD unabhängig von der Geografie und gleichzeitig aus mehreren Institutionen abzubilden. Das SSN kooperiert mit Adjumed Services Zurich, ein digitaler Anbieter mit jahrzehntelanger Erfahrung, der die Standards der Datensicherheit erfüllen und verantworten kann. Das AdjumedCollect bildet die Basis, aufgrund derer die Analysen auf einer interaktiven Website (IAW) abgebildet werden können. Unter einer IAW verstehen wir eine Website, auf der der Sarkom Experte eine Auswahl von definierten Parametern betreffend eines spezifischen Kollektivs frei wählen kann und sich die entsprechende Grafik der korrespondierenden Datenanalyse im Form eines Diagrammes sofort darstellt, mit direktem Zugang zu den Rohdaten zur Kontrolle und Überprüfung (Abb. 1).
Um die Korrektheit der Daten zu überprüfen, wurde eine IAW für fehlende Daten konstruiert. Damit können potentiell fehlende Daten sofort identifiziert und komplettiert werden. Das Herzstück bildet die IAW für die oben aufgeführten Qualitätsindikatoren. Hierbei können auf Knopfdruck deskriptive Analysen von Qualitätsindikatoren eines Kollektivs nach Zeitperiode, nach Dignität, Diagnose, anatomische Lokalisation, Erst- und follow-up Vorstellung, geplante versus ungeplante Resektionen sowie nach Institutionen dargestellt werden. Eine weitere IAW wird für die Kostenerfassung erstellt. Hierbei kann für jede Intervention und z.B. MDT-SB Vorstellung ein «Kostenschild» zugeordnet werden, wodurch die effektiven Kosten für die medizinische Leistung für jeden einzelnen Patienten über den gesamten Behandlungszyklus ermittelt werden können. Zudem wurde eine IAW für PROMS/PREMS erstellt, auf der aktuell insgesamt 9 Fragebogen digital erfasst sind und welche die Patienten z.B. vorgängig zu einer Konsultation auf einem iPad ausfüllen können. Mittlerweile verwenden wir diese routinemässig im Alltag und erfassen alle konsekutiven Patienten. Eine weitere IAW wurde aufgebaut, auf der ein Cockpit erlaubt, eine RTWD Darstellung der PROMS z.B. in Form eines Radar charts direkt zu visualisieren. Selbstverständlich sind alle diese Information mit den Daten des SwissSarcomaRegistry verknüpft, sodass eine holistische Analyse mit allen klinischen metrischen Parametern verknüpft erfolgen kann.
Erwartungen
Die konsekutive, transparente Erfassung eines kompletten Kollektivs von Sarkom Patienten in Form von strukturierten Daten von Qualitätsindikatoren longitudinal über den gesamten Behandlungsverlauf in Echtzeit eröffnet bisher unvorstellbare Möglichkeiten. Diese erlauben, die verschiedenen Abklärungs- und Behandlungsarten in absoluter Zahl zu erfassen, wodurch die Wertigkeit einer Therapie bezogen auf den einzelnen Patienten erstmals definiert und zudem finanziell in Relation zur Behandlungsqualität ausgewiesen werden kann. Dies wird nicht-optimale oder unnötige Behandlungen eliminieren und die Qualität der Behandlung zu definierten Kosten verbessern.
Strukturierte Daten der Behandlung von Sarkompatienten bilden die Grundlage für eine prädiktive Analyse. Mit Hilfe von Machine Learning Algorithmen sowie statistischen Methoden erlauben sie im Kollektiv grundsätzlich eine Aussage betreffend Prognose für einen einzelnen Patienten. Darüber hinaus wird es möglich sein, für jeden Einzelfall Analysen einzelner Therapieschritte zu generieren und aufgrund derer den bestmöglichen Therapieweg für den einzelnen Patienten gezielt auszuwählen. Darauf wird schlussendlich die personalisierte Medizin begründet werden können.
fuchs@sarcoma.surgery
Auf Anfrage beim Verfasser.










 Nach dreijähriger Tätigkeit als CEO hat sich PD Dr. Dr. Martin Reist entschieden die SAKK zu verlassen. Er hat dank einer erfolgreich abgeschlossenen Sanierung die Existenz der SAKK nachhaltig gesichert und deren Leistungsauftrag sichergestellt. Zusammen mit dem Vorstand und seinem Mitarbeiterteam am Koordinationszentrum hat er die SAKK erfolgreich neu strukturiert und weiterentwickelt. Der Vorstand dankt ihm für seinen grossen Einsatz.
Nach dreijähriger Tätigkeit als CEO hat sich PD Dr. Dr. Martin Reist entschieden die SAKK zu verlassen. Er hat dank einer erfolgreich abgeschlossenen Sanierung die Existenz der SAKK nachhaltig gesichert und deren Leistungsauftrag sichergestellt. Zusammen mit dem Vorstand und seinem Mitarbeiterteam am Koordinationszentrum hat er die SAKK erfolgreich neu strukturiert und weiterentwickelt. Der Vorstand dankt ihm für seinen grossen Einsatz.