Konventionelle Herzschrittmacher besitzen Elektroden, die über lange Kabel mit dem Schrittmacheraggregat verbunden sind. Diese Kabel stellen die Achillesferse herkömmlicher Systeme dar und können Komplikationen verursachen. Die Implantationsrate von kabellosen Schrittmachern nimmt daher rasch zu. Der folgende Beitrag gibt eine Übersicht über Vor- und Nachteile kabelloser Systeme, Indikationen, Implantationsablauf, Patientennachsorge und mögliche Zukunftsperspektiven.
Konventionelle Schrittmacher – sind wir am Ende einer Erfolgsgeschichte?
Bereits wenige Jahre nach der Erstimplantation eines voll implantierbaren Herzschrittmachers 1958 hatte sich die Schrittmachertherapie als Methode der Wahl zur Behandlung bradykarder Rhythmusstörungen etabliert. Technische Neuerungen in den kommenden Jahren verbesserten die therapeutischen Möglichkeiten rasch. Die aufgrund der beschränkten Energiespeicherkapazität initial noch kurze Lebensdauer der Geräte vergrösserte sich mit Lithium-basierter Batteriechemie. Mikroprozessor-basierte elektronische Schaltungen und drahtlose Programmierbarkeit erlaubten patientenspezifische Optimierungen. Beschleunigungssensoren und andere Sensoren ermöglichten mit der «rate-response» eine physiologischere Stimulation des Herzens. Die Implementierung eines zusätzlichen Kabels im Rahmen der Resynchronisationstherapie gestattete auch die Stimulation des linken Ventrikels in Patienten mit Herzinsuffizienz. Moderne Aggregate verfügen über vielfältigste Funktionen. Automatische Optimierungen von Stimulationsoutput (zum Energiesparen), Herzinsuffizienz- und Schlafapnoemonitoring oder Fernüberwachung der Gerätefunktion zuhause repräsentieren nur einen kleinen Teil der heute verfügbaren Möglichkeiten.
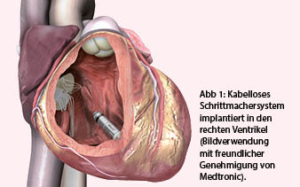
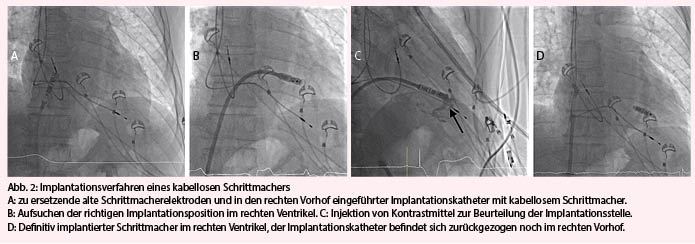
Trotzdem besitzen heutige konventionelle Systeme gewichtige Nachteile. Nebst der endlichen Lebensdauer der Geräte aufgrund limitierter Batteriereserven sind insbesondere die Schrittmacherkabel eine Achillesferse. Die Komplikationsrate nach Schrittmacherimplantation ist erheblich. Bereits zwei Monate nach Implantation erleiden mehr als 10% aller Patienten eine Komplikation, am häufigsten bedingt durch die Schrittmacherkabel (1). Initial handelt es sich oft um Kabeldislokationen, im Laufe der Zeit mehren sich Isolationsdefekte und Kabelbrüche (vgl. auch Fallbeschreibung zu Abb. 2). Es liegt daher auf der Hand, durch Vermeidung von Kabeln und Entwicklung von kabellosen Schrittmachern diese Komplikationen zu umgehen. Der Grundgedanke besteht darin, dass das ganze Schrittmachersystem in den rechten Ventrikel eingeführt wird und somit keine Kabel mehr notwendig sind (Abb. 1).
Kabellose Schrittmacher – die aktuelle Studienlage
Die ersten Patienten, bei denen kabellos der Herzmuskel stimuliert wurde, waren Empfänger eines Gerätes zur kardialen Resynchronisation (CRT). Es handelte sich bei den implantierten Geräten nicht um eigentliche Schrittmacher, sondern lediglich um einen kleinen piezoelektrischen Wandler. Dieser konvertierte im linken Ventrikel einen von aussen zugeführten Ultraschallpuls in einen elektrischen Stimulationspuls (2). Der Ultraschallpulsgenerator wird dabei zusätzlich zum CRT-Generator subkutan implantiert. Im Rahmen der WiSE-CRT-Studie wurde dieses Gerät 13 von 17 Patienten erfolgreich implantiert. Es kam jedoch zu drei Perikard-
ergüssen, einer der betroffenen Patienten verstarb (3). Die Studie wurde daher vorzeitig gestoppt. Auch die später publizierte SELECT-LV-Studie zeigte mit 8.6% eine hohe Anzahl an Akutkomplikationen nach Implantation des Gerätes (4). Der Hersteller des WiSE-CRT®-Systems (EBR Systems) modifizierte daraufhin das Implantat – konklusive Resultate zu diesem Device stehen aus.
Die erste Implantation eines kompletten kabellosen Schrittmachers im Menschen wurde 2012 durchgeführt. 2014 wurden im Rahmen der LEADLESS-Studie Resultate zu 33 Patienten publiziert (5). Sicherheit und Implantationserfolg des ersten kabellosen Schrittmachers (Nanostim®, Abbott) wurden dabei untersucht. In 32 von 33 Patienten war die Implantation erfolgreich, bei einem Patienten kam es zu einer Myokardperforation, an deren Komplikationen der Patient verstarb. In der nachfolgenden multizentrischen LEADLESS II-Studie wurden 526 Patienten nach Nanostim®-Implantation untersucht. Nach sechs Monaten konnten bei 6.7% der Patienten schwerwiegende Komplikationen beobachtet werden (darunter u. a. 1.6% kardiale Perforationen, 1.1% Dislokationen, 1.2% vaskuläre Komplikationen, und 0.8% interventionsbedürftige Reizschwellenerhöhungen) (6). Nach mehreren Todesfällen wurde die weitere Implantation des Gerätes zunächst kurzzeitig gestoppt. Im weiteren Verlauf wurden dann Batterieprobleme mit komplettem Deviceversagen beobachtet, was im Herbst 2016 zu einem weltweiten Implantationsstopp dieser Geräte führte.
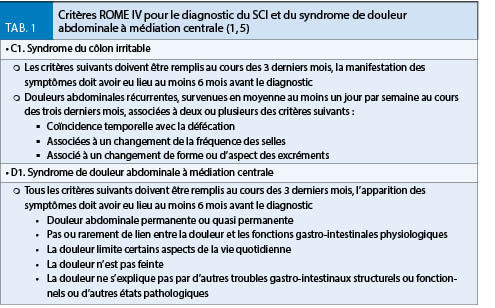
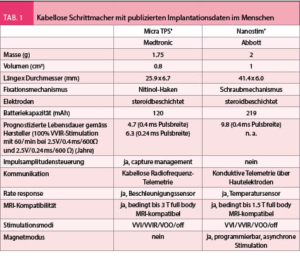
LEADLESS I und II hatten gezeigt, dass kabellose Schrittmacher funktionieren und die Implantation einfach möglich ist, das Gerät hatte aber ernsthafte Probleme verursacht. Eine grössere Studie zu einem kabellosen Schrittmacher eines anderen Herstellers wurde 2016 publiziert. Es handelte sich dabei um eine prospektive multizentrische Studie, welche die Sicherheit des Micra TPS® (Medtronic) in 725 Patienten untersuchte (7). Auch dieses Gerät schien einfach implantierbar zu sein und gute Stimulationsparameter zu erzielen. 25 Patienten (3.4%) entwickelten akute Komplikationen (ein Todesfall, 1.6% kardiale Perforationen, keine Dislokationen). Verglichen mit einer historischen Kontrollgruppe mit konventionellen Schrittmachern war die Komplikationsrate der kabellosen Geräte signifikant geringer. Die Resultate dieser Studie konnten im Rahmen einer weltweiten Registerstudie bestätigt werden (8). Das Micra TPS® konnte in 99.6% der Patienten erfolgreich implantiert werden. Im ersten Monat nach Implantation wurden in 1.51% der Patienten ernste Komplikationen beschrieben (darunter 0.13% Perforationen, 0.13% Dislokationen). Die Rate an schwerwiegenden Komplikationen lag damit tendenziell sogar leicht tiefer als in den initialen Studien zum Micra TPS®. Dieser kabellose Schrittmacher ist derzeit als einziger frei erhältlich und in Europa zugelassen. Weltweit haben mittlerweile gegen 20 000 Patienten diesen Schrittmacher erhalten. Einen Überblick über die technischen Spezifikationen des Micra TPS® und Nanostim® liefert (Tab. 1).
Kabellose Schrittmacher – Implantationsablauf und Besonderheiten in der Nachsorge
Im Gegensatz zu konventionellen Schrittmachern werden kabellose Aggregate ganz in den rechten Ventrikel eingeführt. Dazu wird in Lokalanästhesie (ggf. Sedation) die V. femoralis punktiert, nach einer kleinen Hautinzision der Zugangsweg schrittweise aufgedehnt und schliesslich eine 27-F-Schleuse (Aussendurchmesser) in der Vene platziert. Dadurch wird anschliessend unter Durchleuchtung das ganze Schrittmachersystem mittels eines steuerbaren Katheters via V. cava inferior in die rechte Herzkammer eingeführt (Abb. 2A und 2B). Nach präferenziell septaler Platzierung – allenfalls unter Zuhilfenahme von Kontrastmittel zur RV-Ventrikulografie (Abb. 2C) – wird der Schrittmacher durch ein Fixationssystem (Haken oder Schraubmechanismus) am Myokard fixiert. Die mechanische Fixierung wird mittels sanftem Zug überprüft. Nach Kontrolle der üblichen Stimulationsparameter kann der immer noch am Katheter fixierte Schrittmacher definitiv freigelassen oder umplatziert werden (Abb. 2D). Die femoral eingeführte Schleuse wird schliesslich entfernt und die Hautinzision mit einer Z-Naht verschlossen.
Nach Implantation kann der Patient auf einer intermediate care unit oder einer Normalstation mit geschultem Personal weiter überwacht werden. Einer ambulanten Implantation stehen wir sehr zurückhaltend gegenüber, da es auch Stunden später noch zu einer lebensbedrohlichen Perikardtamponade kommen kann. Einige Stunden nach Implantation kann der Patient mobilisiert werden. Üblicherweise führen wir am Folgetag eine Optimierung der Frequenzadaptierung durch Anpassung des Beschleunigungssensor-Vektors durch. Auch die Z-Naht kann meist bereits entfernt und durch einen Verband ersetzt werden. Auf das Heben schwerer Lasten und Benetzen der Wunde sollte in den Folgetagen verzichtet werden, ansonsten sind keine spezifischen Vorsichtsmassnahmen er-forderlich. Wie üblich erfolgt nach Einheilung des Schrittmachers nach ca.
2 Monaten die erste ambulante Kontrolle, die später in jährlichem Abstand wiederholt wird. Patienten mit kabellosem Schrittmacher lassen sich nach Abheilung der inguinalen Punktionsstelle nicht mehr klinisch identifizieren. Das Gerät kann im Thoraxröntgenbild jedoch noch ausgemacht werden (Abb. 2d). Sämtliche bislang in den Menschen implantierbaren Schrittmacher sind bedingt MRI-kompatibel. Sie müssen aber wie konventionelle Schrittmacher vor und nach der Bildgebung umprogrammiert werden. Auch ist ein MRI erst 6 Wochen nach Implantation zulässig.
Kabellose Schrittmacher – für welchen Patienten?
Bei welchen Patienten sollte nun – bei bestehender Schrittmacherindikation – die Implantation eines kabellosen Schrittmachers erwogen werden? Die 2013 publizierten Guidelines der Europäischen Gesellschaft für Kardiologie machen noch keine Aussagen dazu (9). Werden sie sinngemäss angewendet, stellen kabellose Schrittmacher in erster Linie eine Option dar bei Patienten mit AV-Block und Vorhofflimmern. Gemäss einer multinationalen Umfrage ist dies nebst venösen Zugangsproblemen (z.B. Verschluss der Vv. subcaviae, Dialysekatheter) und Komplikationen nach konventioneller Schrittmachereinlage tatsächlich die häufigste Implantationsindikation (10). Eine mechanische Trikuspidalklappe, ein V. cava-Filter und morbide Adipositas mit einem erwarteten Abstand des Gerätes zum Programmierkopf > 12.5 cm stellen Kontraindikationen zur Implantation dar.
Kabellose Herzschrittmacher – Limitationen und Zukunftsperspektiven
Bei den derzeitig verfügbaren kabellosen Schrittmachern handelt es sich nur um 1-Kammerschrittmacher zur Implantation in den rechten Ventrikel. Die Indikationen zur Implantation solcher Systeme sind limitiert (9), die überwiegende Zahl der heute implantierten konventionellen Schrittmacher sind 2-Kammerschrittmacher oder Resynchronisationsgeräte. Entsprechend werden grosse Anstrengungen unternommen, kabellose Geräte mit VDDR- oder DDDR-Modi zu entwickeln. Diese Programmiermodi erlauben die Detektion der Vorhofaktion und eine entsprechend darauf abgestimmte Schrittmacherstimulation des Ventrikels. Im DDDR-Modus würde sogar eine Vorhofstimulation ermöglicht. Zur Entwicklung genannter Modi werden verschiedene Ansätze verfolgt. Eine Wahrnehmung der aktiven mechanischen Vorhofaktion (A-Welle) scheint theoretisch mit einem Beschleunigungssensor des im rechten Ventrikel sitzenden kabellosen Geräts möglich. Dieser Ansatz wurde im Rahmen der MASS- und MARVEL-Studien untersucht. Es zeigt sich, dass das Konzept grundsätzlich funktioniert, sich damit aber derzeit während lediglich 87% aller Herzschläge eine gewisse VDD-Stimulation erzielen lässt (11). Sollte zusätzlich auch eine Vorhofstimulation gewünscht sein, müsste auch dort noch ein Gerät implantiert werden. Aufgrund der teilweise äusserst geringen Wanddicke des rechen Vorhofs stellt die sichere und komplikationsarme Verankerung eines Gerätes ebendort eine grosse Herausforderung dar. Schliesslich müssten zwei (oder sogar mehrere) kabellose Geräte im Herzen drahtlos miteinander kommunizieren können. Konventionelle Radiofrequenz-Telemetrie scheint dazu aufgrund des relativ hohen Energieverbrauchs nicht geeignet. Eine mögliche Alternative stellt die «intra-body-communication» dar, die die elektrische Leitfähigkeit von Gewebe und Blut nutzt. Dabei werden kurzzeitige hochfrequente Wechselstromimpulse an Myokard und Blut abgegeben, was eine sehr energiesparende, schnelle und bidirektionale Kommunikation erlaubt (12). Kürzlich konnten in Tierversuchen mit dieser Technologie erstmals erfolgreich kabellose Zweikammerschrittmacher implantiert werden.
Universitätsklinik für Kardiologie
Inselspital
3010 Bern
Universität Bern
andres.haeberlin@artorg.unibe.ch
Universitätsklinik für Kardiologie
Inselspital
3010 Bern
Leitende Ärztin Rhythmologie und Elektrophysiologie
Universitätsklinik für Kardiologie
Inselspital
Freiburgstrasse
3010 Bern
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel.
Literatur
1. Udo, E.O., et al., Incidence and predictors of short- and long-term complications in pacemaker therapy: the FOLLOWPACE study. Heart Rhythm, 2012. 9(5): p. 728-35.
2. Auricchio, A., et al., First-in-man implantation of leadless ultrasound-based cardiac stimulation pacing system: novel endocardial left ventricular resynchronization therapy in heart failure patients. Europace, 2013. 15(8): p. 1191-7.
3. Auricchio, A., et al., Feasibility, safety, and short-term outcome of leadless ultrasound-based endocardial left ventricular resynchronization in heart failure patients: results of the wireless stimulation endocardially for CRT (WiSE-CRT) study. Europace, 2014. 16(5): p. 681-8.
4. Reddy, V.Y., et al., Cardiac Resynchronization Therapy With Wireless Left Ventricular Endocardial Pacing: The SELECT-LV Study. J Am Coll Cardiol, 2017. 69(17): p. 2119-2129.
5. Reddy, V.Y., et al., Permanent leadless cardiac pacing: results of the LEADLESS trial. Circulation, 2014. 129(14): p. 1466-71.
6. Reddy, V.Y., et al., Percutaneous Implantation of an Entirely Intracardiac Leadless Pacemaker. N Engl J Med, 2015. 373(12): p. 1125-35.
7. Reynolds, D., et al., A Leadless Intracardiac Transcatheter Pacing System. N Engl J Med, 2016. 374(6): p. 533-41.
8. Roberts, P.R., et al., A leadless pacemaker in the real-world setting: The Micra Transcatheter Pacing System Post-Approval Registry. Heart Rhythm, 2017. 14(9): p. 1375-1379.
9. Brignole, M., et al., 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: the Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Eur Heart J, 2013. 34(29): p. 2281-329.
10. Boveda, S., et al., Use of leadless pacemakers in Europe: results of the European Heart Rhythm Association survey. Europace, 2018. 20(3): p. 555-559.
11. Chinitz, L., et al., Accelerometer-based atrioventricular synchronous pacing with a ventricular leadless pacemaker: Results from the Micra atrioventricular feasibility studies. Heart Rhythm, 2018.
12. Bereuter L., et al., Leadless dual-chamber pacing – a novel communication
method for wireless pacemaker synchronization. JACC Basic to Translational
Science, accepted.






 Das Prinzip der Inhibition von PCSK9 wurde von der Industrie aufgenommen und innerhalb von 10 Jahren konnten 2 Medikamente auf der Basis von monoklonalen Antikörpern gegen PCSK9 entwickelt werden (Alirocumab von Sanofi-Aventis und Evolocumab von Amgen). Prof. Mach erinnerte an die im letzten Jahr veröffentlichte FOURIER-Studie mit Evolocumab, eine Studie mit mehr als 27 000 Patienten, die randomisiert mit der höchsten verträglichen Statindosis mit oder ohne Zusatz von Evolocumab behandelt wurden. Nach 36 Monaten Behandlungsdauer wurde der primäre Endpunkt (kardiovaskulärer Tod, Myokardinfarkt, Schlaganfall, Hospitalisierung wegen instabiler Angina oder koronare Revaskularisierung) in der Evolocumabgruppe um relative 15% gesenkt (absolute Risikosenkung 2%). Der sekundäre Endpunkt (kardiovaskulärer Tod, Myokardinfarkt und Schlaganfall) wurde um 20% gesenkt. 1400 Patienten erreichten LDL-Werte unterhalb 0.4mmol/l. Diese Patienten hatten sogar eine grössere Risikosenkung (LDL-C ≥ 2.6 mmol / l: HR 0.69, LDL <0.26 mmol / l: HR 0.59). Die Sicherheit unterschied sich unter den 2 Patientengruppen nicht. Der Referent zeigte zusätzlich Daten zur kognitiven Funktion mit Statinen und mit Evolocumab. In beiden Fällen zeigte sich kein Unterschied zur Placebogruppe. Prof. Mach erinnerte auch an die SPIRE-Studie mit Bococizumab, einem humanisierten, nicht vollhumanen Antikörper. In SPIRE 1 mit LDL-C-Ausgangswerten > 70 mg / dl wurde kein Unterschied im primären Endpunkt beobachtet, in PIRE-2 bei Ausgangswerten > 100mg / dl eine 21%- ige Reduktion. Die Behandlung mit Bococizumab ging aber mit dem Auftreten von Anti-Medikamenten-Antikörpern einher, die zu einer Einschränkung der LDL-Senkung führten.
Das Prinzip der Inhibition von PCSK9 wurde von der Industrie aufgenommen und innerhalb von 10 Jahren konnten 2 Medikamente auf der Basis von monoklonalen Antikörpern gegen PCSK9 entwickelt werden (Alirocumab von Sanofi-Aventis und Evolocumab von Amgen). Prof. Mach erinnerte an die im letzten Jahr veröffentlichte FOURIER-Studie mit Evolocumab, eine Studie mit mehr als 27 000 Patienten, die randomisiert mit der höchsten verträglichen Statindosis mit oder ohne Zusatz von Evolocumab behandelt wurden. Nach 36 Monaten Behandlungsdauer wurde der primäre Endpunkt (kardiovaskulärer Tod, Myokardinfarkt, Schlaganfall, Hospitalisierung wegen instabiler Angina oder koronare Revaskularisierung) in der Evolocumabgruppe um relative 15% gesenkt (absolute Risikosenkung 2%). Der sekundäre Endpunkt (kardiovaskulärer Tod, Myokardinfarkt und Schlaganfall) wurde um 20% gesenkt. 1400 Patienten erreichten LDL-Werte unterhalb 0.4mmol/l. Diese Patienten hatten sogar eine grössere Risikosenkung (LDL-C ≥ 2.6 mmol / l: HR 0.69, LDL <0.26 mmol / l: HR 0.59). Die Sicherheit unterschied sich unter den 2 Patientengruppen nicht. Der Referent zeigte zusätzlich Daten zur kognitiven Funktion mit Statinen und mit Evolocumab. In beiden Fällen zeigte sich kein Unterschied zur Placebogruppe. Prof. Mach erinnerte auch an die SPIRE-Studie mit Bococizumab, einem humanisierten, nicht vollhumanen Antikörper. In SPIRE 1 mit LDL-C-Ausgangswerten > 70 mg / dl wurde kein Unterschied im primären Endpunkt beobachtet, in PIRE-2 bei Ausgangswerten > 100mg / dl eine 21%- ige Reduktion. Die Behandlung mit Bococizumab ging aber mit dem Auftreten von Anti-Medikamenten-Antikörpern einher, die zu einer Einschränkung der LDL-Senkung führten. Die Ablehnung erfolgte beispielsweise weil die Dosierung von Atorvastatin nur 40 mg statt der Maximaldosis von 80 mg (schlecht ertragen wegen Muskelproblemen) entsprach oder weil das LDL-Cholesterin 3.44 mmol / l statt der geforderten 3.5 mmol / l betrug.
Die Ablehnung erfolgte beispielsweise weil die Dosierung von Atorvastatin nur 40 mg statt der Maximaldosis von 80 mg (schlecht ertragen wegen Muskelproblemen) entsprach oder weil das LDL-Cholesterin 3.44 mmol / l statt der geforderten 3.5 mmol / l betrug. Die RNAs, die man auch als Therapie entwickelt hat, sind die sogenannten SiRNAs, interference RNAs, die mit sehr kleinen Mengen ein Protein praktisch ausschalten können, so der Referent. Um diese RNAs in den Körper zu bringen muss man sie so verändern, dass sie nicht gleich von den RNAs abgebaut werden können. Man muss zudem das RNA Molekül derart verändern, dass keine Immunreaktion stattfindet. Ferner muss die RNA in die Zelle kommen. Der entsprechende Mechanismus erfolgt über Rezeptoren die präferentiell ein Protein, das sich GalNac nennt erkennen. Entsprechend wurde GalNac an die RNA gekoppelt. Dadurch wird das Konjugat RNA-GalNac spezifisch anerkannt und in die Leberzelle aufgenommen. Der Referent wandte sich nun dem ORION-Programm zu, einem Programm, das zum Ziel die Blockierung der PCSK9-Synthese hat, das bislang am weitesten in der Medizin fortgeschritten ist. Das entsprechende Molekül umfasst ein 23 Basenpaare langes Stück, welches ein kleines GalNac Molekül vorne dran hat, welches die Aufnahme in die Leberzelle ermöglicht. Dieses RNA-Molekül bindet dann in der Zelle an einen sogenannten RISC Komplex (RNA –induced silencing complex), der die mRNA degradiert, sodass das PCSK9 Protein nicht mehr entstehen kann. Das kleine modifizierte RNA-GalNac Molekül bleibt immer aktiv, was die lange Wirkungsdauer dieser Therapie erklärt und sie entsprechend attraktiv macht. Prof. Landmesser zeigte erste Phase-I-Studien mit dem PCSK9-siRNA Inclisiran. Mit einer Injektion von Inclisiran konnte der LDL-Spiegel am 180. Tag um 35.5–52.6 % gesenkt werden. In einer Phase-II-Studie wurde die Wirkung von 2 Startdosen von Inclisiran 300 mg untersucht. Dabei zeigte sich nach 270 Tagen eine LDL-Senkung von 40%, die mittlere Senkung über 6 Monate betrug 51%. Inclisiran wird nun im ORION Programm in insgesamt 12 Studien an verschiedenen Populationen weiter untersucht.
Die RNAs, die man auch als Therapie entwickelt hat, sind die sogenannten SiRNAs, interference RNAs, die mit sehr kleinen Mengen ein Protein praktisch ausschalten können, so der Referent. Um diese RNAs in den Körper zu bringen muss man sie so verändern, dass sie nicht gleich von den RNAs abgebaut werden können. Man muss zudem das RNA Molekül derart verändern, dass keine Immunreaktion stattfindet. Ferner muss die RNA in die Zelle kommen. Der entsprechende Mechanismus erfolgt über Rezeptoren die präferentiell ein Protein, das sich GalNac nennt erkennen. Entsprechend wurde GalNac an die RNA gekoppelt. Dadurch wird das Konjugat RNA-GalNac spezifisch anerkannt und in die Leberzelle aufgenommen. Der Referent wandte sich nun dem ORION-Programm zu, einem Programm, das zum Ziel die Blockierung der PCSK9-Synthese hat, das bislang am weitesten in der Medizin fortgeschritten ist. Das entsprechende Molekül umfasst ein 23 Basenpaare langes Stück, welches ein kleines GalNac Molekül vorne dran hat, welches die Aufnahme in die Leberzelle ermöglicht. Dieses RNA-Molekül bindet dann in der Zelle an einen sogenannten RISC Komplex (RNA –induced silencing complex), der die mRNA degradiert, sodass das PCSK9 Protein nicht mehr entstehen kann. Das kleine modifizierte RNA-GalNac Molekül bleibt immer aktiv, was die lange Wirkungsdauer dieser Therapie erklärt und sie entsprechend attraktiv macht. Prof. Landmesser zeigte erste Phase-I-Studien mit dem PCSK9-siRNA Inclisiran. Mit einer Injektion von Inclisiran konnte der LDL-Spiegel am 180. Tag um 35.5–52.6 % gesenkt werden. In einer Phase-II-Studie wurde die Wirkung von 2 Startdosen von Inclisiran 300 mg untersucht. Dabei zeigte sich nach 270 Tagen eine LDL-Senkung von 40%, die mittlere Senkung über 6 Monate betrug 51%. Inclisiran wird nun im ORION Programm in insgesamt 12 Studien an verschiedenen Populationen weiter untersucht. Heute erfolgt die Standardtherapie der Antikoagulation mit NOAKs. Dies aufgrund der Megatrials mit Rivaroxaban, Dabigatran und Apixaban. Dabei sind 3 Punkte für den Referenten wichtig: einmal haben wir eine bessere Wirkung. Sie ist nicht massiv aber relevant besser. Wir haben aber vor allem eine deutlich bessere Sicherheit. Das dritte geht in Richtung Gesamtbenefit: Wir haben auch eine Reduktion der Gesamtmortalität. Frühe Erfahrungen mit Stents haben gezeigt, dass Aspirin zur Prävention der Stentthrombosen nicht genügt. Die zusätzliche Antikoagulation zeigte, dass damit auch im arteriellen Bereich eine positive Wirkung erzielt wird. In den 90iger Jahren kam das Konzept der dualen Plättchenhemmung mit Aspirin und Ticlopidin. Ticlopidin wurde etwas später durch Clopidogrel ersetzt. Clopidogrel ergab eine deutliche Reduktion der kardiovaskulären Ereignisse gegenüber Aspirin allein. Danach kamen die besseren Plättchenhemmer, beginnend mit Prasugrel und fast gleichzeitig Ticagrelor, welche gegenüber Aspirin deutlich weniger kardiovaskuläre Ereignisse zeigten. Prasugrel hatte gewisse Blutungskomplikationen, weshalb es heute nicht mehr so häufig eingesetzt wird. Die zusätzliche Gabe von NOAKs beim akuten Koronarsyndrom ergab aber in der APPRAISE-Studie mit Apixaban, welches zusätzlich zu Clopidogrel und Aspirin gegeben (oder nicht gegeben) wurde, keinen Unterschied bezüglich Wirksamkeit, aber massiv mehr Blutungen. Die Studie wurde vorzeitig abgebrochen. Der zweite Versuch wurde mit Rivaroxaban in tiefer Dosierung (5 mg) oder sehr tiefer Dosierung (2.5 mg), allerdings 2 x täglich in der ATLAS ACS 2 - TIMI 51-Studie unternommen. Die Rivaroxaban-Gruppe hatte ein tieferes kardiovaskuläres Risiko, vergleichbar mit den früheren Daten der Plättchenhemmer. Die Antikoagulation «später» nach Infarkt ergab ein signifikant längeres ereignisloses Überleben unter Warfarin plus Aspirin vs. Warfarin allein, wobei Warfarin allein besser war als Aspirin allein. Es gab massiv mehr Blutungen, aber der INR Zielwert lag zwischen 2.8 und 4.2 und man weiss, dass Blutungen ab INR 3. 4 exponentiell zunehmen. Die Studie hat aber gezeigt, dass grundsätzlich auch im arteriellen System die Prävention mit Antikoagulation funktioniert. Dies führte zur Anwendung von Rixaroxaban 2. 5 mg bid + Aspirin 100 mg od vs. Rivaroxaban 5 mg bid vs. Aspirin 100 mg od in der COMPASS Studie bei stabiler KHK bzw. PAVK. Die Studie wurde wegen der überlegenen Wirksamkeit von Rivaroxaban + Aspirin gegenüber den beiden anderen Armen vorzeitig abgebrochen. Der Effekt war dabei vor allem auf Schlaganfall. Es wurden in dieser Studie etwas mehr Blutungen in der Kombinationsgruppe aber auch in der Warfaringruppe gegenüber Aspirin beobachtet. Der Ort der Blutungen war vor allem gastrointestinal. Der netto klinische Benefit dieser Kombinationstherapie bei stabiler KHK ist indessen eine relative Risikoreduktion des Komposit-Endpunkts kardiovaskulärer Tod, Schlaganfall, tödliche Blutung oder symptomatische Blutungen in kritische Organe beträgt 20% (p < 0.001). Das Risiko für Gesamtmortalität wurde um 18% gesenkt (p 0.01). Die Autoren hatten aber eine präspezifizierte Signifikanz von 0.025 gefordert.
Heute erfolgt die Standardtherapie der Antikoagulation mit NOAKs. Dies aufgrund der Megatrials mit Rivaroxaban, Dabigatran und Apixaban. Dabei sind 3 Punkte für den Referenten wichtig: einmal haben wir eine bessere Wirkung. Sie ist nicht massiv aber relevant besser. Wir haben aber vor allem eine deutlich bessere Sicherheit. Das dritte geht in Richtung Gesamtbenefit: Wir haben auch eine Reduktion der Gesamtmortalität. Frühe Erfahrungen mit Stents haben gezeigt, dass Aspirin zur Prävention der Stentthrombosen nicht genügt. Die zusätzliche Antikoagulation zeigte, dass damit auch im arteriellen Bereich eine positive Wirkung erzielt wird. In den 90iger Jahren kam das Konzept der dualen Plättchenhemmung mit Aspirin und Ticlopidin. Ticlopidin wurde etwas später durch Clopidogrel ersetzt. Clopidogrel ergab eine deutliche Reduktion der kardiovaskulären Ereignisse gegenüber Aspirin allein. Danach kamen die besseren Plättchenhemmer, beginnend mit Prasugrel und fast gleichzeitig Ticagrelor, welche gegenüber Aspirin deutlich weniger kardiovaskuläre Ereignisse zeigten. Prasugrel hatte gewisse Blutungskomplikationen, weshalb es heute nicht mehr so häufig eingesetzt wird. Die zusätzliche Gabe von NOAKs beim akuten Koronarsyndrom ergab aber in der APPRAISE-Studie mit Apixaban, welches zusätzlich zu Clopidogrel und Aspirin gegeben (oder nicht gegeben) wurde, keinen Unterschied bezüglich Wirksamkeit, aber massiv mehr Blutungen. Die Studie wurde vorzeitig abgebrochen. Der zweite Versuch wurde mit Rivaroxaban in tiefer Dosierung (5 mg) oder sehr tiefer Dosierung (2.5 mg), allerdings 2 x täglich in der ATLAS ACS 2 - TIMI 51-Studie unternommen. Die Rivaroxaban-Gruppe hatte ein tieferes kardiovaskuläres Risiko, vergleichbar mit den früheren Daten der Plättchenhemmer. Die Antikoagulation «später» nach Infarkt ergab ein signifikant längeres ereignisloses Überleben unter Warfarin plus Aspirin vs. Warfarin allein, wobei Warfarin allein besser war als Aspirin allein. Es gab massiv mehr Blutungen, aber der INR Zielwert lag zwischen 2.8 und 4.2 und man weiss, dass Blutungen ab INR 3. 4 exponentiell zunehmen. Die Studie hat aber gezeigt, dass grundsätzlich auch im arteriellen System die Prävention mit Antikoagulation funktioniert. Dies führte zur Anwendung von Rixaroxaban 2. 5 mg bid + Aspirin 100 mg od vs. Rivaroxaban 5 mg bid vs. Aspirin 100 mg od in der COMPASS Studie bei stabiler KHK bzw. PAVK. Die Studie wurde wegen der überlegenen Wirksamkeit von Rivaroxaban + Aspirin gegenüber den beiden anderen Armen vorzeitig abgebrochen. Der Effekt war dabei vor allem auf Schlaganfall. Es wurden in dieser Studie etwas mehr Blutungen in der Kombinationsgruppe aber auch in der Warfaringruppe gegenüber Aspirin beobachtet. Der Ort der Blutungen war vor allem gastrointestinal. Der netto klinische Benefit dieser Kombinationstherapie bei stabiler KHK ist indessen eine relative Risikoreduktion des Komposit-Endpunkts kardiovaskulärer Tod, Schlaganfall, tödliche Blutung oder symptomatische Blutungen in kritische Organe beträgt 20% (p < 0.001). Das Risiko für Gesamtmortalität wurde um 18% gesenkt (p 0.01). Die Autoren hatten aber eine präspezifizierte Signifikanz von 0.025 gefordert. Dies führt zu 2 Mechanismen, einerseits zu einer Fibrinaktivierung also eine Aktivierung des Thrombinmechanismus und andrerseits der Aktivierung der Plättchen und diese beiden Mechanismen verstärken sich gegenseitig und führen dann zur Bildung des Thrombus, hielt Prof. Dr. med. Stephan Windecker, Bern, fest. Die Hemmung der Blutplättchenaggregation kann klassischerweise durch Aspirin geschehen, welches zu einer milden Aggregation führt oder durch die neueren P2Y12 Inhibitoren Clopidogrel, Prasugrel und Ticagrelor. Zwischen diesen Medikamenten bestehen wichtige Unterschiede im Wirkmechanismus. Clopidogrel braucht typischerweise 4-6 Stunden bis es seine volle therapeutische Wirkung entfaltet, während Prasugrel und Ticagrelor wesentlich schneller anfluten. Ein weiterer wichtiger Unterschied ist die Irreversibilität bei Prasugrel und Clopidogrel, während Ticagrelor reversibel ist. Die Geschichte der dualen Plättchenhemmung (DAPT) umfasst mittlerweile 2 Jahrzehnte, ihr Einsatz ist in Leitlinien festgelegt. In verschiedenen kleineren Studien hat sich gezeigt, dass diese Medikamente in der Risikosenkung für einen Mykoardinfarkt gegenüber dem damaligen Stand der dualen Antikoagulation und gegenüber der Monotherapie mit Aspirin effizienter sind.
Dies führt zu 2 Mechanismen, einerseits zu einer Fibrinaktivierung also eine Aktivierung des Thrombinmechanismus und andrerseits der Aktivierung der Plättchen und diese beiden Mechanismen verstärken sich gegenseitig und führen dann zur Bildung des Thrombus, hielt Prof. Dr. med. Stephan Windecker, Bern, fest. Die Hemmung der Blutplättchenaggregation kann klassischerweise durch Aspirin geschehen, welches zu einer milden Aggregation führt oder durch die neueren P2Y12 Inhibitoren Clopidogrel, Prasugrel und Ticagrelor. Zwischen diesen Medikamenten bestehen wichtige Unterschiede im Wirkmechanismus. Clopidogrel braucht typischerweise 4-6 Stunden bis es seine volle therapeutische Wirkung entfaltet, während Prasugrel und Ticagrelor wesentlich schneller anfluten. Ein weiterer wichtiger Unterschied ist die Irreversibilität bei Prasugrel und Clopidogrel, während Ticagrelor reversibel ist. Die Geschichte der dualen Plättchenhemmung (DAPT) umfasst mittlerweile 2 Jahrzehnte, ihr Einsatz ist in Leitlinien festgelegt. In verschiedenen kleineren Studien hat sich gezeigt, dass diese Medikamente in der Risikosenkung für einen Mykoardinfarkt gegenüber dem damaligen Stand der dualen Antikoagulation und gegenüber der Monotherapie mit Aspirin effizienter sind.