Erkrankungen der Gallenblase zählen zu den häufigsten Ursachen für Oberbauchbeschwerden und umfassen ein breites Spektrum von symptomatischen Gallensteinen über akute Cholezystitis bis hin zu seltenen neoplastischen Veränderungen. Während asymptomatische Gallensteine in der Regel keiner Therapie bedürfen, ist bei symptomatischer Cholezystolithiasis und entzündlichen Komplikationen häufig eine Cholezystektomie indiziert. Die laparoskopische Cholezystektomie gilt hierbei als sicheres und effektives Standardverfahren mit niedriger Morbidität und Mortalität. Neue Techniken wie die roboterassistierte Chirurgie konnten bislang keinen Vorteil hinsichtlich Komplikationsraten nachweisen. Die Indikationsstellung, das Erkennen von Risikokonstellationen und die Wahl des geeigneten operativen Vorgehens sind entscheidend für die Vermeidung schwerwiegender Komplikationen.
Gallbladder disease is a frequent cause of upper abdominal pain, ranging from symptomatic gallstones and acute cholecystitis to rare neoplastic lesions. While asymptomatic gallstones usually require no intervention, cholecystectomy is indicated in symptomatic and complicated cases. Laparoscopic cholecystectomy remains the safe and effective gold standard with low morbidity and mortality. Emerging approaches such as robot-assisted surgery have not demonstrated a reduction in complication rates. Accurate indication, timely referral, and the choice of the appropriate surgical technique are key to preventing severe complications and optimizing patient outcomes.
Keywords: Gallstones; Cholecystitis; Gallbladder polyp; Laparoscopic cholecystectomy; Surgery
Einleitung
Beschwerden der Gallenblase gehören zu den häufigsten Ursachen für Oberbauchschmerzen in der hausärztlichen Praxis. Die meisten Patient/-innen berichten über unspezifische Verdauungsbeschwerden, typische Koliken oder akute Schmerzattacken. Gallensteine betreffen bis zu 10–15 % der erwachsenen Bevölkerung in westlichen Ländern (1). Während viele Gallensteine stumm bleiben und keinen Handlungsbedarf erfordern, können symptomatische Steine oder entzündliche Komplikationen zu erheblichen Morbiditäten führen. Das frühzeitige Erkennen, differenzialdiagnostisches Abgrenzen und die richtige Weichenstellung zwischen konservativer Betreuung und zeitgerechter Überweisung sind wichtig.
Der Artikel bietet einen Überblick über die wichtigsten Erkrankungen der Gallenblase, beginnend bei steinbedingten Beschwerden, über entzündliche Prozesse bis hin zu seltenen neoplastischen Veränderungen. Im Anschluss werden die aktuellen chirurgischen Therapieoptionen diskutiert.
Cholezystolithiasis
Als Cholezystolithiasis wird die Ansammlung von Konkrementen in der Gallenblase bezeichnet. Ohne begleitende Symptomatik handelt es sich dabei nicht um ein Krankheitsbild im engeren Sinne.
Die meisten Personen mit Gallensteinen sind asymptomatisch. Bei diesen werden Gallensteine zufällig im Rahmen einer abdominalen Bildgebung entdeckt. Die Mehrheit der Patienten mit inzidentellen Gallensteinen bleibt symptomlos. Patienten, die Symptome entwickeln, berichten typischerweise von Gallenkoliken. Nur selten manifestieren sich Komplikationen einer Cholezystolithiasis ohne vorausgegangene Episoden von Gallenkoliken.
Die Gallenkolik zeigt sich typischerweise als starkes, dumpfes Druckgefühl im rechten Oberbauch oder Epigastrium, seltener retrosternal, mit Ausstrahlung in den Rücken bzw. unter das rechte Schulterblatt (2–4). Begleitsymptome sind häufig Übelkeit, Erbrechen und Schwitzen. Trotz der Bezeichnung ist der Schmerz meist konstant und nicht wellenförmig. Patienten mit Gallenkoliken bei unkomplizierter Gallensteinerkrankung wirken meist nicht krank und haben weder Fieber noch Tachykardie. Laborwerte (Blutbild, Aminotransferasen, Bilirubin, alkalische Phosphatase, Amylase und Lipase) sind normal.
Häufig tritt er nach fettreichen Mahlzeiten auf, da die Kontraktion der Gallenblase den Schmerz auslösen kann. Ein klarer Zusammenhang mit der Nahrungsaufnahme besteht jedoch nicht immer, und viele Anfälle ereignen sich nachts (5, 6). Bewegung, Hocken, Stuhlgang oder Winde beeinflussen die Schmerzen nicht (7).
Eine Attacke dauert in der Regel mindestens 30 Minuten, erreicht innerhalb einer Stunde ihr Maximum und klingt dann langsam ab, insgesamt meist nach weniger als sechs Stunden (2). Ursache ist eine Kontraktion der Gallenblase, die einen Stein oder Sludge gegen den Ductus cysticus drückt und so den intravesikalen Druck erhöht. Mit der Entspannung der Gallenblase rutscht das Konkrement oft zurück, und die Beschwerden lassen allmählich nach. Am deutlichsten mit dem Vorliegen von Gallensteinen verbunden sind drei Symptome: Gallenkoliken, Schmerzen mit Ausstrahlung sowie die Einnahme von Schmerzmitteln (8).
Die Häufigkeit wiederkehrender Attacken variiert stark und kann von Stunden bis zu mehreren Jahren reichen; tägliche Beschwerden sind jedoch selten (7). Tritt einmal eine Symptomatik auf, ist ein Wiederauftreten sehr wahrscheinlich, und zugleich steigt das Risiko für Komplikationen (9, 10). In einer Studie mit 305 Patient/-innen mit Gallensteinen berichteten 70 % derjenigen, die bereits Gallenkoliken gehabt hatten, innerhalb von zwei Jahren erneut über Symptome (10).
Bisher wurden keine randomisierten kontrollierten Studien (RCTs) durchgeführt, die den Nutzen einer Cholezystektomie bei asymptomatischen Patient/-innen belegen. Die jährliche Inzidenz von Komplikationen wie akuter Cholezystitis, akuter Pankreatitis, obstruktivem Ikterus oder Cholangitis liegt bei 0,1–0,3 % (11, 9). Zudem sind die Kosten bei asymptomatischen Gallensteinen geringer, wenn man das Auftreten von Symptomen oder Komplikationen abwartet, anstatt eine prophylaktische Cholezystektomie durchzuführen. Auch Diabetiker benötigen keine prophylaktische Therapie (12). Bei Patient/-innen mit symptomatischer Cholezystolithiasis wird in der Regel eine Cholezystektomie empfohlen. Hintergrund ist, dass etwa die Hälfte der Betroffenen nach der ersten Episode erneut Gallenkoliken entwickelt, wodurch die Krankheitslast deutlich zunimmt. Zudem besteht ein relevantes Risiko für schwerwiegende Komplikationen, darunter akute Cholezystitis, biliäre Pankreatitis, obstruktiver Ikterus und Cholangitis. Dieses Risiko wird in der Literatur mit etwa 0,5–3 % pro Jahr angegeben (11, 9, 13, 14), sodass die operative Entfernung der Gallenblase als kurative und komplikationsvermeidende Massnahme gilt.
Als mögliche Alternativen zur Operation kommen die Auflösung von Gallensteinen mit Ursodesoxycholsäure (UDCA) sowie die extrakorporale Stosswellenlithotripsie (ESWL) in Betracht. Diese Verfahren werden jedoch nicht empfohlen, da sie nur eine geringe Erfolgsrate aufweisen, mit einer hohen Rückfallquote verbunden sind und weder Symptome noch Komplikationen nach der Behandlung zuverlässig verhindern können.
Cholezystitis
Die akute Cholezystitis entsteht in der Regel durch eine Verlegung des Ductus cysticus, meist verursacht durch Gallensteine, seltener durch Sludge (15). Entscheidend für das Fortschreiten der Erkrankung und den Schweregrad der Entzündung sind Dauer und Ausmass der Obstruktion. Durch den Verschluss steigt der intraluminale Druck in der Gallenblase an, was zusammen mit cholesterinreicher Galle eine akute Entzündungsreaktion auslöst. In etwa 20 % der Fälle kommt es zusätzlich zu einer bakteriellen Superinfektion, vor allem mit enterischen Keimen wie Escherichia coli, Klebsiella oder Streptococcus faecalis (16). Die akute Cholezystitis verläuft nach einer Obstruktion des Ductus cysticus typischerweise in drei Phasen (4). In der ersten Phase, die etwa zwei bis vier Tage nach Symptombeginn auftritt, kommt es zu einer entzündlichen Reaktion mit Stauung und Ödem der Gallenblasenwand. In der zweiten Phase, meist nach drei bis fünf Tagen, können Hämorrhagien und Nekrosen der Gallenblasenwand entstehen, die im schlimmsten Fall zu einer Perforation im Bereich ischämischer Gangrän und zu einer biliären Peritonitis führen. Ab dem sechsten Tag entwickelt sich schliesslich die dritte Phase, die als chronisch-eitrig bezeichnet wird. Sie ist gekennzeichnet durch eine ausgeprägte Leukozyteninfiltration, nekrotisches Gewebe, eitrige Einschmelzung sowie die Ansammlung von intraluminalem Eiter mit manifester Infektion.
Bei der körperlichen Untersuchung zeigen 95,7 % der Patient/-innen eine Druckschmerzhaftigkeit im rechten Oberbauch, verbunden mit Zeichen einer lokalisierten Peritonitis (17). Das Murphy-Zeichen, Abbruch der Inspiration bei Palpation des rechten Oberbauchs aufgrund von Schmerzen, gilt als pathognomonisch für die akute Cholezystitis. Die Sensitivität des Murphy-Zeichens beträgt 62 %, die Spezifität 96 % (18). Typischerweise liegt zudem eine Leukozytose mit Linksverschiebung vor.
Die Sonographie ist das bildgebende Verfahren der ersten Wahl bei Verdacht auf eine akute Cholezystitis. Hier zeigen sich typischerweise Flüssigkeitsansammlungen um die Gallenblase, eine Dilatation der Gallenblase, eine ödematöse Gallenblasenwand sowie, falls vorhanden, Gallensteine oder Sludge. Eine Metaanalyse aus dem Jahr 2012 mit knapp 6000 Patient/-innen mit akuter Cholezystitis ergab für die Sonographie eine Sensitivität von 81 % und eine Spezifität von 80 %. Die Computertomographie ist bei der Diagnose der akuten Cholezystitis sehr empfindlich (Sensitivität ca. 94 %), jedoch weniger zuverlässig in der Abgrenzung gegenüber anderen Ursachen (Spezifität ca. 59 %) (19). Die Magnetresonanz-Cholangiopankreatikographie (MRCP) ermöglicht den Ausschluss einer begleitenden Choledocholithiasis im Rahmen einer Cholezystitis und kann dadurch zur Planung des therapeutischen Vorgehens beitragen (20).
Die Standardtherapie der akuten Cholezystitis ist die laparoskopische Cholezystektomie (21). Bei geeigneten chirurgischen Kandidaten sollte die Cholezystektomie so früh wie möglich während des Spitalaufenthalts durchgeführt werden. Der Autor dieses Artikels bevorzugt es, die Operation innerhalb der ersten 2 Tage vorzunehmen. Eine frühe Operation ist leichter durchzuführen, da die lokale Entzündung nach 72 Stunden ab dem Beginn der Symptome zunimmt. Dies erschwert die Präzision der Dissektion, erhöht die Schwere möglicher chirurgischer Komplikationen und macht eine Konversion zur offenen Operation wahrscheinlicher. In einer offenen, randomisierten klinischen Studie aus dem Jahr 2013 (n = 618) wurden Patient/-innen mit akuter Cholezystitis verglichen, die entweder innerhalb von 24 Stunden nach Aufnahme operiert wurden, oder zunächst eine antibiotische Therapie erhielten und erst nach 7 bis 45 Tagen einer Cholezystektomie unterzogen wurden. Die Studie zeigte eine deutlich geringere Häufigkeit postoperativer Komplikationen innerhalb der ersten 75 Tage in der Gruppe mit früher Cholezystektomie (11.8 % bei Operation innerhalb von 24 Stunden vs. 34.4 % bei Operation nach 7–45 Tagen). Zudem war die frühe Cholezystektomie mit einem kürzeren durchschnittlichen Spitalaufenthalt (5.4 Tage vs. 10.0 Tage) sowie über 30% niedrigeren Gesamtkosten verbunden.
Bei Patienten mit komplizierter Cholezystitis sind Breitspektrumantibiotika erforderlich. Nach Beginn der Therapie sollte die antibiotische Behandlung so lange fortgesetzt werden, bis entweder die Gallenblase entfernt ist oder sich die Cholezystitis klinisch zurückgebildet hat. Die Häufigkeit von Gallenblasenempyem und pericholezystischem Abszess ist insgesamt gering, jedoch können Patienten selbst aus einer unkomplizierten akuten Cholezystitis leicht eine lebensbedrohliche gramnegative Sepsis entwickeln. Daher werden Antibiotika häufig prophylaktisch verabreicht, um vor Sepsis und Wundinfektionen zu schützen (22). Ob Antibiotika für die Behandlung einer unkomplizierten akuten Cholezystitis erforderlich sind bleibt unklar (23–26).
Eine Drainage der Gallenblase in Kombination mit Antibiotika ist die Therapie der Wahl bei Patienten, die kritisch krank, septisch und initial nicht operabel sind (27–31). Darüber hinaus wird die Drainage auch bei Patienten empfohlen, die konservativ behandelt werden und trotz antibiotischer Therapie nach ein bis drei Tagen entweder eine Krankheitsprogression zeigen oder keine ausreichende klinische Besserung erfahren. Die Gallenblasen-Drainage führt zur Entlastung von infizierter Galle oder Eiter und ermöglicht die Rückbildung lokaler Entzündung sowie systemischer Krankheitszeichen. Dadurch kann die Cholezystektomie zu einem späteren Zeitpunkt mit geringerem Risiko erfolgen. Bevorzugt wird die perkutan-transhepatische Drainage aufgrund ihrer Einfachheit, Sicherheit und geringeren Kosten (32).
Die Mortalität einer einzelnen Episode einer akuten Cholezystitis hängt vom Allgemeinzustand und dem Operationsrisiko des Patienten ab. Insgesamt beträgt die Mortalität etwa 3 %, liegt jedoch bei jungen, sonst gesunden Patienten unter 1 % und erreicht bei Hochrisikopatienten oder bei Auftreten von Komplikationen bis zu 10 % (33, 34).
Tumoren der Gallenblase
Gallenblasenpolypen treten in der Allgemeinbevölkerung bei etwa 1–7 % auf (35–37), wobei Adenome als prämaligne Läsionen weniger als 5 % der Polypen ausmachen (38). Ab einer Grösse von 1 cm steigt das Risiko für Adenome oder Karzinome deutlich an, sodass in diesen Fällen eine Cholezystektomie empfohlen wird. Bei asymptomatischen Polypen zwischen 6 und 10 mm ist der Nutzen einer vorbeugenden Operation jedoch unklar, da die meisten dieser Polypen einen gutartigen Verlauf zeigen, auch wenn in seltenen Fällen maligne Veränderungen bereits bei kleineren Polypen unter 1 cm auftreten können (39). Zur genaueren Beurteilung, insbesondere in dieser Grössenklasse, ist die Endosonographie der transabdominellen Sonographie überlegen.
Eine besondere Situation stellen Patienten mit primär sklerosierender Cholangitis (PSC) dar: Hier sind Gallenblasenläsionen häufig bösartig, weshalb bereits bei Polypen unter 1 cm eine Cholezystektomie angeraten wird (40, 41). Sehr grosse Polypen über 18–20 mm weisen ein erhebliches Malignitätsrisiko auf, sodass in diesen Fällen in der Regel eine offene Cholezystektomie empfohlen wird.
Für Polypen von 6–10 mm, die nicht entfernt werden, gilt ein engmaschiges Ultraschall- oder Endosonographie-Intervall, zunächst alle drei bis sechs Monate, später jährlich, sofern keine Grössenzunahme auftritt (37, 42, 35). Asymptomatische Polypen von höchstens 5 mm müssen in der Regel nicht weiter kontrolliert werden. Zur Unterscheidung von Gallensteinen kann die Lageveränderung des Patienten hilfreich sein, multiple kleine Polypen sprechen eher für Cholesterinpolypen, und mittels Farbduplexsonographie lassen sich in manchen Fällen Gefässstrukturen erkennen, die für Adenome typisch sind (43).
Ein Gallenblasenkarzinom, welches insgesamt eine sehr schlechte Prognose hat, wird entweder vor einer Operation, während des Eingriffs, meist im Rahmen einer Exploration bei zunächst anderweitig vermuteter Ursache abdomineller Beschwerden, oder erst nach der Operation anhand der histologischen Untersuchung des entnommenen Gallenblasenpräparats festgestellt. Nach aktuellen Serien gelingt die Diagnose nur in rund der Hälfte der Fälle bereits präoperativ (44). In sehr frühen Stadien des Gallenblasenkarzinoms (Tis, T1a) ist eine einfache Cholezystektomie ausreichend und führt in der Regel zur Heilung. Bei höheren Tumorstadien wird hingegen eine erweiterte Cholezystektomie empfohlen, bei der die Gallenblase zusammen mit einem mindestens 2 cm breiten Saum des angrenzenden Lebergewebes im Bereich des Gallenblasenbetts entfernt wird. Je nach Tumorsitz (Fundus, Korpus oder Hals) kann zusätzlich eine zentrale Leberresektion der Segmente IVb und V sinnvoll sein (45). Fernmetastasen sowie eine Peritonealkarzinomatose sind absolute Kontraindikation für eine Resektion. Die fünfjährige Überlebensrate beim Gallenblasenkarzinom liegt insgesamt bei nur rund 20 %. In Krankheitsstadien, die über T1N0 hinausgehen, sind die Langzeitergebnisse deutlich schlechter (46).
Chirurgische Aspekte
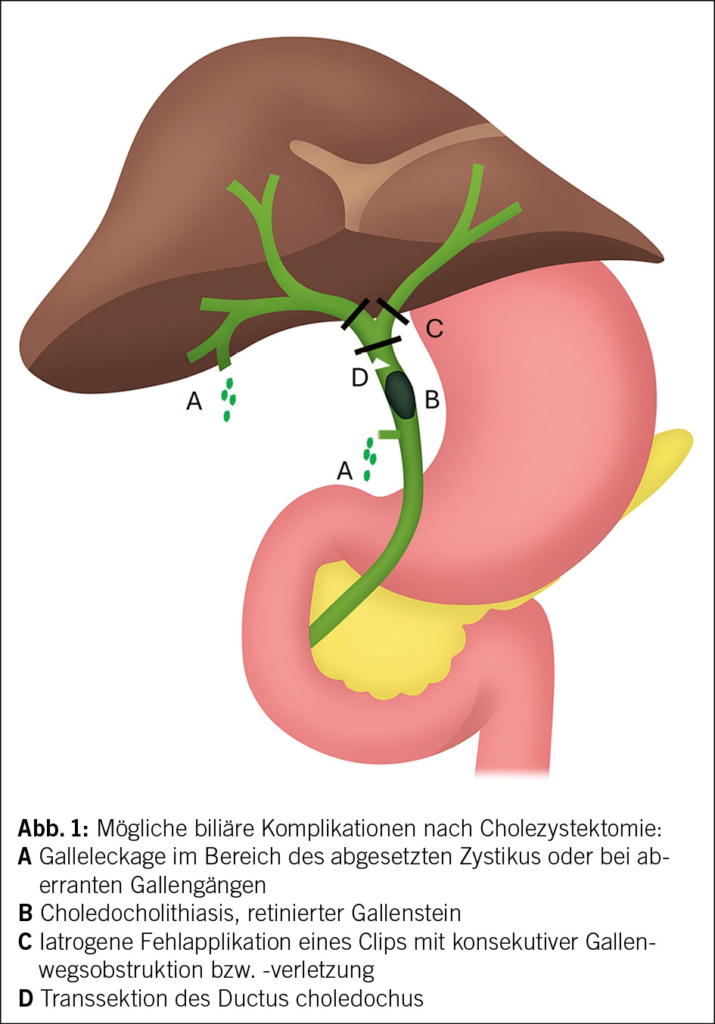
In der Schweiz wurden im Jahr 2023 laut dem Schweizerischen Gesundheitsobservatorium rund 18 000 Cholezystektomien durchgeführt. Die laparoskopische Cholezystektomie gilt insgesamt als sicheres und effektives Verfahren, bei dem sich die meisten Patient/-innen rasch und ohne Komplikationen erholen. Die prospektive, internationale AMBROSE-Studie untersuchte kürzlich über 21 000 Cholezystektomien aus 57 Ländern und berichtete eine 30-Tage-Komplikationsrate von 8 % sowie eine Mortalität von 0.4 %. Gallengangsverletzungen traten in 1.3 % (Leckagen) bzw. 0.2 % (schwere Verletzungen) der Fälle auf. Alter, Komorbiditäten, Operationssetting, chirurgischer Ansatz und intraoperative Schwierigkeit erwiesen sich als die stärksten Prädiktoren für postoperative Komplikationen (47) (Abb. 1). Ein Vorteil in Form einer reduzierten Komplikationsrate konnte für den Einsatz der roboterassistierten Chirurgie bisher nicht nachgewiesen werden, im Gegenteil, es wird sogar über erhöhte Komplikationsraten berichtet (48, 49).
Im deutschsprachigen Raum wird die elektive laparoskopische Cholezystektomie bei sorgfältig ausgewählten Patient/-innen in der S3-Leitlinie als ambulante Option mit hoher Evidenzstufe empfohlen (50). In der Schweiz findet diese Praxis bislang jedoch kaum Anwendung, was in erster Linie auf tarifäre und weniger auf medizinische Gründe zurückzuführen ist.
Copyright
Aerzteverlag medinfo AG
Chirurgie de Rougemont
Römerhofplatz 5
8032 Zürich
olivier.derougemont@usz.ch
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Farthing M, Roberts SE, Samuel DG, Williams JG, Thorne K, Morrison-Rees S. Survey of digestive health across Europe: final report. Part 1: The burden of gastrointestinal diseases and the organisation and delivery of gastroenterology services across Europe. UEG J 2014; 2:539–43.
2. Diehl AK, Sugarek NJ, Todd KH. Clinical evaluation for gallstone disease: usefulness of symptoms and signs in diagnosis. Am J Med 1990; 89(29).
3. LUND J. Surgical indications in cholelithiasis: prophylactic choleithiasis: prophylactic cholecystectomy elucidated on the basis of long-term follow up on 526 nonoperated cases. Ann Surg 1960; 151(153).
4. Gallaher, JR, Charles, A. Acute Cholecystitis: A Review. JAMA 2022; 327(965).
5. Minoli G, Imperiale G, Spinzi GC. Circadian periodicity and other clinical features of biliary pain. J Clin Gastroenterol 1991; 13(546).
6. Rigas B, Torosis J, McDougall CJ. The circadian rhythm of biliary colic. J Clin Gastroenterol 1990; 12(409).
7. Festi D, Sottili S, Colecchia A. Clinical manifestations of gallstone disease: evidence from the multicenter Italian study on cholelithiasis (MICOL. Hepatology 1999; 30(839).
8. Berger MY, Velden JJ, Lijmer JG, Kort H, Prins A, Bohnen AM. Abdominal symptoms: do they predict gallstones? A systematic review. Scand J Gastroenterol 2000; 35:70–6.
9. Friedman GD, Raviola CA, Fireman B. Prognosis of gallstones with mild or no symptoms: 25 years of follow-up in a health maintenance organization. J Clin Epidemiol 1989; 42(127).
10. Thistle JL, Cleary PA, Lachin JM. The natural history of cholelithiasis: the National Cooperative Gallstone Study. Ann Intern Med 1984; 101(171).
11. Attili AF, Santis A, Capri R. The natural history of gallstones: the GREPCO experience. The GREPCO Group. Hepatology; 1995. ( vol 21).
12. Aucott JN, Cooper GS, Bloom AD, Aron DC. Management of gallstones in diabetic patients. Arch Intern Med 1993; 153:1053–8.
13. Festi D, Reggiani ML, Attili AF. Natural history of gallstone disease: Expectant management or active treatment? Results from a population-based cohort study. J Gastroenterol Hepatol 2010; 25(719).
14. Ransohoff DF, Gracie WA. Treatment of gallstones. Ann Intern Med 1993; 119(606).
15. Roslyn JJ, DenBesten L, Thompson JE, Silverman BF. Roles of lithogenic bile and cystic duct occlusion in the pathogenesis of acute cholecystitis. Am J Surg 1980; 140(1):126–30.
16. Kaplan U, Handler C, Chazan B, Weiner N, Hatoum OA, Yanovskay A et al. The Bacteriology of Acute Cholecystitis: Comparison of Bile Cultures and Clinical Outcomes in Diabetic and Non-Diabetic Patients. World J Surg 2021; 45(8):2426–31.
17. Vahed LK, Khedmat L. Frequency of symptoms associated with gallstone disease: a hospital-based cross sectional study. Eur J Transl Myol 2018; 28(2):7412.
18. Jain A, Mehta N, Secko M, Schechter J, Papanagnou D, Pandya S et al. History, Physical Examination, Laboratory Testing, and Emergency Department Ultrasonography for the Diagnosis of Acute Cholecystitis. Acad Emerg Med 2017; 24(3):281–97.
19. Kiewiet JJS, Leeuwenburgh MMN, Bipat S, Bossuyt PMM, Stoker J, Boermeester MA. A systematic review and meta-analysis of diagnostic performance of imaging in acute cholecystitis. Radiology 2012; 264(3):708–20.
20. Hjartarson JH, Hannesson P, Sverrisson I, Blöndal S, Ívarsson B, Björnsson ES. The value of magnetic resonance cholangiopancreatography for the exclusion of choledocholithiasis. Scand J Gastroenterol 2016; 51(10):1249–56.
21. Pucher PH, Brunt LM, Davies N, Linsk A, Munshi A, Rodriguez HA et al. Outcome trends and safety measures after 30 years of laparoscopic cholecystectomy: a systematic review and pooled data analysis. Surg Endosc 2018; 32(5):2175–83.
22. Järvinen H, Renkonen OV, Palmu A. Antibiotics in acute cholecystitis. Ann Clin Res 1978; 10(5):247–51.
23. Strasberg SM. Clinical practice. Acute calculous cholecystitis. N Engl J Med 2008; 358(26):2804–11.
24. Mazeh H, Mizrahi I, Dior U, Simanovsky N, Shapiro M, Freund HR et al. Role of antibiotic therapy in mild acute calculus cholecystitis: a prospective randomized controlled trial. World J Surg 2012; 36(8):1750–9.
25. Kanafani ZA, Khalifé N, Kanj SS, Araj GF, Khalifeh M, Sharara AI. Antibiotic use in acute cholecystitis: practice patterns in the absence of evidence-based guidelines. J Infect 2005; 51(2):128–34.
26. Fuks D, Cossé C, Régimbeau J-M. Antibiotic therapy in acute calculous cholecystitis. J Visc Surg 2013; 150(1):3–8.
27. Gomi H, Solomkin JS, Schlossberg D, Okamoto K, Takada T, Strasberg SM et al. Tokyo Guidelines 2018: antimicrobial therapy for acute cholangitis and cholecystitis. J Hepatobiliary Pancreat Sci 2018; 25(1):3–16.
28. Melin MM, Sarr MG, Bender CE, van Heerden JA. Percutaneous cholecystostomy: a valuable technique in high-risk patients with presumed acute cholecystitis. Br J Surg 1995; 82(9):1274–7.
29. Ito K, Fujita N, Noda Y, Kobayashi G, Kimura K, Sugawara T et al. Percutaneous cholecystostomy versus gallbladder aspiration for acute cholecystitis: a prospective randomized controlled trial. AJR Am J Roentgenol 2004; 183(1):193–6.
30. Davis CA, Landercasper J, Gundersen LH, Lambert PJ. Effective use of percutaneous cholecystostomy in high-risk surgical patients: techniques, tube management, and results. Arch Surg 1999; 134(7):727-31; discussion 731-2.
31. Byrne MF, Suhocki P, Mitchell RM, Pappas TN, Stiffler HL, Jowell PS et al. Percutaneous cholecystostomy in patients with acute cholecystitis: experience of 45 patients at a US referral center. J Am Coll Surg 2003; 197(2):206–11.
32. Pisano M, Allievi N, Gurusamy K, Borzellino G, Cimbanassi S, Boerna D et al. 2020 World Society of Emergency Surgery updated guidelines for the diagnosis and treatment of acute calculus cholecystitis. World J Emerg Surg 2020; 15(1):61.
33. Kamarajah SK, Karri S, Bundred JR, Evans RPT, Lin A, Kew T et al. Perioperative outcomes after laparoscopic cholecystectomy in elderly patients: a systematic review and meta-analysis. Surg Endosc 2020; 34(11):4727–40.
34. Nielsen LBJ, Harboe KM, Bardram L. Cholecystectomy for the elderly: no hesitation for otherwise healthy patients. Surg Endosc 2014; 28(1):171–7.
35. Heyder N, Günter E, Giedl J, Obenauf A, Hahn EG. Polypoide Läsionen der Gallenblase. Dtsch Med Wochenschr 1990; 115(7):243–7.
36. Jørgensen T, Jensen KH. Polyps in the gallbladder. A prevalence study. Scand J Gastroenterol 1990; 25(3):281–6.
37. Myers RP, Shaffer EA, Beck PL. Gallbladder polyps: epidemiology, natural history and management. Can J Gastroenterol 2002; 16(3):187–94.
38. Persley KM. Gallbladder Polyps. Curr Treat Options Gastroenterol 2005; 8(2):105–8.
39. Colecchia A, Larocca A, Scaioli E, Bacchi-Reggiani ML, Di Biase AR, Azzaroli F et al. Natural history of small gallbladder polyps is benign: evidence from a clinical and pathogenetic study. Am J Gastroenterol 2009; 104(3):624–9.
40. Buckles DC, Lindor KD, Larusso NF, Petrovic LM, Gores GJ. In primary sclerosing cholangitis, gallbladder polyps are frequently malignant. Am J Gastroenterol 2002; 97(5):1138–42.
41. Said K, Glaumann H, Bergquist A. Gallbladder disease in patients with primary sclerosing cholangitis. J Hepatol 2008; 48(4):598–605.
42. Lee KF, Wong J, Li JCM, Lai PBS. Polypoid lesions of the gallbladder. Am J Surg 2004; 188(2):186–90.
43. Nuernberg D, Ignee A, Dietrich CF. Aktueller Stand der Sonographie in der Gastroenterologie. Biliopankreatisches System. Med Klin (Munich) 2007; 102(2):112–26.
44. Duffy A, Capanu M, Abou-Alfa GK, Huitzil D, Jarnagin W, Fong Y et al. Gallbladder cancer (GBC): 10-year experience at Memorial Sloan-Kettering Cancer Centre (MSKCC). J Surg Oncol 2008; 98(7):485–9.
45. Cubertafond P, Mathonnet M, Gainant A, Launois B. Radical surgery for gallbladder cancer. Results of the French Surgical Association Survey. Hepatogastroenterology 1999; 46(27):1567–71.
46. Carriaga MT, Henson DE. Liver, gallbladder, extrahepatic bile ducts, and pancreas. Cancer 1995; 75(1 Suppl):171–90.
47. Wong GYM, Wadhawan H, Roth Cardoso V, Bravo Merodio L, Rajeev Y, Maldonado RD et al. 30-day Morbidity and Mortality After Cholecystectomy for Benign Gallbladder Disease (AMBROSE). Ann Surg 2025; 281(2):312–21.
48. Kalata S, Thumma JR, Norton EC, Dimick JB, Sheetz KH. Comparative Safety of Robotic-Assisted vs Laparoscopic Cholecystectomy. JAMA Surg 2023; 158(12):1303.
49. Woldehana NA, Jung A, Parker BC, Coker AM, Haut ER, Adrales GL. Clinical Outcomes of Laparoscopic vs Robotic-Assisted Cholecystectomy in Acute Care Surgery. JAMA Surg 2025; 160(7):755.
50. Gutt C, Jenssen C, Barreiros AP, Gundling F, Lammert F, et al. Aktualisierte S3-Leitlinie zur Prävention, Diagnostik und Behandlung von Gallensteinen. Z Gastroenterol 2018; 56(7):912-66.