In seiner Begrüssungsrede stellte Prof. Edouard Battegay fest: «mit diesem Symposium wollen wir die Neugierde von Prof. Siegenthaler für die Zukunft der Medizin und gleichzeitig seine Achtung für das Altgediente würdigen. Bei Prof. Siegenthaler war das kein Widerspruch. Sein über Generationen und seinen Tod hinaus geschaffenen Werke und Hinterlassenschaften geben uns Orientierung in einer Zeit chaotischer, mikrogemanagter Disruption».
Walter Siegenthaler war in Bonn, der damaligen Hauptstadt der Bundesrepublik Deutschland, und dann am Universitätsspital Zürich einflussreicher Chefarzt. Und er war Dekan der Medizinischen Fakultät der Universität Zürich. Und er war Präsident der Deutschen Gesellschaft für Innere Medizin und von 1990 bis 2004 Präsident der Ludwig-Heilmeyer-Gesellschaft, eine Arzt-Kadergesellschaft der Inneren Medizin Deutschlands. Diese wurde später ihm zu Ehren zur «Walter Siegenthaler Gesellschaft für Fortschritte in der Inneren Medizin» umbenannt. Sein Engagement und Verantwortungsbewusstsein prägten diese Institutionen nachhaltig.

Auch Frau Prof. Beatrice Beck-Schimmer lobte das Interesse von Walter Siegenthaler für Innovationen bei gleichzeitiger Wertschätzung für angestammte Werte. Sie würdigte seine Tätigkeit in Bonn und später in Zürich und darüber hinaus seinen unermüdlichen Einsatz für den Nachwuchs. Sie stellte fest, dass unter Walter Siegenthaler sich das Universitätsspital Zürich zu einem veritablen Hotspot für Ärzte entwickelte.

Die neue CEO des Universitätsspitals, Frau Dr. Monika Jänicke, fügte sich in ihrer Begrüssung dem Vorredner und der Vorrednerin auf sehr eindrückliche Weise an und überzeugte die Anwesenden, dass das Universitätsspital fortan in sehr guten Händen ist.
Frau Dr. Jänicke stellte fest, dass der Geist von Prof. Siegenthaler immer noch in diesen Hallen weht. Er war in vieler Hinsicht prägend, zum einen in der Medizin, zum andern als Ausbildner, aber er war auch eine spannende Persönlichkeit, nicht umsonst wurde ihm ein Buch gewidmet mit dem Titel «Zeitzeuge der Medizin». Er hat einmal gesagt, «das Wichtigste ist, dass der Patient gesagt hat, das war ein netter Arzt». Prof. Siegenthaler hat Menschen betreut, privat oder nicht privat, und wenn man an die Privatpatienten denkt, hat er einflussreiche Persönlichkeiten betreut, vom Bankdirektor über den Regierungspräsidenten über Kunstmaler etc. Es gibt die Anekdote, die sagt, dass ein Kunstmaler mit einem Kunstwerk bezahlt hat. Vielleicht stimmt es. Vielleicht nicht, aber vielleicht hängt der Chagall immer noch irgendwo in der Wohnung von Siegenthalers. Es gibt auch die andere Anekdote, die sich im Hause beharrlich hält, dass es einen Anruf aus dem Vatikan gab und die Telefonistin gesagt hat «also wenn Sie der Papst sind (nämlich Papst Johannes Paul II), dann bin ich die Kaiserin von China». Prof. Siegenthaler hat souverän das Telefon abgenommen und den Heiligen Vater begrüsst mit «Buongiorno Signor Papa». Sein Patient war tatsächlich ein hochrangiger Kardinal. Prof. Siegenthaler lag aber, wie die Vorredner bereits gesagt haben, die Ausbildung des Nachwuchses sehr am Herzen. Man erinnere sich an das Sigirama, am Freitagabend möglichst spät. Man sagt, dass diese Fortbildungen hohen Unterhaltungswert hatten, was zwar bezweifelt werden kann, wenn man gnadenlos der Diskussion ausgesetzt war, aber gelernt hat man sicher unendlich viel. Das ist ebenfalls, was Professor Siegenthaler ausgemacht hat. Sicher gibt es noch viele Anekdoten, ob es der weisse Mantel ist, zugeknöpft mit Krawatte oder auch andere, sie sind alle geprägt von einem hohen Respekt gegenüber der Person von Professor Siegenthaler, aber auch mit einem Schalk und einem Lächeln, was zeigt, wie viel dieser Mann, der Generationen von Medizinern geprägt hat, jedem Studenten bedeutet hat. In diesem Sinne wünschte die Referentin allen Teilnehmern einen wundervollen Nachmittag mit vielen Erinnerungen und mit spannenden Vorträgen, die ganz im Sinne von Prof. Siegenthaler gewesen wären.
Fiebererreger heute und morgen

In der Zeitspanne von Jahr 1900 bis zum Jahr 2000 ist die Mortalität an Infektionskrankheiten von 797 auf 36 pro 100’000 zurückgegangen. 1910 erfolgte die erste kommunale Verwendung von Chlorwasser, 1922 die letzte Übertragung von Mensch zu Mensch der Pest, 1940 wurde erstmals Penicillin angewendet, 1955 wurde die Polio-Vakzine von Salk eingeführt und 1962 erfolgte die Verabschiedung des Gesetzes zur Unterstützung von Impfungen. Die bessere Ernährung, Antibiotika, bessere Hygiene, Abwasserentsorgung, Immunisierungen, sicherere Nahrungsmittel, sowie bessere Unterbringung haben zu dieser eindrücklichen Abnahme der Infektionskrankheiten geführt, stellte Frau Prof. Dr. Dr. med. Annelies Zinkernagel, Klinikdirektorin, Klinik für Infektionskrankheiten und Spitalhygiene, Universitätsspital Zürich, fest. Anhand der Poliomyelitis zeigte die Referentin die Bedeutung der Impfung. Zusätzlich hat man die Swimmingpools geschlossen und die Kranken zu Hause eingesperrt. Ein weiteres Beispiel sind die Masern, eine äusserst kontagiöse Infektion. Eine Maser-Infizierte Person kann bis zu 18 weitere Personen anstecken. Vor 1963 gab es in den USA 2,6 Mio. Todesfälle an Masern, seither wurden 20,4 Mio. Todesfälle verhindert. Heute haben wir allerdings viele Impfskeptiker, die sich und ihre Kinder nicht mehr impfen lassen und so kam es wieder zu einer Zunahme dieser infektiösen Krankheit. Die Impfmüdigkeit trotz Verfügbarkeit von Impfstoffen droht den Fortschritt bei der Bekämpfung von durch Impfung vermeidbaren Krankheiten zunichtezumachen.
Die Impfung ist eine der kosteneffizientesten Massnahmen zur Vermeidung von Krankheiten – sie verhindert derzeit 2 bis 3 Millionen Todesfälle pro Jahr und weitere 1,5 Millionen könnten vermieden werden, wenn die weltweite Durchimpfung verbessert würde. Bei Masern beispielsweise ist die Zahl der Fälle weltweit um 30% gestiegen.
Ein Durchbruch in der Infektionsbekämpfung war die «Erfindung» der Händedesinfektion durch Semmelweis 1847 in Wien. Durch das Händewaschen mit chlorhaltiger Lösung nach jeder Patientin von Hebammen und Medizinstudenten konnte die Mortalität unter Wöchnerinnen von 12,3% auf 1,3% gesenkt werden.
Verhinderung der Transmission
Die Massnahmen entsprechen dem Bauprinzip der CDC: Die Basismassnahmen sind Standardmassnahmen wie Händedesinfektion, Hustenetikette und Desinfektion/Sterilisation. Schutzmassnahmen sind Isolationen, Kontakt, Tröpfchen, aerogene Übertragung.
Neues Coronavirus
Schutzmassnahmen: Isolationen, Kontakt, Tröpfchen, Aerogen. Bei Symptomen sofort testen lassen und zuhause bleiben, Tracing (zur Rückverfolgung, wenn immer möglich Kontaktdaten angeben). Bei positivem Test Isolation, bei Kontakt mit positiv getesteter Person Quarantäne.
Schwere Infektionskrankheiten des 21. Jahrhunderts
Schwere Infektionskrankheiten im 21. Jahrhundert waren SARS, das Dengue-Fieber, die Cholera, die Schweinegrippe, Masern, Ebola, Sars-Covid-19, die Affenpocken, die Zika-und Chikunguya-Virusinfektion.
Ende 20. Jahrhundert gab es grosse gesellschaftliche und technologische Veränderungen. Dazu gehören demographische und Verhaltensänderungen, Umweltveränderungen, Zusammenbruch der Massnahmen im Bereich der öffentlichen Gesundheit, mikrobielle Anpassung und Veränderung, internationaler Reiseverkehr und Handel, Veränderungen in Technologie und Industrie. Auch die Urbanisierung hat Auswirkungen auf die Infektionskrankheiten, so auch das Auftreten von Krankheitserregern aus Wild- und Haustierreservoirs in menschlichen Populationen, wie HIV1, HIV2, 1918 das Influenza-Virus und die entsprechende Pandemie, das Middle East Respiratory Syndrome, SARS-CoV-2 und die Affenpocken.
Stechmücken gedeihen in der Nähe der menschlichen Bevölkerung. Die durch Mücken übertragenen Krankheiten stellen eine zunehmende Gefahr in Europa dar, so die asiatische Tigermücke, die Krankheiten wie Zika, Chikunguya und das Dengue-Fieber übertragen kann.
Die Häufigkeit von Dengue-Fieber ist in den letzten 50 Jahren um das 30-fache gestiegen. Etwa die Hälfte der Weltbevölkerung ist heute durch Dengue-Fieber gefährdet, geschätzte 100 Millionen Infektionen pro Jahr. Im Juni 2021 empfahl das Advisory Committee on Immunization Practices (ACIP) die Verwendung von Dengvaxia zur Vorbeugung von Dengue (Serotypen 1, 2, 3 und 4) bei Kindern im Alter von 9 bis 16 Jahren mit einer im Labor bestätigten früheren Dengue-Virusinfektion, die in Gebieten leben, in denen Dengue endemisch ist. Dengvaxia enthält abgeschwächte (attenuierte) Gelbfieberviren. Der Ausschuss für Humanarzneimittel (CHMP) der EMA hat eine positive Stellungnahme für Dengue Tetravalent Impfstoff (Lebendimpfstoff, abgeschwächt) von Takeda zur Vorbeugung von Krankheiten, die durch die Dengue-Virus-Serotypen 1, 2, 3 und 4 verursacht werden, bei Menschen ab vier Jahren.
2022 Affenpockenausbruch in einigen Ländern ausserhalb des afrikanischen Kontinents, in denen diese Krankheit noch nie aufgetreten ist. Der WHO-Generaldirektor erklärt den anhaltenden Ausbruch der Affenpocken zu einem öffentlichen Gesundheitsnotstand von internationalem Ausmass.
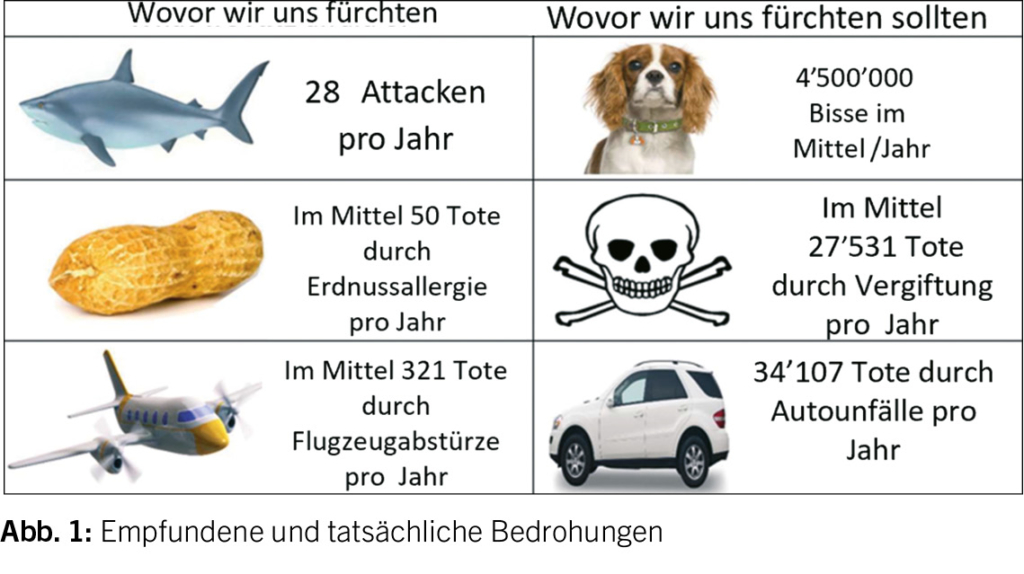
Bedrohungen
Eine neue Bedrohung ist die Anti-Impfbewegung. Eine Welle von Eltern wurde durch Fehlinformationen aus der COVID-Ära radikalisiert und lehnt die üblichen Impfungen für Kinder ab – mit möglicherweise tödlichen Folgen.
Die Bedrohungen, wie wir sie empfinden und wie sie tatsächlich vorhanden sind, sind in der Abbildung 1 wiedergegeben.
Der Ausbruch der Masernfälle hält unvermindert an. Gemäss UNAIDSGLOBAL AIDS Update 2022 verlangsamt sich der weltweite Fortschritt bei der HIV-Bekämpfung eher, als dass er sich beschleunigt. 1,3 Millionen HIV-Neuinfektionen fanden im Jahr 2022 statt (dreimal mehr als das Ziel von 370’000 für 2025). COVID-19 hat das Risiko von Masernausbrüchen erhöht. Über 61 Millionen Dosen masernhaltigen Impfstoffs wurden von 2020 bis 2022 aufgrund COVID-19-bedingtenVerzögerungen nicht verimpft.
Ferner wird eine Zunahme invasiver Guppe A Streptokokken-Infektionen bei Kindern in Europa festgestellt. Unterschiedlich ist das frühere Auftreten als in den vorangegangenen Jahren (starke Saisonabhängigkeit, typischerweise Anstieg im Winter und Höhepunkt im Frühjahr). Bei Kindern unter 10 Jahren sind die iGAS-Fälle deutlich häufiger als in den vorangegangenen fünf Jahren (in Schottland, Irland, den Niederlanden, Frankreich, Schweden und den USA). Beim Bakterium wurden bisher keine Veränderungen festgestellt. Der Wirt aber ist anfälliger. Zur Prävention dienen Masken und weniger wiederholte Kontakte.
Weitere Bedrohungen sind das frühere und häufigere Auftreten von Influenza und RSV.
Resistenz gegen antimikrobielle Mittel
Schätzungsweise werden im Jahr 2050 10 Millionen Personen an antimikrobieller Resistenz sterben. Seit 2017 wurden nur 12 neue Antibiotika zugelassen, von denen 10 zu bereits bestehenden Klassen mit etablierten Mechanismen der Resistenz gegen antimikrobielle Mittel gehören. 77 antibakterielle Wirkstoffe sind in der klinischen Entwicklung, 45 sind traditionelle direkt wirkende kleine Moleküle und 32 nicht-traditionelle Wirkstoffe. Beispiele für letztere sind monoklonale Antikörper und Bakteriophagen.
Fazit
Fiebererreger heute und morgen:
Negativ: Neue Infektionen
– Ausbrüche von neu auftretenden, wieder auftretenden und endemischen Krankheiten
Positiv: Neue Impfungen, besseres Verständnis, Medikamente
Innovation in der Nierentransplantation – von eineiigen Zwillingen zu Schweinenieren

Die heiligen Patrone der Transplantationsmedizin heissen Kosmas und Damian. Sie hatten den Schenkel eines Toten einem Patienten, dem der Krebs sein ganzes Bein weggefressen hatte, transplantiert, so Prof. Dr. Thomas Fehr, Chefarzt und Ärztlicher Direktor, Departementsleiter Innere Medizin, Kantonsspital Chur. Die erste erfolgreiche Nieren-Transplantation erfolgte 1954 durch den späteren (1990) Nobelpreisträger Joseph E. Murray. am Brigham and Women’s Hospital in Boston an eineiigen Zwillingen.
Für die Transplantation gilt seit 1968 bis heute die Hirntoddefinition. Diese Entwicklung kommt aus der Intensivmedizin (Konsens Harvard Med School) – Kriterien für Beendigung einer lebenserhaltenden Therapie bei infauster Prognose. Erst später erfolgte die Anwendung für die Organspende.
1972 wurde Cyclosporin in den damaligen Laboratorien von Sandoz entdeckt, 1978 wurde es erstmals für eine Organtransplantation durch Roy Calne in Cambridge angewandt.
2006 wurde die erste AB0 inkompatible-Transplantation in Zürich durch den Referenten und sein Team durchgeführt. Der Patient wurde zuerst einer Adsorptionsbehandlung durch Apherese unterzogen, wobei die Isoagglutinine entfernt wurden. Die Methode ergab ein exzellentes Überleben einer Transplantation bei Blutgruppeninkompatibilität. Der Referent publizierte mehrere Arbeiten zu dieser Methode (z.B. Fehr T and Stüssi G AB0 incompatible kidney transplantation. Current Opinion in Organ Transplantation2012;17:376-385).
2012 erfolgte die erste Trippel Cross-over Transplantation in der Schweiz. Diese stellt eine neue Option für immunologisch inkompatible Lebendspenden dar.
Die Induktion eines gemischten Chimärismus. Dies kann durch die Transplantation von Zellen unterschiedlicher Herkunft in einen Organismus erreicht werden. 2016 wurde die erste Patientin mit erfolgreicher Toleranzinduktion transplantiert. Inzwischen sind 6 Patienten transplantatiert, alle sind «off immunosuppression»! betonte der Referent. Das Verfahren wurde 2022 in den Frontiers of Immunology publiziert (Fehr T et al. Successful induction of specific immunological tolerance by combined kidney and hematopoietic stem cell transplantation in HLA identical siblings). Diese Methode wurde auch in einem Artikel in der NZZ « ein Leben mit fremdem Organ ohne Medikamente » kommentiert.
Organmangel – mögliche Ansätze
Mögliche Lösungsansätze für den Organmangel sind zum einen Anstrengungen, die Lebendspende zu mehren, zum andern die Xenotransplantation, das Toleranzprotokoll, HLA- Desensibilisierungsprotokolle, die Blutgruppen-inkompatible Transplantation, die altruistische Spende, die systematische Evaluierung der Lebendspende und Anstrengungen, die Kadaverspende zu vermehren.
Xenotransplantation
Nieren von gezüchteten Schweinen mit einem Knockout des alpha-1,3-Glaktosyltransferase-Gens und mit subkapsulärem autologem Thymusgewebe wurden in zwei hirntote menschliche Empfänger, deren Kreislauf- und Atmungsaktivität für die Dauer der Studie an einem Beatmungsgerät aufrechterhalten wurde, transplantiert (Montgomery RA et al NEJM). Die gentechnisch veränderten Nierentransplantate blieben in hirntoten menschlichen Empfängern 54 Stunden lang lebensfähig und funktionsfähig, ohne Anzeichen einer hyperakuten Abstossung.
Wo geht die Reise hin?
Zum Abschluss nannte der Referent die folgenden Möglichkeiten für die Zukunft der Behandlungsmöglichkeiten bei Patienten mit terminaler Niereninsuffizienz: Allotransplantation, tragbare Dialyse, Xenotransplantation und künstliche Niere.
Innovationen in der Thoraxchirurgie

Thorax-Onkologie: Hybrid-Verfahren, Navigations-Bronschokopie, minimalinvasive Chirurgie, fortgeschrittene Lungenerkrankungen, Lungentransplantation und Operation der Chronisch thromboembolischen Pulmonalen Hypertonie war der Themenausblick von Frau Prof. Dr. Isabelle Schmitt-Opitz, Direktorin der Abteilung für Thoraxchirurgie, Lehrstuhl für Lungenkrebszentrum, Universitätsspital Zürich.
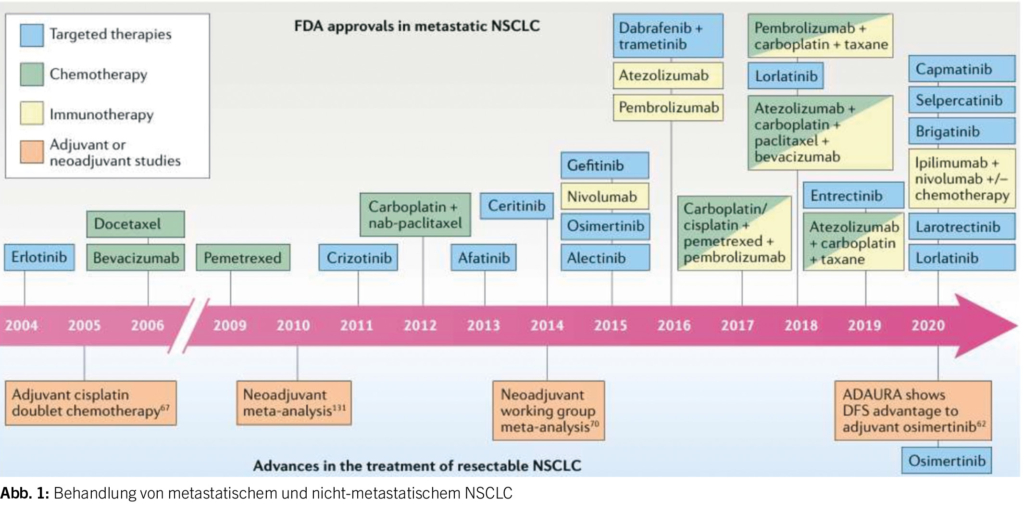
Präzisionsmedizin beim NSCLC
Die Referentin stellte zunächst die traditionelle Medizin mit chirurgischer Entfernung des Tumors, Chemotherapie und Bestrahlung der Präzisionsmedizin mit zielgerichteter Therapie und Immuntherapie beim NSCLC gegenüber.
Screening für Lungenkrebs
In der NELSON Studie, an der Hochrisikopersonen teilnahmen, war die Lungenkrebssterblichkeit bei denjenigen, die an einem CT-Volumenscreening teilnahmen, deutlich niedriger als bei denjenigen, die kein Screening erhielten. Die Rate an Folgeuntersuchungen bei Ergebnissen, die auf Lungenkrebs hindeuten, war gering.
Trotz strenger Kriterien für ein positives Screening, einer zunehmenden Länge des Screening-Intervalls und wenigen weiblichen Teilnehmern führte die Screening-Strategie der NELSON-Studie zu einer günstigen Verteilung des Krebsstadiums bei der Diagnose, was für die Wirksamkeit unserer Screening-Strategie entscheidend ist.
Mit der robotergestützten Bronchoskopie, einem minimalinvasiven Verfahren, können Lungenknoten und -geschwülste mit höherer Genauigkeit und weniger Nebenwirkungen biopsiert werden. Dabei wird ein Roboterarm eingesetzt, der einen Katheter durch die Atemwege des Patienten führt und es ermöglicht, Gewebeproben aus den schwer zugänglichen Bereichen der Lunge zu entnehmen.
Die Navigationsbronchoskopie ist, einfach ausgedrückt, der Einsatz von Technologie (über die Standard-Querschnittsbildgebung hinaus), um dem Bronchoskopiker zu helfen, das Bronchoskop genau zu einem Bereich von Interesse ausserhalb der zentralen Atemwege zu navigieren.
Seit den 1990er Jahren, als die erste videoassistierte thorakoskopische Lobektomie (VATS) durchgeführt wurde, ist das Interesse an der minimalinvasiven Chirurgie (MIS) zur Behandlung von Lungenkrebs stark gestiegen.
Weniger postoperative Schmerzen, ein besseres kosmetisches Ergebnis, ein kürzerer Krankenhausaufenthalt, eine geringere Morbidität und perioperative Mortalität sind nur einige der bemerkenswerten Vorteile der MIC im Vergleich zur offenen Chirurgie. Darüber hinaus haben mehrere Studien gezeigt, dass die minimalinvasive Technik auch bei Lungenkrebs im fortgeschrittenen Stadium keine schlechteren onkologischen Ergebnisse erzielt.
In den letzten Jahrzehnten wurden verschiedene minimalinvasive Verfahren entwickelt, wie die robotergestützte Thoraxchirurgie (RATS) oder die uniportale VATS (U-VATS). Während die Befürworter der VATS-Technik behaupten, die Roboterchirurgie sei teuer und nur für elitäre Krankenhäuser geeignet, stehen die technologische Entwicklung und die Vorteile der RATS sowohl für die Patienten als auch für die Chirurgen ausser Frage.
Die videoassistierte thorakoskopische Lobektomie ist mit weniger Schmerzen, weniger Komplikationen und einer besseren Lebensqualität verbunden, ohne dass das onkologische Ergebnis beeinträchtigt wurde. Die Schlussfolgerungen der Violet-Studie lauten, dass die VATS-Lobektomie bei Lungenkrebs mit weniger Schmerzen, weniger Komplikationen im Krankenhaus sowie kürzerem Krankenhausaufenthalt ohne Beeinträchtigung des frühen onkologischen Ergebnisses verbunden ist. Es gab keine schwerwiegenden unerwünschten Ereignisse. Eine bessere funktionelle Erholung setzte sich in der postoperativen Phase fort mit verbesserter körperlicher Funktion und niedrigeren Wiedereinweisungsraten. Es gab keinen Unterschied im krankheitsfreien Überleben und keinen Unterschied im Gesamtüberleben bis zu einem Jahr. Die neueste Plattform ist das Da Vinci System. Die Vorteile der Roboter-unterstützten Thoraxchirurgie (RATS) sind 3D-Ansicht, Intuitive Bewegungen, Tremor-Filterung, stabile Kameraplattform, erhöhte Anzahl von Freiheitsgraden, 3D-Ansicht, intuitive Bewegungen, Bewegungsskalierung. Äquivalenz zwischen dominanter und nicht dominanter Hand, Auge-Hand-Ziel-Ausrichtung.
Fallvignetten
Vignette eines 74 Jahre alten, männlichen Patienten.
Vorgeschichte: Rauchen, 36 Jahre, Nebendiagnosen: COPD Gold III, FEV1/FVC-Verhältnis (Tiffeneau-Index): 46 %, FEV1: 1,33l (40 %), TLCO: 45 %, RV/TLC: 124%. Koronare Herzkrankheit, dilatative Arteriopathie mit infrarenalem Aortenaneurysma (46 mm). PET-CT: leicht erhöhte FDG-Aufnahme (16 x 11 x 20 mm, SUVmax 0,9), interlobärer Lymphknoten mit erhöhter Aufnahme (Level 11R, 7 mm, SUVmax 4,2), keine Anzeichen einer Fernmetastasierung. Operative Planung: Sublobar-Resektion – Segmentektomie und Keilresektion sollten parenchymale Resektionsränder ≥2 cm oder ≥die Grösse des Knotens erreichen. Die Referentin demonstrierte die verschiedenen Operationsschritte von der Eröffnung der Fissur, Teil 1, Klammerung der Arterie des Segments 6, Dissektion der Vene, S6-Bronchus-Dissektion, zu den RATS – Glühwürmchen.
Die zweite Vignette betraf ein Adenokarzinom bei einer 68 Jahre alten Frau. Ehemalige Raucherin, 30 py (ausgesetzt 2006).
Indikation: TTF1-positives Adenokarzinom (UICC IIIA), teilweises Ansprechen nach Induktionstherapie (3 Zyklen Carboplatin/Pemetrexed). Keine Kontraindikation für eine Lobektomie. Die Referentin präsentierte die entsprechenden Operationsschritte.
Ein dritter Fall betraf einen 66 Jahre alten Patienten.
Medizinische Vorgeschichte: Raucher, 100 Pack-Jahre, COPD Gold 1, cT2N0M0 linkes zentrales Plattenepithelkarzinom, das in die Wand der absteigenden Aorta eindringt.
Entscheidung des Tumorboards: Induktionstherapie nach dem Checkmate 816-Protokoll. Teilweises Ansprechen.
Entscheidung des Tumorboards für eine Operation: Deszendierende thorakale Aortenendoprothese vor der Operation eingesetzt. Endresultat nach erweiterter linksseitiger RATS-Pneumonektomie bis zur Aortenadventitia: Unauffällige Nachuntersuchung mit Entlassung aus dem Krankenhaus nach 6 Tagen. Endgültige Pathologie: ypT2aypN2cM0 Stadium IIIA. Bronchusmanschettenresektionen, Anastomose, intuitiv – Da Vinci SP
Herausforderungen bei der Ausbildung für die Thoraxchirurgie HEUTE
Einschränkungen der Arbeitszeiten: Reicht eine 80-Stunden-Woche für die Ausbildung eines Arztes aus? In einer retrospektiven, multizentrischen konsekutiven Blinddarm- und Gallenblasen-Kohorte bei 29 Assistenzärzten, 298 Blinddarm, 479 Cholezystektomien, Gesamthaft 777 Prozeduren , 13 (4%) offene Blinddarm, 50 (10.4%) offene Cholezystektomien, insgesamt 8,1% offene , 53 Fälle /29 Assistenzärzte/2.5Jahre = 0,86 offene pro Jahr. Ein Assistenzarzt müsste für eine offene Gallenblasenoperation 1,5 Jahre warten und 5 Jahre für eine offene Blinddarmoperation.
Es gibt ein Simulation-Training, das Copenhagen Academy for Medical Education and Simulation (CAMES) und den Chirurgen-Simulator 3D-Apps auf Google Play. Ferner die ESTS Robotic school overview, ein Einjahresprogramm.
Zusätzlich erhöhen die neue perioperative gezielte und die Immuntherapie die Komplexität.
Lungentransplantation
Die Anzahl Lungentransplantationen steigt kontinuierlich an. Waren es im Jahre 1988 noch 69, so stieg diese Zahl im Jahr 2017 auf 4452, wovon die Mehrzahl Doppellungentransplantationen bei bilateralem Tumor waren. Die Sterblichkeit auf der Warteliste ist aufgrund der gestiegenen Nachfrage nach Lungentransplantationen weiterhin ein Problem.
In der Schweiz gibt es bei einer Bevölkerung von 8,7 Mio. zwei Lungentransplantationszentren, in Zürich und Lausanne. In den Jahren 2022 und 2021 gab es 153 Spender, 43 Transplantationen und eine Ausbeute von 28,1%. Im Vergleich dazu Spanien mit 1905 Transplantationen, 666 Spendern, 458 Transplantationen und einer Ausbeute von 24.0%.
Neues Konzept zur Überwindung des Spendermangels
1. Erweiterte Spenderkriterien bei der Lungentransplantation (Current Opinion in Organ Transplant. 2009)
2. Grössenreduzierte Lungentransplantation: eine fortschrittliche operative Strategie zur Linderung des Spenderorganmangels (Tranplantation Proceedings 2004)
3. Transplantation von Lungen eines nicht-herzschlagenden Spenders (Lancet)
4. Update zur lobären Lungentransplantation von Lebendspendern (Current Opinion in Organ Tranplant. 2011)
5. Normothermische Ex-vivo-Lungenperfusion bei klinischer Lungentransplantation (NEJM 2011)
Pulmonalendarteriektomie und chronisch thromboembolische Hypertonie
Mit einem Video illustrierte die Referentin die Pulmonalendarteriektomie (PEA) bei chronisch thromboembolischer Hypertonie (CTEPH). In den ESC Guidelines von 2022 sind CTEPH Teams und Erfahrungskriterien festgelegt. Idealerweise sollten CTEPH-Zentren über PEA-Aktivitäten (>50/Jahr) und BPAs (>30 Patienten/Jahr oder >100 Eingriffe/Jahr) haben, da diese Zahlen mit besseren Ergebnissen in Verbindung gebracht wurden. In der Schweiz wurden vor 2000 keine PEAs durchgeführt. Von 2000 bis 2004 waren es. 6, von 2005-2008 12 und von 2009 bis 2012 16.
Am USZ wurde im Januar 2018 ein CETPH Board zur interdisziplinären Besprechung von CETPH Patienten eingerichtet.
Das CTEPH-Programm Zürich umfasst die folgenden Daten:
– Gesamtresektabilität seit Januar 2015 – Februar 2023:
– 162 von 240 CTEPH-Patienten wurden als operabel eingestuft (67,5%)
– 108 Patienten der 162 operablen CTEPH-Patienten hatten eine PEA (66,6%)
– Resektabilität seit Januar 2018, CTEPH Board:
– 102 von 154 CTEPH-Patienten wurden als operabel eingestuft (66,2%)
– 75 Patienten der 102 operablen CTEPH-Patienten hatten eine PEA (73,5%)
– 30-Tage-Gesamtmortalität seit Januar 2015 – Februar 2023 (der letzte Patient starb im März 2020) 2%.
Zusammenfassung und Schlussfolgerung
Die roboterassistierte thorakoskopische Chirurgie wird in vielen Zentren mehr und mehr als die bevorzugte minimalinvasive Methode angewendet.
Der Ansatz für die anatomische Resektion sollte derjenige sein, mit dem das Zentrum die meiste Erfahrung hat. Nach den aktuellen Leitlinien werden jedoch minimalinvasive Verfahren (VATS oder RATS) bevorzugt. Die operative Strategie für die in Zukunft zunehmende Zahl von Segmentektomien (Lungenkrebs Screening-Programme!) muss im Vorfeld geplant werden – die Technik der Definition der intersegmentalen Ebene wird immer ausgefeilter und sollte onkologisch korrekte Strategien zur Erhaltung sicherer Ränder beinhalten. Angesichts der neuen Erkenntnisse wird die Segmentektomie in Zukunft noch weiterverbreitet sein. Die Prüfungsanforderungen und Lehrprogramme müssen angepasst werden. Dies ist eine institutionelle und gesellschaftliche Verantwortung. Die Ausbildungswege müssen angepasst werden, um weitere Herausforderungen wie Arbeitszeitbeschränkungen, das Spektrum der „closed chest“/“open chest“-Chirurgie, und einen neuen Komplexitätsgrad zu berücksichtigen.
riesen@medinfo-verlag.ch