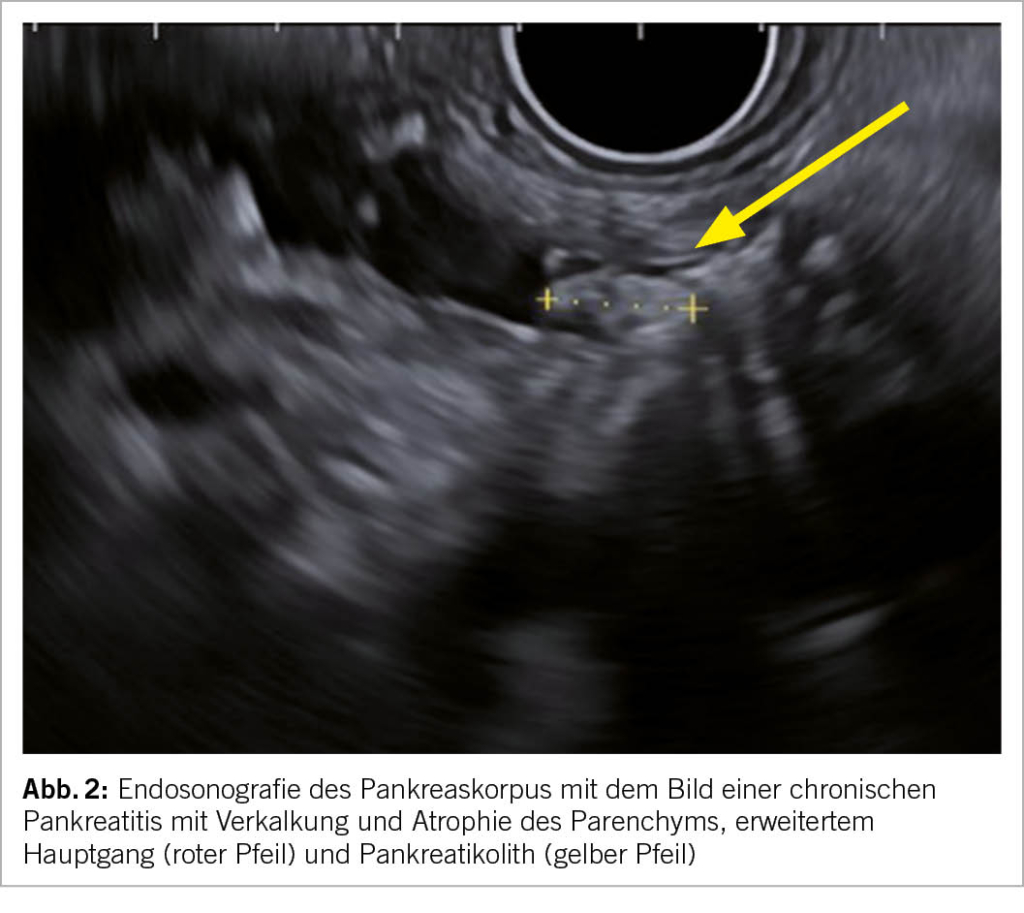
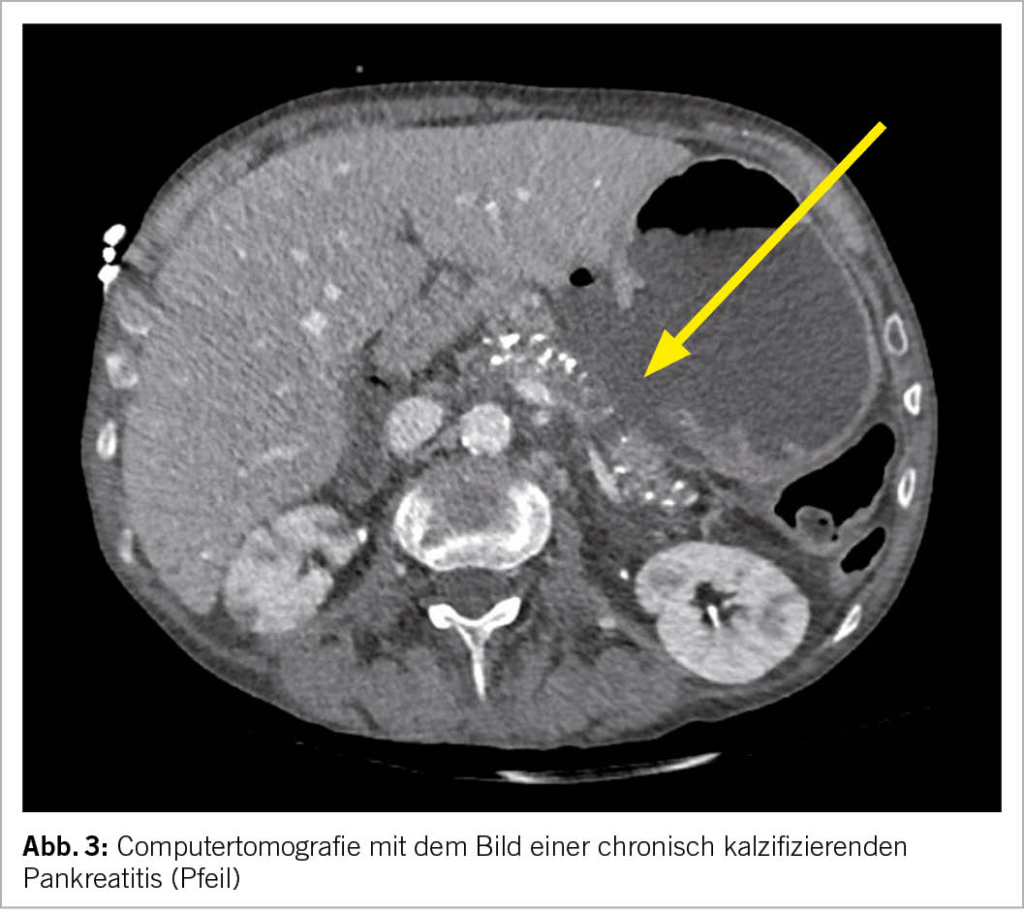
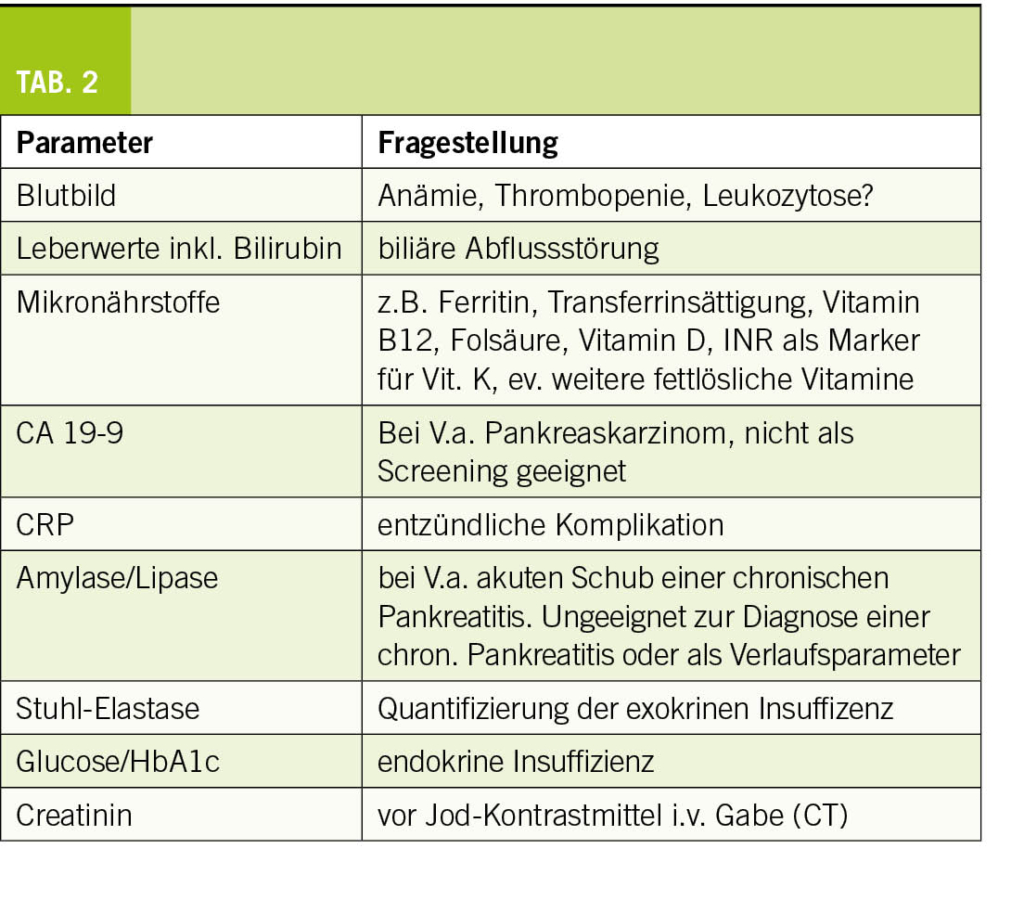
Die Zusammensetzung der Reiseapotheke ist abhängig vom Reiseziel, der Reiseart und der reisenden Person. Neben einer allfällig vorbestehenden Medikation inkl. der ggf. erforderlichen Bescheinigung sollte sie verschiedene Medikamente und Mate-rialien enthalten, die während einer Reise zum Einsatz kommen könnten. Dazu gehören ein guter Mückenschutz, prophylaktische Medikamente (z.B. gegen Malaria), Therapien für gängige wie auch reisespezifische Erkrankungen sowie Materialien und Utensilien für den Notfall. Die Reiseapotheke wird während der Reiseberatung zusammen mit der reisenden Person besprochen und an die geplante Reise angepasst.
The composition of the travel pharmacy-kit depends on the journey type and destination, as well as on the travelling person. Alongside eventually pre-existing medications and necessary medical certificates, the pharmacy-kit should include medications and products that may be needed during the journey. This includes products for effective vector-control, chemoprophylaxis (e.g. against Malaria), medications for the treatment of common as well as travel-specific diseases and instruments and materials for the first-aid. The composition of the travel pharmacy-kit is discussed during the travel medicine consultation and should be tailored to the planned journey.
Key Words: travel, travel pharmacy-kit, malaria
Die Reiseapotheke gehört zu jeder Reise dazu. Ihre Zusammensetzung kann jedoch variieren, abhängig von der Reise (Ziel, Dauer und Art) und der reisenden Person (Alter, Vorerkrankungen, Allergien). Nach einer Abnahme während der COVID-19-Pandemie ist die Anzahl der Reisenden 2022 international wieder auf insgesamt 900 Millionen angestiegen (1). Auch ältere Personen mit entsprechenden chronischen Vorerkrankungen reisen häufiger als früher und haben ein höheres Risiko, während der Reise zu erkranken. Hausärztinnen und Hausärzte werden somit oft nach Empfehlungen für die Reiseapotheke gefragt. Der vorliegende Artikel fasst zusammen, welche Medikamente und Produkte in eine gute Reiseapotheke gehören und erörtert die wichtigsten Indikationen und Besonderheiten. Für bestimmte Zielgruppen, wie z.B. Schwangere, Kinder, ältere Personen und Personen mit chronischen Erkrankungen, sind diese Überlegungen besonders wichtig. Es gelten einige allgemeine Empfehlungen: Die Reiseapotheke gehört ins Handgepäck, damit sie während der Reise nicht verloren gehen kann. Sie soll vor jeder Reise auf Vollständigkeit und Ablaufdaten überprüft werden. Der Inhalt der Reiseapotheke wird im Artikel nach den wichtigsten Kategorien geordnet. Mit den folgenden Tipps können die meisten Fragen der Reisenden beantwortet werden. In komplexen Fällen empfiehlt sich die individuelle Beratung in einer spezialisierten reisemedizinischen Sprechstunde.
Vorbestehende Medikation
Personen, welche auf eine Dauermedikation und/oder Bedarfsmedikation angewiesen sind, müssen diese auch während der Reise zuverlässig einnehmen können. Es wird empfohlen, die entsprechende Menge an Medikamenten für die Dauer der Reise plus eine zusätzliche kleinere Menge als Notvorrat mitzunehmen. Dabei sollten die Medikamente zwischen dem Handgepäck und dem grösseren Gepäck aufgeteilt werden, als Back-up bei Verlust eines Gepäckstücks. Für das Mitführen von Arzneimitteln mit kontrollierten Substanzen oder grösseren Mengen verschreibungspflichtiger Medikamente wird je nach Land ein ärztliches Zeugnis benötigt. Insbesondere Reisenden unter Antikoagulation, mit insulinpflichtigem Diabetes mellitus oder Epilepsie wird empfohlen, einen entsprechenden Ausweis mitzunehmen. Spezielle Therapien und ihre Anpassung während der Reise sollten Patienten vorgängig mit der jeweiligen ärztlichen Fachperson besprechen.
Insektenschutz
In tropischen und subtropischen Ländern können eine Vielzahl von Infektionskrankheiten durch Insekten übertragen werden, wie z.B. Malaria und Dengue-Fieber. Mit den richtigen Schutzmassnahmen kann das Risiko von Insekten-übertragenen Erkrankungen minimiert werden. Repellentien (so genannte «Mückensprays») werden auf die unbedeckte Haut aufgetragen. Wirksame Repellentien enthalten beispielsweise den Wirkstoff DEET (Diethyltoluamid), in einer Konzentration von circa 30% (z.B. Anti Brumm® forte, Kik Active®, Nobite Extreme®) (2). DEET-basierte Repellentien gehören zu den bestuntersuchten und wirksamsten Insektenschutzmitteln und können auch für Kinder ab 2 Monaten sowie bei Schwangeren benutzt werden (3). Alternativ kommen Mittel mit den Wirkstoffen Icaridin (z.B. Bayrepel®, Anti Brumm® Kids sensitive) oder EBAAP® (Ethyl-Butylacetylaminopropionate) in Frage. Die Wirkdauer dieser Repellentien hängt von der Wirkstoffkonzentration sowie individuellen Faktoren wie Schwitzen oder Abrieb ab. Unter tropischen Bedingungen ist von einer Schutzdauer von 2-4 Stunden auszugehen. Repellentien werden durch die Haut aufgenommen, entsprechend sind Ganzkörperanwendungen nicht empfohlen (nur exponierte Stellen, kombiniert mit langer Kleidung). Hände und Gesicht sollten ausgespart werden, insbesondere bei Kindern, um eine orale Aufnahme möglichst zu vermeiden. Insektizide, die auf Textilien aufgetragen werden, bieten einen zusätzlichen Schutz. Sie enthalten meistens Permethrin oder Pyrethrum (z.B. Nobite textile®, KIK Textile®) und können für die Imprägnierung von Kleidern und Moskitonetzen verwendet werden.
Malaria-Medikamente
1. Malaria-Prophylaxe
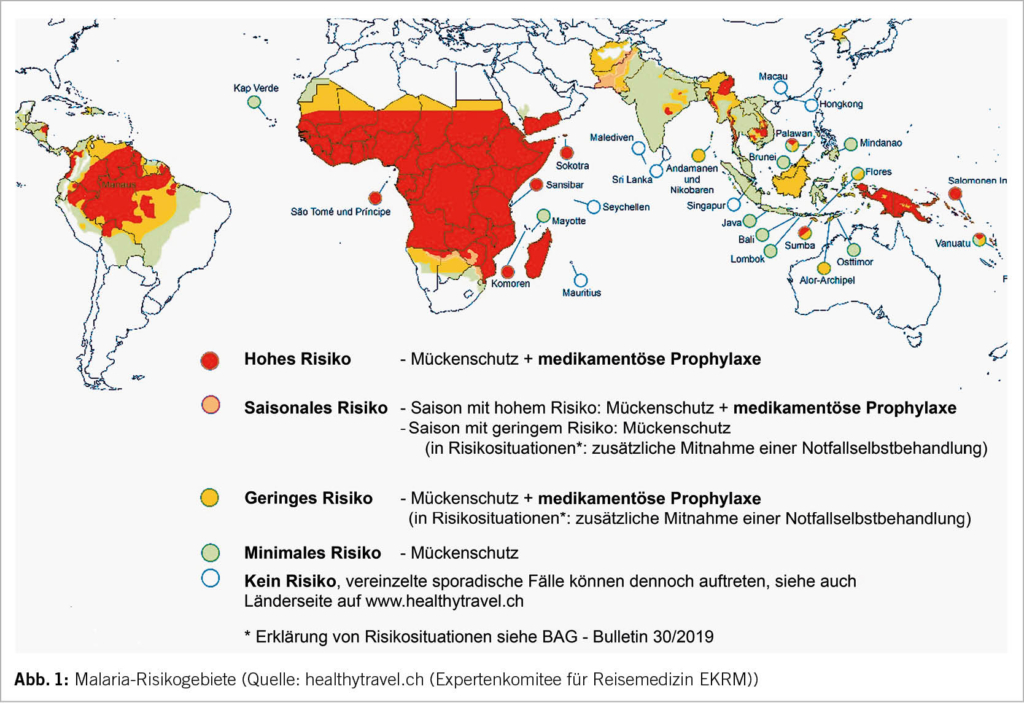
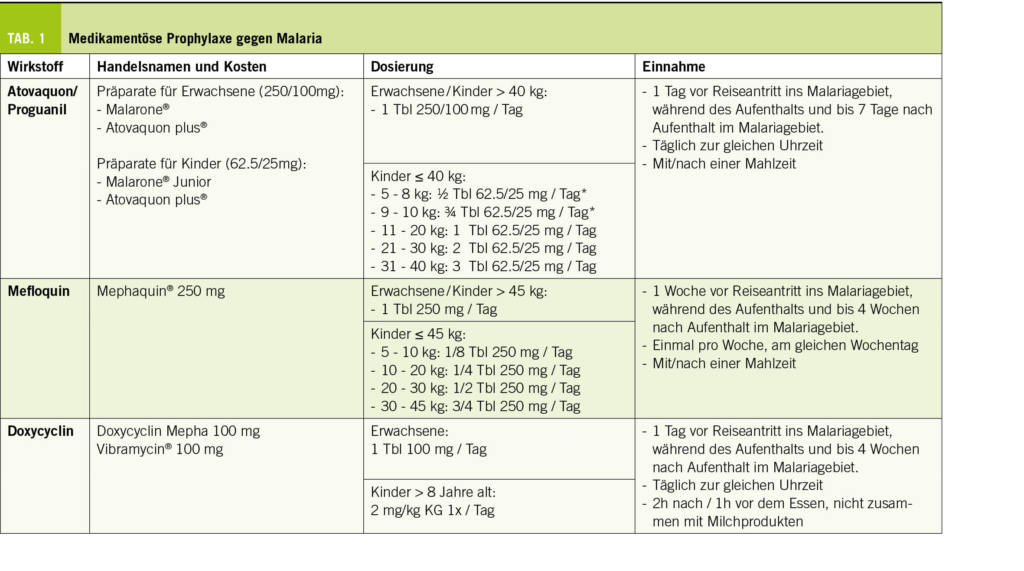
Bei Reisen in Hochrisiko-Gebiete für Malaria ist zusätzlich zum Insektenschutz eine medikamentöse Prophylaxe empfohlen. Verschiedene Optionen stehen zur Verfügung (Tab. 1). Das am häufigsten verwendete Medikament ist Atovaquon/Proguanil (Malarone®). Es eignet sich für die meisten Reisenden, wird täglich eingenommen und hat ein günstiges Nebenwirkungsprofil. Für eine optimale Verträglichkeit sollte es mit dem Essen eingenommen werden. Aufgrund fehlender Daten ist Malarone für Schwangere, Kinder unter 5 kg Körpergewicht und während der Stillzeit nicht empfohlen.
Mefloquin (Mephaquin®) hat eine vergleichbare Wirksamkeit wie Atovaquon/Proguanil (Malarone®) und wird aufgrund der Einnahme-Modalitäten (1 x wöchentlich, teil- und mörserbar) oft als Alternative bei Kindern und für längere Aufenthalte in Hochrisikogebieten bevorzugt. Zu den potentiellen Nebenwirkungen gehören Nausea, Dyspepsie, Schwindel und seltener das Auftreten von psychischen Veränderungen wie Insomnie, Konzentrationsstörung und Stimmungsschwankungen. In sehr seltenen Fällen kann es zu Angststörungen, Depression, Krampfanfällen und Psychosen kommen. Aus diesem Grund ist die Einnahme von Mefloquin bei Personen mit vorbekannten psychischen Problemen nicht empfohlen. Bei Kindern ist die Nebenwirkungshäufigkeit geringer als bei Erwachsenen. Die meisten Nebenwirkungen, die zu einem Abbruch der Prophylaxe führen, treten innerhalb der ersten zwei bis drei Gaben auf (4). Es wird empfohlen, die Einnahme 2-3 Wochen vor Abreise zu beginnen, sodass die Toleranz des Medikamentes getestet werden kann, um das Präparat gegebenenfalls vor Abreise noch austauschen zu können. Mefloquin ist als Prophylaxe auch die erste Wahl während der Schwangerschaft.
Doxycyclin stellt eine weitere Option für die Malaria-Prophylaxe dar, wobei die Photosensibilisierung zu den häufigen Nebenwirkungen zählt. Dies macht gerade in tropischen Ländern einen sehr gewissenhaften Sonnenschutz notwendig. Frauen sollten zudem informiert werden, dass Doxycyclin mit einem erhöhten Risiko für Candida-Vulvovaginitis assoziiert ist.
2. Notfallmässige Malaria-Selbstbehandlung
Die Indikation für die Mitnahme einer sogenannten notfallmässigen Selbstbehandlung für Reisen in Gebieten mit geringem Malariarisiko wurde in den letzten Jahren eingegrenzt (5). Da sich die medizinische Infrastruktur in den Reiseländern deutlich verbessert hat, ist eine zeitnahe Malariadiagnostik und -therapie in den allermeisten Fällen gut erreichbar. Daten weisen zudem darauf hin, dass die Notfall-Einnahme nur von einem sehr kleinen Anteil der Reisenden korrekt umgesetzt wurde (6). Die Mitnahme von Notfallmedikamenten wird daher nur noch in speziellen Risikosituationen empfohlen, zum Beispiel bei Reisen in entlegene ländliche Gebiete, wenn eine medizinische Einrichtung nicht innerhalb von 48 Stunden erreichbar ist. Unabhängig von den verfügbaren medikamentösen Strategien ist es wichtig, allen Reisenden in Malaria-Risikogebiete das Bewusstsein für das Malariarisiko und die Wichtigkeit eines optimalen Mückenschutzes zu vermitteln. Bei Auftreten von Fieber während oder auch erst Monate nach einer Reise, muss an eine Malaria gedacht werden.
Diarrhoe
Die akute Reisediarrhoe gehört zu den häufigsten Krankheiten bei Reisenden (7). Die Symptomatik ist in den meisten Fällen nach wenigen Tagen selbstlimitierend, sodass eine spezifische Behandlung mit Antibiotika in der Regel nicht indiziert ist. Eine adäquate Flüssigkeitszufuhr mit Elektrolytsubstitution ist die wichtigste Massnahme. Dafür können vorgefertigte Elektrolytlösungen wie z.B. Normolytoral® benutzt werden, insbesondere bei Kindern. Darmmotilitätshemmer wie Loperamid (z.B. Imodium®) können bei fehlenden Warnzeichen (Fieber, Dysenterie) bei Erwachsenen und bei Kindern ab 6 Jahren eingesetzt werden.
Fieber/Schmerzen
Zur analgetischen und antipyretischen Therapie auf Reisen ist Paracetamol (z.B. Dafalgan®) zu bevorzugen. Acetylsalicylsäure (z.B. Aspirin®) oder andere nicht-steroidale antiinflammatorische Medikamente (NSAR) sollten vermieden werden, da dadurch das Risiko von Blutungskomplikationen im Fall einer Dengue-Virus-Infektion erhöht wird (8). Bei Kindern ist die gewichtsadaptierte Dosierung von Paracetamol und die orale Einnahme zu beachten. Suppositorien sind ungeeignet, da sie bei warmen Temperaturen schmelzen und dann nicht mehr verabreicht werden können. Ein Fieberthermometer ist ein wichtiges Utensil in jeder Reiseapotheke, da, wie schon beschrieben, bei Fieber sofort eine Malariadiagnostik in die Wege geleitet werden sollte.
Verschiedenes
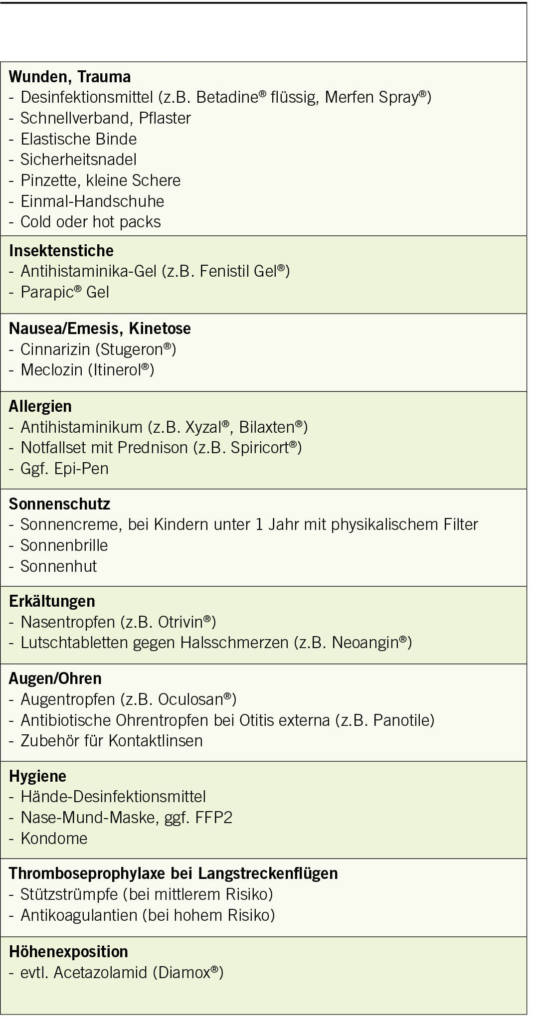
Weitere Medikamente und Produkte, die während einer Reise hilfreich sein können, finden sich in Tabelle 2. Bei komplexen Reisesituationen empfiehlt sich eine individuelle Beratung in einer reisemedizinischen Sprechstunde. Weitere hilfreiche Tipps und länderspezifische Informationen finden Sie auf www.healthytravel.ch.
Copyright bei Aerzteverlag medinfo AG
Reisemedizin, Klinik für Infektiologie/Spitalhygiene
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Reisemedizin, Klinik für Infektiologie/Spitalhygiene
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Reisemedizin, Klinik für Infektiologie/Spitalhygiene
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Die Autorinnen/der Autor haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1. UNWTO World Tourism Barometer and Statistical Annex, January 2023: UNWTO World Tourism Barometer (English version): Vol 21, No 1 [Internet]. [cited 2023 Mar 20]. Available from: https://www.e-unwto.org/doi/epdf/10.18111/wtobarometereng.2023.21.1.1
2. Fradin MS, Day JF. Comparative efficacy of insect repellent against mosquito bites. N Engl J Med. 2002;347(1):13–8.
3. Schlagenhauf P, Haller S, Wagner N, Chappuis F. Malaria und Kinder, die reisen – Prophylaxe und Therapie. Ther Umschau [Internet]. 2013 Jun 1;70(6):323–33. Available from: https://econtent.hogrefe.com/doi/10.1024/0040-5930/a000411
4. Chen LH, Wilson ME, Schlagenhauf P. Controversies and Misconceptions in Malaria Chemoprophylaxis for Travelers. JAMA [Internet]. 2007 May 23;297(20):2251. Available from: http://jama.jamanetwork.com/article.aspx?doi=10.1001/jama.297.20.2251
5. Schweizerisches Expertenkommitees für Reisemedizin. Aktualisierte Empfehlungen des Schweizerischen Expertenkomitees für Reisemedizin zur Prävention einer Malaria bei Reisenden 2019 : angepasster Einsatz der notfallmässigen Selbstbehandlung ( NSB ) und der medikamentösen Prophylaxe. BAG-Bulletin 30. 2019.
6. Tan R, Elmers J, Genton B. Malaria standby emergency treatment (SBET) for travellers visiting malaria endemic areas: a systematic review and meta-analysis. J Travel Med [Internet]. 2019 Apr 17;1–8. Available from: https://academic.oup.com/jtm/advance-article/doi/10.1093/jtm/taz027/5475009
7. Steffen R, Hill DR, DuPont HL. Traveler’s diarrhea a clinical review. JAMA – J Am Med Assoc. 2015;313(1):71–80.
8. World Health Organization (WHO). Dengue and severe dengue [Internet]. 2022 [cited 2023 Mar 20]. Available from: https://www.who.int/news-room/fact-sheets/detail/dengue-and-severe-dengue
9. UpToDate
10. HealthyTravel.ch