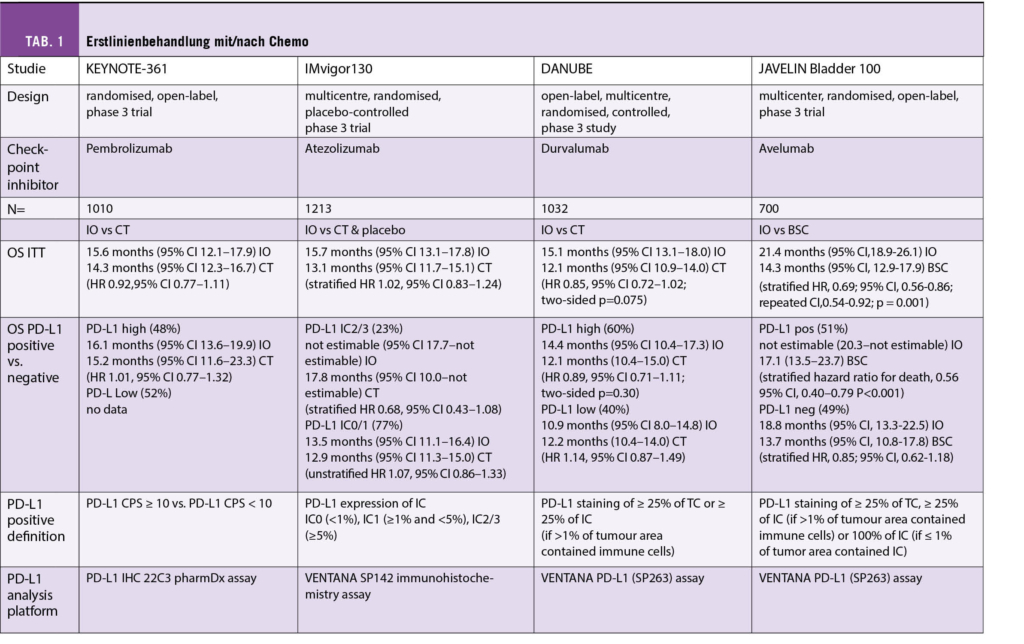
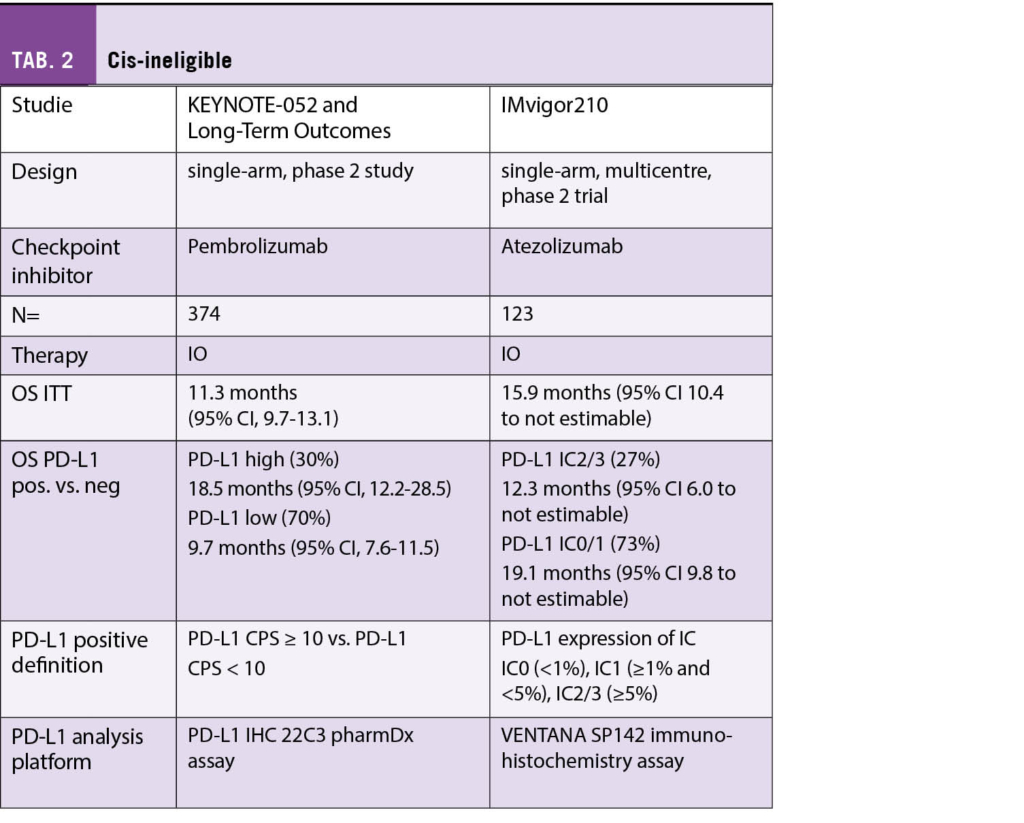
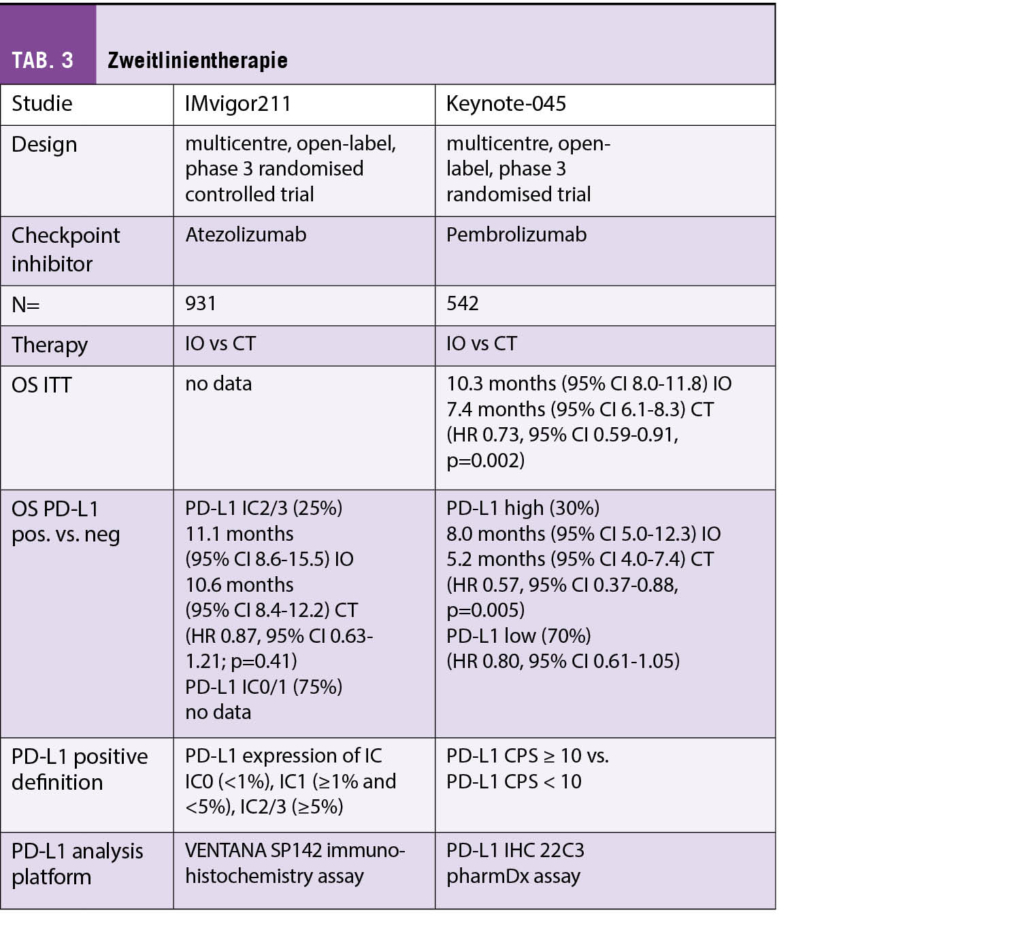
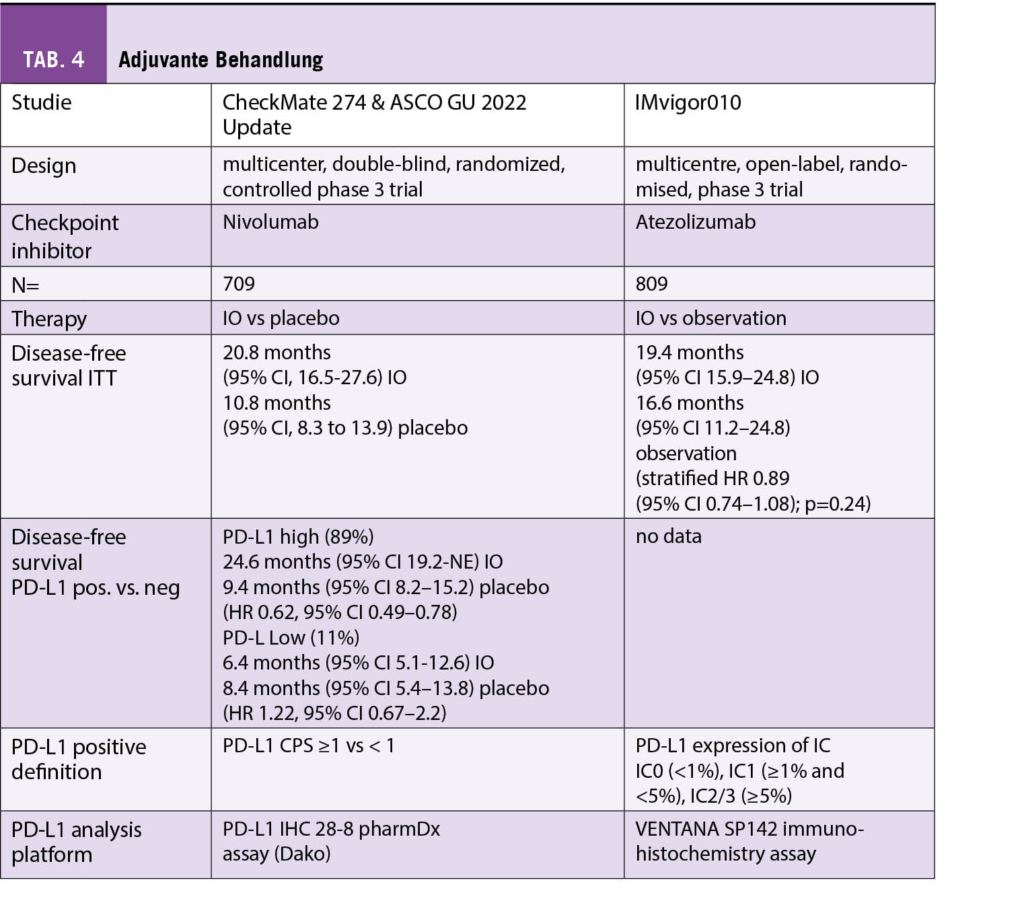
Seit September 2021 ist Manuela Eicher neue Präsidentin der Onkologiepflege Schweiz (OPS).
Im Interview erzählt sie, wie sie zu diesem Amt gekommen ist, was sie als Präsidentin erreichen möchte – und welches ihr Lieblingsessen ist.
Manuela, wie bist du zu deinem Amt als OPS-Präsidentin gekommen?
Ich bin seit rund zehn Jahren OPS-Mitglied. Früher war ich mehr engagiert in der akademischen Fachgesellschaft Onkologiepflege, wo ich ein paar Jahre lang Präsidentin war, und auf europäischer Ebene, beispielsweise bei der EONS. Bei der OPS war ich nur im Hintergrund tätig, zum Beispiel bei Kongressvorbereitungen. Als die Präsidentschaft ausgeschrieben wurde, habe ich mich darum beworben, nachdem ich vorher mit Irène Bachmann und verschiedenen Vorstandsmitgliedern gesprochen hatte.

Du bist jetzt seit rund acht Monaten OPS-Präsidentin. Wie hast du diese Zeit erlebt?
Ich hatte einen sanften Einstieg, da ich die OPS und die Vorstandsmitglieder ja schon lange kenne. In den ersten Sitzungen beschlossen wir gemeinsam eine Neuorganisation des Vorstands: Zukünftig werden wir mit einem Co-Präsidium sowie definierten Ressorts arbeiten und die Verantwortlichkeiten unter den Mitgliedern aufteilen. Damit organisieren wir uns nun gleich wie andere Onkologiepflege-Organisationen, zum Beispiel in den USA oder Kanada. Hier möchte ich auch anmerken, dass die Arbeit im Vorstand mehrheitlich ehrenamtlich erfolgt. Die Mitglieder bekommen für Sitzungen ein Sitzungsgeld, aber ihr Engagement geht natürlich weit darüber hinaus.
Wir möchten als OPS auch vermehrt politisch Stellung beziehen, und dazu hatten wir letzten Herbst bereits Gelegenheit bei der Pflegeinitiative und deren Folgen. Gemeinsam mit oncosuisse bezogen wir eine ganz klare Position und publizierten einen offenen Brief, in dem wir auf die grosse Belastung des Pflegepersonals aufmerksam machten und für eine Annahme der Initiative plädierten. Diese Abstimmung war sehr wertvoll. Vielen Menschen wurde bewusst, was Pflegende leisten und dass es in Zukunft mehr Pflegende braucht. Das gilt ganz besonders für die Onkologie, weil Krebserkrankungen bei mehr und mehr Patientinnen und Patienten zu chronischen Krankheiten werden. Die Betroffenen und ihre Angehörigen brauchen nicht nur Therapien, sondern auch Unterstützung im Umgang mit der Krankheit – und da sind die Pflegenden gefragt.
Was möchtest du mit der OPS erreichen?
Für mich ist es ein Anliegen, dass die OPS noch mehr zu einer Organisation mit einer gemeinsamen Identität wird. Es gibt sehr viele Aktivitäten in der Romandie, im Tessin und in der Deutschschweiz, aber der Brückenschlag zwischen den Landesteilen scheint mir noch nicht ganz gelungen. Ich glaube, dazu kann ich viel beitragen, da ich bilingue bin und die beiden grösseren Sprachregionen recht gut kenne.
Mir ist ebenfalls wichtig, dass die Stimme der Pflegenden stärker gehört wird, auch auf politischer Ebene. Ich bin in verschiedenen nationalen Gremien tätig, unter anderem in der SAKK, der SAMW und der nationalen Qualitätskommission. Meine Vernetzung kann der OPS hoffentlich nützlich sein. Das sind auch Gründe, warum ich mich als Präsidentin zur Verfügung gestellt habe.
Zudem soll die OPS in der Onkologie-Community noch besser sichtbar werden. Allen soll klar sein, welch grossen Beitrag die Onkologiepflegenden für die Versorgung der betroffenen Personen leisten. Deshalb müssen wir uns zum Beispiel im Board der oncosuisse auch zu Themen äussern, die nicht nur die Pflegenden betreffen – so können wir die Sicht der Pflegenden auch bei übergeordneten Aspekten einbringen.
Soll die OPS auch vermehrt an Kongressen präsent sein?
Auf jeden Fall, auch international. Wir beteiligen uns regelmässig am Pflegeprogramm des DGHO-Kongresses, dem gemeinsamen Kongress der deutschen, schweizerischen und österreichischen Onkologie-Gesellschaften. Und ab diesem Jahr sind wir im Komitee des Schweizerischen Kongresses für Onkologie und Hämatologie (SOHC) vertreten und nehmen am Kongress im November in Basel teil. Wie andere wichtige onkologische Gesellschaften der Schweiz sind wir nun also auch dort vertreten.
Wie wichtig ist Nachwuchsförderung?
Sehr wichtig! Wir müssen und wollen zeigen, dass Onkologiepflege ein attraktives Berufsfeld ist und es sich lohnt, in die Onkologiepflege einzusteigen. Im Vorstand und im Beirat haben wir inzwischen zwei neue junge Mitglieder, die auch die Sicht der jüngeren Generation einbringen.
Welche Rolle spielt die Forschung bei der Weiterentwicklung der Onkologiepflege?
In meiner Tätigkeit als Forscherin habe ich gemerkt, dass Forschung allein wenig verändern kann. Es braucht die enge Verzahnung von Forschung, Praxis, Weiterbildung und Gesundheitspolitik, um Veränderungen anzustossen. Hier kann ich mit meinem akademischen Hintergrund sicher auch Impulse geben, dass die Vernetzung der Praxis mit der akademischen Welt noch besser gelingt. Dabei ist aber die Praxisorientierung entscheidend. Das Ziel muss immer sein, dass wir den Pflegenden in der Praxis möglichst viel Unterstützung anbieten, sodass sie ihre Rolle gut ausfüllen können.
Welche Themen interessieren dich in der Forschung besonders?
Das sind drei Bereiche. Erstens wie man Patientinnen und Patienten möglichst gut in die Pflege- und Therapieprozesse einbinden kann, zum Beispiel mit patient-reported outcomes. Zweitens die Unterstützung des Symptommanagements, und zwar sowohl das Selbstmanagement der Patienten und Patientinnen als auch das pflegerische Management. Als drittes interessiert mich die Rolle der Onkologiepflegenden: Welche Kompetenzen müssen sie mitbringen, damit sie möglichst gut auf die Bedürfnisse der Krebsbetroffenen eingehen können?
Dein erstes Fazit zu deiner Tätigkeit als OPS-Präsidentin?
Für mich ist es eine grosse Ehre und Freude, dieses Amt zu übernehmen. Es passt auch gut in meine jetzige Lebensphase: Ich bin jetzt 51, meine beiden Kinder sind 16 und 14. Die OPS ist sehr gut aufgestellt, dank der beeindruckenden Arbeit von Irène Bachmann: Sie hat die OPS geformt, zu einem wichtigen nationalen Dachverband gemacht und viel Pionierarbeit geleistet. Sie musste sich in verschiedenen Gremien sicher noch mit Vorurteilen gegenüber Frauen und Pflegenden auseinandersetzen. Dass ich eine Frau bin, ist heute kaum mehr ein Thema. Eher wird es noch als seltsam empfunden, dass Pflegende forschen – und das in der Pflege. An der ersten Sitzung der SOHC-Beteiligten wurde die OPS begeistert begrüsst, da damit ein wichtiger Schritt in Richtung einer «Cancer Community» gemacht wird. Das wäre vor 30 Jahren vielleicht noch nicht möglich gewesen.
Wann in deiner Karriere kamst du erstmals in Berührung mit Onkologiepflege?
Ich arbeitete zu Beginn meiner Laufbahn in der Inneren Medizin. Während meines Studiums der Pflegewissenschaften machte ich meine Masterarbeit in der Onkologie: Ich untersuchte, wie Ärztinnen, Ärzte und Pflegende mit den Patientinnen und Patienten in ambulanten onkologischen Abteilungen interagieren. Darauf wurde ich im Brust- und Tumorzentrum im Inselspital angestellt, um die Rolle einer Breast Care Nurse zu entwickeln, und machte auch meine Doktorarbeit zu diesem Thema. Praktisch habe ich nie in der Onkologiepflege gearbeitet, ich habe aber Erfahrung in der Inneren Medizin und im Bereich HIV/Aids. Die Pflege dort ähnelt in vielerlei Hinsicht der Arbeit mit Personen, die an Krebs erkrankt sind.
Spielt es für dein Amt eine Rolle, dass du keine Onkologiepflegende bist?
Das kann ich selbst nicht so gut beurteilen. Die Zusammenarbeit mit den Kolleginnen aus der Praxis gestaltet sich aus meiner Wahrnehmung sehr konstruktiv. Das ist auch in meinem Beruf so. Im Universitätsspital Lausanne (CHUV) habe ich auf der Abteilung der ambulanten Onkologie ein Büro und bin dort im regelmässigen Austausch mit Pflegeforscherinnen und Pflegenden. Mir ist immer sehr wichtig, genau hinzuhören, was meine Kolleginnen aus der Praxis sagen.
Wie sieht dein Arbeitsalltag aus, wenn du nicht gerade mit dem Vorstand der OPS zusammensitzt?
Ich habe drei grosse Aufgaben: Die Leitung eines Instituts, was sehr viele Gespräche mit Mitarbeitenden, Partnern, der Direktion etc. sowie Entwicklungsarbeit mit sich bringt. Dann bin ich Professorin an der Universität Lausanne, halte Vorlesungen auf Masterniveau und betreue Studierende, die zu onkologischen Themen eine Master- oder Doktorarbeit schreiben. Das ist bereits eng verknüpft mit dem dritten Gebiet, der Forschung: Ich entwickle und leite Studien. An diesen sollen die Patient:innen zukünftig noch stärker direkt beteiligt sein. Einen «normalen» Arbeitsalltag habe ich deshalb nicht, jeder Tag ist anders, oft mit vielen Terminen.
Wohnst du in Lausanne?
Nein, in Fribourg. Mein Mann ist Professor in Bern, und so pendeln wir beide mit dem Zug zur Arbeit und die Kinder gehen in Fribourg zur Schule. Das Pendeln macht mir nichts aus: Am Morgen kann ich den Arbeitstag vorbereiten, am Abend von der Arbeit «runterfahren».
Wachsen deine Kinder bilingue auf?
Sogar «trilingue», denn mit meinem Mann reden sie hochdeutsch, mit mir schweizerdeutsch und in Schule und Freizeit deutsch und französisch. Das ergibt manchmal ein herrliches Kauderwelsch!
Wie verbringst du deine Freizeit?
Ich bin sehr gerne draussen, am liebsten am Wasser oder in den Bergen, zu Fuss oder mit dem Velo. Wenn ich einen Tag draussen unterwegs sein kann, ist das für mich wie eine Woche Ferien! Zum anderen liebe ich es, mit anderen Menschen zusammen zu sein, beim Kochen, Essen, Diskutieren …
Hast du einen Sehnsuchtsort?
Ich habe ein Jahr in Brasilien gelebt. Als ich dort ankam, fühlte es sich für mich an, als wäre ich endlich zu Hause. Das brasilianische Lebensgefühl liebe ich bis heute, die Freude an der Musik, an der Bewegung, die Spontaneität.
Welche Zeitungen liest du? Und auf Papier oder online?
Die «Freiburger Nachrichten» haben wir wegen der Lokalnachrichten abonniert, die lese ich auf Papier. Ein «Spiegel» liegt immer neben meinem Bett. Und am Wochenende lesen wir die «Süddeutsche Zeitung», ebenfalls auf Papier. Diverse andere Zeitungen lese ich online.
Hast du ein Lieblingsessen?
Raclette am Feuer. Damit bin ich aufgewachsen. Ich ging mit meinen Grosseltern wandern, und da hatte der Grossvater manchmal einen halben Raclettekäse im Rucksack, und die Kartoffeln dazu transportierte meine Grossmutter in einer Thermoskanne. In meinem Haus haben wir das Chemineé umbauen lassen, jetzt kann man bequem Raclette am Feuer zubereiten. Das zelebrieren wir nun mit unseren Kindern, und sie lieben es ebenfalls!
Dr. med. Eva Ebnöther
Erstpublikation des Artikels 2021, Zeitschrift Onkologiepflege
Zur Person:
Manuela Eicher hat ein Diplom in allgemeiner Krankenpflege der Lindenhof Schule in Bern, einen Bachelor und einen Master of Science in Pflege (BScN und MScN) und einen Doctor rerum medicinalium der Universität Witten / Herdecke in Deutschland. In Fribourg war sie als Dekanin für Angewandte Forschung und Entwicklung an der Haute Ecole de Santé (HEdS-FR) tätig. Im Juni 2016 wurde sie zur Professeure Associée des Universitätsinstituts für Lehre und Forschung in Versorgungswissenschaften (IUFRS) der Universität Lausanne ernannt. Am Departement d’Oncologie des Universitätsspitals Lausanne (CHUV) leitet Manuela Eicher die Pflegeforschung. Sie ist zudem in verschiedenen internationalen und nationalen Institutionen vertreten (EONS, IPOS, MASSC, SIDIIEF, akademische Fachgesellschaft Onkologiepflege des VfP, SAMW, SBK, SAKK, SVFM).