Die Behandlung von Brustkrebs konnte in den letzten Jahren stetig verbessert werden. Mittlerweile liegt die Überlebensrate bei ca. 80%.
Das liegt auch daran, dass es für die behandelnden Ärzte zunehmend leichter wird, individuelle Therapieempfehlungen für jede Patientin auszusprechen. Multigentests spielen neben den prognostischen klinisch-pathologischen Faktoren bei der Bestimmung des Rezidivrisikos eine wesentliche Rolle. Der Oncotype DX Breast Recurrence Score® Test verfügt über die Prognose hinaus über prädiktive Eigenschaften und ermöglicht so eine Einschätzung über den voraussichtlichen Nutzen einer Chemotherapie. Prof. Dr. med. Christian Kurzeder, Chefarzt am Brustzentrum des Universitätsspitals Basel, und PD Dr. med. Marcus Vetter, leitender Arzt für medizinische Onkologie am Brustzentrum Basel, behandeln jährlich ca. 200 Patientinnen mit neu diagnostiziertem Brustkrebs. Im Interview erklären sie die Funktion von Multigentests und die Bedeutung von Prädiktion für die Brustkrebstherapie
Apport de la neuro-imagerie dans le diagnostic des troubles cognitifs
Les troubles cognitifs représentent une condition prévalente et invalidante avec un impact majeur sur la santé publique. Dans la démarche diagnostique, les techniques d’ imagerie radiologique et de médicine nucléaire peuvent souvent déterminer l’ étiologie du déclin cognitif et ainsi permettre une prise en charge individualisée et adaptée. Dans cet article nous allons résumer les indications et l’ apport des différentes techniques d’ imagerie utilisées en pratique clinique.
Face au vieillissement de la population, les troubles cognitifs sont devenus un enjeu de santé publique prioritaire, avec une prévalence en Suisse en 2019 de 154 700 personnes et près de 29 500 nouveaux cas par année (source OFSP). L’ impact économique est très important avec près de 11.8 milliards de francs dépensés en 2017 selon une étude réalisée en 2019 sur mandat de l’ Association Alzheimer, sans compter les pertes en lien avec des retraits précoces de population active. Face à cela, il apparaît important de mettre en œuvre des stratégies d’ investigation permettant d’ établir un diagnostic précoce et correct, permettant de mettre en place une prise en charge médicale et sociale adaptée à ces patients. Ceci peut comprendre un accompagnement personnalisé, mais aussi l’ institution de traitements pour freiner la progression du déclin et pour diminuer ses symptômes. Le tableau clinique seul, sans examen d’ imagerie associée, ne permet pas en effet de différencier avec une précision satisfaisante un déclin cognitif dû, par exemple, à une dépression, d’ un processus neurodégénératif.
Parmi les principales causes de démence on trouve notamment: la maladie neurodégénérative d’ Alzheimer (MA) – qui représente à elle seule deux tiers des cas – la démence d’ origine vasculaire, la maladie à corps de Lewy, et la démence fronto-temporale.
Le diagnostic initial d’ un trouble cognitif repose sur la clinique et le bilan neuropsychologique, à la suite desquels il sera possible d’ établir des hypothèses étiologiques, qui seront ensuite confirmées ou infirmées grâce à l’ imagerie. En effet, grâce aux progrès technologiques récents et à la complémentarité de la neuro-imagerie anatomique et moléculaire, il est dorénavant possible d’ établir dans la majorité des cas un diagnostic étiologique précis (1).
Imagerie anatomique par IRM
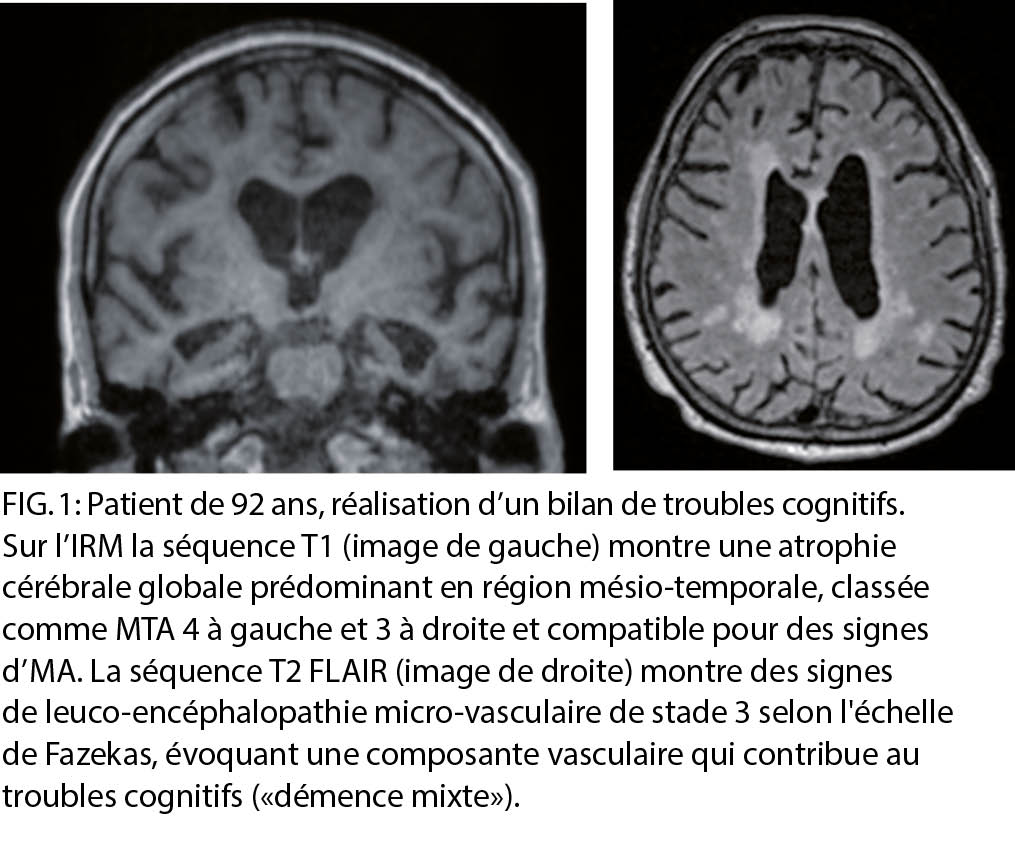
L’ imagerie anatomique a pour but initial d’ exclure une cause traitable, chirurgicale ou non, expliquant les troubles cognitifs (p.ex.: hématome extra-/sous-dural, hydrocéphalie, tumeur, encéphalite). Elle permet ensuite d’ orienter le diagnostic notamment par la recherche d’ une atrophie cérébrale générale ou focalisée sur une région du cerveau, compatible avec une démence dégénérative primaire, ainsi que la recherche de lésions vasculaires, telles que les séquelles d’ infarctus ou d’ anomalies de signal de la substance blanche. La modalité d’ imagerie recommandée en première intention est l’ IRM, plus sensible que le scanner, avec un protocole comprenant les séquences résumées dans le tableau 1 (2) (fig. 1).
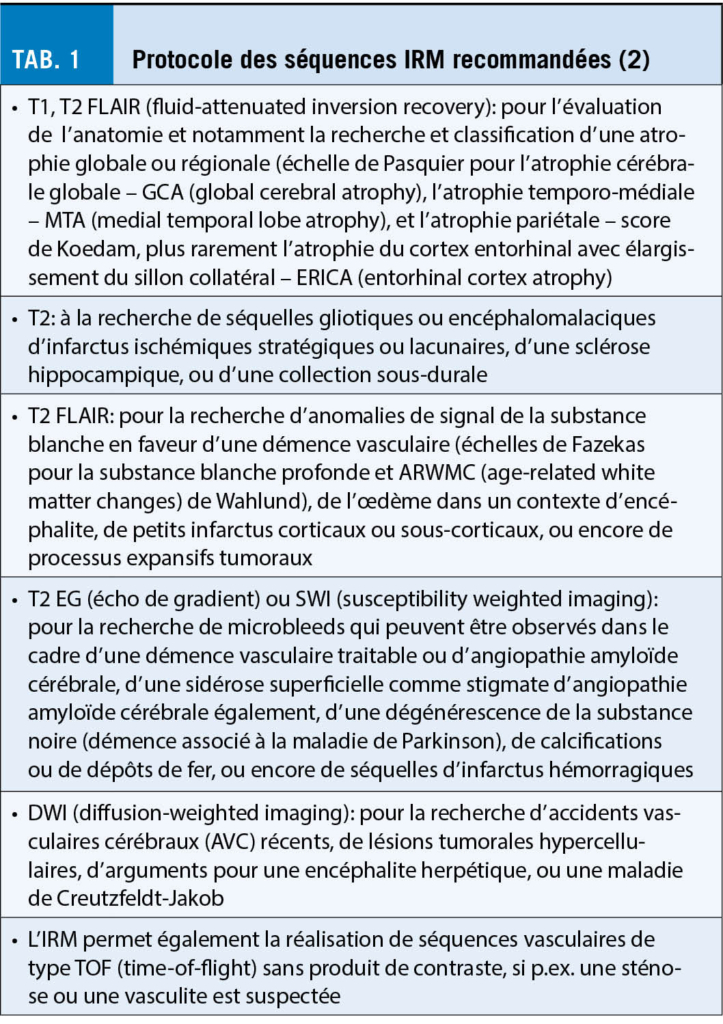
Des techniques d’ IRM avancées qui ne sont pas utilisées en routine clinique mais qui peuvent contribuer au diagnostic d’ une démence comprennent le DTI (diffusion tensor imaging), la perfusion ASL (arterial spin labeling) et la resting state fMRI (IRM fonctionnelle). Les examens IRM peuvent facilement être répétés pour surveiller la vitesse de progression d’ un atteinte neurodégénérative ou vasculaire, pour juger de l’ effet d’ un traitement débuté. Des examens IRM répétées sont également utiles pour exclure des effets secondaires de traitements anti-amyloïdes tels que l’ ARIA (amyloid-related imaging abnormalities). Quand l’ IRM n’ est pas disponible ou contre-indiquée, ou chez les patient claustrophobiques ou ne supportant pas un examen d’ une certaine durée, un scanner sans injection de produit de contraste peut être proposé. Il permettra notamment d’ apprécier la trophicité cérébrale et la présence de séquelles vasculaires, même si son contraste est moindre.
Imagerie moléculaire par TEP et TEMP
Devant une forme cliniquement atypique ou une évolution rapide de troubles cognitifs, chez les patients jeunes (<65 ans), ou dans tous les cas dans lesquels l’ évaluation clinique, neuropsychologique et d’ imagerie morphologique ne permettent pas au médecin d’ arriver à un diagnostic avec un niveau de confiance adéquat, des examens d’ imagerie moléculaire peuvent s’ avérer un outil complémentaire précieux (3). Plusieurs modalités d’ imagerie utilisant différents radiotraceurs sont utilisées à l’ heure actuelle pour ces bilans parmi lesquels on trouve la tomographie par émission de positrons (TEP) avec de la 18F-fluorodésoxyglucose (18F-FDG), la TEP amyloïde et la TEMP (tomographie par émission mono-photonique) au 123I-ioflupane (DaT scan).
La TEP cérébrale avec 18F-FDG permet de réaliser une imagerie du métabolisme cérébral, en utilisant un radiotraceur constitué d’ une molécule de glucose sur laquelle un groupe hydroxyle est remplacé par du 18-fluor. Le radiotraceur est transporté dans les cellules par des transporteurs de glucose, puis phosphorylé, restant ainsi piégé dans les cellules et permettant d’ étudier le métabolisme cellulaire régional. L’ examen est réalisé avec des appareils hybrides qui associent l’ acquisition TEP avec une imagerie de tomodensitométrie (TEP-TDM).
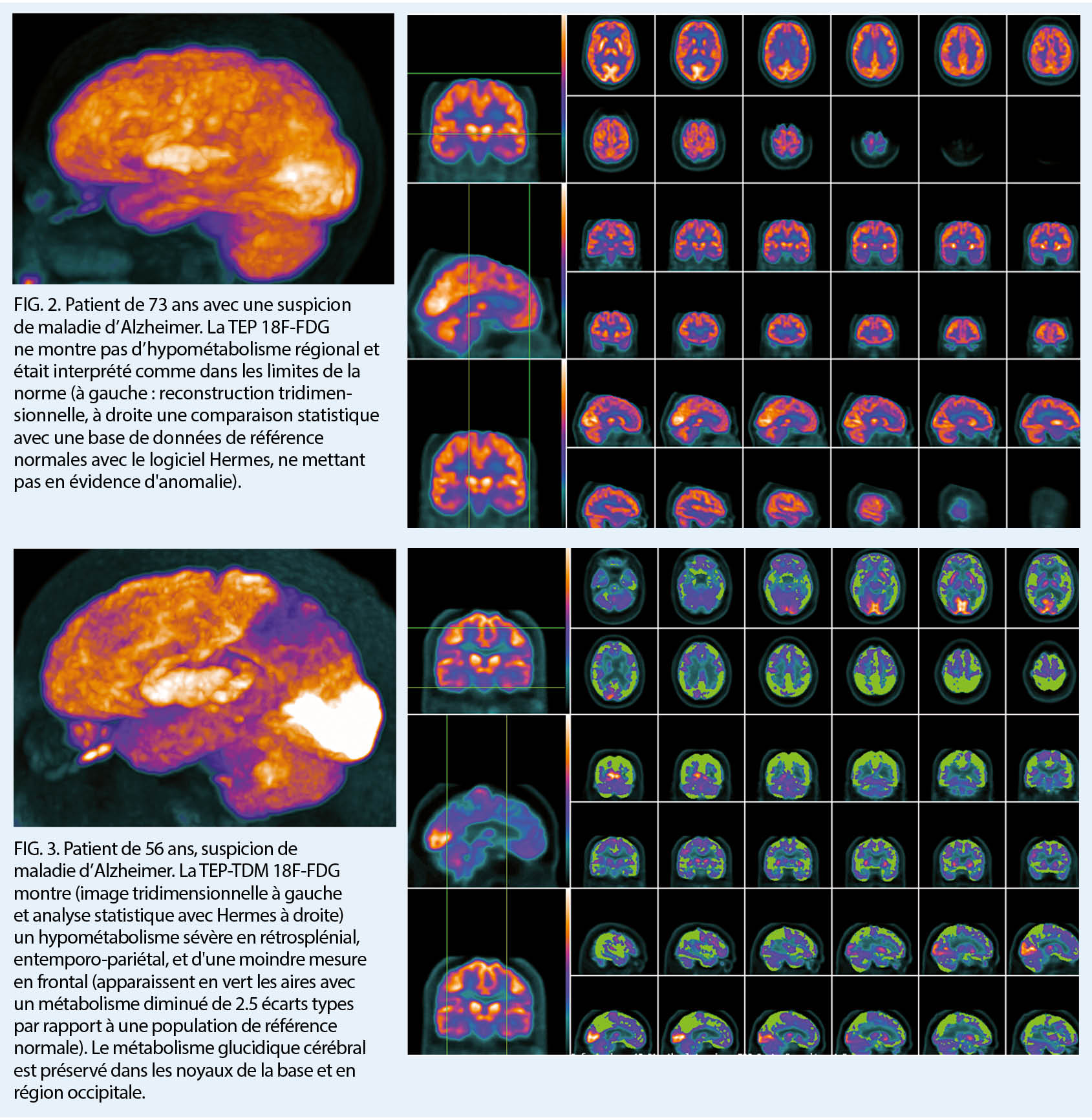
Le cerveau étant glucose-dépendant et métaboliquement actif, la cartographie du métabolisme glucidique cérébral constitue le reflet de l’ activité neuronale et permet ainsi une détection topographique des zones hypo- ou hyperfonctionnelles, correspondant à une perte ou un dysfonctionnement synaptique à ces niveaux. L’ hypométabolisme ayant une topographie régionale différente selon les différentes atteintes neurodégénératives, la TEP F18-FDG est utile pour les différencier (4) (fig. 2, 3)
A titre d’ exemple, le pattern topographique métabolique visualisé pour la MA montre un hypométabolisme plutôt postérieur, au niveau du néocortex temporo-pariétal, et au niveau du cortex cingulaire postérieur, en préservant les aires primaires, le cervelet et les noyaux gris centraux, avec une sensibilité de 80% et une spécificité de 90% pour la MA au stade de démence. Cet examen est à l’ heure actuelle pris en charge selon l’ Ordonnance sur les prestations de l’ assurance des soins (OPAS) dans les cadre suivant: «Comme examen complémentaire dans des cas peu clairs, après un examen non conclusif du liquide céphalo-rachidien ou lorsqu’ une ponction lombaire est impossible ou contre-indiquée après un examen préalable interdisciplinaire et sur prescription de spécialistes en médecine interne générale avec formation approfondie en gériatrie, en psychiatrie et psychothérapie ou en neurologie; jusqu’ à l’ âge de 80 ans révolus, avec un test de Folstein (Mini-Mental-Status-Test) d’ au moins 10 points et une démence durant depuis 5 ans au maximum; pas d’ examen préalable par TEP ou TEMP (Single Photon Emission Computed Tomography).»
Les radiotraceurs amyloïdes ont révolutionné l’ étude de la MA
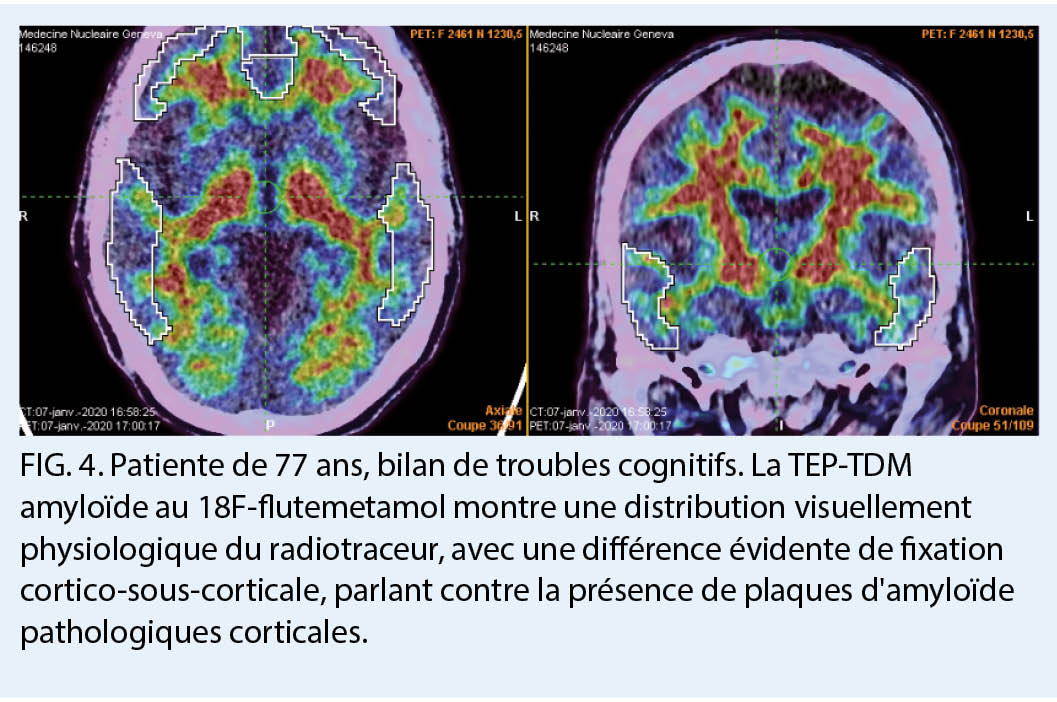
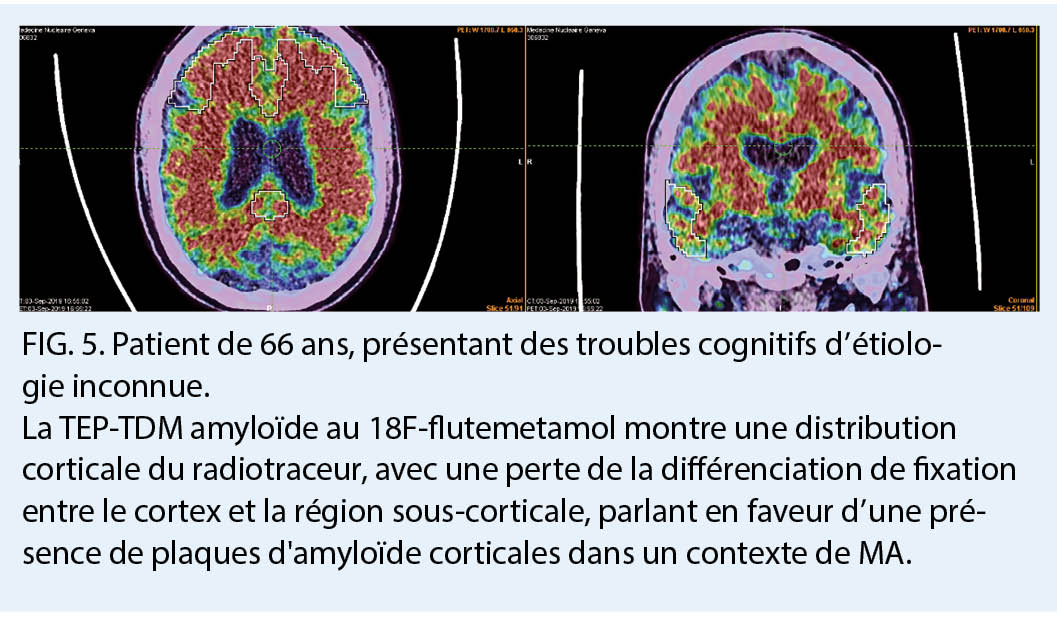
Un groupe plus récent de radiotraceurs a révolutionné l’ étude de la MA en permettant de mesurer avec une sensibilité et spécificité élevée la présence au niveau cortical de plaques de bêta-amyloïde extracellulaires, l’ un des deux marqueurs moléculaires requis pour le diagnostic neuropathologique de la maladie d’ Alzheimer. Le 18F-flutemetamol, le 18F-florbetaben, et le 18F-florbetapir ont été approuvés pour cette indication par Swissmedic. Le mécanisme de ces traceurs étant de se lier aux plaques amyloïdes, ils constituent ainsi un traceur physiopathologique. Ainsi, l’ analyse des images montrera une fixation physiologique de la substance blanche dans un cas négatif, et a contrario, une augmentation de la fixation dans les zones corticales sera considérée comme positive pour une déposition corticale de plaques amyloïdes. Une imagerie négative permet d’ exclure le diagnostic de MA (haute spécificité), alors qu’ une imagerie positive, surtout en association avec un marqueur de neurodégénérescence tel qu’ une atrophie temporo-mésiale ou un hypométabolisme postérieur, permet d’ identifier parmi les sujets avec un déficit cognitif léger (mild cognitive impairment, MCI) ceux qui sont susceptibles d’ évoluer vers un stade démentiel de la MA (5) (fig. 4, 5). Des acquisitions en phase précoce immédiatement après injection du radiotraceur permettent d’ estimer la perfusion cérébrale régionale et donnent des informations similaires à celles données par la TEP 18F-FDG, permettant ainsi de combiner les deux informations sur un même examen grâce à une acquisition multiphasique.
La TEP avec traceurs amyloïdes est prise en charge selon l’ OPAS avec les mêmes indications et restrictions appliqués pour la TEP 18F-FDG. Vu que l’ examen n’ est pas admissible après un examen préalable par TEP 18F-FDG, une seule TEP remboursée, à FDG ou amyloïde, peut à l’ heure actuelle être proposée au patient dans le cadre de l’ OPAS. Pourtant, les deux examens donnent des informations complémentaires et les arbres décisionnels proposés par différentes sociétés savantes proposent la réalisation des deux examens pour obtenir un diagnostic concluant selon le tableau clinique et le résultat du test (6).
DaT-scan
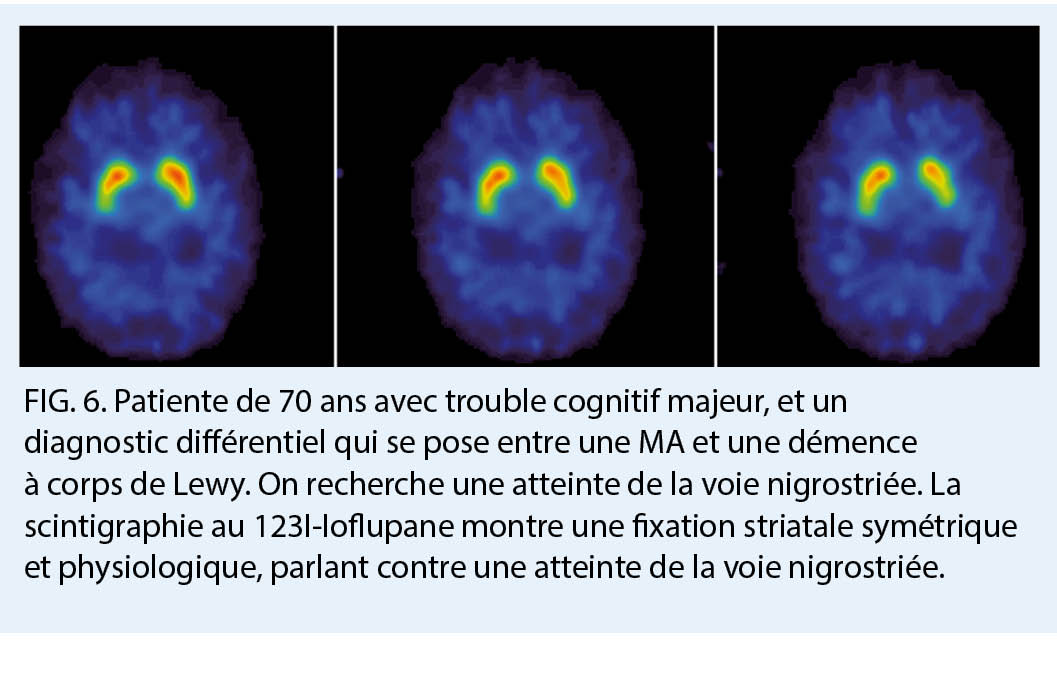
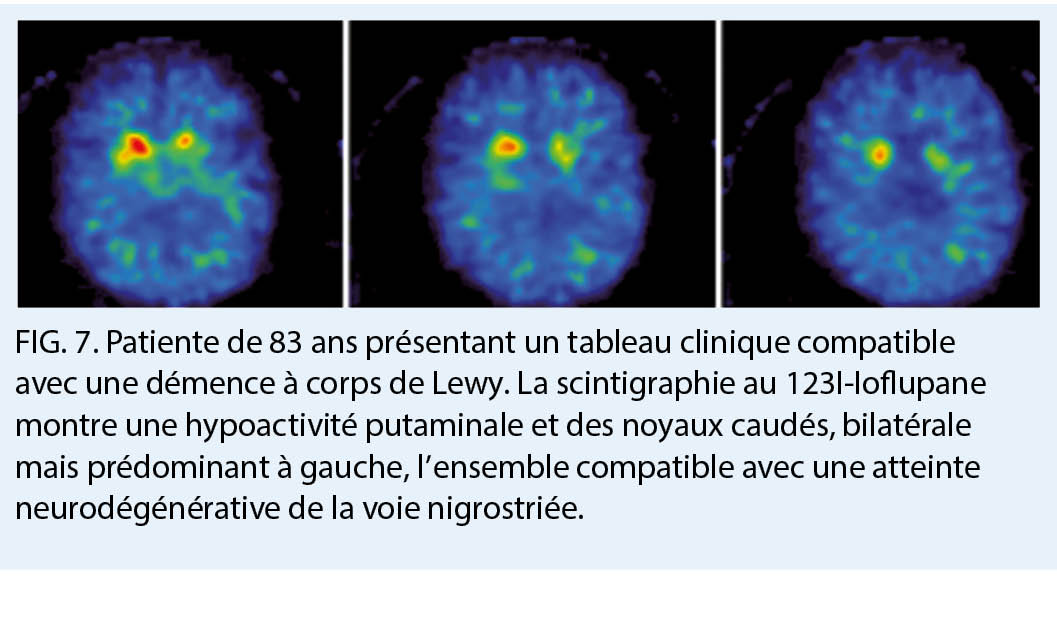
La TEMP 123I ioflupane (DaT-scan) permet pour sa part une analyse des terminaisons synaptiques des neurones dopaminergiques, qui sont spécifiquement atteints dans la démence à corps de Lewy, la démence de la maladie de Parkinson, et dans d’ autres syndromes parkinsoniens pouvant être associés à une démence telles que la paralysie supra-nucléaire progressive, l’ atrophie multi-systématisée, et la dégénérescence cortico-basale. Ces neurones, principalement retrouvés dans la substance noire, ont des axones s’ étendant dans le striatum, et dont le fonctionnement repose sur le largage de dopamine. Le radiotraceur lui va cibler le transporteur dopaminergique présynaptique (dopamine transporter, DaT). Dans les atteintes de la voie nigrostriée, il existe ainsi une disparition des neurones dopaminergiques résultant en une diminution voir une absence d’ accumulation du radiotraceur. Le DaT-scan permettra d’ aider au diagnostic différentiel notamment entre une démence à corps de Lewy et une MA (7). Cette indication n’ est pas prise en charge par l’ assurance obligatoire de soins à l’ heure actuelle.
Radiotraceurs tau
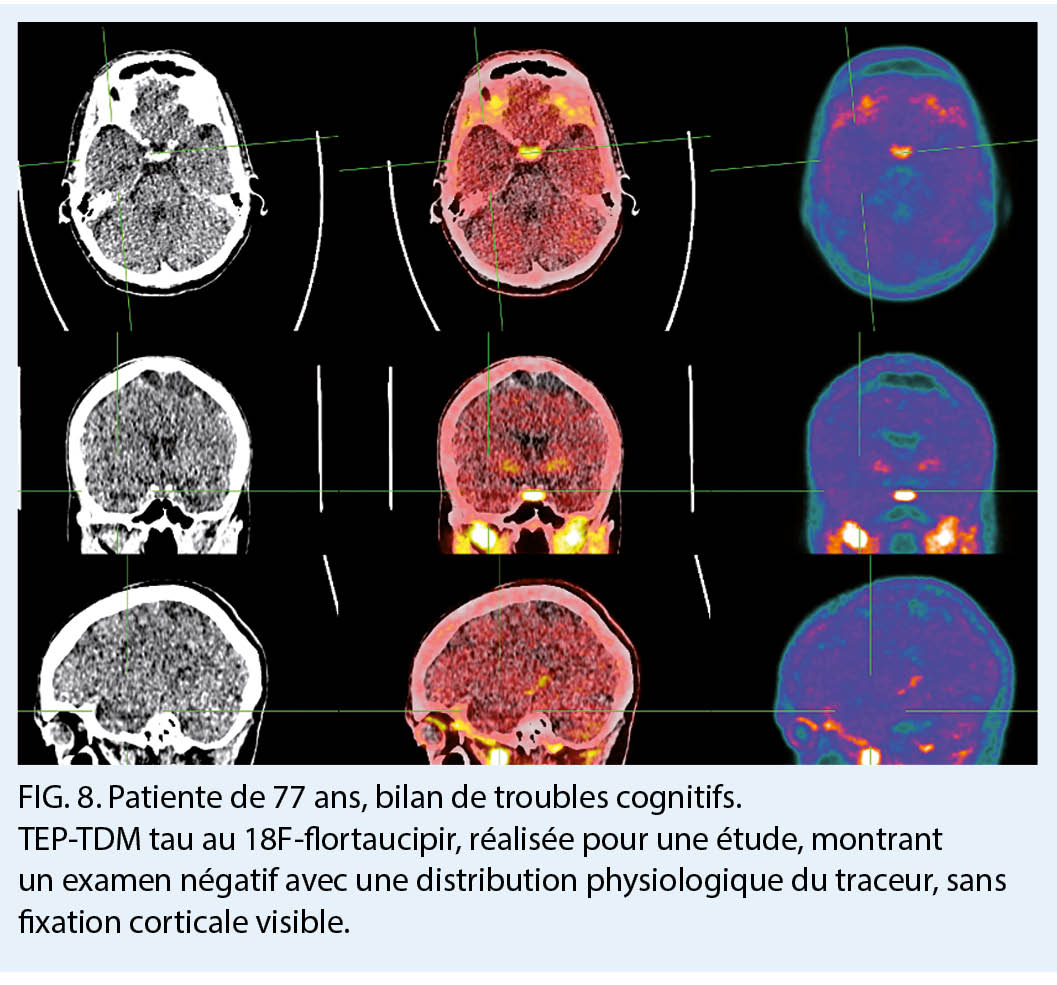
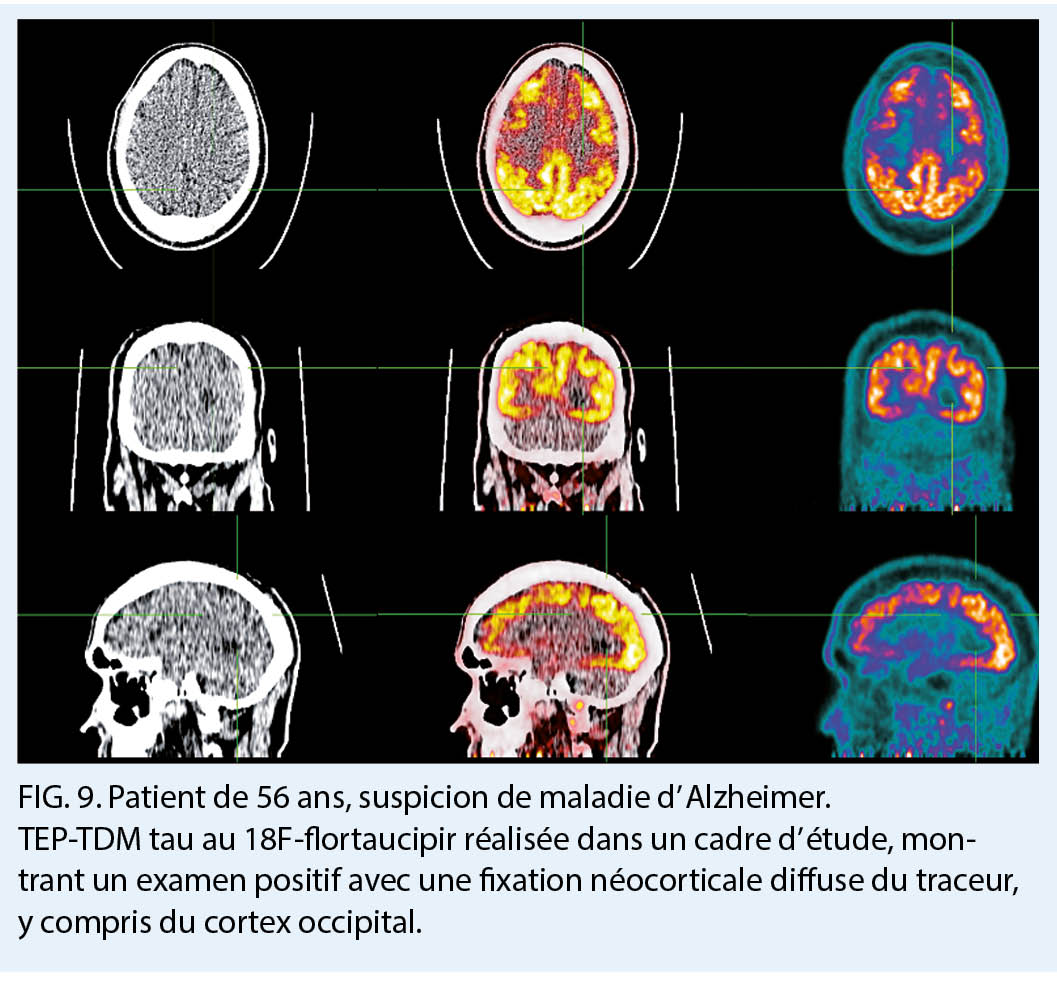
Enfin, parmi les derniers radiotraceurs physiopathologiques développés pour le diagnostic d’ une MA se trouvent les radiotraceurs tau, dont le plus répandu est le 18F-flortaucipir (8). L’ hyperphosporylation et l’ agrégation intracellulaire anormale des protéines tau constituent le deuxième marqueur moléculaire de la MA, en association avec les plaques extracellulaires d’ amyloïde. Les traceurs se fixent ainsi sélectivement sur les amas neurofibrillaires et permettent de visualiser l’ accumulation progressive du radiotraceur au niveau de différentes régions cérébrales selon les patterns topographiques des stades de Braak telles qu’ elles sont retrouvées lors d’ études neuropathologiques. Ces traceurs présentent un grand potentiel pour le staging et le suivi de la MA, mais également pour distinguer les pathologies MA versus non MA, puisqu’ ils permettent de mesurer avec une bonne précision les stades neuropathologiques avancés de la MA qui s’ associent quasi invariablement à la présence de plaques amyloïdes (fig. 8, 9). L’ imagerie TEP tau a récemment (mai 2020) franchi une étape importante pour son utilisation dans la pratique clinique en obtenant une approbation par la Food and Drug Administration (FDA) aux Etats-Unis pour cette indication. En Suisse, cette modalité d’ imagerie est utilisée dans le cadre d’ études de recherche mais n’ est pas encore approuvée pour son utilisation clinique.
Pour conclure, le diagnostic des troubles cognitifs constitue un enjeu important dans la médecine actuelle, aussi bien pour l’ adaptation de la prise en charge de ces patients que pour la mise en place et le développement de nouveaux traitements. Pour ce faire, le bilan minimal comprendra une évaluation neuropsychologique mais également une imagerie cérébrale dont l’ IRM est l’ examen de première intention. La neuro-imagerie moléculaire peut constituer un outil diagnostic précieux puisqu’ elle permet, de par l’ utilisation de radiotraceurs topographiques tel que la 18F-FDG et physiopathologiques tels que les traceurs dopaminergiques, amyloïde et tau, de s’ approcher du diagnostic «anatomo-pathologique» in vivo.
Copyright Aerzteverlag medinfo AG
– Service de Médecine Nucléaire et Imagerie Moléculaire,
Département Diagnostique, Hôpitaux Universitaires de Genève
– NIMTlab, Faculté de Médecine, Université de Genève
Service de Médecine Nucléaire et Imagerie Moléculaire
Département Diagnostique, Hôpitaux Universitaires de Genève
Rue Gabrielle-Perret-Gentil 4
1205 Genève
elsa.hervier@hcuge.ch
Service de Radiologie, Département Diagnostique, Hôpitaux Universitaires de Genève
Service de Médecine Nucléaire et Imagerie Moléculaire
Département Diagnostique, Hôpitaux Universitaires de Genève
Rue Gabrielle-Perret-Gentil 4
1205 Genève
– Service de Médecine Nucléaire et Imagerie Moléculaire,
Département Diagnostique, Hôpitaux Universitaires de Genève
– NIMTlab, Faculté de Médecine, Université de Genève
Service de Médecine Nucléaire et Imagerie Moléculaire
Département Diagnostique, Hôpitaux Universitaires de Genève
Rue Gabrielle-Perret-Gentil 4
1205 Genève
Les auteurs déclarent n’ avoir aucun lien d’ intérêt en relation avec le contenu de cet article. VG a reçu des financements pour la recherche du Fonds National Suisse de la recherche scientifique (projets IZSEZ0_188355, 320030_169876 et 320030_185028) et de la Fondation Velux (projet 1123), ainsi que des financements pour la recherche et pour des présentations scientifiques à travers son institution, de la part de Siemens Healthineers, GE Healthcare, Life Molecular Imaging, Cerveau Technologies, Roche, Merck.
1. Scheltens, P., Blennow, K., Breteler, M.M., de Strooper, B., Frisoni, G.B., Salloway, S., Van der Flier, W.M., 2016. Alzheimer’s disease. Lancet. 388, 505-17.
2. Park, M., Moon, W.J., 2016. Structural MR Imaging in the Diagnosis of Alzheimer’s Disease and Other Neurodegenerative Dementia: Current Imaging Approach and Future Perspectives. Korean J Radiol. 17, 827-845.
3. Frisoni, G.B., Boccardi, M., Barkhof, F., Blennow, K., Cappa, S., Chiotis, K., Demonet, J.F., Garibotto, V., Giannakopoulos, P., Gietl, A., Hansson, O., Herholz, K., Jack, C.R., Jr., Nobili, F., Nordberg, A., Snyder, H.M., Ten Kate, M., Varrone, A., Albanese, E., Becker, S., Bossuyt, P., Carrillo, M.C., Cerami, C., Dubois, B., Gallo, V., Giacobini, E., Gold, G., Hurst, S., Lonneborg, A., Lovblad, K.O., Mattsson, N., Molinuevo, J.L., Monsch, A.U., Mosimann, U., Padovani, A., Picco, A., Porteri, C., Ratib, O., Saint-Aubert, L., Scerri, C., Scheltens, P., Schott, J.M., Sonni, I., Teipel, S., Vineis, P., Visser, P.J., Yasui, Y., Winblad, B., 2017. Strategic roadmap for an early diagnosis of Alzheimer’s disease based on biomarkers. Lancet Neurol. 16, 661-676.
4. Nobili, F., Arbizu, J., Bouwman, F., Drzezga, A., Agosta, F., Nestor, P., Walker, Z., Boccardi, M., 2018. European Association of Nuclear Medicine and European Academy of Neurology recommendations for the use of brain (18) F-fluorodeoxyglucose positron emission tomography in neurodegenerative cognitive impairment and dementia: Delphi consensus. Eur J Neurol. 25, 1201-1217.
5. Chiotis, K., Saint-Aubert, L., Boccardi, M., Gietl, A., Picco, A., Varrone, A., Garibotto, V., Herholz, K., Nobili, F., Nordberg, A., 2017. Clinical validity of increased cortical uptake of amyloid ligands on PET as a biomarker for Alzheimer’s disease in the context of a structured 5-phase development framework. Neurobiol Aging. 52, 214-227.
6. Boccardi, M., Nicolosi, V., Festari, C., Bianchetti, A., Cappa, S., Chiasserini, D., Falini, A., Guerra, U.P., Nobili, F., Padovani, A., Sancesario, G., Morbelli, S., Parnetti, L., Tiraboschi, P., Muscio, C., Perani, D., Pizzini, F.B., Beltramello, A., Salvini Porro, G., Ciaccio, M., Schillaci, O., Trabucchi, M., Tagliavini, F., Frisoni, G.B., 2020. Italian consensus recommendations for a biomarker-based aetiological diagnosis in mild cognitive impairment patients. Eur J Neurol. 27, 475-483.
7. Vaamonde-Gamo, J., Flores-Barragan, J.M., Ibanez, R., Gudin, M., Hernandez, A., 2005. [DaT-SCAN SPECT in the differential diagnosis of dementia with Lewy bodies and Alzheimer’s disease]. Rev Neurol. 41, 276-9.
8. Dodich, A., Mendes, A., Assal, F., Chicherio, C., Rakotomiaramanana, B., Andryszak, P., Festari, C., Ribaldi, F., Scheffler, M., Schibli, R., Schwarz, A.J., Zekry, D., Lovblad, K.O., Boccardi, M., Unschuld, P.G., Gold, G., Frisoni, G.B., Garibotto, V., 2020. The A/T/N model applied through imaging biomarkers in a memory clinic. Eur J Nucl Med Mol Imaging. 47, 247-255.
L’ incontinence urinaire dans la vieillesse
L’ incontinence de la femme âgée est examinée d’ un point de vue gynécologique. Nous exposons les problèmes de base, une évaluation adaptée et montrons les options thérapeutiques, leurs dangers et les limites de ce qui est possible.
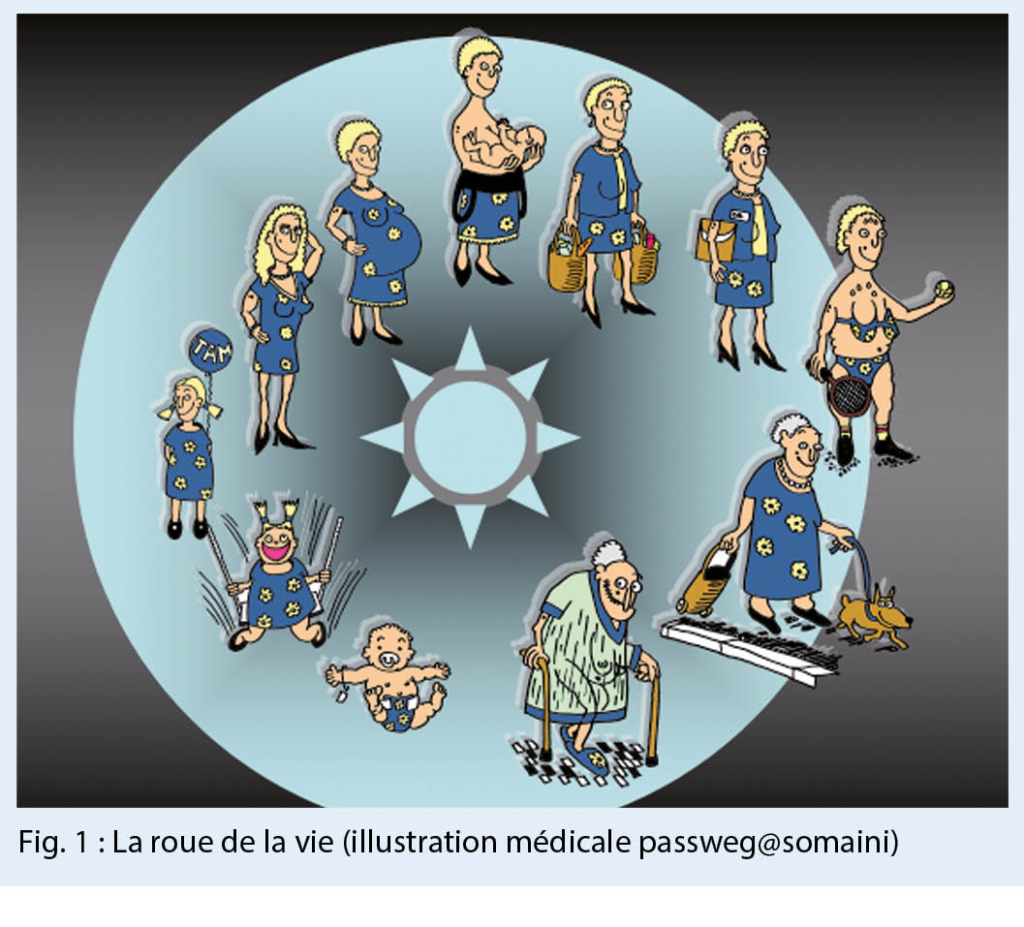
Le groupe des « personnes âgées » est hétérogène. Il va de la retraitée âgée active à la résidente à peine mobile en institution. L’incontinence augmente avec l’âge (1) et la fragilité (2) (fig. 1). Les causes sont multifactorielles. Les changements anatomiques liés à l’ âge, les maladies chroniques, la polymédication ainsi que les limitations fonctionnelles et cognitives jouent un rôle. L’ incontinence est un syndrome gériatrique qui peut survenir sans perturbation du tractus urogénital. (3). L’ incontinence doit donc être comprise comme un marqueur de la fragilité et il n’ est pas rare que l’ incontinence soit – tout comme un trouble neurocognitif – une raison d’ admission dans un foyer (4, 5). Les troubles neurocognitifs et l’ incontinence vont de pair (6). En urodynamique, cependant, seule l’ hyperactivité mesurable du détrusor (7) peut être reconnue, ce qui ne rend pas justice au tableau clinique.
Chez la personne âgée, nous oscillons entre nihilisme thérapeutique et surtraitement. Pour les personnes âgées, la thérapie exige une perspective plus large et l’ implication du médecin de famille et du médecin de la maison de soins ainsi que du personnel soignant et des proches.
Changements liés à l’ âge dans l’ appareil urogénital
Changements de la vessie liés à l’ âge
Le volume de l’ urine éliminée au cours de la miction a tendance à diminuer, le détrusor devient plus instable, l’ urine résiduelle augmente, la capacité vésicale relative diminue (8), les résultats urodynamiques n’ ayant qu’ une faible corrélation avec la clinique (9). La contractilité de la vessie diminue également avec l’ âge (10). L’ hypocontractilité de la vessie et l’ augmentation des urines résiduelles qui en résulte peuvent contribuer à la pollakiurie et à la nycturie (11). Un détrusor instable combiné à une contractilité réduite est souvent observé chez les personnes âgées (12). Cette combinaison peut provoquer des symptômes d’ urgence, de stress et d’ obstruction et constitue un défi thérapeutique.
Changements liés à l’ âge dans l’ urètre
La fonction d’ occlusion de l’ urètre, mesurée comme étant la pression d’ occlusion urétrale maximale, diminue de 15 cm H2O par décennie (13, 14). La muqueuse devient de plus en plus mince, la coaptation devient insuffisante, ce qui favorise également l’ ascension des bactéries (15). Cet amincissement de l’ urètre peut s’ étendre jusqu’ au trigone de la vessie et déclencher l’ instabilité du détrusor décrite ci-dessus par le biais d’ afférences sensibles (16). Perucchini a pu montrer que la quantité de fibres musculaires striées du rhabdomyospincter urétral diminue de 1 % par année de vie (17). Le muscle lisse du sphincter urétral (18) est soumis aux mêmes modifications.
Changements liés à l’ âge dans le vagin
À la ménopause, la muqueuse vaginale s’ amincit et la valeur du pH augmente à mesure que les bactéries pathogènes remplacent les lactobacilles qui préfèrent les œstrogènes. Cela peut entraîner des infections récurrentes des voies urinaires (19).
Changements anatomiques
Les troubles obstructifs sont rares chez les femmes ; ils sont généralement causés par une descente d’ organes génitaux pertinente avec une plicature de l’ urètre consécutive ou par une intervention pour traiter l’ incontinence d’ effort.
Causes non gynécologiques contribuant à l’ incontinence
Un diabète mal contrôlé entraîne une polyurie, une cystopathie diabétique et une polyneuropathie diabétique (20) ainsi que des troubles du stockage vésical.
Les changements musculo-squelettiques peuvent accentuer une envie par l’ immobilité, car la patiente ne peut plus atteindre les toilettes dans un délai raisonnable. Des toilettes mal placées ou mal conçues, ainsi que le manque d’ assistance aggravent la situation. L’ envie est à nouveau un facteur de risque pour les chutes et les fractures (21).
Les maladies pulmonaires accompagnées d’ une toux chronique favorisent l’ incontinence à l’ effort. L’ insuffisance cardiaque ainsi que l’ insuffisance veineuse chronique aggravent la nycturie en raison de la réabsorption nocturne de l’ œdème.
Les accidents cérébrovasculaires entraînent la formation de zones ischémiques, qui sont résumées dans la terminologie neuro-
urologique comme des lésions suprapontines (lésions au-dessus du centre de miction pontine). Celles-ci peuvent réduire la fonction inhibitrice des zones corticales et sous-corticales pertinentes pour la miction au centre de miction pontine (centre de coordination). La conséquence en est une suractivité neurogène du détrusor. Un autre exemple typique est la maladie de Parkinson. L’ urine résiduelle, qui s’ explique par l’ hyopkinésie du sphincter strié de l’ urètre, est moins fréquente dans la maladie de Parkinson. Souvent, la thérapie à la L-dopa n’ améliore pas la continence (22). La maladie d’ Alzheimer et d’ autres formes de démence provoquent également des lésions suprapontines. La suractivité du détrusor d’ origine neurologique décrite ci-dessus est également évidente, ce qui s’ accompagne de difficultés d’ orientation et de coordination propres à la démence.
Les séniors qui souffrent de maladies mentales telles que la dépression peuvent perdre leur motivation à rester continents. D’ autre part, l’ incontinence aggrave la dépression (23).
La constipation est également associée à l’ incontinence urinaire (24).
La clarification de l’ incontinence de la femme âgée
L’ incontinence peut également être traitée au cours de la vieillesse : une clarification plus approfondie peut être utile. Il est possible de déterminer dans quelle mesure l’ incontinence est due à une cause urogénitale et une proposition de thérapie adaptée aux circonstances de vie de la patiente peut être élaborée en concertation avec les soignants.
Au début se trouve l’ anamnèse exacte, si nécessaire aussi par des tiers. L’ enregistrement des comorbidités et de la médication actuelle ainsi que de la situation sociale est central.
En mesurant l’ urine résiduelle au moyen d’ une échographie ou d’ un cathéter jetable, on obtient une indication de la fonction vésicale et on peut prendre des décisions thérapeutiques (25).
L’ état gynécologique reconnaît un descensus sévère, qui peut conduire à une perturbation obstructive de la miction et, en cas de formation d’ urine résiduelle pertinente, à une incontinence par regorgement (overflow). La congestion des voies urinaires supérieures est très rare et peut être exclue par une échographie rénale. Une attention particulière est accordée à la trophicité urogénitale. Un simple test de toux avec une vessie pleine suffit pour détecter cliniquement l’ incontinence d’ effort (26, 27).
Bien que l’ anamnèse, l’ examen clinique et l’ échographie puissent être très utiles et bien que le bilan urodynamique ne soit pas recommandé comme examen de routine dans la clarification de base de l’ incontinence urinaire (EAU Guidelines 2018), le bilan urodynamique et la cystoscopie peuvent également être effectuées chez les patientes âgées et aident à définir précisément le dysfonctionnement de la vessie (28). Cet examen est indiqué avant un traitement invasif. Le bilan urodynamique est indispensable en cas de lésions transversales. Chez la patiente âgée, cependant, le bilan urodynamique n’ est presque jamais au centre de l’ attention; l’ accent est mis sur la pathologie inhérente au détrusor, la formation d’ urine résiduelle, la faiblesse de l’ occlusion et l’ obstruction fonctionnelle.
Le traitement de l’ incontinence
Les thérapies comportementales doivent être essayées avant la thérapie médicamenteuse. La clé d’ attribution des postes d’ une institution ne permet pas toujours d’ obtenir l’ aide nécessaire – comme la marche assistée vers les toilettes (29).
La thérapie médicamenteuse doit être soigneusement indiquée. Elle peut être inadaptée aux patientes âgées, par exemple aux résidentes en institution qui n’ ont pas l’ intention d’ aller aux toilettes ou qui sont gravement atteintes de troubles cognitifs et fonctionnels, de sorte qu’ une amélioration par la médication n’ est plus à attendre (30).
Thérapie médicamenteuse :
L’ œstrogène local doit être commencé très tôt en tant que thérapie de base à faible dose. Les œstrogènes locaux – contrairement aux œstrogènes administrés par voie systémique – sont sans risque, préviennent ou traitent l’ atrophie qui contribue à l’ incontinence et protègent la femme ménopausée contre les infections urinaires récurrentes (31). Les œstrogènes appliqués localement traitent le syndrome ménopausique génito-urétral bien plus efficacement que l’ hormonothérapie substitutive systémique. En Suisse, seules les préparations à faible ou très faible dose sont autorisées (32).
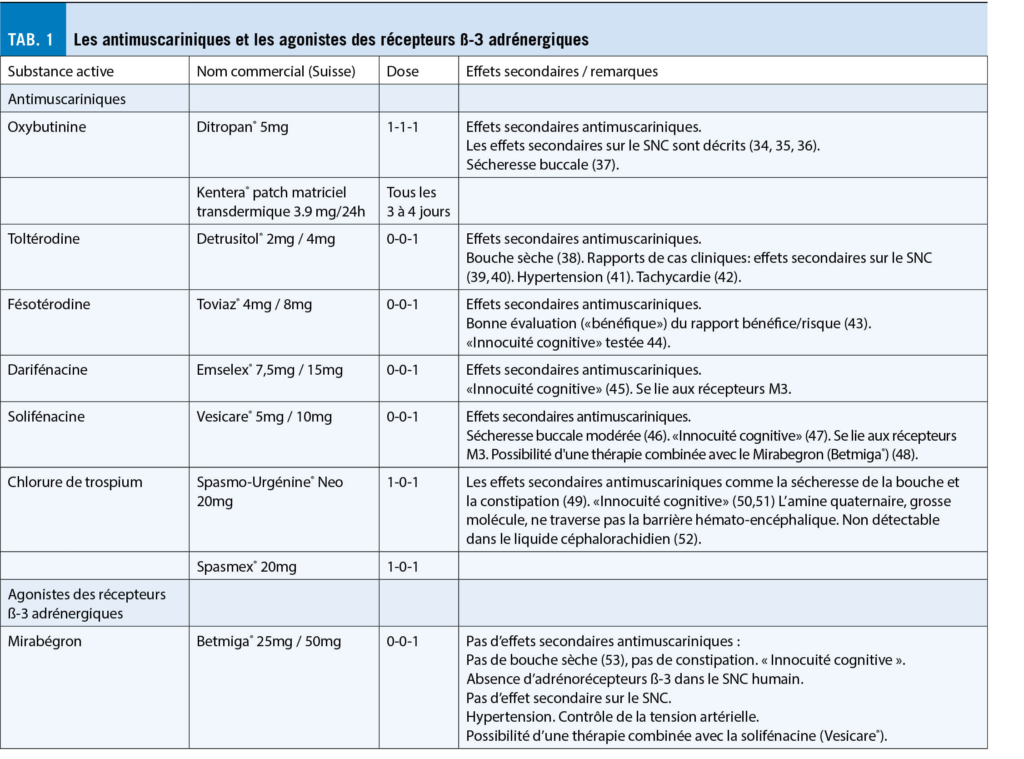
Les médicaments antimuscariniques inhibent de manière compétitive les récepteurs muscariniques du détrusor et bloquent le système nerveux parasympathique, qui est responsable de la vidange de la vessie. Ils ont un effet modéré (33) et peuvent réduire le nombre d’ épisodes d’ incontinence et la fréquence des mictions. Les médicaments antimuscariniques sont généralement testés dans le cadre d’ études utilisant des journaux de miction, par opposition à un placebo ou un médicament antimuscarinique plus ancien. Ils ne diffèrent guère les uns des autres en termes d’ efficacité, mais se distinguent par leur profil d’ effets secondaires : des effets secondaires sur le SNC ont été décrits pour l’ ancienne préparation d’ oxybutynine (Ditropan®, Kentera®, des patches matriciels transdermiques). La toltérodine (Detrusitol®) et la fésotérodine (Toviaz®) se concentreraient davantage sur la vessie, et la fesotérodine aurait un bon rapport risque-bénéfice. La solifénacine (Vesicare®) et la darifénacine (Emselex®) sont des sélectives du récepteur M3 et se lient principalement au sous-type III des récepteurs muscariniques et moins au sous-type II, qui se trouve dans le SNC, et sont considérées comme sûres en ce qui concerne les effets secondaires sur le SNC. Le chlorure de trospium, une amine quaternaire (Spasmo-Urgenin® Neo, Spasmex®), est une grosse molécule et ne peut pas passer la barrière hémato-encéphalique, étant donc « inoffensif sur le plan cognitif » (tab. 1).
Le mirabégron, un agoniste des récepteurs ß-3 adrénergiques, stimule les adrénorécepteurs ß-3 du détrusor. Ces récepteurs β-3 sympathiques sur le muscle de la vessie servent à la relaxation de la vessie et donc au remplissage de la vessie. Cet autre mécanisme est une bonne alternative aux médicaments antimuscariniques. La tension artérielle doit être contrôlée. Le mirabégron (Betmiga®) et la solifénacine (Vesicare®) ont été testés comme thérapie combinée (tab. 1).
Chez les patients âgés, la pharmacocinétique doit être prise en compte. Une insuffisance rénale ou une fonction hépatique restreinte sont souvent présentes : pour cette raison, les thérapies médicamenteuses doivent toujours être instaurées avec la dose la plus faible possible (54). La polymédication (>5 médicaments) est courante chez les personnes âgées (55), les interactions peuvent difficilement être contrôlées et certains médicaments peuvent augmenter l’ incontinence (56) : les médicaments qui augmentent le volume d’ urine comme les diurétiques ou le lithium aggravent le besoin d’ uriner et la nycturie. Les sédatifs, hypnotiques et antipsychotiques influencent la vigilance, le sommeil et la mobilité et donc la continence. Les inhibiteurs de la cholinestérase tels que la galantamine (Reminyl®), qui sont utilisés dans la maladie d’ Alzheimer, peuvent déclencher une incontinence par impériosité (57, 58). Les préparations anticholinergiques peuvent entraîner une incontinence par regorgement (overflow).
L’ éclaircissement d’ une longue liste de médicaments n’ est pas de la compétence du spécialiste en uro-gynécologie. Une bonne indication est nécessaire pour ajouter des antimuscariniques à la liste et l’ efficacité de la thérapie doit être surveillée.
Effets secondaires des médicaments
La maladie d’ Alzheimer et d’ autres formes de démence sont caractérisées par un déficit cholinergique du SNC (59). Tandis que les médicaments anticholinergiques provoquent une sécheresse de la bouche, des troubles de l’ accommodation ou de la constipation chez les jeunes, des effets secondaires plus importants tels que la sédation, le délire, les hallucinations et les chutes avec fractures consécutives peuvent se produire chez les personnes âgées (60). Les patients atteints de la maladie de Parkinson sont particulièrement sensibles aux médicaments ayant des effets antimuscariniques ( 61). Les données épidémiologiques montrent une corrélation positive entre la charge antimuscarinique à long terme et les troubles cognitifs ainsi que le développement de la démence (62, 63). Dans le cas d’ une démence préexistante, le lien est moins évident (64, 65).
Outre les médicaments antimuscariniques utilisés pour traiter la vessie hyperactive, d’ autres médicaments ont également des propriétés anticholinergiques, tels que les bipérides (Akineton®), la butylscopalamine (Buscopan®), l’ umeclidinium (Incruse Ellipta®) et également de nombreux antidépresseurs, neuroleptiques et antihistaminiques (66). La charge anticholinergique s’ accumule avec chaque préparation supplémentaire utilisée. Chez les patientes âgées, la charge anticholinergique totale doit être maintenue aussi faible que possible.
Traitement chirurgical de l’ incontinence
L’ indication de l’ opération doit être discutée avec la patiente, le médecin de famille et les soignants responsables. L’ âge et les comorbidités entraînent davantage de complications anesthésiologiques et périopératoires. Il faut s’ attendre à une hospitalisation plus longue et à un besoin de soins plus important après la sortie de l’ hôpital.
La chirurgie offre le traitement le plus efficace pour l’ incontinence d’ effort, même à un âge avancé (67). Les patientes âgées sont souvent défavorisées concernant le traitement chirurgical de l’ incontinence d’ effort : Elles sont pré-opérées, le profil de la pression urétrale est mauvais et l’ urètre n’ est pas très mobile. EIles présentent une atrophie génitale et peut-être aussi un détrusor instable. Les échecs et les récidives sont plus fréquents à un âge avancé (68, 69, 70). Néanmoins, les insertions de bandelettes sous-urétrales sont des interventions bien documentées (71), courtes et mini-invasives qui peuvent être réalisées sous anesthésie locale et analgésie. La charge de l’ opération est faible. Il en va de même pour l’ injection d’ agents gonflants (bulking agents) dans l’ urètre.
Le traitement chirurgical du détrusor hyperactif est réalisé par l’ application de la toxine onabotulique A (Botox®). Celle-ci est injectée par cystoscopie dans le détrusor et entraîne une dénervation partielle, mais aussi réversible, de la vessie, selon la dose. L’ intervention est courte et à peine gênante et est pratiquée sous anesthésie locale, si nécessaire en combinaison avec une sédation. La dose et l’ intervalle doivent être titrés individuellement. Le grand avantage : la thérapie antimuscarinique perorale est remplacée par une thérapie locale plus efficace (72, 73). La formation d’ urine résiduelle et la durée d’ action plus courte sont plus fréquentes chez les patientes âgées (74).
Produits d’ hygiène et cathéters
Pour de nombreuses personnes âgées, un approvisionnement optimal en protections contre l’ incontinence est essentiel pour la qualité de vie et conduit à un bien-être physique, psychologique et social (75). Même si cette mesure a l’ allure d’ un forfait, elle est souvent adaptée à la situation et rarement impopulaire.
L’ autocathétérisme est le traitement approprié de la vessie atone avec de grandes quantités d’ urine résiduelle (overflow). Chez les personnes âgées, cette option est généralement irréaliste en raison de l’ immobilité, des tremblements ou de la déficience visuelle. Heureusement, des quantités importantes d’ urine résiduelle peuvent être tolérées dans la vessie acontractile ou dénervée. Il n’ y a pratiquement pas de développement de pression vésicale et par conséquant le reflux et donc les dommages aux voies urinaires supérieures sont rares.
Un drainage permanent (cathéter permanent) est impopulaire et – présentant un risque accru d’ infection (danger de septicémie/délire) – ne doit être envisagé que dans certains cas, chez les patientes avec des restrictions fonctionnelles graves ou qui ont une fonction rénale compromise dans le cadre du trouble mictionnel.
Article traduit de «der informierte arzt» 07_2020
Copyright Aerzteverlag medinfo AG
Frauenklinik Stadtspital Weid und Triemli
Birmensdorferstrasse 501
8063 Zürich
daniel.passweg@triemli.zuerich.ch
Frauenklinik Stadtspital Weid und Triemli
Birmensdorferstrasse 501
8063 Zürich
Les auteurs ont déclaré n’ avoir aucun conflit d’ intérêts en rapport avec cet article.
1. B . Baltes, P.B. and J. Smith, New frontiers in the future of aging: from successful aging of the young old to the dilemmas of the fourth age. Gerontology, 2003. 49(2): p. 123-35.
2. Silva, V.A., K.L. Souza, and M.J. D’Elboux, [Urinary incontinence and the criteria of frailness among the elderly outpatients]. Revista da Escola de Enfermagem da U S P, 2011. 45(3): p. 672-8.
3. Inouye, S.K., et al., Geriatric syndromes: clinical, research, and policy implications of a core geriatric concept. J Am Geriatr Soc, 2007. 55(5): p. 780-91.
4. Thom, D.H., M.N. Haan, and S.K. Van Den Eeden, Medically recognized urinary incontinence and risks of hospitalization, nursing home admission and mortality. Age Ageing, 1997. 26(5): p. 367-74.
5. Prince, M., et al., The global prevalence of dementia: a systematic review and metaanalysis. Alzheimer’s & dementia : the journal of the Alzheimer’s Association, 2013. 9(1): p. 63-75 e2.
6. Byles, J., et al., Living with urinary incontinence: a longitudinal study of older women. Age Ageing, 2009. 38(3): p. 333-8; discussion 251.
7. Lee, S.H., et al., Urinary incontinence in patients with Alzheimer’s disease: relationship between symptom status and urodynamic diagnoses. International journal of urology : official journal of the Japanese Urological Association, 2014. 21(7): p. 683-7.
8. Madersbacher, S., et al., The aging lower urinary tract: a comparative urodynamic study of men and women. Urology, 1998. 51(2): p. 206- 12.
9. Resnick, N.M., Elbadawi, A. E., Yalla, S. V., Age and the lower urinary tract: what is normal? . Neurourology and Urodynamics, 1995. 14: p. 1647.
10. Malone-Lee, J., Wahedna, I., Characterisation of detrusor contractile function in relation to oldage. Br J Urol 1993. 72: p. 873-880.
11. Taylor, J.A., 3rd and G.A. Kuchel, Detrusor underactivity: Clinical features and pathogenesis of an underdiagnosed geriatric condition. J Am Geriatr Soc, 2006. 54(12): p. 1920-32.
12. Resnick, N.M. and S.V. Yalla, Detrusor hyperactivity with impaired contractile function. An unrecognized but common cause of incontinence in elderly patients. JAMA, 1987. 257(22): p. 3076-81.
13. Rud, T., Urethral pressure profile in continent women from childhood to old age. Acta obstetricia et gynecologica Scandinavica, 1980. 59(4): p. 331-5.
14. Trowbridge, E.R., et al., Effects of aging on lower urinary tract and pelvic floor function in nulliparous women. Obstetrics and gynecology, 2007. 109(3): p. 715-20.
15. Samsioe, G., et al., Occurrence, nature and treatment of urinary incontinence in a 70-yearold female population. Maturitas, 1985. 7(4): p. 335-42.
16. Kenton, K., et al., Urethral and bladder current perception thresholds: normative data in women. The Journal of urology, 2007. 178(1): p. 189-92; discussion 192.
17. Perucchini, D., et al., Age effects on urethral striated muscle. II. Anatomic location of muscle loss. American journal of obstetrics and gynecology, 2002. 186(3): p. 356-60.
18. Clobes, A., J.O. DeLancey, and D.M. Morgan, Urethral circular smooth muscle in young and old women. Am J Obstet Gynecol, 2008. 198(5): p. 587 e1-5.
19. Juthani-Mehta, M., et al., Diagnostic accuracy of criteria for urinary tract infection in a cohort of nursing home residents. J Am Geriatr Soc, 2007. 55(7): p. 1072-7.
20. Tai, H.C., et al., Metabolic syndrome components worsen lower urinary tract symptoms in women with type 2 diabetes. J Clin Endocrinol Metab, 2010. 95(3): p. 1143-50.
21. Brown, J.S., et al., Urinary incontinence: does it increase risk for falls and fractures? Study of Osteoporotic Fractures Research Group. J Am Geriatr Soc, 2000. 48(7): p. 721-5.
22. Wullner, U., et al., Autonomic dysfunction in 3414 Parkinson’s disease patients enrolled in the German Network on Parkinson’s disease (KNP e V.) the effect of ageing. European Journal of Neurology, 2007. 14(1405-1408).
23. Dugan, E., et al., The association of depressive symptoms and urinary incontinence among older adults. J Am Geriatr Soc, 2000. 48: p. 413-416.
24. Wen-Qing L., et al., Constipation and Risk of Urinary Incontinence in Women: A Meta-Analysis. Int Urogynecol J, 2019. 30(10): p. 1629-1634.
25. Smith, P.P. and G.A. Kuchel, Clinical Meaning of a High Postvoid Residual: When the Value of a Result Is Less and More than One Would Expect. J Am Geriatr Soc, 2015. 63(7): p. 1432-4.
26. Resnick, N.M., et al., Misdiagnosis of urinary incontinence in nursing home women: prevalence and a proposed solution. Neurourol Urodyn, 1996. 15(6): p. 599-613; discussion 613- 8.
27. Diokno, A.C., T.J. Wells, and C.A. Brink, Urinary incontinence in elderly women: urodynamic evaluation. J Am Geriatr Soc, 1987. 35(10): p. 940-6.
28. Resnick, N.M., S.V. Yalla, and E. Laurino, The pathophysiology of urinary incontinence among institutionalized elderly persons. N Engl J Med, 1989. 320(1): p. 1-7.
29. Schnelle, J.F., et al., A standardized quality assessment system to evaluate incontinence care in the nursing home. J Am Geriatr Soc, 2003. 51(12): p. 1754-61.
30. Narayanan, S., et al., Is drug therapy for urinary incontinence used optimally in long-term care facilities? Journal of the American Medical Directors Association, 2007. 8(2): p. 98-104.
31. Raz, R., et al.,A controlled trial of intravaginal estriol in postmenopausal women with recurrent urinary tract infections. N Engl J Med, 1993. 329(11): p. 753.
32. Birkhäuser, M., Risiken einer vaginalen Estrogengabe – worum geht es?. info@gynäkologie, 2020. 4(01): p. 15–17.
33. Herbison, P., et al., Effectiveness of Anticholinergic Drugs Compared with Placebo in the Treatment of Overactive Bladder: Systematic Review. BMJ, 2003. 326(7394): p. 841-4.
34. Gray, S.L., et al., Cumulative use of strong anticholinergics and incident dementia: a prospective cohort study. JAMA internal medicine, 2015. 175(3): p. 401-7.
35. Donnellan, C.A., et al., Oxybutynin and cognitive dysfunction. BMJ, 1997. 315(7119): p. 1363-4.
36. Wagg, A., et al., Randomised, multicentre, placebo-controlled, double-blind crossover study investigating the effect of solifenacin and oxybutynin in elderly people with mild cognitive impairment: the SENIOR study. European Urology, 2013. 64(1): p. 74-81.
37. Zellner, M., et al., Trospium chloride and oxybutynin hydrochloride in a german study of adults with urinary urge incontinence: results of a 12-week, multicenter, randomized, doubleblind, parallel-group, flexible-dose noninferiority trial. Clinical therapeutics, 2009. 31(11): p. 2519-39.
38. Aziminekoo, E., et al., Oxybutynin and tolterodine in a trial for treatment of overactive bladder in Iranian women. J Family Reprod Health, 2014. 8(2): p. 73-6.
39. Tsao, J.W. and K.M. Heilman, Transient memory impairment and hallucinations associated with tolterodine use. N Engl J Med, 2003. 349(23): p. 2274-5.
40. Edwards, K.R. and J.T. O’Connor, Risk of delirium with concomitant use of tolterodine and acetylcholinesterase inhibitors. J Am Geriatr Soc, 2002. 50(6): p. 1165-6.
41. Wagg, A., et al., The efficacy and tolerability of the beta3-adrenoceptor agonist mirabegron for the treatment of symptoms of overactive bladder in older patients. Age Ageing, 2014. 43(5): p. 666-75.
42. Layton, D., G.L. Pearce, and S.A. Shakir, Safety profile of tolterodine as used in general practice in England: results of prescriptionevent monitoring. Drug Saf, 2001. 24(9): p. 703-13.
43. Oelke, M., et al., Appropriateness of oral drugs for long-term treatment of lower urinary tract symptoms in older persons: results of a systematic literature review and international consensus validation process (LUTS-FORTA 2014). Age Ageing, 2015. 44(5): p. 745-55.
44. Kay, G.G., et al., Evaluation of cognitive function in healthy older subjects treated with fesoterodine. Postgraduate medicine, 2012. 124(3): p. 7-15.
45. Kay, G., et al., Differential effects of the antimuscarinic agents darifenacin and oxybutynin ER on memory in older subjects. European Urology, 2006. 50(2): p. 317-26.
46. Herschorn, S., et al., Tolerability of solifenacin and oxybutynin immediate release in older (> 65 years) and younger (</= 65 years) patients with overactive bladder: sub-analysis from a Canadian, randomized, double-blind study. Current medical research and opinion, 2011. 27(2): p. 375-82.
47. Wesnes, K.A., et al., Exploratory pilot study assessing the risk of cognitive impairment or sedation in the elderly following single doses of solifenacin 10 mg. Expert opinion on drug safety, 2009. 8(6): p. 615-26.
48. Yamaguchi, O., et al., Safety and efficacy of mirabegron as ‚add-on‘ therapy in patients with overactive bladder treated with solifenacin: a post-marketing, open-label study in Japan (MILAI study). BJU Int, 2015. 116(4): p. 612-22.
49. Sand, P.K., et al., Trospium chloride once-daily extended release is efficacious and tolerated in elderly subjects (aged >/= 75 years) with overactive bladder syndrome. BJU international, 2011. 107(4): p. 612-20.
50. Staskin, D., Kay, G., Tannenbaum,C., Goldman, H.B., Bhashi, K., Ling, J., Oefelein, M.G., Trospium chloride has no effect on memory testing and is assay undetectable in the central nervous system of older patients with overactive bladder. International journal of Clinical Practice, 2010. 64(9): p. 1294 – 1300.
51. Isik, A.T., et al., Trospium and cognition in patients with late onset Alzheimer disease. J Nutr Health Aging, 2009. 13(8): p. 672-6.
52. Staskin, D., Kay, G., Tannenbaum, C., Goldman, H.B., Bhash,i K., Ling, J., Oefelein, M.G., Trospium chloride is undetectable in older human central nervous system. Journal of the American Geriatrics Society, 2010. 58(8): p. 1618 – 1619.
53. Wagg, A., et al., The efficacy and tolerability of the beta3-adrenoceptor agonist mirabegron for the treatment of symptoms of overactive bladder in older patients. Age Ageing, 2014. 43(5): p. 666-75.
54. Rochon, P.A., et al., Age- and gender-related use of low-dose drug therapy: the need to manufacture low-dose therapy and evaluate the minimum effective dose. J Am Geriatr Soc, 1999. 47(8): p. 954-9.
55. Qato, D.M., et al., Changes in Prescription and Over-the-Counter Medication and Dietary Supplement Use Among Older Adults in the United States, 2005 vs 2011. JAMA Intern Med, 2016. 176(4): p. 473-82.
56. Kashyap, M., M. Tu le, and C. Tannenbaum, Prevalence of commonly prescribed medications potentially contributing to urinary symptoms in a cohort of older patients seeking care for incontinence. BMC Geriatr, 2013. 13: p. 57.
57. Hashimoto, M., et al., Urinary incontinence: an unrecognised adverse effect with donepezil. Lancet, 2000. 356(9229): p. 568.
58. Starr, J.M., Cholinesterase inhibitor treatment and urinary incontinence in Alzheimer’s disease. J Am Geriatr Soc, 2007. 55(5): p. 800-1.
59. Terry, A.V., Jr. and J.J. Buccafusco, The cholinergic hypothesis of age and Alzheimer’s disease-related cognitive deficits: recent challenges and their implications for novel drug development. The Journal of pharmacology and experimental therapeutics, 2003. 306(3): p. 821-7.
60. Feinberg, M., The problems of anticholinergic adverse effects in older patients. Drugs Aging, 1993. 3(4): p. 335-48.
61. Wagg, A., C. Verdejo, and U. Molander, Review of cognitive impairment with antimuscarinic agents in elderly patients with overactive bladder. International journal of Clinical Practice, 2010. 64(9): p. 1279-86.
62. Gray, S.L., et al., Cumulative use of strong anticholinergics and incident dementia: a prospective cohort study. JAMA internal medicine, 2015. 175(3): p. 401-7.
63. Fox, C., et al., Effect of medications with anticholinergic properties on cognitive function, delirium, physical function and mortality: a systematic review. Age Ageing, 2014. 43(5): p. 604-15.
64. Fox, C., et al., The impact of anticholinergic burden in Alzheimer’s dementia-the LASERAD study. Age and Ageing, 2011. 40(6): p. 730- 5.
65. Jewart, R.D., et al., Cognitive, behavioral, and physiological changes in Alzheimer disease patients as a function of incontinence medications. Am J Geriatr Psychiatry, 2005. 13(4): p. 324-8.
66. Marti, N., Nebenwirkungen aktuell. pharma-kritik, 2019. 41(4): p. 13 – 16.
67. Malek, J.M., et al., The effect of age on stress and urgency urinary incontinence outcomes in women undergoing primary midurethral sling. Int Urogynecol J, 2015. 26(6): p. 831-5.
68. Tennstedt, S., Design of the Stress Incontinence Surgical Treatment Efficacy Trial (SISTEr). Urology, 2005. 66(6): p. 1213-7.
69. Hellberg, D., et al., The very obese woman and the very old woman: tension-free vaginal tape for the treatment of stress urinary incontinence. Int Urogynecol J Pelvic Floor Dysfunct, 2007. 18(4): p. 423-9.
70. Kim, J., et al., Worse long-term surgical outcomes in elderly patients undergoing SPARC retropubic midurethral sling placement. BJU international, 2011. 108(5): p. 708-12.
71. Nilsson, C.G., et al., Long-term Results of the Tension-Free Vaginal Tape (TVT) Procedure for Surgical Treatment of Female Stress Urinary Incontinence. Int Urogynecol J Pelvic Floor Dysfunct, 2001. 12 Suppl 2: p. 5-8.
72. Everaert K, Sriram R, A. Kohan A, et al. The efficacy and safety of onabotulinumtoxinA and solifenacin compared to placebo in solifenacin-naïve patients with idiopathic overactive bladder: Results from a multicentre, randomised, double-blind, phase 3b trial. European Urology Supplements, Volume 15, Issue 3, March 2016, Pages e877, e877
73. Visco AG, Brubaker L, Richter HE, et al.; Pelvic Floor Disorders Network. Anticholinergic versus botulinum toxin A comparison trial for the treatment of bothersome urge urinary incontinence: ABC trial. Contemp Clin Trials. 2012 Jan;33(1):184- 96.
74. Liao, C.H. and H.C. Kuo, Increased risk of large post-void residual urine and decreaswed longterm success rate after intravesical onabotulinumtoxinA injection for refractory idiopathic detrusor overactivity. The Journal of urology, 2013. 189(5): p. 1804-10.
75. Getliffe, K., et al., Absorbent products for incontinence: ‚treatment effects‘ and impact on quality of life. J Clin Nurs, 2007. 16(10): p. 1936-45.
La sarcoïdose – une maladie multi- systémique avec des aspects divers
La plupart des patients atteints de sarcoïdose sont initialement asymptomatiques. Lorsque les symptômes apparaissent, les patients signalent principalement un essoufflement, une toux ou des douleurs thoraciques non spécifiques. Les rémissions spontanées sont courantes, mais dans environ 25 % des cas, on observe une augmentation de la maladie pulmonaire qui, dans 10 % des cas, peut entraîner un sérieux dysfonctionnement pulmonaire. Cet article présente les actuelles options de traitement.
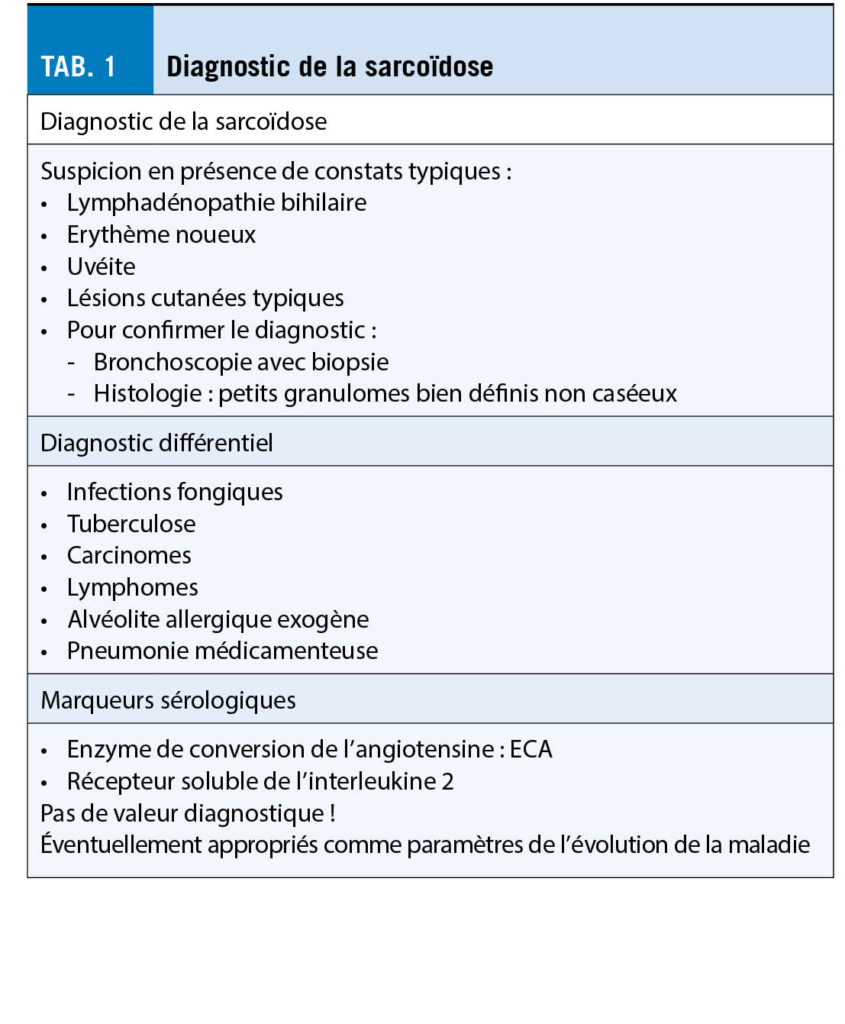
La sarcoïdose est une affection multisystémique caractérisée par des granulomes non caséeux. Ils peuvent se produire dans tous les organes, mais le plus souvent et le plus fréquemment, les poumons, les ganglions lymphatiques, la peau, les yeux et le foie sont touchés. La cause est inconnue, bien que l’ inhalation de substances nocives soit suspectée dans les cas de prédisposition génétique. La prévalence en Suisse est de 44/100 000, la prévalence des sarcoïdoses hospitalisées de 16/100 000. L’ incidence annuelle moyenne est de 7/100 000. Les informations sur le diagnostic, le diagnostic différentiel et les marqueurs sérologiques sont résumées dans le tableau 1.
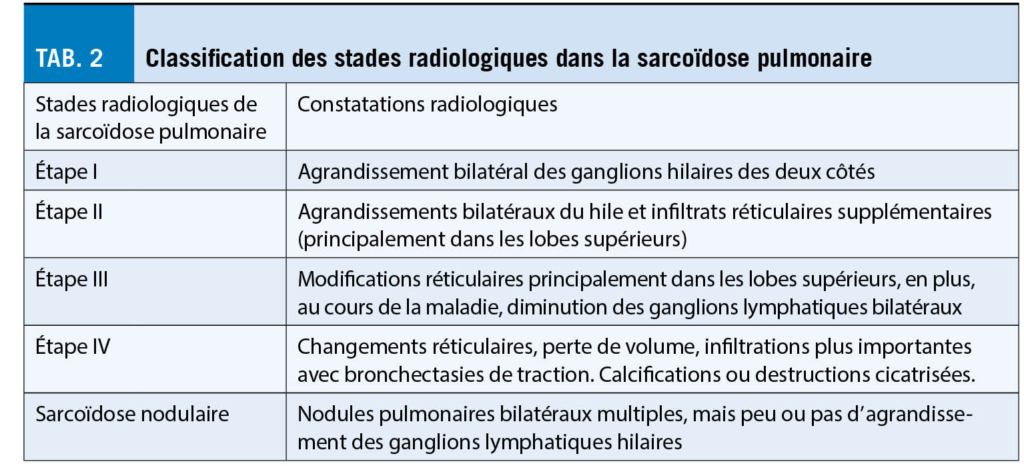
La plupart des patients atteints de sarcoïdose pulmonaire n’ ont pas besoin de traitement, car un grand nombre d’ entre eux restent asymptomatiques, ne progressent pas ou même guérissent spontanément. Toutefois, pour les patients présentant une atteinte fonctionnelle importante des poumons, il faut discuter d’ un traitement afin d’ éviter des lésions irréversibles des organes pulmonaires telles que la fibrose pulmonaire ou ce qu’ on appelle le Honeycombing (pour la classification des stades radiologiques, voir le tableau 2).
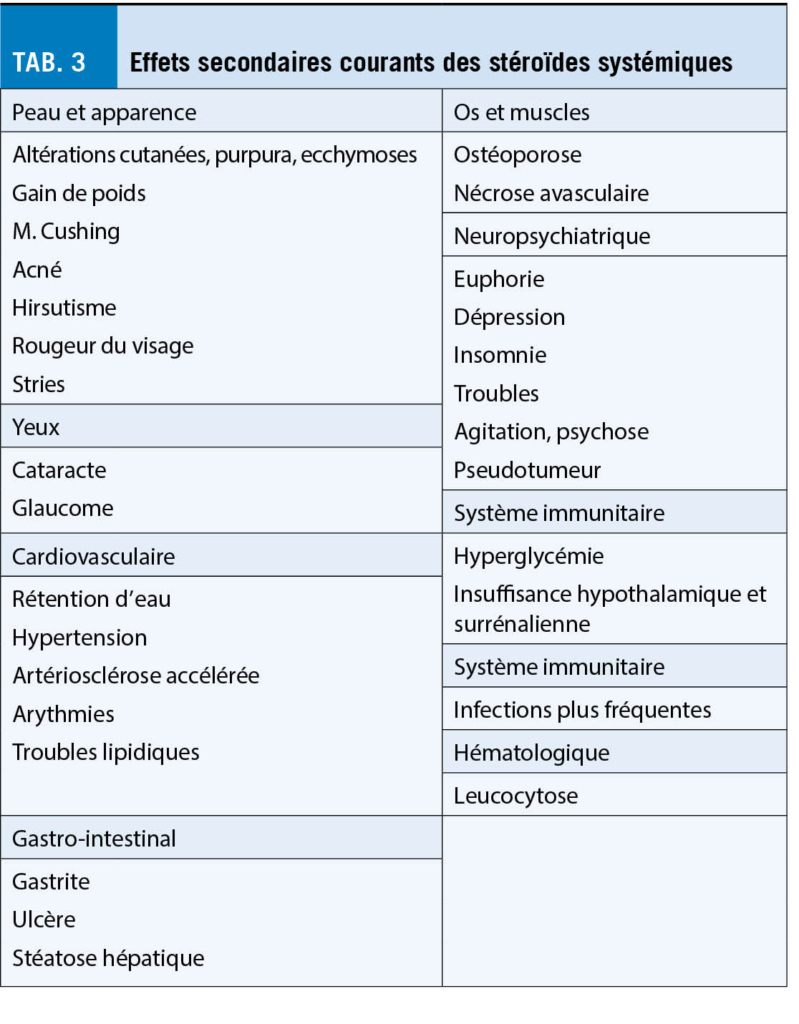
Les stéroïdes systémiques sont toujours les médicaments les plus utilisés pour le traitement de la sarcoïdose pulmonaire, car ils peuvent généralement réduire le processus inflammatoire granulomateux. Cependant, en raison des effets secondaires connus, leur utilisation et l’ évolution spontanée de la sarcoïdose doivent toujours faire l’ objet d’ un examen critique.
Indication pour une thérapie
Afin de décider si une thérapie glucocorticoïde doit être utilisée, il faut tenir compte du fait que certains patients présentent généralement une évolution bénigne, comme le stade I et l’ absence de symptômes, ce qui n’ est pas une indication de thérapie ! Donc attitude attentiste mais surveillance.
En cas de symptômes, notamment de dyspnée et d’ atteinte de plus de trois organes ou d’ augmentation des infiltrats pulmonaires, un traitement doit être appliqué.
Sarcoïdose pulmonaire
L’ indication actuelle du traitement de la sarcoïdose pulmonaire par glucocorticoïdes est la détérioration de la fonction pulmonaire dans un intervalle de 3 à 6 mois, lorsque la capacité pulmonaire totale (CPT) baisse de 10 % ou plus, lorsque la capacité de diffusion (DLCO/VA) baisse de 20 % ou plus, ou lorsque l’ analyse des gaz du sang artériel se détériore. En outre, des changements radiographiques progressifs avec augmentation des infiltrats interstitiels, le développement de cavités ou des signes de développement d’ une fibrose avec Honeycombing, ou bien des signes d’ hypertension pulmonaire.
Sarcoïdose extrapulmonaire
Parfois, une manifestation extrapulmonaire de sarcoïdose est à l’ origine d’ une thérapie glucocorticoïde, bien que les modifications pulmonaires soient stables. Cela inclut les manifestations de sarcoïdose des yeux, du système nerveux, du cœur, des reins ou une hypercalcémie persistante. D’ autres indications potentielles pour la thérapie sont la détérioration de l’ état général, les arthralgies ou les affections cutanées dérangeantes. En outre, maladie des sinus paranasaux ou du foie.
Quand peut-on se passer de thérapie ?
La thérapie glucocorticoïde n’ est pas indiquée chez les patients suivants :
- Patients asymptomatiques au stade radiologique I : 60 à 80 % de ces patients ont une rémission spontanée.
- Patients asymptomatiques en phase II : Modifications radiologiques et fonction pulmonaire normale et seulement légèrement restreinte (légèrement restrictive ou obstructive avec un échange gazeux normal). Ces patients sont examinés tous les 3 à 6 mois afin d’ exclure toute progression. Chez ces patients, il est important de surveiller la détérioration progressive au moyen d’ un grand test de la fonction pulmonaire ou de superviser l’ échange gazeux avant de commencer le traitement. 50% des patients non traités en phase II restent stables
- Patients asymptomatiques au stade III et fonction pulmonaire normale ou légèrement limitée : Ces patients doivent également être contrôlés tous les 3 à 6 mois. Dans ce groupe, 33% des patients non traités présentent une disparition des infiltrats dans les 5 ans, mais la plupart des patients ont besoin d’ une thérapie.
Thérapie initiale
Les glucocorticoïdes oraux sont les plus couramment utilisés dans le monde pour réduire les symptômes de la sarcoïdose et de la maladie pulmonaire progressive, bien que les stéroïdes ne guérissent généralement pas complètement la maladie. Ils améliorent généralement les symptômes tels que la toux chronique ou l’ essoufflement. De plus, les changements radiologiques s’ améliorent au cours de la maladie, surtout au début. Néanmoins, l’ inconvénient est l’ apparition d’ effets secondaires (tab. 3) et le bénéfice incertain de la thérapie dans le cadre d’ un traitement à long terme. Avant de commencer une thérapie, les patients doivent être examinés en détail, en particulier les organes affectés doivent être identifiés et les comorbidités telles que l’ insuffisance cardiaque, la thromboembolie, l’ hypertension pulmonaire, le diabète sucré ou la tuberculose, qui peuvent initialement se dérouler de manière similaire, doivent être exclues par un diagnostic différentiel. La clarification porte sur la fonction pulmonaire pléthysmographique, l’ HRCT des poumons, l’ exclusion de la tuberculose par des méthodes bactériologiques et des tests interféron-gamma, et, en cas de suspicion, l’ échocardiographie pour exclure l’ hypertension pulmonaire.
Le traitement commence généralement par une dose de 0,3 à 0,6 mg de prednisone orale par kg de poids corporel (ce qui signifie normalement 20 à 40 mg par jour, selon la gravité de la maladie). Pour les patients souffrant de détresse respiratoire à l’ effort avec des infiltrats radiographiques n’ augmentant que lentement, la dose la plus faible suffit en général. Pour les patients présentant une progression rapide de la maladie, par ex. ayant besoin d’ oxygène, il convient de choisir en priorité des doses plus élevées. La dose initiale est indiquée pendant 4 à 6 semaines, après le patient est à nouveau évalué. Si, au cours de la maladie, les symptômes et les changements radiologiques, y compris les tests fonctionnels des poumons, restent stables ou s’ améliorent, la dose peut être réduite lentement (5 à 10 mg toutes les 4 à 12 semaines pour atteindre une dose minimale de 0,2 à 0,4 mg par kilo, soit environ 10 à 15 mg par jour). Si dans un délai de 6 semaines les paramètres restent inchangés, la dose sera prolongée de 6 semaines supplémentaires. La thérapie glucocorticoïde à haute dose (80-100 mg par jour) est rarement utilisée, le plus souvent en cas d’ insuffisance respiratoire aiguë ou de manifestation cardiaque, neurologique, ophtalmologique dans les voies respiratoires supérieures.
Réponse clinique
Les patients qui répondent à la thérapie glucocorticoïde systémique doivent l’ éliminer lentement sur une période maximale de 12 mois si les symptômes et les résultats radiographiques s’ améliorent.
Absence d’ amélioration ou intolérance aux glucocorticoïdes
Bien que la majorité des patients répondent aux glucocorticoïdes, il y a aussi ceux qui n’ y répondent pas ou qui développent des effets secondaires graves. Ces patients sont candidats à une thérapie immunosuppressive telle que le méthotrexate, l’ azathioprine, le léflunomide ou les inhibiteurs du TNF-alpha.
Thérapie d’ entretien
Il n’ y a pas de recommandation bien fondée sur des preuves. L’ expérience montre que des doses de 10 à 15 mg par jour sont généralement suffisantes pour prévenir toute détérioration supplémentaire. Pendant la thérapie d’ entretien, le patient est examiné toutes les 4 à 12 semaines pour détecter les effets secondaires. Dans la plupart des cas, les patients peuvent réduire progressivement et arrêter les stéroïdes dans un délai d’ un an. Un tiers des patients doivent à nouveau augmenter la dose et seule une petite partie des patients ont besoin d’ une thérapie sur plusieurs années.
Cas résistants
Chez les patients qui développent des effets secondaires pertinents de la thérapie glucocorticoïde ou qui souffrent de diabète sucré, d’ ostéoporose ou d’ autres maladies compliquées, on essaie une autre forme de thérapie immunosuppressive légère.
Les médicaments ayant l’ effet et le bénéfice attendus les plus importants dans la sarcoïdose pulmonaire progressive avec des effets secondaires le plus souvent légers sont le méthotrexate, l’ azathioprine, le léflunomide ou les mycophénolates. En outre, les antagonistes du TNF-alpha présentent de bons effets. Cependant, il n’ existe pas de bonnes études randomisées sur ces médicaments immunosuppresseurs. Tous présentent un risque de toxicité, en particulier de myélosuppression, d’ hépatotoxicité ou d’ apparition d’ infections opportunistes. Le méthotrexate est le médicament le plus couramment utilisé à la place des stéroïdes, mais son utilisation n’ est pas possible en cas de maladie du foie. Les patients qui ne peuvent pas tolérer le méthotrexate sont généralement traités avec l’ une des autres thérapies immunosuppressives mentionnées ci-dessus. Si aucune des thérapies mentionnées ci-dessus n’ est possible, on passe aux antagonistes du TNF-alpha, en particulier l’ infliximab ou l’ adalimumab. La combinaison d’ un inhibiteur du TNF-alpha avec le méthotrexate est utilisée avec succès dans la polyarthrite rhumatoïde, elle est effective et réduit le risque de développer des anticorps inhibiteurs du TNF-alpha. Pourtant, cette thérapie n’ a jamais été correctement étudiée dans le cas de la sarcoïdose et peut être associée à un risque accru d’ infection ou de développement tumoral.
Suivi de la thérapie
De la même manière que pour la thérapie glucocorticoïde, l’ effet est régulièrement évalué au moyen de tests de la fonction pulmonaire, d’ analyses des gaz du sang et en observant les changements radiologiques.
Thérapie glucocorticoïde par inhalation
L’ utilisation de glucocorticoïdes inhalés pour le traitement de la sarcoïdose pulmonaire donne des résultats contradictoires. Les glucocorticoïdes inhalés semblent améliorer l’ alvéolite et peuvent être bénéfiques chez certains patients. Le budésonide a été le mieux étudié à une dose de 800-1600 µg deux fois par jour et s’ est révélé avoir un bon effet sur la toux chronique dans la sarcoïdose.
Article traduit de «der informierte arzt» 11_2020
Copyright Aerzteverlag medinfo AG
LungenZentrum Hirslanden
Witellikerstrasse 40
8032 Zürich
L’ auteur a déclaré n’ avoir aucun conflit d’ intérêts en relation avec cet article.
1. Epidemiology of sarcoidosis, Ungprasert P, Carmona EM, Utz JP et al Mayo Clin Proc. 2016 Feb;91(2):183-8. Epub 2015 Dec 22.
2. Outcome of the treatment for sarcoidosis, Hunninhake GW, Gilbert S, Pueringer R et al Am J Respir Crit Care Med. 1994; 149(4 Pt 1):893
3. New treatment strategies for pulmonary sarcoidosis: antimetabolits, biological drugs, and other treatment approaches, Lancet Respir Med. 2015 Oct;3(10):813-22. Epub 2015 Jul 20.
4. Sarcoidosis, Iannuzzi MC, Rybicki BA, Teirstein AS. N Engl J Med. 2007; 357(21):2153
5. Corticosteroid treatment in pulmonary sarcoidosis, Turner-Warwick M, Mc Allister W, Lawrence R et al, Thorax.1986:41(12):903
6. Pharmacotherapy for pulmonary sarcoidosis: a Delphi consensus study. Schutt AC, Bullington WM, Judson MA, Respir Med 2010;104(5):717. Epub 2010 Jan 20
7. Inhaled corticosteroids can modulate the immunpathogenesis of pulmonary sarcoidosis, Spiteri MA, Newman SP, Clarke SW, Poulter LW, Eur Respir J 1989; 2(3):218
Traitement de la polyarthrite rhumatoïde
La polyarthrite rhumatoïde (PR) est une maladie auto-immune chronique caractérisée par une incapacité articulaire progressive, une inflammation systémique et une morbidité élevée (1, 2). Ces dernières années, plusieurs études ont montré que la pathogenèse de la PR est induite par une multitude de cellules inflammatoires associées à un réseau complexe de cytokines, entraînant à la fois la destruction et la perte de la fonction articulaire et des manifestations systémiques telles que la fatigue, l’ anémie, l’ ostéoporose et les troubles cardiovasculaires (3).
L’ utilisation d’ agents biotechnologiques a révolutionné l’ approche thérapeutique et la lutte contre la progression de la PR. En particulier, il a été démontré que l’ interleukine-6 (IL-6) est une cytokine centrale dans la pathogenèse de la maladie (4). L’ IL-6 contribue à la perturbation du système immunitaire inné et adaptatif et à la production de protéines en phase aiguë impliquées dans l’ expression systémique de la maladie. Le premier bloqueur de l’ IL-6 commercialisé a été le tocilizumab, un anticorps monoclonal humanisé contre le récepteur de l’ IL-6 (anti-IL-6R) (5). L’ utilisation réussie du tocilizumab dans la PR a encouragé le développement d’ autres agents biologiques qui ciblent spécifiquement la voie de signalisation de l’ IL-6 et sont dirigés soit contre la cytokine IL-6 (le sirukumab, l’ olokizumab et le clazakizumab), soit contre le récepteur de l’ IL-6 (le sarilumab).
Le sarilumab (Kevzara®) est un anticorps monoclonal IgG1 entièrement humain qui se lie avec une grande affinité à l’ IL-6Rα soluble et membranaire (6). Les données précliniques sur le sarilumab ont montré une inhibition dose-dépendante de la signalisation de l’ IL-6 à des concentrations inférieures à celles du tocilizumab et sans preuve de cytotoxicité à médiation cellulaire dépendante du complément ou des anticorps (7, 8).
Efficacité du sarilumab
Dans l’ étude randomisée et contrôlée par placebo MOBILITY (9), 1197 patients atteints de PR active et présentant une réponse inadéquate au méthotrexate (MTX) ont reçu du sarilumab par voie sous-cutanée (150 ou 200 mg) ou un placebo plus du MTX toutes les 2 semaines (q2w) pendant une période allant jusqu’ à 1 an. Dans le cadre de TARGET, 546 patients présentant une réponse inadéquate ou une intolérance aux antagonistes du TNF-α ont été traités avec un DMARD (disease-modifying antirheumatic drug) plus des doses faibles ou normales du sarilumab plus un placebo pendant 24 semaines (10).
Les deux groupes ont montré une réponse plus élevée et plus rapide au traitement par rapport au placebo, un taux de rémission plus élevé et une meilleure inhibition de la progression radiologique enregistrée. Ces résultats positifs ont été confirmés dans les prolongations ouvertes à long terme (11, 12).
Sécurité du sarilumab
L’ innocuité du sarilumab était conforme au blocage des récepteurs IL-6. La réponse clinique a été similaire indépendamment du traitement initial et la progression radiologique s’ est stabilisée. Les patients traités par le sarilumab 200 mg q2w ont eu les meilleurs résultats radiologiques. Le profil de sécurité à long terme du sarilumab, soit en combinaison avec les DMARD ou en monothérapie, est resté stable et conforme au profil attendu d’ une molécule qui inhibe la voie de signalisation de l’ IL6. (13).
Fazit
- L’ IL-6 représente une cible plus spécifique pour le traitement de la PR par rapport à l’ effet général et non spécifique du blocage du TNF.
- Le sarilumab, un inhibiteur des récepteurs IL-6, montre une large efficacité similaire dans tous les sous-types de PR, du MTX au TNFi, chez les patients qui ne répondent pas bien.
- Le profil de sécurité du sarilumab semble être conforme à celui attendu pour les inhibiteurs de l’ IL-6. En outre, le sarilumab a montré une affinité nettement plus élevée que le tocilizumab, avec une demi-vie plus longue, ce qui permet une fréquence d’ administration plus faible (une semaine sur deux au lieu d’ une fois par semaine).
riesen@medinfo-verlag.ch
1. McInnes IB, Schett G. The pathogenesis of rheumatoid arthritis. N Engl J Med. 2011;365:2205–2219.
2. Smolen JS, et al. Rheumatoid arthritis. Lancet. 2016;388:2023–2038.
3 Smolen JS, et al. The pathogenesis of rheumatoid arthritis: new insights from old clinical data? Nat Rev Rheumatol. 2012;8:235–243.
4. Fonseca JE, et al Interleukin-6 as a key player in systemic inflammation and joint destruction. Autoimmun Rev. 2009;8:538–542.
5. Sebba A. Tocilizumab: the first interleukin-6-receptor inhibitor. Am J Health Syst Pharm. 2008; 65:1413-8.
6. Kim GW et al. IL-6 inhibitors for treatment of rheumatoid arthritis: past, present, and future. Arch Pharm Res. 2015;38:575–584.
7. Genovese MC, et al. Sarilumab, a subcutaneously-administered, fully-human
monoclonal antibody inhibitor of the IL-6 receptor: relationship between EULAR
responses and change from baseline of selected clinical parameters [abstract]
Ann Rheum Dis. 2013;72(Suppl 3):620.
8. Wang LH et al. Preclinical development of sarilumab, the first fully-human monoclonal antibody (mAb) against IL-6R alpha: utilization and value of double humanized animal model [abstract] Ann Rheum Dis. 2013;72(Suppl 3):375.
9. Huizinga TWJ et al. Sarilumab, a fully human monoclonal antibody against IL-6Rα in patients with rheumatoid arthritis and an inadequate response to methotrexate: efficacy and safety results from the randomised SARIL-RA-MOBILITY Part A trial. Drug Des Devel Ther. 2017; 11: 1593–1603.
10. Fleischman R et al. Sarilumab and nonbiologic disease-modifying antirheumatic drugs in patients with active rheumatoid arthritis and inadequate response or intolerance to tumor necrosis factor inhibitors. Arthritis Rheumatol 2017; 69: 277-90.
11. Burmester GR et al. Ann Rheum Dis 2018; 77: 946-47.
12. Genovese MC et al. Two years of sarilumab in patients with rheumatoid arthritis and an inadequate response to MTX: safety , afficacy and radiographic outcomes. Rheumatology (Oxford) 2018;57:1423-1431.
13. Fleischmann R et al. Long-term safety of sarilumab in rheumatoid arthritis: an integrated analysis with up to 7 years’ follow-up Rheumatology (Oxford). 2020; 59: 292–302.
Dasatinib-Blinatumomab bei Ph-positiver akuter lymphatischer Leukämie bei Erwachsenen
Quelle: Foà R et al. Dasatinib–Blinatumomab for Ph-Positive Acute Lymphoblastic Leukemia in Adults. New Engl J Med 2020; 383:1613-1623
Hintergrund
Die Resultate bei Patienten mit Philadelphia-Chromosom (Ph)-positiver akuter lymphoblastischer Leukämie (ALL) haben sich durch den Einsatz von Tyrosinkinase-Inhibitoren verbessert. Die molekulare Remission ist ein primäres Behandlungsziel.
Methoden
Die Autoren führten eine Phase 2 Studie der Erstlinientherapie bei Erwachsenen mit neu diagnostizierter Ph-positiver ALL (ohne obere Altersgrenze) durch. Es wurden Dasatinib plus Glukokortikoide verabreicht, gefolgt von zwei Zyklen mit Blinatumomab. Der primäre Endpunkt war ein anhaltendes molekulares Ansprechen im Knochenmark.
Ergebnisse
Bei 98% der 63 in die Studie eingeschlossenen Patienten (mittleres Alter, 54 Jahre; Bereich, 24 bis 82), wurde eine vollständige Remission beobachtet. Am Ende der Dasatinib-Induktionstherapie (Tag 85) hatten 29% der Patienten ein molekulares Ansprechen, und dieser Prozentsatz stieg nach zwei Blinatumomab-Zyklen auf 60%; der Prozentsatz der Patienten mit einem molekularen Ansprechen stieg nach weiteren Blinatumomab-Zyklen weiter an. Bei einem medianen Follow-up von 18 Monaten betrug das Gesamtüberleben 95% und das krankheitsfreie Überleben 88%; das krankheitsfreie Überleben war niedriger bei Patienten, die eine IKZF1-Deletion plus zusätzliche genetische Aberrationen (CDKN2A oder CDKN2B, PAX5 oder beide [i.e. IKZF1plus]) aufwiesen. Bei 6 Patienten, die während der Induktionstherapie eine erhöhte minimale Resterkrankung aufwiesen wurden ABL1-Mutationen nachgewiesen. Alle diese Mutationen wurden durch Blinatumomab eliminiert. Sechs Rezidive traten auf. Insgesamt wurden 21 unerwünschte Ereignisse vom Grad 3 oder höher registriert. Insgesamt 24 Patienten erhielten eine allogene hämatopoietische Stammzelltransplantation, wobei ein Todesfall im Zusammenhang mit der Transplantation (4%) stand.
Schlussfolgerungen
Die chemotherapie-freie Induktions- und Konsolidierungstherapie der Erstlinienbehandlung mit Dasatinib und Blinatumomab, die auf einer gezielten immuntherapeutischen Strategie basierte, war bei Erwachsenen mit Ph-positiver ALL mit einer hoher Inzidenz molekularen Ansprechens, einer hohen Überlebensrate und wenigen Nebenwirkungen Grad 3 oder höher assoziiert.
Zentrum für Hämatologie und Onkologie
UniversitätsSpital Zürich
Zentrum für Hämatologie und Onkologie
UniversitätsSpital Zürich
Alexandre.Theocharides@usz.ch