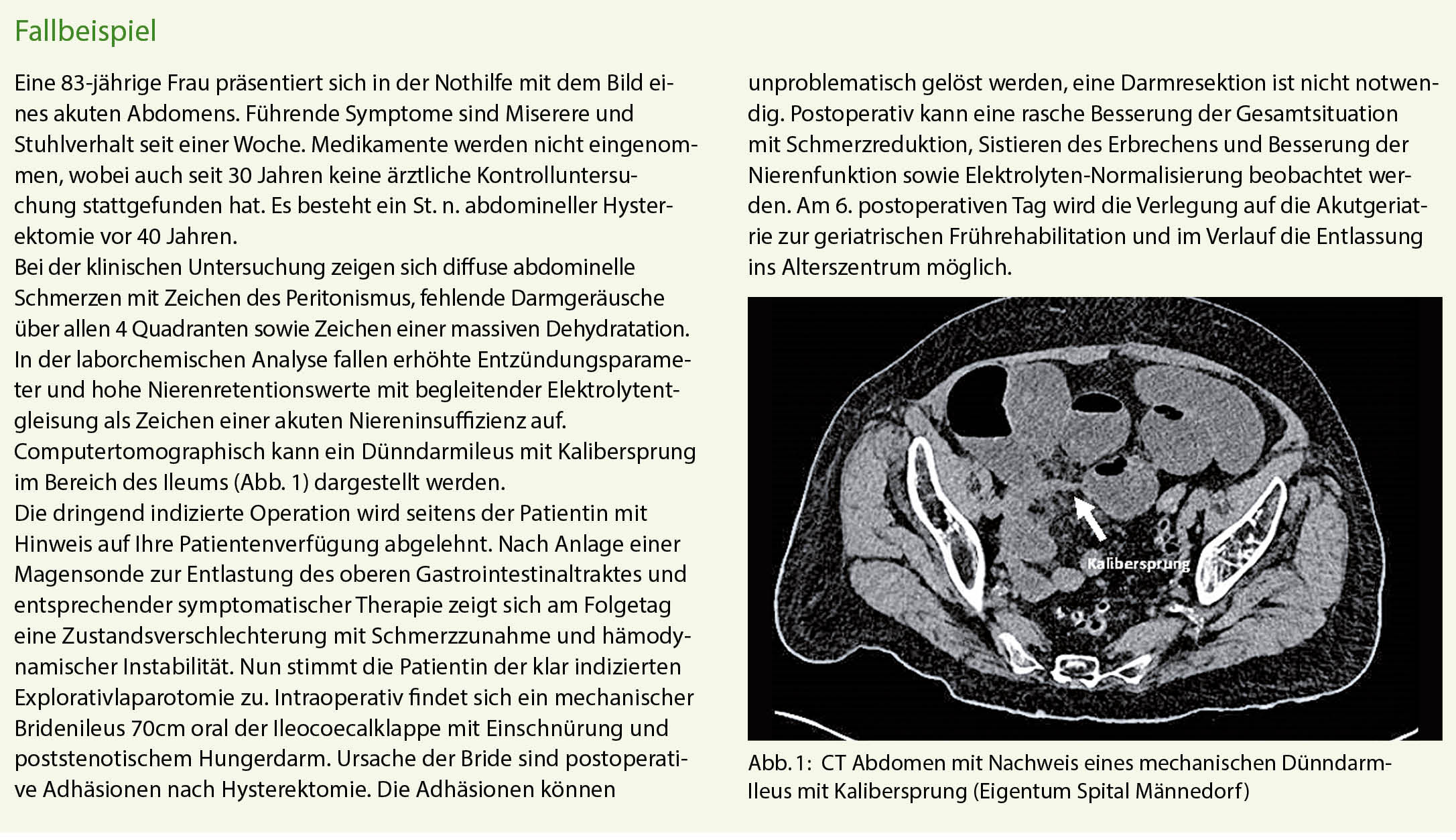
Die meisten Patienten mit einer Sarkoidose sind anfänglich asymptomatisch. Wenn Symptome auftreten, dann berichten die Patienten vor allem über Atemnot, Husten oder unspezifische Brustbeschwerden. Eine spontane Remission ist häufig, aber in ca. 25% der Fälle tritt eine zunehmende Lungenerkrankung auf, welche in bis 10% zu einer relevanten Lungenfunktionsstörung führen kann. Dieser Artikel präsentiert die aktuellen Therapiemöglichkeiten.
Die Sarkoidose ist eine Multisystem-Erkrankung, die durch nicht-verkäsende Granulome charakterisiert ist. Diese können in allen Organen auftreten, vor allem aber und am häufigsten sind die Lungen, Lymphknoten, die Haut, Augen und die Leber betroffen. Die Ursache ist ungeklärt, wobei ein Verdacht auf inhalative Noxen besteht bei genetischer Prädisposition. Die Prävalenz in der Schweiz beträgt 44/100 000, die Prävalenz hospitalisationsbedürftiger Sarkoidosen 16/100 000. Die durchschnittliche jährliche Inzidenz liegt bei 7/100 000. Hinweise zur Diagnostik, Differentialdiagnose und zu serologischen Markern sind in Tab. 1 zusammengefasst.
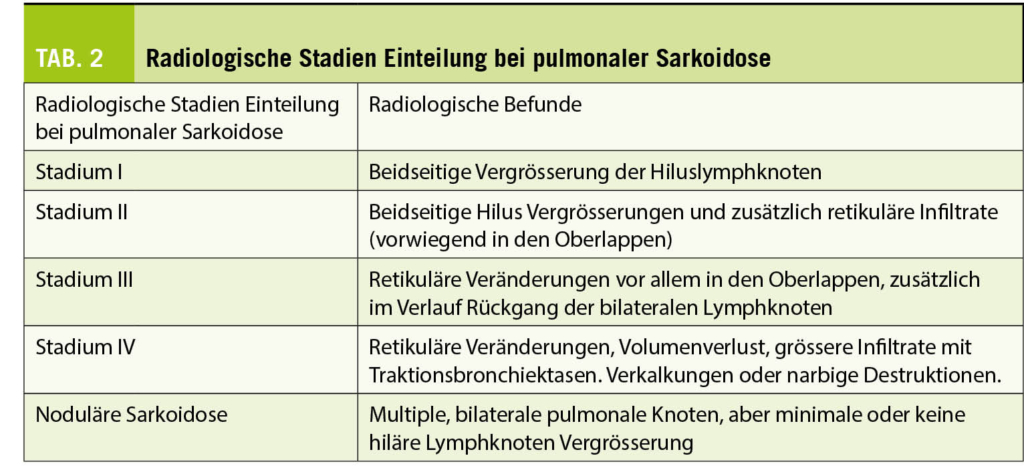
Die meisten Patienten mit pulmonaler Sarkoidose brauchen keine Behandlung, da eine grosse Anzahl asymptomatisch bleibt, nicht progressiv verläuft oder sogar spontan abheilt. Für Patienten mit deutlicher Funktionseinschränkung der Lungen muss aber eine Therapie diskutiert werden, um irreversible pulmonale Organschädigungen wie Lungenfibrose oder sogenanntes Honeycombing zu vermeiden (Zur radiologischen Stadieneinteilung siehe Tab. 2).
Systemische Steroide sind die immer noch die am häufigsten verwendeten Medikamente zur Therapie der pulmonalen Sarkoidose, da Sie meistens den granulomatösen entzündlichen Prozess verringern können. Wegen der bekannten Nebenwirkungen muss der Spontanverlauf einer Sarkoidose und deren Einsatz aber immer kritisch hinterfragt werden.
Indikation für eine Therapie
Um zu entscheiden, ob eine Glucorticoid-Therapie eingesetzt werden soll, muss man berücksichtigen, dass es Patienten gibt, die meist einen benignen Verlauf zeigen, wie bei Stadium I und Fehlen von Symptomen, was also keine Therapie-Indikation darstellt! Daher abwartende Haltung aber Überwachen.
Bei Symptomen, v.a. Dyspnoe, und Beteiligung von mehr als drei Organen oder zunehmenden Lungeninfiltraten muss eine Therapie eingesetzt werden.
Pulmonale Sarkoidose
Die aktuelle Indikation einer Therapie bei der pulmonalen Sarkoidose mit Glucorticoiden besteht bei Verschlechterung der Lungenfunktion im Rahmen von 3-6 monatigen Intervallen, wenn die totale Lungenkapazität (TLC) 10% oder mehr abfällt, bei einem Rückgang der Diffusionkapazität (DLCO/VA) von 20% oder mehr oder bei Verschlechterung der arteriellen Blutgasanalyse. Zudem bei progressiven radiographischen Veränderungen mit Vermehrung der interstitiellen Infiltrate, Entwicklung von Kavernen oder Anzeichen einer Entwicklung einer Fibrose mit Honeycombing oder Zeichen einer pulmonalen Hypertonie.
Extrapulmonale Sarkoidose
Gelegentlich ist eine extrapulmonale Manifestation der Sarkoidose Grund für eine Glucorticoid-Therapie, obwohl die Lungenveränderungen stabil sind. Dies betrifft Sarkoidose-Manifestationen der Augen, des Nervensystems, des Herzens, der Nieren oder eine persistierende Hyperkalzämie. Andere potentielle Indikationen für eine Therapie sind AZ-Verschlechterung, Arthralgien oder belastende Hautbefunde. Zusätzlich Erkrankung der Nasennebenhöhlen oder der Leber.
Wann kann auf eine Therapie verzichtet werden?
Eine Glucorticoid-Therapie ist nicht indiziert bei folgenden Patienten:
Asymptomatische Patienten im radiologischen Stadium I
-60-80% dieser Patienten haben eine spontane Remission
Asymptomatische Patienten im Stadium II
-Radiologische Veränderungen und normale und nur leicht eingeschränkte Lungenfunktion (mild restriktiv oder obstruktiv mit normalem Gasaustausch). Diese Patienten werden alle 3-6 Monate untersucht, um eine Progression auszuschliessen. Bei diesen Patienten ist es wichtig, eine progressive Verschlechterung mittels grosser Lungenfunktionsprüfung oder Gasaustausch zu monitorisieren, bevor man eine Therapie beginnt. 50% der nicht behandelten Patienten im Stadium II bleiben stabil.
Asymptomatische Patienten im Stadium III und normaler oder leicht eingeschränkter Lungenfunktion
-Diese Patienten sollten ebenfalls alle 3-6 Monate nachkontrolliert werden. In dieser Gruppe zeigen 33% der nicht behandelten Patienten ein Verschwinden der Infiltrate innerhalb von
5 Jahren, die meisten Patienten brauchen aber eine Therapie.
Initiale Therapie
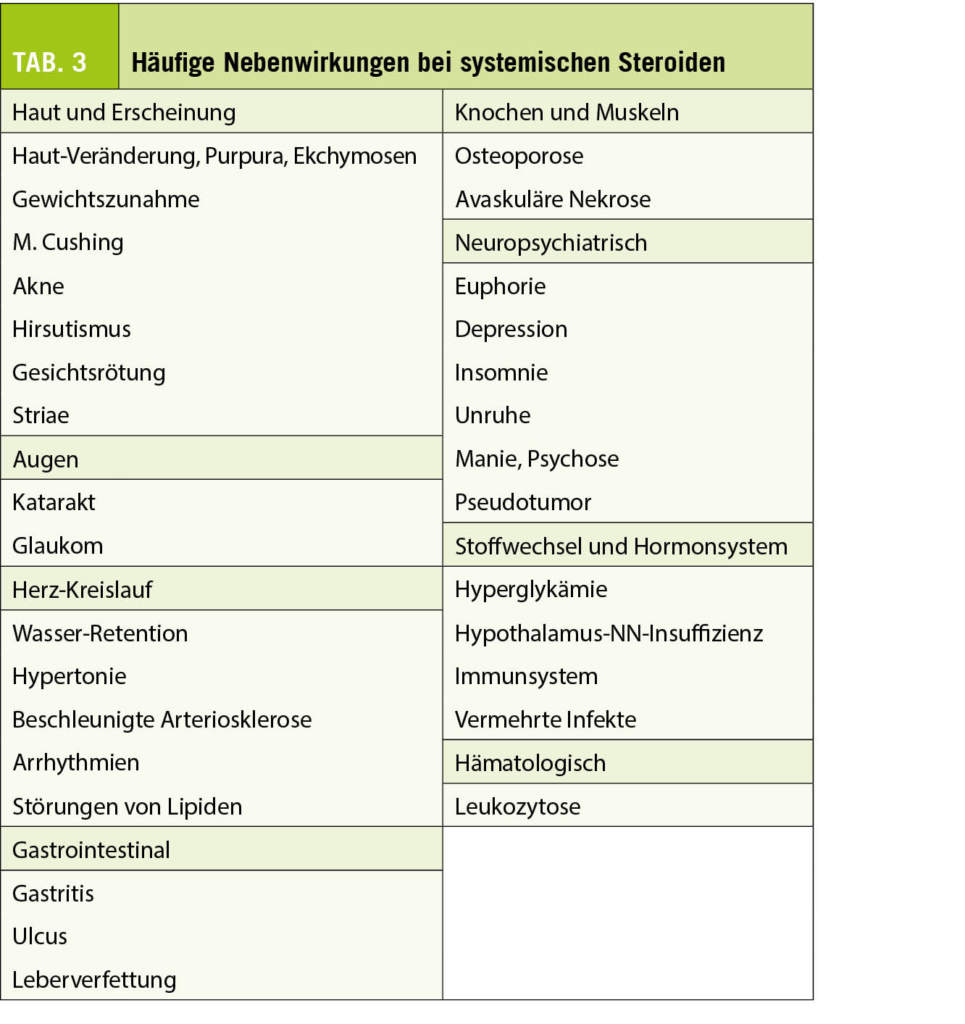
Orale Glucocorticoide werden weltweit am häufigsten eigesetzt, um Sarkoidose-Symptome und eine fortschreitende Lungenerkrankung zu bremsen, dies obwohl durch Steroide die Erkrankung meistens nicht vollständig abheilt. Sie verbessern meistens die Symptome wie chronischen Husten oder Atemnot. Zusätzlich bessern im Verlauf die radiologischen Veränderungen, vor allem zu Beginn. Trotzdem ist der Nachteil das Auftreten von Nebenwirkungen (Tab. 3) und der unsichere Benefit der Therapie im Rahmen einer Langzeitbehandlung. Vor Starten einer Therapie müssen die Patienten genau untersucht werden, vor allem müssen mitbeteiligte Organe erkannt und komorbide Erkrankungen wie Herzinsuffizienz, Thromboembolie, pulmonale Hypertonie, Diabetes mellitus oder eine Tuberkulose, welche initial ähnlich verlaufen kann, differenzialdiagnostisch ausgeschlossen werden. Die Abklärung umfasst eine plethysmographische Lungenfunktion, ein HRCT der Lungen, den Ausschluss einer Tuberkulose mittels bakteriologischer Methoden und Interferon-Gamma-Tests, sowie bei entsprechendem Verdacht eine Echokardiographie zum Ausschluss einer pulmonalen Hypertonie.
Eine Therapie wird normalerweise mit oralem Prednison mit einer Dosis von 0.3-0.6 mg pro Kilogramm Körpergewicht gestartet (im Normalfall bedeutet dies 20-40 mg pro Tag, je nach Schweregrad der Erkrankung). Für Patienten mit Atemnot bei Belastung bei nur langsam zunehmenden radiographischen Infiltraten genügt meistens die tiefste Dosis. Für Patienten mit schneller Progression der Erkrankung wie Sauerstoffbedürftigkeit sollte man primär schon höhere Dosen wählen. Die initiale Dosis ist für 4-6 Wochen indiziert, nachher wird der Patient wieder beurteilt. Wenn im Verlauf die Symptome und radiologischen Veränderungen inklusiv der funktionellen Lungentestung stabil bleiben oder sich verbessern, kann man die Dosis langsam reduzieren (5-10mg alle 4-12 Wochen bis zu einer minimalen Dosis von 0.2-0.4mg pro Kilo, ca. 10-15 mg pro Tag). Wenn im Verlauf die Parameter innerhalb von 6 Wochen unverändert bleiben wird die Dosis für weitere 6 Wochen verlängert. Eine hochdosierte Glucorticoid-Therapie (80-100 mg pro Tag) wird selten gebraucht, am ehesten bei akutem respiratorischem Versagen oder kardialen, neurologischen, ophthalmologischen Manifestation im Bereich der oberen Atemwege.
Klinisches Ansprechen
Patienten, welche auf eine systemische Glucorticoid-Therapie ansprechen, sollten diese über längstens 12 Monate langsam ausschleichen, wenn Symptome und radiographische Befunde bessern.
Fehlende Besserung oder Intoleranz auf Glucorticoide
Während der Grossteil der Patienten auf Glucorticoide anspricht, gibt es Patienten, welche nicht ansprechen oder schwerwiegende Nebenwirkungen entwickeln. Diese Patienten sind Kandidaten für eine immunsuppressive Therapie wie Methotrexat, Azathioprin, Leflunomid oder TNF-Alpha-Inhibitoren.
Erhaltungstherapie
Es gibt keine gut evidenzbasierte Empfehlung. Erfahrungsgemäss genügen meist Dosen von 10- 15 mg täglich, um eine erneute Verschlechterung zu verhindern. Während der Erhaltungstherapie wird der Patient bezüglich Nebenwirkungen alle 4 bis 12 Wochen kontrolliert. Meistens können Patienten die Steroide innerhalb eines Jahres ausschleichen. Ein Drittel der Betroffenen muss die Dosis wieder erhöhen und nur ein kleiner Teil der Patienten braucht eine Therapie über mehrere Jahre.
Resistente Fälle
Bei Patienten, welche relevante Nebenwirkungen einer Glucocorticoid-Therapie entwickeln oder einen Diabetes mellitus, eine Osteoporose oder andere komplizierende Erkrankungen aufweisen, versucht man eine andere Form von milder immunsuppressiver Therapie.
Medikamente mit zu erwartendem grösstem Effekt und Benefit bei einer progredienten pulmonalen Sarkoidose mit meist nur milden Nebenwirkungen sind Methotrexat, Azathioprin, Leflunomid oder Mycophenolate. Zudem zeigen Tumornekrosefaktor-Alpha (TNF-Alpha Antagonisten) gute Effekte. Gute randomisierte Studien bezüglich dieser Immunsuppressiva fehlen allerdings. All diese Medikamente haben das Risiko von Toxizität, vor allem Myelosuppression, Hepatotoxizität oder Auftreten von opportunistischen Infekten. Methotrexat ist das Medikament, das am meisten anstelle von Steroiden eingesetzt wird, allerdings ist der Einsatz bei Lebererkrankungen nicht möglich. Patienten, welche Methotrexat nicht vertragen, werden meist mit einer der oben erwähnten anderen immunsuppressiven Therapie behandelt. Falls keine der erwähnten Therapien möglich ist, wechselt man zu TNF-Alpha-Antagonisten, vor allem Infliximab oder Adalimumab. Kombination eines TNF-Alpha-Inhibitors mit Methotrexat wird mit Erfolg bei rheumatoider Arthritis eingesetzt, zeigt Wirkung und reduziert das Risiko der Entwicklung von TNF-Alpha-Inhibitor-Antikörpern. Diese Therapie wurde aber bei der Sarkoidose nie richtig untersucht und kann mit einem erhöhten Risiko eines Infektes oder Tumorentstehung einhergehen.
Verlaufskontrolle der Therapie
Genau gleich wie diese bei Glucorticoid-Therapie durchgeführt wird, wird die Wirkung regelmässig mittels Lungenfunktionstestung, Blutgasanalysen und radiologischem Verlauf beurteilt.
Inhalative Glucorticoid-Therapie
Der Einsatz inhalativer Glucorticoide zur Behandlung der pulmonalen Sarkoidose zeigt widersprechende Resultate. Die inhalativen Glucorticoide scheinen eine Alveolitis zu verbessern und können bei gewissen Patienten von Vorteil sein. Am besten wurde Budesonid in einer Dosis von 800-1600 µg 2 x täglich studiert und konnte vor allem eine gute Wirkung auf chronischen Husten bei einer Sarkoidose zeigen.
Copyright bei Aerzteverlag medinfo AG
LungenZentrum Hirslanden
Witellikerstrasse 40
8032 Zürich
Der Autor hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
1. Epidemiology of sarcoidosis, Ungprasert P, Carmona EM, Utz JP et al Mayo Clin Proc. 2016 Feb;91(2):183-8. Epub 2015 Dec 22.
2. Outcome of the treatment for sarcoidosis, Hunninhake GW, Gilbert S, Pueringer R et al Am J Respir Crit Care Med. 1994; 149(4 Pt 1):893
3. New treatment strategies for pulmonary sarcoidosis: antimetabolits, biological drugs, and other treatment approaches, Lancet Respir Med. 2015 Oct;3(10):813-22. Epub 2015 Jul 20.
4. Sarcoidosis, Iannuzzi MC, Rybicki BA, Teirstein AS. N Engl J Med. 2007; 357(21):2153
5. Corticosteroid treatment in pulmonary sarcoidosis, Turner-Warwick M, Mc Allister W, Lawrence R et al, Thorax.1986:41(12):903
6. Pharmacotherapy for pulmonary sarcoidosis: a Delphi consensus study. Schutt AC, Bullington WM, Judson MA, Respir Med 2010;104(5):717. Epub 2010 Jan 20
7. Inhaled corticosteroids can modulate the immunpathogenesis of pulmonary sarcoidosis, Spiteri MA, Newman SP, Clarke SW, Poulter LW, Eur Respir J 1989; 2(3):218