La fréquence et l’ampleur du surpoids et de l’obésité chez les enfants et les adolescents ont également fortement augmenté en Suisse au cours des dernières décennies. Le médecin de famille ou le pédiatre est généralement le premier interlocuteur des familles. Il/elle peut détecter le surpoids à temps et mettre en place rapidement un traitement approprié. Les causes de l’obésité sont extrêmement complexes et varient d’un individu à l’autre. Outre une balance énergétique perturbée, des facteurs génétiques et sociaux jouent un rôle important. Il est fort probable que l’obésité et les maladies secondaires persistent jusqu’à l’âge adulte. L’objectif du traitement des enfants et des adolescents est de contrôler le poids et de réduire la masse grasse à long terme, tout en veillant à ce que la croissance et le développement se déroulent normalement.
The frequency and extent of overweight and obesity in children and adolescents have also increased significantly in Switzerland over the last few decades. The family doctor or pediatrician is usually the first point of contact for families. He/she can identify obesity in good time and initiate appro- priate treatment at an early stage. The causes of obesity are extremely complex and vary from person to person. In addition to a disturbed energy balance, genetic and social factors play an important role. There is a high probability that both obesity and the accompanying illnesses will persist into adulthood. The aim of treating children and adolescents is to control weight and reduce fat mass in the long term, while ensuring that growth and development proceed normally.
Key words: Childhood obesity, obesity in adolescents, adiposity comorbidities, weight management, childhood obesity treatment, bariatric.
Contexte
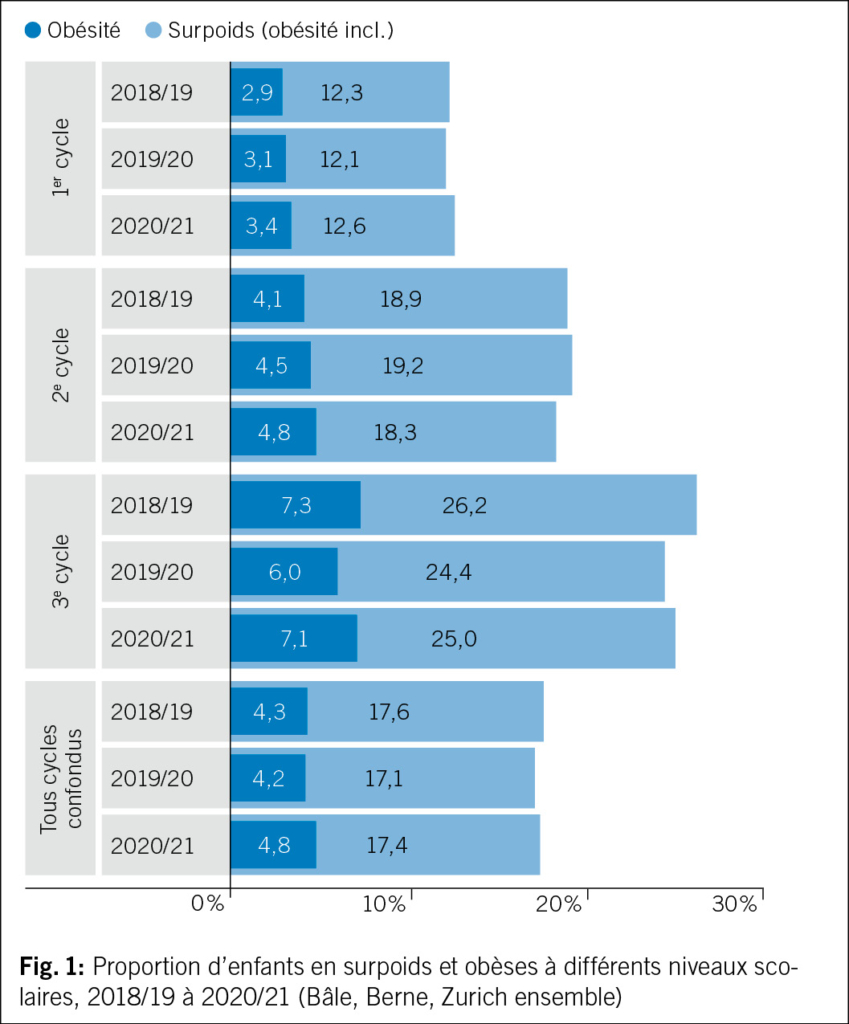
En Suisse, environ un écolier sur six est en surpoids ou obèse. Depuis l’ année 2005/06, Promotion Santé Suisse évalue les don- nées des services médicaux scolaires sur l’ indice de masse cor- porelle (IMC) des élèves des villes de Bâle, Berne et Zurich pour le monitoring annuel de l’ IMC. L’ analyse des données les plus récentes montre qu’ en 2020/21, tous niveaux scolaires confondus, 17.4 % des élèves étaient en surpoids, dont 4.8 % obèses d’ après l’ IMC. La comparaison avec les années précédentes montre toutefois que la proportion d’ écoliers en surpoids reste stable ces dernières années.
Selon les données de Promotion Santé Suisse, la fréquence du surpoids chez les enfants et les adolescents augmente avec l’ âge: ainsi, en 2020/21, un quart des adolescents du secondaire étaient en surpoids ou obèses, alors qu’ à l’ école enfantine, seul 1 enfant sur 8 était concerné par le surpoids (1).
Jusqu’ à il y a quelques années, l’ obésité était uniquement considé- rée comme facteur de risque pour des maladies secondaires. Elle est désormais reconnue en tant que maladie chronique (Fig. 1).
Qui est trop gros?
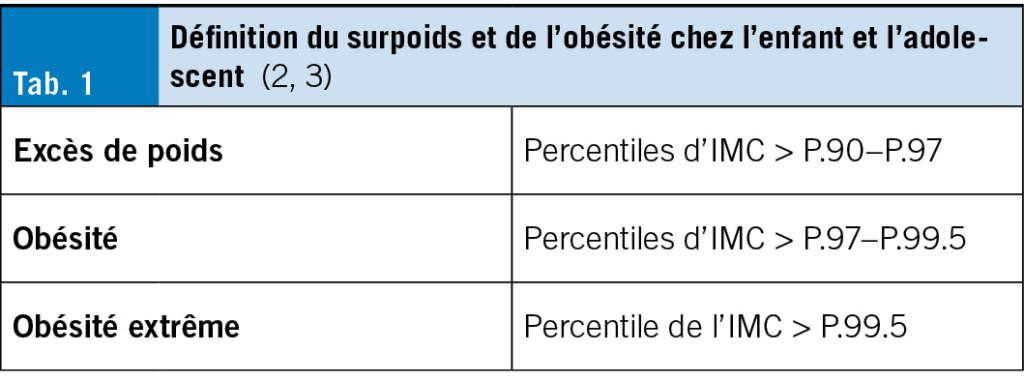
On parle d’ obésité lorsque la proportion de graisse corporelle par rapport à la masse corporelle totale est pathologiquement élevée. L’ IMC, défini comme le quotient du poids corporel mesuré en kg et le carré de la taille mesurée en m, constitue une mesure indirecte acceptable de la masse grasse corporelle totale. Il est également recommandé chez les enfants pour définir le sur- poids et l’ obésité. Contrairement aux adultes, pour lesquels la définition épidémiologique du surpoids et de l’ obésité est déter- minée par des seuils fixes indiquant chacun un risque accru pour la santé (obésité: IMC > 30 kg/m2, surpoids: IMC > 25 kg/m2), les seuils pour les enfants et les adolescents dépendent de l’ âge en raison de leur développement physique. Il y a surpoids lorsque l’ IMC est supérieur au 90e percentile spécifique à l’ âge et au sexe ; l’ obésité chez l’ enfant et l’ adolescent est défi- nie par un IMC supérieur au 97e percentile. En Suisse, on utilise les courbes de référence allemandes de Kromeyer-Hauschild (2) pour définir l’ obésité chez l’ enfant et l’ adolescent. (Tab. 1) (Fig. 2)
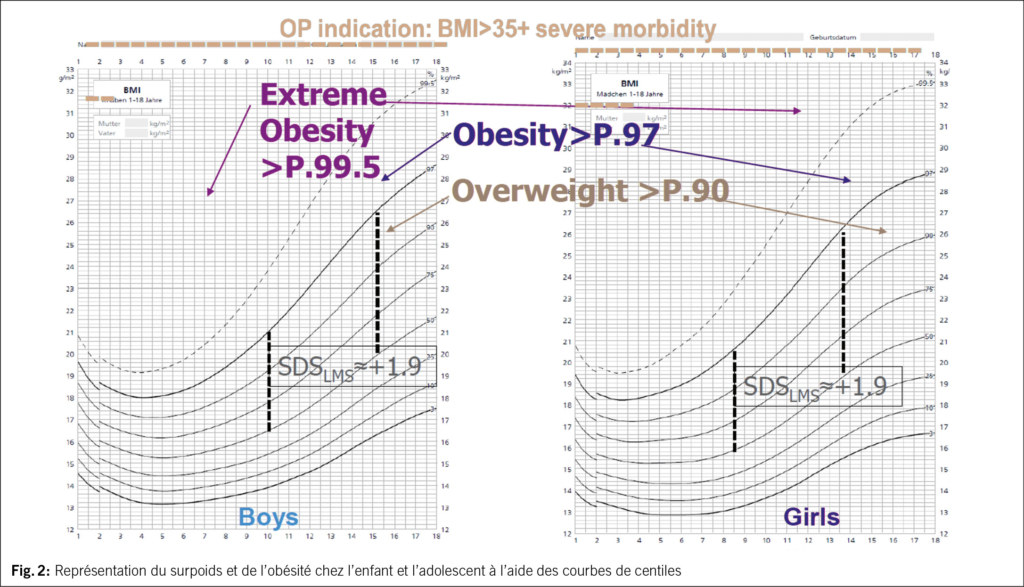
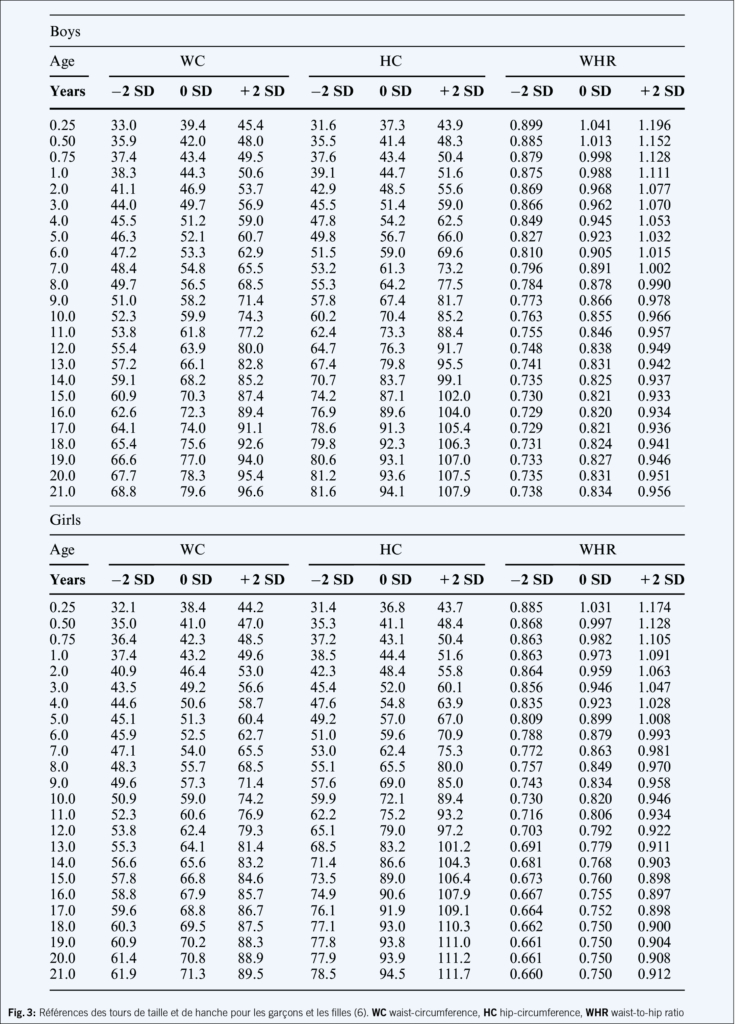
Étant donné que l’ IMC ne détermine pas seulement la masse grasse mais aussi la masse corporelle totale, il n’ est que peu pertinent dans certaines situations, surtout pendant l’ enfance et l’ adolescence (jeunes filles pubères, des sportifs avec une masse musculaire importante, en cas de petite ou grande taille et de maladies endocriniennes). Dans ces cas, il convient de mettre en évidence l’ augmentation de la masse grasse par des méthodes alternatives, comme le DEXA ou l’ analyse de bio-impédance (BIA) (4). La mesure du tour de taille et de hanches ainsi que la mesure de l’ épaisseur des plis cutanés (5) peuvent également être utilisées pour évaluer le risque individuel de santé (6) (Fig. 3).
Comorbidités liées au poids
Un indice de masse corporelle élevé est un facteur de risque important pour les maladies non transmissibles telles que le can- cer, le diabète sucré de type 2, l’ apnée du sommeil et les mala- dies hépatiques et cardiovasculaires, et s’ accompagne également d’ un risque accru de morbidité pendant l’ enfance et l’ adoles- cence (5).
De nombreux enfants et adolescents obèses présentent déjà un ou plusieurs facteurs de risque cardio-métaboliques, par exemple une dyslipidémie, un trouble de la tolérance au glucose ou un diabète de type 2 ou une hyperuricémie. Le nombre de comor- bidités liées au poids augmente avec l’ ampleur de l’ obésité. Des études ont montré que la tension artérielle et le pouls au repos augmentent de manière significative avec l’ IMC. Il peut y avoir une accélération de la croissance en longueur et de la maturité squelettique, et la puberté peut débuter prématurément. Une partie non négligeable des personnes concernées présente déjà des augmentations significatives des transaminases ainsi qu’ une stéatose hépatique à l’ échographie dans le cadre d’ une maladie hépatique associée à un dysfonctionnement métabolique (MASLD; anciennement stéatose hépatique non alcoolique = NAFLD). Un genou en valgus se manifeste chez environ 55 % des enfants souffrant d’obésité et entraîne des douleurs aux genoux et favorise les troubles arthrosiques (7).
Mais ce qui est particulièrement grave pour les enfants concernés, est la stigmatisation. Ils sont souvent victimes de harcèlement, manquent de confiance en eux et sont moins bien intégrés socialement. Cette situation est souvent associée à des maladies psychiques telles que la dépression, l’ anxiété, les troubles du sommeil et les troubles alimentaires (8).
Pathogenèse de l’ obésité
L’ origine de l’ obésité est multifactorielle. Outre la perturbation de l’ équilibre entre la dépense et l’ apport d’ énergie, les facteurs génétiques et sociaux jouent un rôle important. On estime que l’ influence de la prédisposition génétique sur le poids corporel est d’ environ 40 % à 70 % (9–11).
Un comportement alimentaire défavorable avec une disponibi- lité permanente de sucreries, de fast-food et de soft-drinks/sodas, un manque d’ activité physique et une consommation accrue de médias sont d’ autres facteurs qui jouent un rôle considérable dans le métabolisme énergétique. Mais des facteurs socio-éco- nomiques et socio-culturels tels que le contexte migratoire, le statut social et l’ empreinte de l’ environnement social et culturel influencent également l’ apparition du surpoids et de l’ obésité. Par exemple, les enfants dont les parents fument ont un risque augmenté de 30 % de devenir obèses (11, 12).
Certains médicaments tels que les glucocorticostéroïdes («cor- tisone») et certains antidépresseurs peuvent influencer la prise de poids et entraîner une surcharge pondérale. Les maladies endocrinologiques des glandes productrices d’ hormones, telles que l’ hypothyroïdie, le syndrome de Cushing ou les maladies de l’ hypophyse, sont à l’ origine d’ environ 1 % des enfants obèses. Il convient également de mentionner certaines formes monogé- niques rares d’ obésité, telles que le déficit en leptine, les défauts du récepteur de la leptine ou les mutations/polymorphismes du système mélanocorticoïde, qui se caractérisent par une prise de poids rapide après l’ accouchement avec une hyperphagie mar- quée et qui peuvent de nos jours déjà être traitées de manière ciblée. Il est tout aussi important de reconnaître l’ obésité dans le cadre de maladies syndromiques, comme par exemple le syndrome de Prader-Willi ou de Bardet-Biedl.
Evolution
L’ obésité ne disparaît malheureusement pas en grandissant. Les études pédiatriques sur l’ obésité ou basées sur la population montrent que l’ obésité ne «se perd» que très rarement de manière spontanée et que la prise de poids acquise à partir de 7 ans est généralement maintenue à l’ âge adulte. Plus les enfants sont âgés (> 11–12 ans) et obèses, plus la probabilité de souffrir d’ obésité à l’ âge adulte est élevée (66 et 77 %). Les données épidémiologiques montrent en outre que les enfants qui prennent rapidement du poids entre 2 et 6 ans développent généralement une obésité persistante, ce qui indique de manière évidente que cette tranche d’ âge représente une phase de vie particulièrement vulnérable (13). Si au moins l’ un des parents est obèse, la probabilité pour un enfant en surpoids de finir obèse jusqu’ à l’ âge adulte augmente d’ environ 30 % par rapport à un enfant dont les parents ont un poids normal (14).
Diagnostic des maladies de base et secondaires de l’ obésité
Pour pouvoir prendre à temps des mesures efficaces, il est impor- tant de reconnaître à temps le surpoids et de le prendre au sérieux en tant que problème de santé. Les médecins de famille ou les pédiatres attentionnés devraient toujours aborder le problème du surpoids dans le cadre de leurs examens préventifs . Souvent, les parents ne reconnaissent ni leur propre surpoids ni celui de leur enfant.
Les indications pour le diagnostic et le traitement se prennent de manière échelonnée en fonction de l’ ampleur et de l’ évolution de l’ obésité et des risques anamnestiques. Un examen médical approfondi et une prise de sang pour un bilan de laboratoire sont indiqués pour tous les enfants dont l’ IMC est supérieur à P. 97. En cas de surpoids (IMC > P. 90 < P. 97), un diagnostic médical est conseillé si l’ anamnèse familiale chez des parents du 1er ou du 2e degré est positive pour l’ obésité ou les maladies associées (diabète de type 2, maladies athéro-scléreuses précoces, hypertension artérielle, hypercholestérolémie), s’ il existe une comorbidité liée au poids et/ou si des facteurs de risque tels qu’ une augmentation du cholestérol total, du glucose ou de la tension artérielle, entre autres, sont connus chez l’ enfant. Mais aussi en cas d’ augmentation particulièrement forte de l’ IMC (p. ex. > 3 kg/m2 par an), il convient de procéder à un examen complet des facteurs de risque cardio-métaboliques ou des comorbidités associées au poids (Tab. 2) (15).

Traitement du surpoids et de l’ obésité chez les enfants et les adolescents
L’ objectif premier d’ un traitement pédiatrique de l’ obésité n’ est pas de faire baisser le poids corporel, mais d’ obtenir une amé- lioration à long terme de l’ état de santé. Les enfants en pleine croissance présentent une prise de poids normale de 3 à 4 kg par an. L’ objectif devrait être de ralentir la prise de poids et de la maintenir en dessous de cette marge, mais pas de réduire le poids.
Un traitement est toujours indiqué en cas d’ obésité (IMC > 97e percentile, tour de taille ou masse grasse supérieurs à P. 97, res- pectivement +2 DS) ou de surpoids (IMC entre les percentiles 90 et 97) avec présence d’ au moins une des maladies suivantes, dont l’ obésité aggrave le pronostic ou qui est une conséquence de celle-ci: l’ hypertension artérielle, le diabète sucré de type 2, la tolérance au glucose perturbée, des troubles endocriniens, le syndrome des ovaires polykystiques (SOPK), des maladies orthopédiques, la maladie hépatique stéatosique associée à un dysfonctionnement métabolique, des maladies respiratoires, une glomérulopathie ou des troubles alimentaires avec traitement psychiatrique.
Traitement structuré de l’ obésité pédiatrique
Depuis le début de l’ année 2014, les enfants et les adolescents peuvent être pris en charge de manière globale en Suisse au moyen de la thérapie structurée de l’ obésité pédiatrique (16). Si l’ indication pour une thérapie est donnée, les médecins traitants (m/f) spécialisés en pédiatrie ou en médecine de famille peuvent prescrire pendant 6 mois, en plus de leurs propres consultations, la thérapie individuelle structurée multiprofessionnelle (TIMS) (conseils nutritionnels max. 6 fois, physiothérapie 2 fois). Si, après 6 mois, l’ IMC ou d’ autres paramètres ou la comorbidité psychique/somatique ont augmenté, le patient doit/devrait être inclus dans un programme de groupe multiprofessionnel (PMG) ou être adressé à un(e) spécialiste de l’ obésité pour enfants et adolescents. Les interventions comprennent des mesures visant à modifier le comportement en matière d’ alimentation saine, d’ activité physique, de bien-être mental et de travail sur écran. Les programmes englobent les parents et les enfants (séparément et/ou ensemble) et peuvent être menés en groupe, individuellement ou en famille.
Chirurgie bariatrique
Les traitements conservateurs (interventions sur le mode de vie), sont les traitements de premier choix. Ils doivent être menés de manière multimodale et structurée. Toutefois, lorsque les possibilités de traitement conservateur ont été utilisées sans succès pendant plus de 2 ans, les procédures chirurgicales représentent de plus en plus une option thérapeutique efficace, même pour les adolescents souffrant d’ obésité morbide. Il convient de souligner que les procédures chirurgicales bariatriques n’ agissent pas par une restriction mécanique de l’ apport alimentaire et une diminution de l’ absorption des macronutriments, mais par des mécanismes d’ action neuroendocriniens complexes qui influencent la régulation de la faim et de l’ appétit. L’ analyse de l’ indication pour une opération bariatrique doit être effectuée selon les directives pour le traitement chirurgical de l’ obésité de la SMOB dans un centre de référence bariatrique reconnu par la SMOB (www.smob.ch) en collaboration avec un centre de référence pour l’ obésité pédiatrique certifié (Tab. 3).

Jusqu’ à présent, des études prospectives ont examiné les résul- tats à moyen et long terme après une chirurgie bariatrique. Une méta-analyse incluant 29 études de cohorte avec un total cumulé de 4970 patients a montré une réduction moyenne de l’ IMC de 13.1 kg/m2 ainsi que des taux élevés de rémissions de comorbi- dités préexistantes telles que le diabète sucré de type 2 (90 %), la dyslipidémie (77 %), l’ hypertension artérielle (81 %), l’ apnée du sommeil (81 %), et l’ asthme (92.5 %) (18). D’ autres données montrent une perte de poids de 29 % 8 ans après un bypass gastrique Roux-en-Y, correspondant à une réduction de l’ IMC de 16.9 kg/m2 (19). Après une sleeve gastrectomie, la réduction moyenne de l’ IMC après 7 ans était d’ environ 16.3 kg/m2.
Outre les risques associés à l’ opération tels que les problèmes cardiorespiratoires, la thrombose veineuse profonde avec, le cas échéant, une embolie pulmonaire consécutive, les insuffisances d’ une anastomose et les troubles de la cicatrisation, il convient surtout de prendre en compte les risques liés aux complications à plus long terme telles que les troubles gastro-intestinaux (nausées, vomissements, diarrhée, RGO), les carences en micro-nutriments (fer, vitamine B1, vitamine B12, vitamine D, acide folique, zinc), les perturbations électrolytiques avec déshydrata-tion, voire la réduction de la densité osseuse (20–22). Un suivi systématique est donc obligatoire.
Thérapie médicamenteuse
Lorsqu’ une prise en charge multiprofessionnelle n’ est pas suffisamment efficace, un traitement médicamenteux avec les agonistes du récepteur du glucagon-like peptide-1 (GLP-1), le liraglutide (Saxenda®) et le sémaglutide (Wegovy®), est disponible pour les enfants et les adolescents souffrant d’ obésité à partir de 12 ans afin de réduire leur poids. Le médicament peut être utilisé en cas de poids corporel ≥ 60 kg et d’ obésité selon les valeurs limites acceptées au niveau international (correspondant à un IMC ≥ 30 kg/m2 chez les adultes), en complément d’ une alimentation saine et d’ une activité physique accrue.
Les agonistes des récepteurs GLP-1 agissent par différentes voies dans les centres nerveux centraux de la régulation de la faim et de l’ appétit. La sensation de faim est réduite, la sensation de satiété est augmentée et l’ envie de manger est réduite. Comme l’ ont montré les études d’ homologation, un traitement par liraglutide réduit le poids corporel de 5 % en moyenne après 56 semaines de traitement (23), tandis que le semaglutide réduit le poids corporel d’ environ 16 % en moyenne après 68 semaines de traitement (24). Les effets secondaires les plus fréquents du lira- glutide sont des troubles gastro-intestinaux tels que nausées, vomissements, diarrhée, douleurs abdominales et constipation. Ceci explique qu’ environ 10 % des adolescents traités ne tolèrent pas le traitement et doivent donc l’ arrêter.
Prévention du surpoids et de l’ obésité par le médecin généraliste
Les études actuelles mettent de plus en plus l’ accent sur l’ impor- tance et l’ efficacité de la promotion précoce d’ un poids corpo- rel sain chez les enfants et les adolescents. L’ enseignement d’ un mode de vie sain devrait commencer le plus tôt possible dans la vie et atteindre les familles, les enfants et les adolescents dans leur milieu de vie. Les médecins de famille et les cabinets pédiatriques sont généralement les premiers interlocuteurs des familles en ce qui concerne la prise en charge des problèmes de santé et jouent donc un rôle décisif dans le contexte de la prévention du surpoids et de l’ obésité. Dans le cadre des contacts étroits et répétés avec les enfants et la famille, la promotion d’ un mode de vie physiquement actif ainsi que l’ amélioration du choix des aliments, à la fois pauvres en énergie et denses en nutriments (par exemple fruits, légumes et salades) et l’ adaptation de la taille des portions devraient toujours être abordées.
Copyright Aerzteverlag medinfo AG
Cet article est une traduction de «der informierte arzt, die informierte ärztin» 10_2024
Spécialiste en pédiatrie
Endocrinologie pédiatrique et diabétologie
Formation approfondie interdisciplinaire en médecine
psychosomatique et psychosociale (SAPPM)
Centre du métabolisme de Saint-Gall
friendlyDocs AG
Lerchentalstrasse 21
9016 St. Gallen
stoffwechselzentrum@friendlydocs.ch
Bernd Schultes est vice-président de la SMOB. Il reçoit des honoraires de conférence et de conseil de Novo Nordisk et Eli Lilly, ainsi qu’ un soutien financier pour la recherche de la part de Novo Nordisk.
1. Promouvoir la santé et prévenir les maladies | Promotion Santé Suisse [Internet]. [cited 2024 Sep 19]. Available from: https://gesund- heitsfoerderung.ch/
2. AGA – Société de l’ obésité [Internet]. [cited 2024 Sep 19]. Disponible à partir de: https://adipositas-gesellschaft.de/aga/
3. Cole TJ, Bellizzi MC, Flegal KM, Dietz WH. Establishing a standard definition for child overweight and obesity worldwide: international survey. BMJ. 2000 May 6;320(7244):1240–3.
4. Boot AM, Bouquet J, de Ridder MA, Krenning EP, de Muinck Keizer-Schrama SM. Determinants of body composition measured by dual-energy X-ray absorptiometry in Dutch children and adolescents. Am J Clin Nutr. 1997 Aug;66(2):232–8.
5. 050-002l_S3_Therapie-Praevention-Adipositas-Kinder-Jugendliche_2019-11.pdf [Internet]. [cited 2024 Sep 19]. Available from: https://register.awmf.org/assets/guidelines/050-002l_S3_Therapie-Praevention-Adipositas-Kinder-Jugendliche_2019-11.pdf
6. Fredriks AM, van Buuren S, Fekkes M, Verloove-Vanhorick SP, Wit JM. Are age references for waist circumference, hip circumference and waist-hip ratio in Dutch children useful in clinical practice? Eur J Pediatr. 2005 Apr;164(4):216–22.
7. I’ Allemand D, Wiegand S, Reinehr T, Müller J, Wabitsch M, Widhalm K, et al. Cardiovascular risk in 26,008 European overweight children as established by a multicenter database. Obesity (Silver Spring). 2008 Jul;16(7):1672–9.
8. Puhl RM, King KM. Weight discrimination and bullying. Best Pract Res Clin Endocrinol Metab. 2013 Apr;27(2):117–27.
9. Stunkard AJ, Foch TT, Hrubec Z. A twin study of human obesity. JAMA. 1986 Jul 4;256(1):51–4.
10. Silventoinen K, Jelenkovic A, Sund R, Yokoyama Y, Hur YM, Cozen W, et al. Differences in genetic and environmental variation in adult BMI by sex, age, time period, and region: an individual-based pooled analysis of 40 twin cohorts. Am J Clin Nutr. 2017 Aug;106(2):457–66.
11. Jaakkola JM, Rovio SP, Pahkala K, Viikari J, Rönnemaa T, Jula A, et al. Childhood exposure to parental smoking and life-course overweight and central obesity. Ann Med. 2021 Dec;53(1):208–16.
12. Styne DM, Arslanian SA, Connor EL, Farooqi IS, Murad MH, Silverstein JH, et al. Pediatric Obesity-Assessment, Treatment, and Prevention: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2017 Mar 1;102(3):709–57.
13. Geserick M, Vogel M, Gausche R, Lipek T, Spielau U, Keller E, et al. Acceleration of BMI in Early Childhood and Risk of Sustained Obesity. N Engl J Med. 2018 Oct 4;379(14):1303–12.
14. Simmonds M, Llewellyn A, Owen CG, Woolacott N. Predicting adult obesity from childhood obesity: a systematic review and meta-analysis. Obes Rev. 2016 Feb;17(2):95–107.
15. l’ Allemand D. Definition, diagnostisches Vorgehen und Therapie-Indikationen bei Übergewicht im Kindes- und Jugendalter [Internet]. pädiatrie schweiz. 2006 [cited 2024 Sep 19]. Available from: https://www.paediatrieschweiz.ch/definition-diagnostisches-vorgehen-und-therapie-indikationen-bei-uebergewicht-im-kindes-und-jugendalter/
16. Übergewichtige Kinder können jetzt umfassend behandelt werden. Schweiz Ärzteztg [Internet]. 2014 Oct 28 [cited 2024 Sep 19];95(44). Available from: https://doi.emh.ch/saez.2014.03089
17. Richtlinien zur operativen Behandlung von Übergewicht – SMOB : Swiss Society for the Study of Morbid Obesity and Metabolic Disorders [Internet]. [cited 2024 Sep 19]. Available from: https://www.smob.ch/richtlinien-zur-operativen-behandlung-von-uebergewicht/
18. Wu Z, Gao Z, Qiao Y, Chen F, Guan B, Wu L, et al. Long-Term Results of Bariatric Surgery in Adolescents with at Least 5 Years of Follow-up: a Systematic Review and Meta-Analysis. Obes Surg. 2023 Jun;33(6):1730–45.
19. Inge TH, Jenkins TM, Xanthakos SA, Dixon JB, Daniels SR, Zeller MH, et al. Long-term outcomes of bariatric surgery in adolescents with severe obesity (FABS-5+): a prospective follow-up analysis. Lancet Diabetes Endocrinol. 2017 Mar;5(3):165–73.
20. Mitra AT, Das B, Sarraf KM, Ford-Adams M, Fehervari M, Ashrafian H. Bone health following paediatric and adolescent bariatric surgery: a systematic review and meta-analysis. EClinicalMedicine. 2024 Mar;69:102462.
21. Zolfaghari F, Khorshidi Y, Moslehi N, Golzarand M, Asghari G. Nutrient Deficiency After Bariatric Surgery in Adolescents: A Systematic Review and Meta-Analysis. Obes Surg. 2024 Jan;34(1):206–17.
22. Beamish AJ, Ryan Harper E, Järvholm K, Janson A, Olbers T. Long-term Outcomes Following Adolescent Metabolic and Bariatric Surgery. J Clin Endocrinol Metab. 2023 Aug 18;108(9):2184–92.
23. Kelly AS, Auerbach P, Barrientos-Perez M, Gies I, Hale PM, Marcus C, et al. A Randomized, Controlled Trial of Liraglutide for Adolescents with Obesity. N Engl J Med. 2020 May 28;382(22):2117–28.
24. Weghuber D, Barrett T, Barrientos-Pérez M, Gies I, Hesse D, Jeppesen OK, et al. Once-Weekly Semaglutide in Adolescents with Obesity. N Engl J Med. 2022 Dec 15;387(24):2245–57.