EDITORIAL Aus der Wissenschaft für die Praxis
Die Jahrestagung der European Society for Cardiology (ESC), die in diesem Jahr zusammen mit dem Weltkongress für Kardiologie in Paris stattfand, ist mit ca. 35 000 Teilnehmern der weltweit grösste Kardiologenkongress. Auch diesmal wurde den Besuchern ein umfangreiches wissenschaftliches Programm geboten nach dem Motto: Wer vieles bietet, wird manchem etwas bieten und jeder geht zufrieden aus dem Haus (Faust).
Die Frage nach den diesjährigen Highlights ist sicherlich nicht einfach zu beantworten, zumal die Auswahl von subjektiven Erwartungen beeinflusst wird. Aber in der Tat wurde eine Reihe von neuen interessanten Studiendaten präsentiert, die rasch Eingang finden dürften in den klinischen Alltag.
Besonderes Interesse fand sicherlich die DAPA-HF-Studie, in der die Wirksamkeit eines neuen Antidiabetikums, nämlich eines SGLT2-Inhibitors bei herzinsuffizienten Patienten untersucht wurde. Und in der Tat, die günstige Wirkung entfaltete diese Substanz auch bei Patienten ohne Diabetes. Mit dieser Studie wurde der Werdegang eines Antidiabetikums zum Kardiakum eingeläutet.
Mit der COMPLETE-Studie wurden die letzten Zweifel beseitigt, dass beim STEMI die möglichst rasche vollständige Revaskularisation für den Patienten vorteilhaft ist. Bzgl. dem ARNI sprechen neue Daten aus der PROVE-HF- und EVALUATE-HF-Studie dafür, dass seine Überlegenheit nur durch kardiale und nicht durch vaskuläre Effekte zu erklären ist.
Doch bei der HFpEF enttäuschte die Substanz, wie die Daten der PARAGON-Studie zeigen. Sehr interessant sind auch die Ergebnisse der ISAR-REACT 5-Studie, bei der Ticagrelor mit Prasugrel beim ACS verglichen wurde. Solche head-to-head-Studien sind aus nachvollziehbaren Gründen etwas sehr Seltenes. Der Gewinner ist eindeutig Prasugrel.
Aber nicht nur viele neue Studien sondern auch die aktualisierten Guidelines wurden vorgestellt: Dyslipidaemien, Diabetes, SVT, CCS und die akute Pulmonare Embolien.
Diese kurzen Schlaglichter mögen zeigen, wie vielfältig das Programm war.
Wir von «info@herz+gefäss» waren wieder vor Ort und haben die wichtigsten News für Sie liebe Leser zusammengetragen.
Und wie Sie bereits gewohnt sind, wird unsere Berichterstattung immer von Interviews von kompetenten Schweizer Kardiologen umrahmt.
Viel Spass beim durchstöbern unserer Kongresszeitung wünscht Ihnen
Ihre Eleonore E. Droux, Verlegerin & Publizistische Leitung
Tour de Coeur 2019 – im Velosattel zum ESC
Ein Zeichen für kardiovaskuläre Prävention
Bereits zum 9. Mal radelte eine Gruppe von sportlichen Schweizer Kardiologen, einigen Industrievertretern sowie dem Verlagsleiter des Aerzteverlag medinfo zum ESC – diesmal 740 km von Yverdons-les-Bains nach Paris.
Der Initiator Prof. Hans Rickli vom Kantonsspital St. Gallen betonte zur 9. Tour de Coeur einmal mehr, dass die Radtour «Werbung» für körperliche Aktivität, sportliche Leistung und die kardioprotektive Wirkung des Velofahrens sei – die Kardiologen also vorführen, was allen geraten wird. Zudem biete sie aber auch eine Plattform, sich unter Kollegen besser zu vernetzen und gegenseitige Ideen auszutauschen. Dies sei ihm in der Kardiologie ein grosses Anliegen.
Mit diesem Appell machten wir uns dieses Jahr mit auch einigen neuen Teilnehmern auf den rund 740 km langen Weg Richtung Paris – zunächst bis zur ersten Übernachtung in Arbois nach einem Tagespensum von 95 km und Überquerung erster kleinerer Pässe. Gefahren wurde jeweils in 3 Gruppen, so dass sich jeder je nach körperlicher Verfassung die schnelle oder langsamere Gruppe aussuchen konnte.
In den darauffolgenden Tagen durchquerten wir auf abgelegenen Strässchen die Wein-gebiete des Burgunds bis zur Übernachtung in einem alten Chateau ausserhalb von Avallon, wo wir in einem herrschaftlichen Schlosssaal mit einem wunderbaren Nachtessen verwöhnt wurden – nach rund 125 km Velofahrt eine schöne Entschädigung!
Bei Sonnenschein und warmen Temperaturen wurden wir, angeführt von Prof. Rickli, am ersten Kongresstag, Samstag, 31. August, beim Rathaus in Paris festlich empfangen. Die Verlegerin Eleonore E. Droux mit dem Wissenschaftlichen Leiter von «info@herz+gefäss», Prof. Walter Riesen,
begrüssten uns Radler zusammen mit dem Präsidenten der SGK,
Prof. Giovanni Pedrazini, welcher für alle Teilnehmer ein «maillot jaune» mit der Aufschrift der Tour de Coeur 2019 bereithielt.
Im nächsten Sommer 2020 feiert die Tour de Coeur ihr 10-jähriges Jubiläum – es geht nach Amsterdam – und Prof. Rickli würde sich freuen, wieder viele neue Gesichter zum Radeln begrüssen zu können!
Andreas J. Bleiker, Verlagsleiter Aerzteverlag medinfo
HOTLINES
Nicht zu viel Plättchenhemmung bei MINOCA
Unter MINOCA versteht man Patienten mit Infarkt, bei denen sich keine relevante koronare Stenose findet (Patients with myocardial infarction without obstructive coronary artery disease). In einer Studie mit 28.783 Infarkt-Patienten war dies bei 6,7% der Fall. Diese Patienten sind in der Regel jünger, haben weniger Komorbiditäten und seltener einen STEMI. Pathogenetisch spielen bei diesen Patienten Plaqueerosionen bzw. –rupturen, Thromboembolien, spontane Koronardissektionen und eine Mikroangiopathie die entscheidende Rolle. Die Prognose der MINOCA-Patienten ist nach den Ergebnissen der grossen CURRENT-OASIS 7-Studie günstiger als die von Non-MINOCA-Patienten. Der kombinierte Endpunkt aus Gesamtmortalität, kardiovaskulärer Mortalität, Reinfarkt und stärkere Blutungsereignisse liegt unter 1% und ist somit 3- bis 4-mal niedriger als in der Non-MINOCA-Gruppe.
Doch welche therapeutischen Konsequenzen ergeben sich aus diesen Daten, vor allem was die Intensität der Plättchenhemmer-Therapie betrifft. Im Rahmen der o.g. Studie wurden zwei Clopidogrel- Strategien miteinander verglichen: 600 mg Tag 1, 150 mg Tag 2-7 und dann 75 mg täglich vs. 300 mg Tag 1 und dann 75 mg täglich. Die höhere Clopidogrel-Dosis erhöhte bei den MINOCA-Patienten das Risiko für kardiovaskulären Tod, Infarkt und Schlaganfall um das Dreifache im Vergleich zur Standarddosierung. Ein solch negativer Effekt wurde nicht bei den Non-MINOCA-Patienten beobachtet. Interessanterweise war aber das Blutungsrisiko bei den MINOCA-Patienten unter der doppelten Clopidogrel-Dosis nicht erhöht, aber bei den Patienten mit einer obstruktiven KHK. Die Daten sprechen dafür, das auch für die Plättchenhemmung beim ACS gilt: One size fits not all. Gefragt ist vielmehr eine individuelle Therapie (Matthias Bossard, Luzern). PS
THEMIS-Studie: Ticagrelor plus ASS bei Diabetikern mit stabiler KHK
Typ 2-Diabetiker mit einer KHK haben ein deutlich erhöhtes Risiko für ein kardiovaskuläres Ereignis. Der Frage, ob eine kombinierte Plättchenhemmung mit Ticagrelor plus ASS einer ASS-Monotherapie im Hinblick auf die Verhinderung eines solchen Ereignisses überlegen ist, wurde im Rahmen der THEMIS-Studie nachgegangen. Bei dieser doppelblinden, placebokontrollierten Studie, in die über 19.000 diabetische KHK-Patienten mit einem Alter von 50 Jahren und mehr aufgenommen wurden, erhielten die Patienten randomisiert entweder die Kombination 75 -150 mg ASS plus zweimal täglich 90 mg Ticagrelor mit der Möglichkeit der Dosisreduktion auf zweimal 60 mg oder nur ASS plus Placebo. Patienten mit bekanntem Myokardinfarkt oder Schlaganfall wurden ausgeschlossen.
Der kombinierte Endpunkt kardiovaskulärer Tod, Infarkt oder Schlaganfall wurde nach einer Beobachtung von 36 Monaten in der Placebo-Gruppe von 7,6%, in der Ticagrelor-Gruppe dagegen nur von 6,9% erreicht (HR 0,90; p = 0,038). Bei der kardiovaskulären Mortalität waren die Vergleichszahlen 3,3% vs. 3,0%, also nicht signifikant unterschiedlich. Doch beim isolierten Endpunkt Infarkt erwies sich die Kombination als signifikant effektiver (2,6% vs. 3,3%). Das gleiche gilt für den Endpunkt Schlaganfall (1,5% vs. 1,8%). Bei der On-treatment-Auswertung waren die Vergleichszahlen für den kombinierten Endpunkt 5,2% unter Ticagrelor vs. 6,4% unter Placebo.
Unter der Kombination war allerdings das Blutungsrisiko erhöht. Es lag bei 0.89 grösseren Blutungen pro 100 Patientenjahre unter der Kombination im Vergleich zu nur 0,36 Ereignissen pro 100 Patientenjahre in der Placebo-Gruppe. Zusammenfassend sagen diese Daten, dass die duale Plättchenhemmung in der Langzeittherapie für Diabetiker mit einer stabilen KHK dann vorteilhaft sein kann, wenn ein niedriges Blutungsrisiko und ein hohes ischämisches Risiko vorliegen (Deepak L. Bhatt, Paris).
Im Rahmen der THEMIS-PCI-Studie wurde die Subgruppe der Patienten, die früher eine PCI erhalten hatten, analysiert. Dabei zeigte sich, dass nur PCI-Patienten von der dualen Therapie profitierten (6,5% mit Ticagrelor vs. 7,7% mit Placebo), aber nicht solche ohne eine interventionelle Therapie in der Vorgeschichte (7,4% vs. 7,5%). Doch das erhöhte Blutungsrisiko bestand in beiden Gruppen. Ein Netto-klinischer Benefit ergab sich somit nur in der PCI-Subgruppe (8,2% vs. 9,7%; p = 0,005) (P. Gabriel Steg, Paris). PS
DAPA-HF-Studie: Dapagliflozin bei Herzinsuffizienz
In mehreren Studien konnte gezeigt werden, dass SGLT2-Inhibitoren bei Typ-2-Diabetikern das Risiko für die Manifestation einer Herzinsuffizienz senken. Dieser Effekt tritt bereits sehr schnell, nämlich innerhalb von einigen Wochen nach Therapiebeginn auf, so dass er nicht durch eine bessere Stoffwechselkontrolle erklärt werden kann. Vielmehr dürften direkte kardioprotektive Mechanismen die entscheidende Rolle spielen. Dies ist die Rationale für die DAPA-HF-Studie, die die Wirkung des SGLT2-Inhibitors Dapagliflozin bei herzinsuffizienten Patienten untersuchte.
Aufgenommen wurden 4 744 Patienten, die eine HFrEF mit einer LVEF < 40% hatten. Sie erhielten randomisiert 20 mg Dapagliflozin einmal täglich oder Placebo neben der Leitlinien-gerechten Standardtherapie (ARNI oder AT1-Blocker oder ACE-Hemmer 94%, Betablocker 86%, Mineralokortikoid-Rezeptor-Antagonist 71%). Primärer Endpunkt der Studie war die Kombination aus Auftreten oder Verschlechterung einer Herzinsuffizienz und kardiovaskulärem Tod. Nur die Hälfte der Studienteilnehmer hatte einen Typ 2-Diabetes.
Durch Dapagliflozin konnte bei einem medianen Follow up von 18,2 Monaten der primäre kombinierte Endpunkt um 26% (< 0,00001), das Risiko für eine Herzinsuffizienz bzw. eine Verschlechterung einer solchen um 30% (p = 0,00003) und das kardiovaskuläre Sterberisiko um 18% (p = 0,029) reduziert werden. Die Gesamtmortalität wurde um 17% (p = 0,022) gesenkt. Auch die Lebensqualität wurde deutlich verbessert. Dapagliflozin wurde gut vertragen und es gab bei der Verträglichkeit keinen Unterschied zu Placebo. Nur ein Flüssigkeitsmangel trat unter Dapagliflozin etwas häufiger auf (6,5% vs. 6,8%). Die Vergleichszahlen bei der Verschlechterung einer Niereninsuffizienz lagen bei 6,5% vs. 7,2% (John McMurray, Glasgow). PS
COMPLETE-Studie: Revaskularisation beim STEMI
Patienten mit einem STEMI haben nicht selten eine koronare Mehrgefässerkrankung mit mehreren signifikanten Stenosen. Die Frage, ob primär nur die Culprit-lesion oder alle relevanten Stenosen sofort interventionell oder zunächst nur konservativ medikamentös behandelt werden sollten, wird seit vielen Jahren kontrovers diskutiert. Frühere Studien und Metaanalysen sprechen zumindest dafür, dass möglicherweise die vollständige Revaskularisation auch der Non-culprit-lesions das Reinfarkt-Risiko senken und die Prognose verbessern kann. Jetzt wurde dieser Frage im Rahmen der COMPLETE-Studie erneut nachgegangen.
Randomisiert wurden 4 041 Patienten mit einem STEMI, die leitliniengerecht behandelt wurden. Die Hälfte der Patienten erhielt nur eine Revaskularisation der Culprit-lesion, die andere Hälfte wurde komplett revaskularisiert entweder sofort im Rahmen des ersten Krankenhausaufenthaltes oder innerhalb von 23 Tagen. Eine komplette Revaskularisation mit einem SYNTAX-Score von 0 gelang bei 90,1% der Patienten. Als primäre Endpunkte wurden die Kombination kardiovaskulärer Tod oder Infarkt und die Kombination kardiovaskulärer Tod oder Infarkt oder Ischämie-getriggerte Revaskularisation festgelegt bei einem Follow up von 3 Jahren.
Der erste primäre kombinierte Endpunkt wurde bei kompletter Revaskularisation von 7,8% der Patienten, aber von 10,5% der Patienten, bei denen nur die Culprit-lesion angegangen wurde, erreicht. Dies entspricht einer Risikoreduktion von 26% (HR: 0,74; p = 0,004). Das entspricht einer NNT von 37 über 3 Jahre. Beim zweiten kombinierten Endpunkt war der Benefit der vollständigen Revaskularisation mit einer Risikoreduktion von 49% noch ausgeprägter (HR: 0,51; NNT = 13). Die Überlegenheit der kompletten Revaskularisation war unabhängig davon, ob der Eingriff primär am ersten Tag oder im Rahmen eines zweiten Krankenhausaufenthaltes innerhalb von im Median 3 Wochen durchgeführt wurde. Im Hinblick auf Komplikationen (Stentthrombose, Blutung, Schlaganfall) zeigte sich kein Unterschied zwischen den beiden Behandlungsstrategien (Shamir R. Mehta, Hamilton). PS
CLARIFY-Studie: Langzeitverlauf des chronischen Koronarsyndroms
Von der CLARIFY-Registerstudie wurden jetzt die 5-Jahresdaten von 32 703 Patienten mit einem chronischen Koronarsyndrom präsentiert. Bei diesen Patienten lag der Infarkt oder die Revaskularisation länger als 3 Monate zurück, eine symptomatische Myokardischämie war gesichert und angiografisch war eine >50%ige Koronarstenose dokumentiert. Bei einer Beobachtungsdauer von 5 Jahren lag die Rate an Todesfällen oder einem nicht-tödlichen Infarkt bei 1,7% pro 100 Patientenjahre und sie war bei beiden Geschlechtern gleich. Die Angina pectoris war nur bei Post-Infarktpatienten von prognostischer Relevanz. Patienten mit Angina und einem durchgemachten Infarkt waren besonders gefährdet für ein erneutes Ereignis. Sie erfordern ein besonders intensives Management im Rahmen der Sekundärprävention (Emmanuel Sorbets, Paris). PS
NZOTACS-Studie: Sauerstoff beim ACS
Ob man allen Patienten mit einem ACS routinemässig Sauerstoff geben sollte, diese Frage wird seit vielen Jahren kontrovers diskutiert. Jetzt wurde dieses Thema erneut Gegenstand einer grossen Studie, nachdem die vorausgegangenen Untersuchungen kein eindeutiges Ergebnis gebracht hatten. Auch gab es Hinweise dafür, dass Sauerstoff evtl. sogar von Nachteil sein könnte. Ausgewertet wurden die Daten von > 40 000 ACS-Patienten, die entweder eine high flow oder eine leichte Oxygenierung erhielten. Bzgl. der 30-Tagesmortalität ergab sich kein Unterschied zwischen den beiden Strategien (3,0% vs. 3,1%). Bei 85-90% der ACS-Patienten lag kein Sauerstoffmangel vor. Diese Patienten profitierten nicht von einer Sauerstoffgabe. Eine solche war jedoch ungefährlich. Patienten mit einer schlechten Oxygenierung zeigten ein 4- bis 5-fach erhöhtes Sterberisiko. Bei ihnen konnte die Mortalität durch die intensive Sauerstoffgabe um 1% gesenkt werden. Das Fazit dieser Studie lautet: Sauerstoff schadet bei einem ACS nicht, aber ist nur sinnvoll, wenn eine Untersättigung vorliegt (Ralph Stewart, Auckland). PS
HISTORIC- und RAPID-TnT-Studie: Stratifizierung mittels hs-Troponin beim ACS
In der HISTORIC-Studie wurde gezeigt, dass mit Hilfe des hs-Troponins ein früher, rascher und zuverlässiger bzw. sicherer Ausschluss eines ACS bei Patienten mit unklaren Thoraxschmerzen gelingt und zwar bereits nach wenigen Stunden nach Einsetzen der Symptome. Im Unterschied zum konventionellen Vorgehen, das eine Troponin-Kontrolle nach 3-4 Stunden vorsieht, erfolgt die zweite Testung beim hs-Troponin bereits nach 1 Stunde. Durch die Implementierung dieses Biomarkers in den klinischen Alltag kann die Dauer des Klinikaufenthaltes um 3,3 Stunden reduziert und der Anteil der Patienten, die umgehend entlassen werden können, auf 57% erhöht werden (Nicholas Mills, Edinburgh).
Diese Ergebnisse werden durch die Daten der randomisierten RAPID-TnT-Studie bestätigt. Auch in dieser Studie wurde die Verweildauer in der Klinik von 5,6 auf 4,6 Stunden verkürzt und es konnten 45,1% ohne weitere Diagnostik wieder entlassen werden, in der Kontrollgruppe waren es nur 32,3% (Derek Chew, Adelaide).
Der eingeladene Diskussionsteilnehmer, Prof. Christian Eugen Müller, Universitätsspital Basel, sagte, dass RAPID-TnT eine «grosse Leistung» sei und eine «sehr, sehr wichtige Säule» zu den Daten darstelle, die die Sicherheit und Wirksamkeit des ESC 0/1-Stunden-Algorithmus dokumentieren. PS
Im Gespräch mit Prof. Firat Duru – Leiter der Rhythmologie, Abteilung für Kardiologie, Universitäres Herzzentrum Zürich
Welche Auswirkungen haben die neu vorgestellten Leitlinien für Ihre Praxistätigkeit?
Die medikamentösen Therapien für die Behandlung von Patienten mit supraventrikulären Tachykardien (SVT) haben sich seit der Veröffentlichung der vorherigen Leitlinien im Jahr 2003 nicht wesentlich geändert. Nichtsdestotrotz verfügen wir heute über mehr Daten zu den potenziellen Vorteilen und Risiken dieser Medikamente und wissen, wie sie sicherer eingesetzt werden können.
Die wichtigste Veränderung in der klinischen Praxis in den letzten Jahren ist auf die Verfügbarkeit effizienterer und sicherer invasiver Methoden zur Behandlung der Arrhythmie durch Katheterablation zurückzuführen. In dieser Hinsicht liegt der Schwerpunkt der neuen SVT-Leitlinien, die von der European Society of Cardiology (ESC) auf ihrem Kongress 2019 in Paris eingeführt wurden, auf der Verbesserung der Sicherheit und Wirksamkeit der Katheterablation für einen langfristigen Nutzen. Wir können nun diese Behandlungsmodalität, welche die Versorgung absolut revolutioniert hat, den meisten unserer Patienten mit SVT anbieten.
Die meisten Änderungen in Bezug auf medikamentöse Therapie gegenüber früheren Empfehlungen umfassen Verschiebungen der Empfehlungsgrade für Therapien mit Medikamenten. Zum Beispiel beinhalten die neuen Leitlinien eine Empfehlung der Klasse I für Ibutilid (bisher Klasse IIa) zur Konversion von Vorhofflattern, hingegen eine Empfehlung der Klasse III (Kontraindikation!) für Flecainid und Propafenon (bisher Klasse IIb).
Zu den aktualisierten Empfehlungen für die akute Behandlung von Schmalkomplex-Tachykardien mit Klasse IIa Indikation gehören Verapamil und Diltiazem (bisher Klasse I) und Betablocker (bisher Klasse IIb). Amiodaron und Digoxin wurden in den neuen Leitlinien nicht erwähnt.
Für die akute Behandlung von Breitkomplex-Tachykardien werden Procainamid (Klasse IIa, bisher Klasse I), Adenosin (Klasse IIa, bisher Klasse IIb) und Amiodaron (Klasse IIb, bisher Klasse I) empfohlen. Sotalol und Lidocain wurden in den neuen Leitlinien nicht erwähnt.
Schwangere Frauen mit anhaltenden Herzrhythmusstörungen, die auf Medikamente (z.B. auf Verapamil – neu mit Klasse IIa Indikation) nicht ansprechen oder bei denen eine medikamentöse Therapie kontraindiziert oder unerwünscht ist (vor allem im ersten Schwangerschaftsdrittel), können nun mit einer Katheterablation (ohne Röntgenstrahlung) behandelt werden.
Eleonore E. Droux
BIOSTEMI-Studie
Biodegradierbarer DES ist persistierendem DES überlegen
Stents mit einer biodegradierbaren Matrix bieten eine Reihe von potentiellen Vorteilen. Im Rahmen der BIOSTEMI-Studie konnte mit einem solchen Stent bei STEMI-Patienten das Zielläsions-Versagen im Vergleich mit einem persistierenden Stent gesenkt werden.
Für den Einsatz eines biodegradierbaren Stents gibt es gute Argumente. So fällt der Stimulus für Entzündungsprozesse weg, Hypersensitivitätsreaktionen werden vermieden und dadurch besteht die potentielle Chance, späte und sehr späte Stentthrombosen zu verhindern. In der BIOSCIENCE-Studie wurde bei der Subgruppe der STEMI-Patienten eine Überlegenheit des Orsiro®-Stents, der ein 60 µm Strebendesign aufweist und aus einer biodegradierbaren Polymer-Matrix besteht, dokumentiert.
Im Rahmen der BIOSTEMI-Studie wurde jetzt gezielt bei Patienten mit einem STEMI dieser ultradünne biodegradierbare Sirolimus-beschichtete Stent (BP-SES, Orsiro®) mit dem konventionellen Everolimus-beschichteten Stent (DP-EES, XIENCE®), der aus
einem persistierenden Polymer besteht, verglichen. Das Polymer beim BP-SES besteht aus biodegradierbarer Poly-L-Milchsäure, welches Sirolimus über 12-14 Wochen freisetzt. Bei der Studie handelt es sich um eine prospektive einfach blinde randomisierte Überlegenheitsstudie, in die 1.300 STEMI-Patienten (12% Frauen, 11% Diabetiker) mit einem durchschnittlichen Alter von 62 Jahren aufgenommen wurden.
Weniger Zielläsions-Versagen
Der primäre Endpunkt der Studie war das Zielläsions-Versagen (target lesion failure) innerhalb eines Jahres, also ein neues klinisches Ereignis, das durch die primär interventionell behandelte Koronarläsion verursacht war wie ein Myokardinfarkt oder die Notwendigkeit für eine erneute Revaskularisation. Nach einem Jahr betrug dieses Zielläsion-Versagen in der BP-SES-Gruppe 4% im Vergleich zu 6% beim DP-EES. Auch bei dem sekundären Endpunkt Gesamtmortalität war der biodegradierbare Stent überlegen (3% vs. 6%). Kein Unterschied gab es bei der Infarktrate (2% in beiden Gruppen) und der Rate an Stentthrombosen (2% in beiden Gruppen) (Juan F. Iglesias, Genf).
Dr. med. Peter Stiefelhagen
ICD use in HF-Studie: Langzeitverlauf von ICD-Tägern
Ziel dieser Registerstudie ist es, die Wirksamkeit des ICD im Rahmen der Primärprävention im Hinblick auf die Abnahme der Mortalität im Alltag zu beleuchten. Dabei wurden die Daten von 1.305 Patienten, denen nach den offiziellen Empfehlungen ein ICD implantiert wurde, mit denen von 1.305 Patienten, die trotz gegebener Indikation einen solchen nicht erhalten hatten, verglichen. Die Daten lassen den Schluss zu, dass zu selten ein ICD implantiert wird; denn der ICD senkte sowohl die Kurzzeit- als auch die Langzeit-Mortalität und zwar in allen Subgruppen. Die Ergebnisse unterstreichen den Stellenwert der geltenden Leitlinie (Benedikt Schrage, Hamburg). PS
SWEDEHEART-Studie: Sekundärprävention nach Bypass-Operation
In dieser schwedischen Registerstudie wurde die medikamentöse Sekundärprävention bei Bypass-Patienten im Langzeitverlauf dokumentiert. Die Leitlinie empfiehlt für solche Patienten Statine, RAAS-Inhibitoren und Plättchenhemmer. Alle drei Substanzgruppen erwiesen sich als prognostisch relevant, wobei Statine am stärksten die Mortalität beeinflussen. Deshalb sollten diese Medikamente im Langzeitverlauf nicht abgesetzt und auch bei >75-Jährigen weiter verordnet werden. Dagegen entwickelten Betablocker keinen prognostischen Benefit. Doch die Registerdaten zeigen, dass innerhalb von 8 Jahren die medikamentöse Adhärenz von über 90% auf 80% abnimmt (Erik Bjoerklund, Gothenburg). PS
ENTRUST-AF-PCI-Studie: Edoxaban bei AF-Patienten mit ACS
Die Komorbidität Vorhofflimmern und KHK ist nicht selten. 15% der AF-Patienten entwickeln ein ACS und werden dann mit einem Stent versorgt. Dies erfordert bisher eine antithrombotische Triple-Therapie mit einem oralen Antikoagulanz und zwei Plättchenhemmern.
In dieser Studie wurde in diesem Setting eine duale Therapie mit dem NOAK Edoxaban 60 mg einmal täglich plus einem P2Y12-Inhibitor mit dem Vitamin-K-Antagonisten plus dualer Plättchenhemmung mit einem P2Y12-Inhibitor + ASS verglichen. Eingeschlossen wurden 1 506 AF-Patienten mit einem ACS. Der primäre Endpunkt der Studie waren grössere Blutungsereignisse. Dabei erwies sich die duale Therapie mit Edoxaban der Triple-Therapie mit dem VKA als nicht unterlegen. Eine Überlegenheit konnte nicht dokumentiert werden. Bei den ischämischen Komplikationen (Schlaganfall, Infarkt und Stentthrombose) gab es keinen signifikanten Unterschied zwischen den beiden Behandlungsregimen (Andreas Götte, Paderborn). PS
POPular Genetics-Studie: Gentestung bei P2Y12-Inhibitoren
Die modernen P2Y12-Inhibitoren, nämlich Prasugrel und Ticagrelor, sind bei ACS-Patienten wirksamer im Hinblick auf die Vermeidung von Stentthrombosen und Reinfarkte als Clopidogrel und werden deshalb in der Leitlinie als Substanzen der ersten Wahl propagiert. Doch ihr Einsatz ist mit einem höheren Blutungsrisiko assoziiert. Die Überlegenheit könnte sich daraus ergeben, dass ca. bei 30% aller Patienten eine Mutation im CYP2C19-Gen vorliegt, die die Wirksamkeit von Clopidogrel abschwächt. Bei fehlender Mutation müsste Clopidogrel ebenso effektiv sein wie die modernen P2Y12-Inhibitoren. Somit müsste man durch einen gezielten Einsatz dieser Substanzen das Blutungsrisiko vermindern können.
Das war die Rationale für die POPular Genetics-Studie. In dieser Studie wurden 2.488 ACS-Patienten randomisiert entweder ohne genetische Testung immer mit Prasugrel oder Ticagrelor behandelt oder nach entsprechender Genuntersuchung nur dann mit einer dieser beiden Substanzen therapiert, wenn eine Mutation im CYP2C19-Gen nachgewiesen wurde. Ansonsten erhielten die Patienten Clopidogrel. Durch die genetische Testung wurde der kombinierte Endpunkt aus Stentthrombose, Schlaganfall und grössere Blutung statistisch signifikant von 5,9% auf 5,1% und die Gesamtrate an Blutungen von 12,5% auf 9,8% gesenkt (Jurrien M. ten Berg, Nieuwegein). PS
Mitra-fr-Studie: MitraClip™ bei sekundärer Mitralinsuffizienz
Diese Studie untersucht die prognostische Wirkung des MitraClip™ bei sekundärer Mitralinsuffizienz. Bereits die Erstveröffentlichung beim ESC 2018 in München hat grosses Aufsehen erregt, zumal eine fast gleichzeitig veröffentlichte amerikanische Studie (COAPT-Studie) ein exakt gegenteiliges Ergebnis erbrachte. In der Mitra-fr-Studie konnte durch die Intervention die Prognose der Patienten nach 1 Jahr nicht verbessert werden.
Auch nach einer zweijährigen Beobachtung zeigte sich kein signifikanter Unterschied beim Überleben, lediglich zuletzt ein Trend für eine Überlegenheit des MitraClip™. Ob sich dies im weiteren Verlauf zu einer signifikant besseren Überlebensrate entwickeln wird, bleibt abzuwarten (Jean-Francois Obadia, Lyon). PS
Kontrolle des Kaliums bei Patienten mit Herzinsuffizienz
Auf dem Weg zum State of the Art – sind wir schon soweit?
Die Hyperkaliämie ist eine chronische Elektrolytstörung, die bei Patienten mit Herzinsuffizienz weit verbreitet ist und zu schlechten Ergebnissen führt, erklärte der Chairman des Symposiums Prof. Dr. Stefan Anker, Berlin.
Die Hyperkaliämie ist eine Barriere für die von den Richtlinien empfohlene RAAS- Inhibitionstherapie, die zu einem submaximalen Einsatz dieser lebensrettenden Medikamente und einer erhöhten Mortalität führt. Die klinischen Leitlinien empfehlen jedoch keine wirksamen Alternativen. Traditionell sind Therapien bei Hyperkali-ämie mit einer Reihe von Einschränkungen verbunden. Das Symposium soll aufzeigen, wie neue Ansätze den Standard der Behandlung verändern können.
Chronizität und Belastung durch Hyperkaliämie bei Herzinsuffizienz. Ein Update
Die Prävalenz der Hyperkaliämie ist bei verschiedenen Patientenpopulationen unterschiedlich. Bei der Allgemeinbevölkerung beträgt sie 2-3%, bei resistenter Hypertonie 8-17%, bei Diabetes mellitus ca. 17%, bei fortgeschrittener Nierenerkrankung ca. 50%, bei schwerer Herzinsuffizienz unter MRA Behandlung ca 51% und nach Myokardinfarkt 67%, stellte Prof. Dr. Mitja Lainscak, Ljubljana, fest.
Die Hyperkaliämie tritt bei Herzinsuffizienz periodisch wieder auf, wobei die Intervalle sich stets verkürzen. Das Risiko für Hyperkaliämie-assoziierte Mortalität ist bei Komorbiditäten höher, wobei auch die Hypokaliämie mit einer erhöhten Mortalität einhergeht. Hohe Raten einer suboptimalen RAAS-Inhibitor Therapie gehen mit hohen Sterblichkeitsraten bei Patienten mit Herzinsuffizienz einher. Ca. 90% der Patienten sind entweder nicht auf der Zieldosierung oder der RAAS-Inhibitor wurde zurücktitriert oder die Therapie abgebrochen.
Hyperkaliämie als Barriere für die von der Richtlinie empfohlene RAASi-Therapie?
Prof. Anker stellte einen imaginären Patienten vor, der wegen Kurzatmigkeit hospitalisiert wurde. Er hatte einen kontrollierten Diabetes, eine Vorgeschichte von Bluthochdruck. der aktuelle Blutdruck beträgt 124/78 mmHg. Das Serumkalium ist 4.4mEq/l., die eGFR 41 ml/min/1.73 m2, HbA1c 7.2%.
Nach optimiertem Behandlungsschema (Aspirin, Metformin, Furosemid 40 mg/BID, Carvedilol 18.75 mg BID, Sacubitril/Valsartan 49/51 mg BID) beträgt der Blutdruck 100/66 mmHg, das Serumkalium 4.9 mEq/l. Dr Patient stellt fest «ich möchte eine gute Zeit mit meinen Enkeln verbringen, aber alltägliche Dinge, die ich einst für selbstverständlich hielt, lassen mich jetzt erschöpft fühlen». Ist dieser Patient optimal therapiert? Die Europäischen Guidelines empfehlen eine MRA Therapie bei Patienten, die nach ACE-Hemmer- und Betablocker-Therapie und mit LVEF ≤ 35% symptomatisch bleiben. In der RALES Studie senkte Spironolacton die Mortalität bei Patienten mit Herzinsuffizienz, in EMPHASIS-HF wurden die Hospitalisierungsrate und die Mortalität bei HrEF signifikant durch Eplerenon gesenkt. Entsprechend wurde eine Behandlung mit der halben Dosis Spironolacton(12.5 mg QD) begonnen. Der Blutdruck betrug jetzt 102/62 mmHg, das Serum Kalium 5.2 mEq/l, die eGFR 41 ml/min/1.73m2. Bei erneuter Auftitration des Spironolactons sank der Blutdruck auf 96/60mmHg, das Serumkalium stieg auf 5.4 mEq/l an und die eGFR sank auf 35ml/min/1.73m2 ab. Bei erneuter Halbierung der Spironolacton-Dosis betrug der Blutdruck 102/62 mmHg, das Serumkalium 5.1 mEq/l und die eGFR 38,l/min/1.72m2.
Die Prävalenz der Hyperkaliämie kann bei Patienten mit Herzinsuffizienz, die MRAs erhalten, bis zu 50% betragen. Die Hyperkaliämie führt zum Vermeiden von MRAs bei Patienten mit Herzinsuffizienz. dies vor allem bei Patienten mit Serumkalium > 5.0 mEq/l. Der Patient stellt fest «ich fühlte mich viel besser, ich konnte sogar meine Enkelin zur Schule begleiten. Aber jetzt hat der Doktor die Dosis wieder halbiert und ich fürchte, dass ich mich wieder müde fühle. Es muss doch einen Weg geben, dieses Hyperkaliämie-Problem zu lösen».
Das Management der Hyperkaliämie bei Herzinsuffizienz:
Gibt es Verbesserungsmöglichkeiten?
Die traditionellen Behandlungsoptionen für Hyperkaliämie gehen mit Limitationen einher. Die an Kalium niedrige Diät ist schwierig zu befolgen, die Einschränkung Kaliumreicher Nahrung kann zu Obstipation führen. Sie steht im Widerspruch zur DASH Diät und kann zur Verschlechterung einer chronischen Hypertonie führen, so Prof. Mikhail Kosiborod, Kansas City. Die Wirksamkeit von Diuretika hängt von der Restnierenfunktion ab. Es besteht ein erhöhtes Risiko für Gicht und Diabetes, Die Behandlung kann zu einer Volumenkontraktion, zu vermindertem distalen Nephronfluss, zu einer Verschlechterung der Nierenfunktion und reduzierter Kalium-Ausscheidung, je nach Wahl des Diuretikums kommen. Der Abbruch oder die Halbierung der RAAS Inhibitionstherapie führt zur suboptimalen Einhaltung von Richtlinien. Bei den traditionellen Kaliumbinden (Natriumpolystyrolsulphonat, SPS) wurde die Langzeitwirkamkeit nicht geprüft. Die Nebenwirkungen sind Magenirritationen, Anorexie, Nausea, Erbrechen, Obstipation und gelegentlich Diarrhoe, unangenehmer Geschmack. Nach 2 monatiger Therapie mit SPS haben in einer grossen Studie 90% die Behandlung abgebrochen. SPS ist mit erhöhtem Risiko für Hospitalisierung wegen schweren gastrointestinalen Ereignissen verbunden.
Neue Kaliumbinder für die Behandlung der Hyperkaliämie bei Erwachsenen
Neue Kaliumbinder sind: Patiromer und Natrium-Zirkonium-Cyclosilikat
Patiromer
Der Wirkungseintritt von Patiromer beträgt 4-7 Stunden. In einer einfach-blinden Phase 3 Studie bei Patienten mit chronischer Nierenerkrankung, die mindestens einen RAAS Inhibitor einnahmen, erreichten 76% nach 4 Wochen eine Normokaliämie (Weir MR, NEJM 2015; 372: 211-221. Unter Patiromer blieben die Serumkalium-Werte bis zu
einem Jahr im Normbereich.
Die Hauptcharakteristika von Patiromer sind Wirkmechanismus: Nicht spezifische Kationenbindung im Austausch für Calcium.
Wirkungseintritt: 4-7 Stunden nach der ersten Dosis
Wirksamkeitsdaten: Wirkung bis zu einem Jahr bei chronischer Behandlung aufrecht erhalten.
Medikamenteninteraktionen: Die Gabe sollte mindestens 3 Stunden von der Einnahme anderer Medikamente entfernt sein, da Patiromer das Potenzial andere orale Medikamente zu binden, hat. Ort der Kalium-Bindung: vorwiegend im distalen Colon.
Unerwünschte Wirkungen: Hypermagnesiämie (5.3%), milde bis moderate gastrointestinale Beschwerden, z.B. Obstipation (6.25%), Hypokaliämie (2.3%).
Natriumzironiumcyclosilikat (NZS)
Der Wirkungseintritt erfolgt innerhalb einer Stunde (HARMONIZE 004). 98% der Patienten erreichten eine Normokaliämie innerhalb der 48 stündigen Korrekturphase mit 10 g NZS dreimal pro Tag. 88% der Patienten, die NZS einnahmen, behielten ein mittleres Serumkalium über 1 Jahr.
Die Hauptcharakteristika von Natriumzirkoniumcyclosilikat sind:
Wirkmechanismus: Bevorzugte Kaliumbindung im Austausch gegen Natrium und Wasserstoff. Wirkungseintritt: Bereits 1 Stunde nach der ersten Einnahme.
Wirksamkeitsdaten: Wirkung über ein Jahr bei chronischer Behandlung aufrecht erhalten.
Medikamenteninteraktionen: Begrenzte Auswirkungen auf die Funktion oder Bindung an andere Medikamente. Die Einnahme von NZS sollte 2 Stunden von der Einnahme anderer Medikamente mit klinisch relevanter pH-abhängiger Bioverfügbarkeit entfernt sein, z.B. anti-HIV Medikamente, Azol Antifungizide und Tyrosinkinaseinhibitoren.
Ort der Kalium-Bindung: im ganzen Gastrointestinaltrakt.
Unerwünschte Wirkungen: Hypokaliämie (4.1%), Oedem-bezogene Ereignisse (5.7%).
Das ESC-HF Konsensus-Dokument 2019 schliesst neue Kaliumbinder als therapeutische Option mit ein.
Die Empfehlungen lauten: NZS oder Patiromer können zum Management der Hyperkaliämie und um die Verwendung von RAAS Inhibitoren und MRA bei Patienten mit Herzinsuffizienz mit oder ohne chronische Nierenerkrankung in Betracht gezogen werden.
NZS oder Patiromer können bei ausgewählten Patienten mit Herzinsuffizienz mit oder ohne chronische Nierenerkrankung zur Auftitration von MRA zur Vermeidung einer Hyperkaliämie in Betracht gezogen werden.
Abschliessend erwähnte der Referent die beiden Studien PRIORITIZE-HF mit NZS, die 2020 terminiert ist und DIAMOND, mit Patiromer deren Abschluss für 2022 geplant ist.
Prof. Dr. Dr. h.c. Walter F. Riesen
Eugene Braunwald Lecture
Welches ist das geeignete Alter zum Beginn einer lipidsenkenden Therapie?
- Es existieren 3 fundamentale Prinzipien:
- Die Atherosklerotische kardiovaskuläre Krankheit ist nach wie vor die Ursache Nummer 1 für Tod und Arbeitsunfähigkeit
- Ein erhöhter LDL-Cholesterinwert ist der wichtigste Risikofaktor für die Entwicklung und die Progression von atherosklerotischer kardiovaskulärer Krankheit
- Welchen LDL-Cholesterinwert sollten wir anstreben?
Je tiefer desto besser
Dies die einleitenden Bemerkungen von Prof. Eugene Braunwald, Harvard Medical School, Boston, in seiner ESC Lecture.
Zwei Konzepte für die Atherogenese:
- Die kumulative LDL-Last: Der Wert des zirkulierenden LDL-Cholesterins g/dl multipliziert mit der Anzahl Expositionsjahre.
- Die Schwelle für die atherosklerotische kardiovaskuläre Krankheit: Das Alter in Jahren, wenn die kumulative LDL-Last den Wert erreicht, welcher klinisch atherosklerotische Krankheit verursacht .

Der Referent illustrierte das Konzept der LDL-Last anhand von 3 beispielhaften LDL-Cholesterinwerten: LDL-C 100mg/dl (2.6mmol/l) (Mittelwert der Bevölkerung), LDL-C 200mg/dl (5.2mmol/l) (heterozygote fam. Hypercholesterinämie) und LDL-C 750mg/dl (19.4mmol/l) (homozygote fam. Hypercholesterinämie). Während die Person mit einem LDL-C von 100mg/dl die Schwelle für atherosklerotische kardiovaskuläre Krankheit im Alter von 70 Jahren erreicht, ist dies bei der Person mit LDL-C 200mg/dl bereits bei ca. 30 Jahren der Fall und bei der Patientin mit 750mg/dl sogar bei etwas über 10 Jahren.
Die familiäre Hypercholesterinämie (FH)
Die 2016 ESC/EAS Guidelines empfehlen die Behandlung der homozygoten familiären Hypercholesterinämie (HoFH) mit Medikamenten so früh als möglich. Dies gilt auch für heterozygote Patienten (HeFH) mit extrem hohen Werten, wie ≥10.3mmol/l (400mg/dl). Beim Screening von 98098 Personen im Copenhagen General Population Survey wurde die Prävalenz von Mutationen, die eine FH verursachen, auf 1 in 217 geschätzt. Der Referent zeigte Daten zum Effekt von Rosuvastatin auf die Carotis-Intima-Media-Dicke (CIMT) bei Kindern mit HeFH. Kinder mit HeFH, die mit Rosuvastatin behandelt wurden, zeigten ein geringeres Fortschreiten der Karotis-Atherosklerose, gemessen an der CIMT, und der Unterschied in der CIMT zwischen ihnen und den nicht betroffenen Geschwistern wurde verringert. Diese Ergebnisse unterstützen den Wert einer frühzeitigen Einleitung einer aggressiven LDL-C-Reduktion mit einer wirksameren Statinbehandlung bei Kindern mit HeFH, wie der Referent ausführte.
Polygene Risikoscores
Die koronare Herzkrankheit hat eine hohe Vererbbarkeit und eine polygene Architektur. Ein genomischer Score wurde an 480000 Erwachsenen zur Vorhersage einer koronaren Herzkrankheit getestet (Inouye M et al JACC 2018). Es zeigte sich dabei, dass der genomische Score unabhängig von den konventionellen Risikofaktoren, aber komplementär zu diesen ist, dass er bei Geburt oder davor quantifizierbar ist und damit ein Potenzial für das Risikoscreening im frühen Lebensalter hat. Die Erhöhung des Risikos, durch seltene kodierende Mutationen frühzeitig einen Myokardinfarkt zu erleiden, ist im Vergleich zu einem hohen polygenen Score gleichwertig. Die relativen Beiträge des monogenen und des polygenen Risikos für den früh einsetzenden Myokardinfarkt sind ähnlich.
Neue orale lipidsenkende Medikamente
Prof. Braunwald stellte zwei neue Medikamente zur Lipidsenkung vor: Bempedoinsäure und Gemcabene. Bempedoinsäure als Zusatz zu maximaler Statintherapie senkte LDL-C um 16.5% gegenüber Statin allein und zeigte keine Zunahme unerwünschter Nebenwirkungen gegenüber Placebo in einer Studie an 2230 Patienten. Auch Gemcabene wird zusätzlich zu maximaler Statintherapie gegeben. Es ergab eine LDL-C Senkung von 23.4% bei einer Dosierung von 300mg und eine von 27.7% bei der Gabe von 900mg. CRP wurde um 26.1 bzw. 53.9% gesenkt. Die Studie umfasste allerdings nur 60 Patienten.
Lipoprotein (a), Lp(a)
Lp(a) wurde in mehreren Studien als unabhängiger zusätzlicher Risikofaktor erkannt. Genetische Daten bestätigen, dass Lp(a) in der Pathophysiologie atherosklerotischer vaskulärer Krankheit und Aortenstenose ein kausaler Faktor ist. Der Plasmawert von Lp(a) ist grossenteils genetisch determiniert. Genetisch erniedrigte Lp(a)-Werte sind mit einem geringeren Risiko für periphere Verschlusskrankheit, Schlaganfall, Herzinsuffizienz und ACS assoziiert. Dies eröffnet die Möglichkeit, durch pharmakologische Lp(a)-Senkung eine Reihe von Krankheiten, die mit Atherosklerose assoziiert sind, zu beeinflussen, stellte der Referent fest. Die Wirkung einer Lp(a)-Senkung um eine Standarddeviation gab er mit einer Reduktion von 29% für koronare Herzkrankheit, 31% für periphere Verschlusskrankheit, 17% für Herzinsuffizienz, 13% für Schlaganfall, 9% für chronische Nierenerkrankung und 37% für Aortenstenose an. Die Therapie von Lp(a) mit Antisense Oligonucleotiden erlaubt eine Senkung um bis zu 75% gegenüber Placebo, wie erste Studien gezeigt haben.
Triglyceride
Ein weiteres Thema, das Prof. Braunwald erörterte, sind die Triglyceride. Er erwähnte dabei die Behandlung mit Icosapent-Ethyl (Eicosapentaensäure (EPA) in reiner Form), welches erstmals in der Studie REDUCE IT eine Senkung des kardiovaskulären Risikos gezeigt hat. Der kombinierte primäre Endpunkt aus kardiovaskulärem Tod, MI, Schlaganfall, koronarer Revaskularisierung, instabiler Angina wurde um 25% gesenkt (NNT 21; p= 0.00000001).
ANGPTL3
Loss-of-Function-Varianten in ANGPTL3 sind mit einem geringeren Risiko für KHK assoziiert, was die antiatherogenen Effekte einer Senkung von ANGPTL3 mit Hilfe eines monoklonalen Antikörpers (Evinacumab) bei Mäusen widerspiegelt. Bei humanen Volontären war die Inhibition von ANGPTL3 mit Evanicumab mit dosisabhängigen Senkungen von LDL-C und der Triglyceride verbunden. Die ANGPTL3-Inhibition zusätzlich zu Statinen, Ezetimibe, Lomitapib und PCSK9-Antikörper führte bei homozygoter familiärer Hypercholesterinämie zu einer Senkung des LDL-C um 49%.
Die PCSK9-Geschichte
Der Referent erinnerte an die Entdeckung von Mutationen im PCSK9-Gen, welche zu autosomaler, dominanter Hypercholesterinämie führen (Abifadel M et al Nature Genetics 2003) und die Tatsache, dass Sequenzvariationen in PCSK9 mit tiefen LDL-C-Werten und Schutz gegen koronare Herzkrankheit einhergehen (Cohen JC et al. New Engl J Med 2008). Innerhalb von 14 Jahren wurde aus dieser Beobachtung eine Therapie mit Hilfe von monoklonalen Antikörpern (Evolocumab, Alirocumab) entwickelt. In der FOURIER-Studie wurde eine 59%ige LDL-C-Senkung (Evolocumab) erzielt, die mit einer Senkung des primären Endpunkts um 15% assoziiert war (Sabatine MS et al New Engl J Med 2017).
Die Entdeckung, dass doppelsträngige RNA einen enzymatischen Mechanismus aktiviert, der zu einer Genabschaltung führt (AZ Fire und CC Mello, Nobelpreis 2006), wurde auch auf PCSK9 angewandt (Fitzgerald K et al. Lancet 2014). Das entsprechende Medikament Inclisiran erlaubt LDL-C-Senkungen um 50% über einen Zeitraum von mehreren Monaten (Ray KK et al Circulation 2018).
Der Referent knüpfte an seine Ausführungen mit der eingangs gemachten Feststellung der kumulativen LDL-Belastung (LDL-C mal Jahre der Exposition) an. Die Senkung des LDL-C von 2.6mmol/l auf 1.5mmol/l mit Inclisiran im Alter von 30 Jahren würde eine Lebensverlängerung um 30 Jahre erlauben, schloss Prof. Braunwald. WFR

EVOPACS-Studie
Evolocumab zur frühzeitigen Reduktion des LDL-Cholesterinspiegels bei Patienten mit akuten koronaren Syndromen

Der Beginn einer Therapie mit Evolocumab während der Akutphase eines akuten Koronarsyndroms (ACS), zusätzlich zur hochintensiven Statintherapie, führte zu einer signifikanten Reduktion von LDL-Cholesterin (LDL-C)
bei Patienten, die im Krankenhaus mit ACS behandelt wurden, wobei die Patienten bis Woche acht mehrheitlich die angestrebten LDL-C-Werte erreichten. Dies sind die Ergebnisse der EVOPACS-Studie, die am 31. 8. in einer Late-Breaking-Session von Dr. Konstantinos Koskinas, Bern, vorgestellt und gleichzeitig im Journal of the American College of Cardio-logy (Koskinas K et al. JACC 2019; pii: S0735-1097(19)36274-6. doi: 10.1016/j.jacc. 2019.08.010. Epub ahead of print) veröffentlicht wurden.
EVOPACS ist die erste randomisierte, doppelblinde Studie zur Beurteilung eines PCSK9-Hemmers in dem sehr risikoreichen Umfeld eines ACS. Dabei wurde die Machbarkeit, Sicherheit und LDL-C-senkende Wirksamkeit dieses Therapieansatzes untersucht. Ausgangspunkt der Studie war die Feststellung, dass die im Krankenhaus für ACS-Patienten eingeleitete hochintensive Statintherapie frühe Ereignisse zwar reduziert, der Wirkungseintritt jedoch verzögert stattfindet und viele Patienten mit dieser Therapie allein die LDL-C-Zielwerte nicht erreichen.
Patienten, die mit ACS (n = 308) mit erhöhten LDL-C-Werten ins Krankenhaus eingeliefert wurden, erhielten randomisiert eine Behandlung mit Evolocumab 420 mg (n = 155) oder Placebo (n = 153). Die Therapie wurde im Krankenhaus eingeleitet und dann alle vier Wochen fortgeführt. Allen Patienten wurde Atorvastatin 40 mg verordnet. Die meisten Patienten (78,2 Prozent) waren bisher nicht mit einem Statin behandelt worden.
Das berechnete LDL-C war zu Studienbeginn und nach acht Wochen bei 277 Patienten (90 Prozent) verfügbar. In der achten Woche sanken die durchschnittlichen LDL-C-Werte von 3,61 mmol/L (139,59 mg/dL) auf 0,79 mmol/L (30,5 mg/dL) unter Evolocumab und von 3,42 mmol/L (132,25 mg/dL) auf 2,06 mmol/L (79,66 mg/dL) unter Placebo.
Nach acht Wochen war der primäre Endpunkt der prozentualen Veränderung von LDL-C gegenüber dem Ausgangswert -77,1 ± 15,8 % in der Evolocumab-Gruppe gegenüber -35,4 ± 26,6% in der Placebogruppe (p < 0,001). Die LDL-C-Reduktionen wurden nach vier Wochen beobachtet und über acht Wochen aufrechterhalten.Mehr Patienten erreichten in der Evolocumab-Gruppe eine LDL-C-Reduktion auf < 1.8 mmol/L als in der Placebogruppe (95,7 Prozent vs. 37,6 Prozent).
Evolocumab wurde gut vertragen und Nebenwirkungen (sekundärer Endpunkt) unterschieden sich nicht signifikant zwischen den Gruppen. «Die Behandlung mit Evolocumab ermöglichte es, die derzeit empfohlenen LDL-C-Zielwerte bei > 95 Prozent der Patienten schnell zu erreichen, verglichen mit einem Drittel der placebobehandelten Patienten», schloss der Referent.
Prof. Dr. Dr. h.c. Walter F. Riesen
Lipidmodifikation zur Reduktion des kardiovaskulären Risikos
Die ESC/EAS-Guidelines 2019 zum Management von Dyslipidämien
Grundlagen für die neuen Guidelines

Diese Richtlinien anerkennen, dass LDL und andere Apolipoprotein B(Apo B)-haltige Lipoproteine ASCVD (atherosklerotische, kardiovaskuläre Krankheit) verursachen, stellte
Prof. Brian Ference, Cambridge, einleitend fest. Sie geben daher Empfehlungen, zur
Reduktion der ASCVD durch Senkung der Apo B–haltigen Lipoproteine.
Die Leitlinien nehmen zur Kenntnis, dass der Nutzen von lipidsenkenden Therapien sowohl durch die absolute Reduktion von LDL und anderen apo B-haltigen Lipoproteinen als auch durch die entsprechende absolute Reduktion des ASCVD-
Risikos bestimmt wird.
Sie empfehlen daher, die Intensität der lipidsenkenden Therapie, die sowohl auf dem Basis-Lipidspiegel als auch dem Basisrisiko bei ASCVD basiert, zu titrieren.
Die Richtlinien priorisieren die Identifizierung von Personen mit hohem und sehr hohem 10-Jahres-Risiko für ein kardiovaskuläres Ereignis, da sie höchstwahrscheinlich den grössten kurzfristigen klinischen Nutzen aus einer aggressiven lipidsenkenden Therapie ziehen werden. Aufgrund des
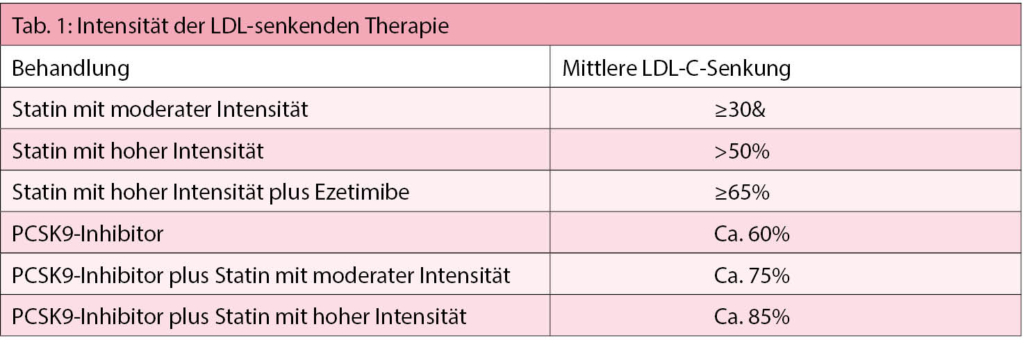
Basis-LDL-Cholesterinwerts und Basisrisikos für ASCVD kann der erwartete Nutzen der LDL-senkenden Therapien geschätzt werden. Der Referent verwies auf die Wirksamkeit der einzelnen LDL-senkenden Medikamente (Tabelle 1).
Empfehlung für die Schätzung des kardiovaskulären Risikos
Die Risikoschätzung umfasst 3 Stufen:
- Klinische Evaluation: Es wird empfohlen, dass Personen mit hohem und sehr hohem Risiko auf der Basis dokumentierter kardiovaskulärer Krankheit, Diabetes mellitus, moderater bis schwerer Nierenerkrankung, sehr hohen Werten einzelner Risikofaktoren, FH oder einem hohen SCORE-Risiko identifiziert werden. Diese Patienten gelten als prioritär für die Beratung und Behandlung aller Risikofaktoren. Diese Empfehlung erhielt eine Klasse I/C-Empfehlung.
- 10-Jahresrisiko nach SCORE-Berechnung: Die Schätzung des Gesamtrisikos mit Hilfe eines Risikoschätzungssystems wie SCORE wird für asymptomatische Erwachsene ab
40 Jahren ohne Anzeichen von kardidovaskulärer Krankheit, Diabetes mellitus, chronischer Nierenerkrankung, familiärer Hypercholesterinämie oder LDL-C > 4.9 mmol/l empfohlen. Dies ist ebenfalls eine I/C Empfehlung. - Bewertung von Risikomodifikatoren: Bei ausgewählten Personen mit niedrigem bis moderatem Risiko können andere Faktoren, einschliesslich erhöhtes Apo B, Lipoprotein (a), (Lp(a)) oder C-reaktives Protein (CRP), Familienanamnese für verfrühte ASCVD oder die Präsenz von atherosklerotischen Plaques im Imaging die Risikostratifikation verbessern und die Behandlungsentscheidung beeinflussen. Ebenfalls eine I/C Empfehlung.
Risikokategorien: klinische Beurteilung
Der Referent präsentierte anschliessend die verschiedenen Risikokategorien, die insgesamt 4 Kategorein umfassen, von niedrigem bis sehr hohem kardiovaskulärem Risiko.
Sehr hohes kardiovaskuläres Risiko: Dokumentierte ASCVD entweder klinisch oder eindeutig durch Bildgebung.Dokumentierte ASCVD schliesst früheres ACS (MI oder instabile Angina), stabile Angina, koronare Revaskularisierung (PCI, CABG und andere arterielle Revaskularisierungsprozeduren), Schlaganfall und TIA und periphere arterielle Verschlusskrankheit mit ein. Durch Bildgebung eindeutig dokumentierte ASCVD schliesst Befunde mit ein, von denen man weiss, dass sie für klinische Ereignisse prädiktiv sind, wie besipielsweise signifikante Plaques in der Koronarangiographie oder im CT-Scan (Mehrgefässherzkrankheit mit 2 wichtigen epikardialen Arterien, die > 50% Stenosen aufweisen) oder im Karotisultraschall. Diabetes mellitus mit Zielorganschaden, ≥3 Hauptrisikofaktoren oder frühes Auftreten von T1DM mit langer Dauer (> 20 Jahre), schwere chronische Nierenkrankheit (eGFR < 30 ml/min/1.73 m2). Familiäre Hypercholesterinämie mit ASCVD oder mit einem andern Hauptrisikofaktor. Ein kalkulierter SCORE von ≥10% für das 10-Jahresrisiko für ein tödliches kardiovaskuläres Ereignis.
Hohes kardiovaskuläres Risiko: Personen mit stark erhöhten einzelnen Risikofaktoren, insbesondere Gesamtcholesterin > 8 mmol/l, LDL-C > 3.9 mmol/l oder Blutdruck > 180/110mmHg. Patienten mit familiärer Hypercholesterinämie ohne weitere Risikofaktoren. Patienten mit Diabetes mellitus ohne Zielorganschaden, mit Diabetesdauer ≥10 Jahre oder einem weiteren, zusätzlichen Risikofaktor. Berechneter Risikoscore ≥5% und < 10% für das 10 Jahresrisiko für ein tödliches kardiovaskuläres Ereignis.
Moderates Risiko: Junge Patienten (T1DM < 35 Jahre, T2DM < 50 Jahre mit Diabetesdauer unter 10 Jahren) ohne weitere Risikofaktoren. Berechneter Risikoscore ≥1% und < 5% für das 10-Jahresrisiko für ein tödliches kardiovaskuläres Ereignis.
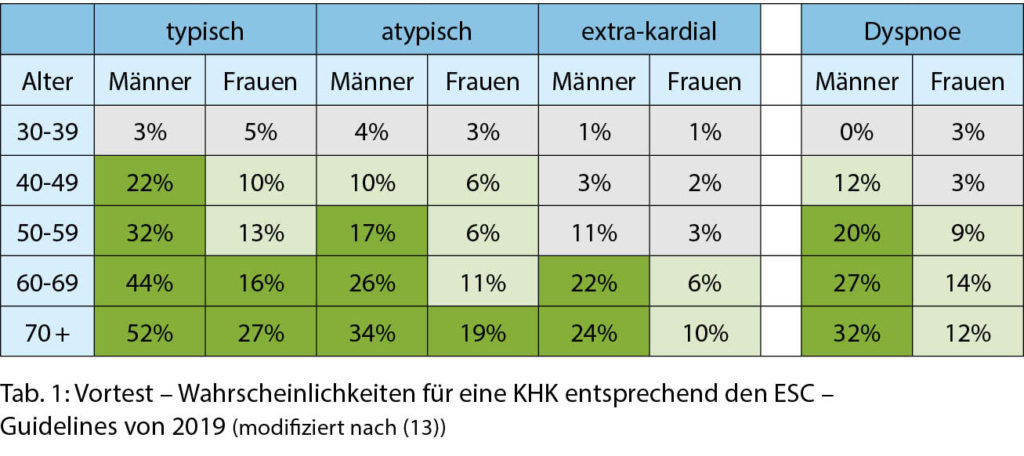
Niedriges Risiko: Keines der oben genannten Merkmale. Berechneter Risikoscore < 1% für das 10-Jahresrisiko für ein tödliches kardiovaskuläres Ereignis. Der Referent wies auf die kardiovaskulären Risiko-Score-Charts für europäische Populationen mit hohem und solche mit niedrigem kardiovaskulärem Risiko hin. Die Schweiz gehört zu den Niedrigrisiko-Populationen.
Der Referent betonte, dass die Charts bei der Risikoschätzung helfen können, dass sie aber im Lichte der Erfahrungen des Klinikers und der Patienten-Prätest-Wahrscheinlichkeit für kardiovaskuläre Krankheit interpretiert werden sollen. Ferner betonte er, dass bei Frauen die Risikoabschätzungen tiefer sind als bei Männern, dass aber das Risiko nur verschoben ist und dass das Risiko einer 60-jährigen Frau ähnlich wie dasjenige eines 50-jährigen Mannes ist. Er wies ferner darauf hin, dass das Risiko bei jungen Personen unerwartet hoch sein kann, auch wenn die absoluten Werte niedrig sind. Die Chart mit dem relativen Risiko und das geschätzte Risikoalter können in diesen Fällen hilfreich sein. Er zeigte das Beispiel eines 40-jährigen männlichen Rauchers mit Risikofaktoren, dessen Gesamtrisiko gleich hoch ist (3-4%) wie dasjenige eines 65-jährigen Mannes mit idealen Risikowerten. Deshalb ist das Risikoalter dieses 40 Jährigen 65 Jahre.
Empfehlungen für Lipidanalysen
Gesamtcholesterin wird für die Abschätzung des kardiovaskulären Gesamtrisikos mit Hilfe des SCORE-Systems benötigt (I/C). HDL-Cholesterin wird empfohlen zur Risikoverfeinerung mit dem online SCORE-System (I/C). Die Bestimmung von LDL-Cholesterin ist als primäre Lipidanalyse für Screening, Diagnose und Management empfohlen (I/C). Die Bestimmung der Triglyceride ist als Teil der Routine-Lipid-Analyse empfohlen (I/C). Non-HDL-C ist für die Risikoabschätzung empfohlen, insbesondere bei Personen mit hohen Triglyceriden, Diabetes, Übergewicht oder sehr tiefen LDL-C Werten (I/C). Die Bestimmung von Apo B ist für die Risikoabschätzung empfohlen, insbesondere bei Personen mit hohen Triglyceriden, Diabetes, Übergewicht oder dem metabolischen Syndrom oder sehr tiefen LDL-C Werten. Diese kann, falls verfügbar, alternativ zu LDL-C als primäre Messung für Screening, Diagnose und Management verwendet werden und kann gegenüber non HDL-C bevorzugt werden bei Personen mit hohen Triglyceriden, Diabetes, Übergewicht oder sehr tiefen LDL-C Werten (I/C). Die Bestimmung von Lp(a) sollte mindestens einmal im Leben einer jeden Person in Betracht gezogen werden, um die Personen mit vererbten, sehr hohen Werten > 180 mg/dl (> 430 nmol/l) zu finden, die ein äquivalentes lebenslanges Risiko aufweisen wie Patienten mit heterozygoter familiärer Hypercholesterinämie (IIa/C). Lp(a) sollte bei ausgewählten Personen mit einer familiären Belastung durch verfrühte kardiovaskuläre Krankheit bestimmt werden und zur Reklassifizierung von Personen, die ein grenzwertiges Risiko zwischen moderat und hoch aufweisen (IIa/C).
Fazit
- Bei scheinbar gesunden Personen ist das kardiovaskuläre Risiko häufig das Resultat von multiplen, interagierenden Risikofaktoren. Dies ist die Grundlage für die Gesamt-
risikoabschätzung und das Management. - Bestimmte Personen sind mit einem sehr hohen oder hohen CVD-Risiko konfrontiert, ohne dass sie ein Risiko-Scoring benötigen und erfordern sofortige Aufmerksamkeit bezüglich aller Risikofaktoren. Dies gilt für Patienten mit dokumentierter CVD, Diabetes, familiärer Hypercholesterinämie, chronischer Nierenerkrankung, Carotis- oder Femurplaques, einem Koronar-Calciumscore > 100 oder extremer Lp(a)-Konzentration.
- Ein Risikoabschätzungssystem wie SCORE kann bei logischen Managemententscheidungen helfen und kann dazu beitragen, sowohl Unter- als auch Überbehandlungen zu vermeiden.
- Alle Risikoeinschätzungssysteme sind relativ roh und erfordern Aufmerksamkeit in
Bezug auf qualifizierende Aussagen. - Zusätzliche risikorelevante Faktoren können in elektronischen Risikoschätzungssystemen wie HeartScore (www.heartscore.org) berücksichtigt werden.
- Der Gesamtrisikoansatz ermöglicht Flexibilität: Wenn eine optimale Kontrolle mit einem Risikofaktor nicht erreicht werden kann, kann eine stärkere Auseinandersetzung mit den anderen Risikofaktoren das Risiko dennoch reduzieren.
Bildgebung zur Verbesserung der Auswahl von Patienten für die lipidsenkende Behandlung

Die neuen Guidelines empfehlen, dass die arterielle Plaquebelastung (A. carotis oder A. femoralis) bei der arteriellen Ultraschalluntersuchung als Risikomodifikator bei Personen mit geringem oder mittlerem Risiko in Betracht gezogen wird (IIa/B), so Dr. Victoria Delgado, Leiden.
Die Referentin präsentierte die verschiedenen Risikokategorien und die Interventionsstrategien in Funktion des kardiovaskulären Gesamtrisikos und der unbehandelten LDL-Cholesterin-Werte. Sie wandte sich dann den bildgebenden Techniken zur Evaluation des kardiovaskulären Risikos zu und wies auf Daten hin, die zeigen, dass die Ultraschalluntersuchung der Karotisplaques eine höhere diagnostische Genauigkeit für die Vorhersage von koronaren Ereignissen hat als die Karotis-Intima-mMedia-Dicke. Die Referentin zeigte ferner Daten zum Koronarkalziumscore, der die langzeitprognostische Genauigkeit für MACE-Ereignisse und Mortalität unabhängig von Alter und Risikofaktoren verbessert. Der Kalziumscore mit CT sollte als Risikomodifikator in der Bewertung des kardiovaskulären Risikos bei asymptomatischen Personen mit niedrigem bis moderatem Risiko in Betracht gezogen werden (IIa/B).
Geeignete Behandlungsziele/ -strategien zur Senkung der Lipidwerte

Die Rolle von LDL in der Atherogenese und die pathogenetische Plausibilität wurde von Prof. Alberico Catapano, Milano in Erinnerung gerufen.
Der Referent zeigte eine Metaanalyse verschiedener Methoden zur LDL-Senkung und ihren Einfluss auf das relative Risiko schwerer kardiovaskulärer Ereignisse. Unabhängig von der Art der Lipidsenkung ergibt eine LDL-C-Senkung von 1 mmol/l eine relative Senkung des kardiovaskulären Risikos von 23%. Auch genetische Evidenz unterstützt LDL-C als Risikofaktor für kardiovaskuläre Ereignisse. Die Untersuchungen zeigen, dass nicht nur die LDL-C-Senkung an sich, sondern auch die Dauer der Senkung eine grosse Rolle bei der Risikoreduktion spielt. Dabei ergab die Senkung durch Statine im ersten Jahr eine Risikoreduktion um 9%, im zweiten Jahr um 22%, nach 2-3 Jahren um 24%.
Prof. Catapano illustrierte ferner das Konzept des Risikoalters anhand der SCORE Charts, wie es bereits im Referat von Prof. Ference beschrieben wurde. Der Referent wies ferner auf die Risikofunktion unter Einschluss von HDL-Cholesterin hin. Als Schlüsselbotschaft zur Risikoabschätzung nannte der Referent unter anderem, dass bei folgenden Personen alle Risikofaktoren ohne ein Risikofaktoren-Scoring sofort berücksichtigt werden müssen: Personen mit dokumentierter kardiovaskulärer Krankheit, Diabetes, familiärer Hypercholesterinämie, chronischer Nierenerkrankung, Karotis- oder Femurplaques, einem Koronarkalziumscore von > 100 oder einer extremen Lp(a)-Erhöhung. Er erinnerte daran, dass die Risiko-Scores relativ rohe Angaben enthalten und Aufmerksamkeit für qualifizierende Aussagen erfordern. Zusätzliche Risikofaktoren können durch elektronische Risikoabschätzungssysteme wie HeartScore berücksichtigt werden. Der Gesamtrisikoansatz erlaubt Flexibilität, betonte der Referent. Wenn die optimale Kontrolle mit einem Risikofaktor nicht möglich ist, kann die Behandlung der andern Risikofaktoren das Risiko immer noch senken.
Lipidanalysen
Prof. Catapano widmete sich des Weiteren den Empfehlungen zur Lipidbestimmung. Das Totalcholesterin sollte für die Abschätzung des kardiovaskulären Gesamtrisikos mit Hilfe des SCORE-Systems bestimmt werden (I/C). HDL-C wird empfohlen zur weiteren Verfeinerung der Risikoabschätzung unter Zuhilfenahme des Online-SCORE-Systems (I/C). Die Bestimmung von LDL-C wird für die primäre Lipidanalyse für Screening, Diagnose und Behandlung empfohlen (I/C). Die Triglyceridbestimmung wird als Teil der Routine-Lipidbestimmung empfohlen (I/C). Der Referent erinnerte ferner an die bereits von Dr. Delgado erwähnte Bestimmung der Plaquebelastung (IIa/B) und des Kalziumscores mit CT (IIa/B).
Behandlungsziele
Als Behandlungsziele für die Prävention kardiovaskulärer Krankheit erwähnte der Referent: Keine Belastung durch Tabak in irgendeiner Form, gesunde Ernährung mit niedrigem Gehalt an gesättigten Fettsäuren mit Schwerpunkt auf Vollkornprodukten, Gemüse, Obst und Fisch, 3.5-7h mässig starke körperliche Aktivität pro Woche oder 30-60 Min. an den meisten Tagen, BMI 20-25 kg/m2, Bauchumfang < 94cm (Männer) und < 80 cm (Frauen). Blutdruck < 140/90 mmHg.
LDL-Cholesterin bei sehr hohem Risiko: In der Sekundärprävention ist eine Behandlung, die eine Senkung des Ausgangswerts um ≥50% und einen Zielwert von < 1.4mmol/l erlaubt, empfohlen (I/A). Dies gilt auch für Personen mit sehr hohem Risiko, aber ohne familiäre Hypercholesterinämie (I/C).
In der Primärprävention bei Personen mit familiärer Hypercholesterinämie und sehr hohem Risiko wird ebenfalls eine LDL-C-Senkung um ≥50% und ein Zielwert < 1.4mmol/l empfohlen (Ia/C).
Für Personen mit einem zweiten vaskulären Ereignis innerhalb von 2 Jahren, die eine maximal tolerierte Statindosis einnehmen, sollte ein LDL-C-Zielwert von < 1.0 mmol/l in Betracht gezogen werden (IIb/B).
Für Personen mit hohem Risiko ist eine LDL-C-Senkung um ≥50% vom Ausgangswert und ein Zielwert von < 1.8mmol/l empfohlen (I/A).
Für Personen mit moderatem Risiko ist ein LDL-C-Zielwert von < 2.6 mmol/l empfohlen (IIa/A), bei niedrigem Risiko ein LDL-C-Zielwert von < 3.0 mmol/l (IIb/A).
Für Non-HDL-C sind die sekundären Zielwerte < 2.2, < 2.6 und < 3.4 mmol/l für sehr hohes, hohes und moderates Risiko. Für Apolipoprotein B gelten als sekundäres Ziel < 65, 80 und 100mg/l für sehr hohes, hohes und moderates Risiko.
Für die Triglyceride wird kein Ziel angegeben, aber < 1.7 mmol/l bedeutet geringeres Risiko und höhere Werte erfordern die Suche nach andern Risikofaktoren.
Diabetes: Für HbA1c gilt < 7%.
Empfehlungen für die pharmakologische Behandlung von LDL-Cholesterin und der Hypertriglyceridämien
Es wird empfohlen, ein hoch intensives Statin bis zur höchsten tolerierten Dosis zur Erreichung der jeweils spezifischen Zielwerte für die verschiedenen Risikokategorien zu verschreiben (I/A).
Falls die Ziele mit der maximalen Statindosis nicht erreicht werden können, ist die Verwendung von Ezetimibe empfohlen (I/B). Für die Primärprävention bei Patienten mit sehr hohem Risiko, aber ohne familiäre Hypercholesterinämie, ist bei Nichterreichung des Zielwerts unter maximaler Statindosis und Ezetimibe die Verwendung eines PCSK9-Inhibitors empfohlen (IIb/C). In der Sekundärprävention ist bei Patienten mit sehr hohem Risiko, die ihren Zielwert unter maximaler Statindosis und Ezetimibe nicht erreichen, die Kombination mit einem PCSK9-Hemmer empfohlen (I/A).
Für Patienten mit familiärer Hypercholesterinämie mit sehr hohem Risiko (d.h. mit ASCVD oder mit einem andern Hauptrisikofaktor) unter maximaler Statindosis und Ezetimibe ist eine Kombination mit einem PCSK9-Inhibitor empfohlen (I/C).
Wenn eine Statintherapie bei irgendeiner Dosis nicht vertragen wird (sogar nach Rechallenge), ist Ezetimibe empfohlen (IIa/C).
Im obigen Fall kann auch die Zugabe eines PCSK9-Inhibitors zu Ezetimibe in Betracht gezogen werden (IIb/C).
Falls der LDL-C-Zielwert nicht erreicht wird, kann die Kombination eines Statins mit einem Gallensäurebinder in Betracht gezogen werden (IIb/C).
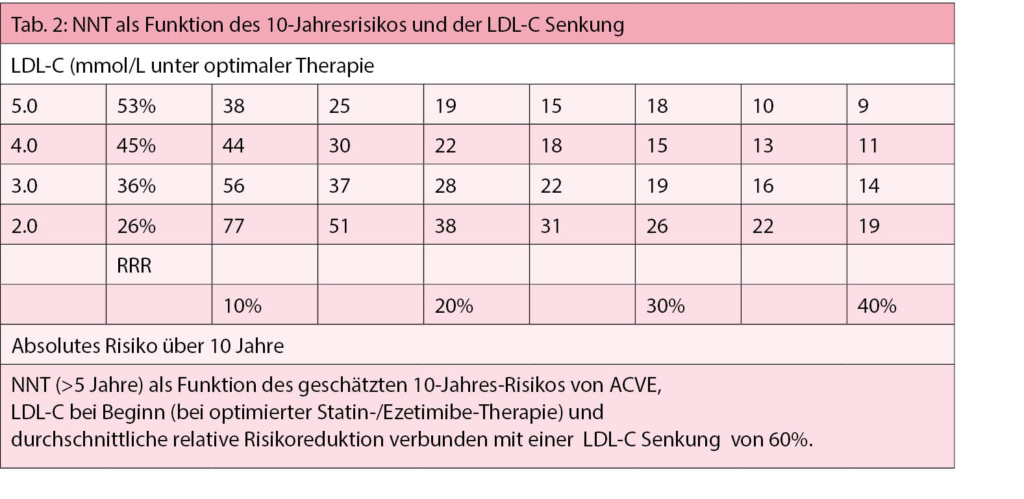
Die NNT (Number Needed To Treat) in Funktion des 10-Jahresrisikos für ein akutes Koronareignis, Ausgangs-LDL (bei optimierter Statin/Ezetimibe-Therapie) und durchschnittliche Risikoreduktion im Zusammenhang mit einer LDL-C-Senkung um 60% ist in der Tab. 2 wiedergegeben.
Statine sind als Therapie der ersten Wahl zur Senkung des kardiovaskulären Risikos bei Hochrisiko-Personen mit Hypertriglyceridämie (> 2.3 mmol/l) empfohlen (I/B). Bei Personen mit hohem (oder sehr hohem) Risiko mit Triglyceriden zwischen 1.5 und 5.6 mmol/l trotz Statintherapie können mehrfach ungesättigte Fettsäuren (Icosapent-Ethyl 2 x 2g/d) in Kombination mit einem Statin in Betracht gezogen werden (IIa/B).
In der Primärprävention bei Patienten mit LDL-C-Zielwert, die Triglyceridwerte > 2.3 mmol/l aufweisen, kann Fenofibrat oder Bezafibrat in Kombination mit Statinen in Betracht gezogen werden (IIb/B). Dies gilt auch für Hochrisikopatienten mit LDL-C-Zielwert und Triglyceriden > 2.3 mmol/l (IIb/B).
Interventionsstrategien als Funktion des kardiovaskulären Gesamtrisikos und unbehandelter LDL-Cholesterinwerte
Der Referent schloss mit einer Betrachtung der Interventionsstrategien als Funktion des kardiovaskulären Gesamtrisikos und der unbehandelten LDL-Cholesterinwerte und zeigte tabellarisch die Risikokategorien von niedrigem bis sehr hohem Risiko und unbehandelter LDL-Cholesterinwerte von < 1.4 mmol/l bis ≥ 4.9 mmol/l. Bei niedrigem Risiko sind LDL-C Werte bis < 3.0 mmol/l durch Lebensstilberatung zu behandeln. Bei Werten über 3 mmol/l kann neben der Lebensstiländerung (falls ungenügend) eine medikamentöse Behandlung in Betracht gezogen werden, bei Werten ≥4.9 mmol/l ist eine Lebensstiländerung mit begleitender medikamentöser Therapie empfohlen. Bei sehr hohem Risiko ist jedoch bei LDL-C Werten > 1.4 mmol/l neben der Lebensstiländerung zusätzlich eine medikamentöse Therapie in Betracht zu ziehen, bei allen höheren LDL-C-Werten ist eine medikamentöse Therapie neben der Lebensstiländerung indiziert.
Lipidbehandlung bei ausgewählten Patientenpopulationen

Die Behandlung erhöhter Lipide bei Frauen, bei Hypertriglyceridämie, familiärer Hypercholesterinämie, älteren Personen, Diabetes, akuten Koronarsyndromen, ischämischem Schlaganfall und chronischer Nierenerkrankung wurde von Prof. François Mach, Genf, präsentiert.
Statinbehandling bei Frauen Die Statinbehandlung ist bei Frauen gleich wie bei Männern indiziert. Lipidsenkende Medikamente sollten aber nicht eingenommen werden, wenn eine Schwangerschaft geplant ist, auch nicht während Schwangerschaft und Stillen. Bei Patientinnen mit schwerer familiärer Hypercholesterinämie können aber Gallensäurebinder (die nicht absorbiert werden) oder die LDL-Apherese in Betracht gezogen werden. Was die Empfehlungen bezüglich der Triglyceride betrifft, verwies Prof. Mach auf seine Vorredner (siehe dazu oben).
An die Diagnose familiäre Hypercholesterinämie sollte bei Patienten mit koronarer Herzkrankheit unterhalb von 55 Jahren bei Männern und unterhalb 60 Jahren bei Frauen, ebenso bei Personen mit Verwandten mit verfrühter tödlicher oder nicht-tödlicher kardiovaskulärer Krankheit oder Sehnenxanthomen oder LDL-C-Werten > 5mmol/l (Erwachsene) bzw. > 4 mmol/l (Kinder) und bei erstgradig Verwandten von Patienten mit familiärer Hypercholesterinämie gedacht werden (I/C). Es wird die Diagnose aufgrund klinischer Kriterien empfohlen und die Bestätigung, falls möglich, mit DNA-Analytik (IIa/C). Nachdem ein Index-Patient diagnostiziert ist, ist ein Kaskadenscreening empfohlen (I/C). Die Behandlung von Patienten mit familiärer Hypercholesterinämie wurde bereits zuvor besprochen. In Bezug auf die Behandlung alter Personen wird die Behandlung mit Statinen bei ≤ 75-Jährigen wie bei Jungen empfohlen (I/A). Der Beginn einer Statintherapie kann bei Personen > 75 Jahre in Betracht gezogen werden, wenn das Risiko hoch oder sehr hoch ist (IIb/B). Der Beginn mit einer niedrigen Dosierung ist bei signifikanter Nierenfunktionsstörung und/oder Potential für Medikamenteninteraktionen empfohlen, bei nachfolgender Titration zur Erreichung der Zielwerte (I/C).
Diabetes Typ 2
Bei Typ-2-Diabetes-Patienten mit sehr hohem Risiko ist eine Senkung um mindestens 50% und ein Zielwert für LDL-C von < 1.4 mmol/l empfohlen, für diejenigen mit hohem Risiko eine Senkung um mindestens 50% und ein Zielwert von < 1.8 mmol/l (I/A). Bei Typ-1-Diabetes-Patienten mit hohem oder sehr hohem Risiko sind Statine empfohlen (I/A). Die Intensivierung der Statintherapie sollte vor der Einführung einer Kombinationstherapie erfolgen (IIa/C), und falls der Zielwert nicht erreicht wird, ist eine Kombination mit Ezetimibe in Betracht zu ziehen (IIb/B). Dagegen ist eine Statintherapie bei prämenopausalen Frauen mit Diabetes, die eine Schwangerschaft ins Auge fassen oder keine adäquate Verhütungsmethode anwenden nicht empfohlen (III/C). Statine können sowohl bei Typ-1- als auch Typ-2-Diabetes-Patientinnen ≤ 30 Jahre mit Evidenz für Endorganschaden und/oder LDL-C > 2.5 mmol/l in Erwägung gezogen werden, sofern keine Schwangerschaft geplant ist (IIb/C).
Patienten mit akuten Koronarsyndromen und sehr hohem Risiko
Bei allen Patienten mit akuten Koronarsyndromen ohne Kontraindikation oder definitiver Statinintoleranz ist der möglichst frühe Beginn oder die Fortsetzung einer intensiven Statintherapie ohne Berücksichtigung der Ausgangs-LDL-C-Werte empfohlen (I/A). Die Lipidwerte sollten nach 4-6 Wochen in Bezug auf LDL-C-Senkung ≥ 50% und Zielwert < 1.4 mmol/l kontrolliert werden. Dabei sollten Sicherheitsaspekte beachtet und entsprechende Dosisanpassungen vorgenommen werden (IIa/C). Bei Nichterreichen der Zielwerte ist eine Kombination mit Ezetimibe empfohlen (I/B). Falls nach 4-6 Wochen der LDL-C-Zielwert trotz maximal tolerierter Statindosierung und Ezetimibe nicht erreicht wird, ist die Zugabe eines PCSK9-Inhibitors empfohlen (I/B). Bei Patienten mit Statinintoleranz oder wenn ein Statin kontraindiziert ist, sollte Ezetimibe in Betracht gezogen werden (IIa/C). Wenn der LDL-C-Zielwert nicht erreicht wird trotz maximal tolerierter Statindosis plus Ezetimibe, sollte die Zugabe eines PCSK9-Inhibitors möglichst früh nach dem Ereignis (wenn möglich während der Hospitalisierung) erwogen werden (IIa/C).
Patienten unter PCI
Routinemässige Vorbehandlung oder Aufladen mit Hochdosis-Statintherapie sollte bei Patienten, die sich einer PCI unterziehen, in Betracht gezogen werden (IIa/B).
Patienten mit vorhergehendem Schlaganfall
Patienten nach Schlaganfall oder TIA haben ein sehr hohes Risiko für ASCVD, insbesondere erneuten ischämischen Schlaganfall. Deshalb ist eine intensive LDL-C-Senkungstherapie empfohlen (I/A).
Patienten mit schwerer chronischer Nierenerkrankung (KDOQI- Stadien 3-5)
Patienten mit KDOQI-Stadien 3-5 werden als mit hohem bis sehr hohem Risiko für ASCVD betrachtet (I/A). Die Verwendung von Statinen oder die Kombination Statin/Ezetimibe werden bei Patienten mit nicht Dialyse-abhängiger chronischer Nierenerkrankung Stadium 3-5 empfohlen (I/A). Falls die Patienten bei Dialysebeginn bereits auf Therapie mit Statinen, Ezetimibe oder Statin/Ezetimibe- Kombination sind, sollte die Weiterführung dieser Therapie in Betracht gezogen werden, insbesondere bei Patienten mit ASCVD (IIa/C). Bei Patienten mit Dialyse-abhängiger Nierenerkrankung ohne ASCVD ist dagegen eine Statintherapie nicht empfohlen (III/A).
Prof. Dr. Dr. h.c. Walter F. Riesen
AFIRE-Studie: Rivaroxaban bei AF-Patienten mit stabiler KHK
Die Leitlinie empfiehlt bisher bei AF-Patienten mit einer KHK für 1 Jahr nach einem akuten Ereignis die Kombination eines oralen Antikoagulanz mit einem Plättchenhemmer, danach bei stabiler Erkrankung nur eine orale Antikoagulation. Im Rahmen dieser randomisierten Studie wurde bei AF-Patienten mit einer stabilen KHK eine Rivaroxaban-Monotherapie (10 oder 15 mg täglich) mit der Kombination Rivaroxaban plus einem Plättchenhemmer verglichen. Dabei erwies sich bei einem zweijährigen Follow up die NOAK-Monotherapie im Hinblick auf kardiovaskuläre Ereignisse und die Gesamtmortalität der Kombination als nicht unterlegen (5,75% pro Patientenjahr unter der Kombination vs. 4,14% pro Patientenjahr unter Monotherapie; HR:0,72) und, was grössere Blutungsereignisse betrifft, sogar als überlegen (2,76% pro Patientenjahr vs. 1,62% pro Patientenjahr; HR: 0,59) (Satoshi Yasuda, Suita). PS
GALACTIC-Studie: Vasodilatatoren bei akuter kardialer Dekompensation
Bei der Therapie der akuten kardialen Dekompensation mit Lungenstauung ist eine rasche Vasodilatation aus symptomatischen Gründen unverzichtbar. Doch wie intensiv und wie lange sollte diese Therapie durchgeführt werden? Kann durch eine intensivere und längere Gabe des Vasodilatators die Prognose verbessert werden? Dieser Frage wurde im Rahmen der GALACTIC-Studie nachgegangen. Die Patienten erhielten randomisiert Vasodilatatoren (Nitrate, Hydralazin, ACE-Hemmer, AT1-Blocker, ARNI) in konventioneller Dosierung oder in höherer Dosierung und über eine längere Zeit. Das Ergebnis ist enttäuschend: Die intensive Strategie verbesserte weder das Gesamtüberleben noch das Risiko für eine erneute Krankenhausbehandlung wegen einer akuten Dekompensation (Christian Müller, Basel). PS
SYNTAX-Studie: Bypass vs. PCI bei Mehrgefässerkrankung
Bei dieser Studie handelt es sich um die erste grosse Studie, in der bei 1 800 Patienten mit einer koronaren Mehrgefässerkrankung bzw. Hauptstammstenose in einem randomisierten Design die operative mit der interventionellen (Paclitaxel-DES) Therapie verglichen wurde. Bei früheren Auswertungen hatte es keinen eindeutigen Sieger gegeben, d.h. die Lebenserwartung im Gesamtkollektiv war gleich. Nur Patienten mit einer 3-Gefäss-Erkrankung profitierten prognostisch von der Bypass-Operation. Bei Patienten mit einer Hauptstammstenose gab es keinen signifikanten Unterschied.
Jetzt wurden die 10-Jahresdaten der SYNTAX-Studie vorgestellt. Auch nach dieser Zeit waren die Überlebensdaten vergleichbar. Die Gesamtmortalität in der DES-Gruppe betrug 27%, in der Bypass-Gruppe 23,5% (HR: 1,17; p=0,092). Doch Patienten mit einer 3-Gefässerkrankung profitierten weiterhin prognostisch von der Operation (Gesamtmortalität bei PCI 27,7% vs. 20,6% bei Bypass; HR: 1,41; p=0,006). Bei der Hauptstammstenose ergab sich auch nach diesem langen Follow up kein signifikanter Unterschied (Gesamtmortalität 26,1% bei PCI vs. 26,7% bei Bypass; HR: 0,90; p=0,47) (Daniel JF Thuijs, Rotterdam). PS
HOPE 4-Studie: Interventionsprogramm für die KHK-Prävention
Eine frühe Erkennung der modifizierbaren kardiovaskulären Risikofaktoren mit entsprechenden Veränderungen des Lifestyle und einer konsequenten medikamentösen evidenzbasierten Therapie reduziert das KHK-Risiko stärker als erwartet. Die Umsetzung dieser Empfehlung brachte in der HOPE 4-Studie eine Risikoreduktion von 40% in 10 Jahren. Im Vergleich zu einer Kontrollgruppe führte die intensive Intervention nämlich zu einer Abnahme des Risikos von 11,17% auf 6,4% (p < 0,0001) (Jon-David Schwalm, Hamilton). PS