Die Thrombozytose stellt mit ihrem sehr breiten Ursachenspektrum aus zahlreichen reaktiven aber auch primär neoplastischen Erkrankungen eine ernst zu nehmende und stets abklärungsbedürftige Blutbildveränderung dar. Dieser Artikel legt den Fokus auf die ersten, weichenstellenden diagnostischen Schritte in der Abklärung einer Thrombozytose. Anhand des klinischen Kontextes sowie laboranalytischer Basisabklärungen sollen einerseits reaktive Ursachen identifiziert, andererseits Hinweise auf eine primäre Thrombozytose («red flags») erkannt werden, um den Patienten einer hämatologischen Abklärung zuzuführen.
Die Thrombozytose ist eine sehr häufige, typischerweise im Sinne eines Zufallsbefundes nachgewiesene Laborabnormität, stellt aber keine Diagnose dar. Sie wird bei gut einem Drittel der intensivpflichtigen Patienten und einem Fünftel der Traumapatienten verzeichnet (1, 2). Obwohl im ambulanten setting etwas weniger prävalent (3), hat sie als möglicher Hinweis auf ein zugrundeliegendes solides Malignom oder aber eine primär hämatologische Neoplasie einen hohen klinischen Stellenwert.
Unter einer Thrombozytose versteht man einen Thrombozytenwert, der den oberen Normwert übersteigt (4). Eine einheitliche numerische Definition hingegen existiert nicht, dies nicht zuletzt aufgrund unterschiedlicher Analysegeräte und ungenügender Validierung der Normwerte. In der Literatur findet sich häufig ein oberer Grenzwert von 450G/l (5, 6), wobei ein Wert unterhalb dieses cutoffs eine hämatologische Stammzellerkrankung nicht auszuschliessen vermag. Bei uns am Luzerner Kantonsspital kommt der obere Normwert mit 330G/l deutlich tiefer zu liegen. In Anbetracht dessen erachten wir anstelle einer strikten numerischen Grenze die Zusammenschau aus Thrombozytenwert und klinischem Kontext («red flags», siehe unten) als essentielle Grundlage für das Einleiten allfälliger weiterführender Abklärungen.
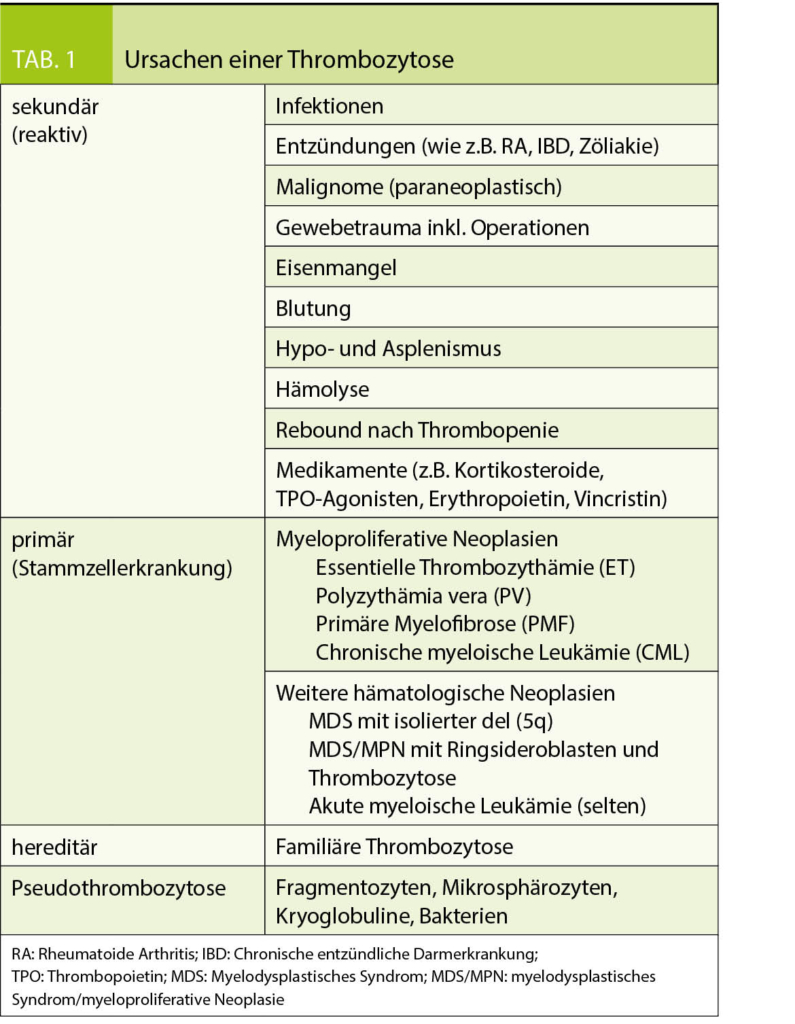
Häufige Ursachen der Thrombozytose
Sekundäre (reaktive) Thrombozytose
Die Differentialdiagnose der Thrombozytose beinhaltet primäre sowie sekundäre (reaktive) Ursachen, wobei die reaktiven Ursachen über alle Altersgruppen hinweg deutlich überwiegen. In einer Serie von 732 medizinischen und chirurgischen Patienten waren 88% der Thrombozytosen (Thrombozyten > 500G/l) reaktiver Natur (4), ähnlich auch in einer Serie von 91 Patienten, in welcher 70% der Thrombozytosen (Thrombozyten > 600G/l) einer sekundären Ursache zugeordnet werden konnten (7). Etwas erstaunlich lässt auch das Ausmass der Thrombozytose keine klaren Schlüsse auf deren Ätiologie zu, so liess sich in einer Serie von 280 hospitalisierten Patienten mit extremer Thrombozytose (Thrombozyten > 1000G/l) bei ebenfalls 82% ein ursächlich reaktiver Prozess eruieren (11).
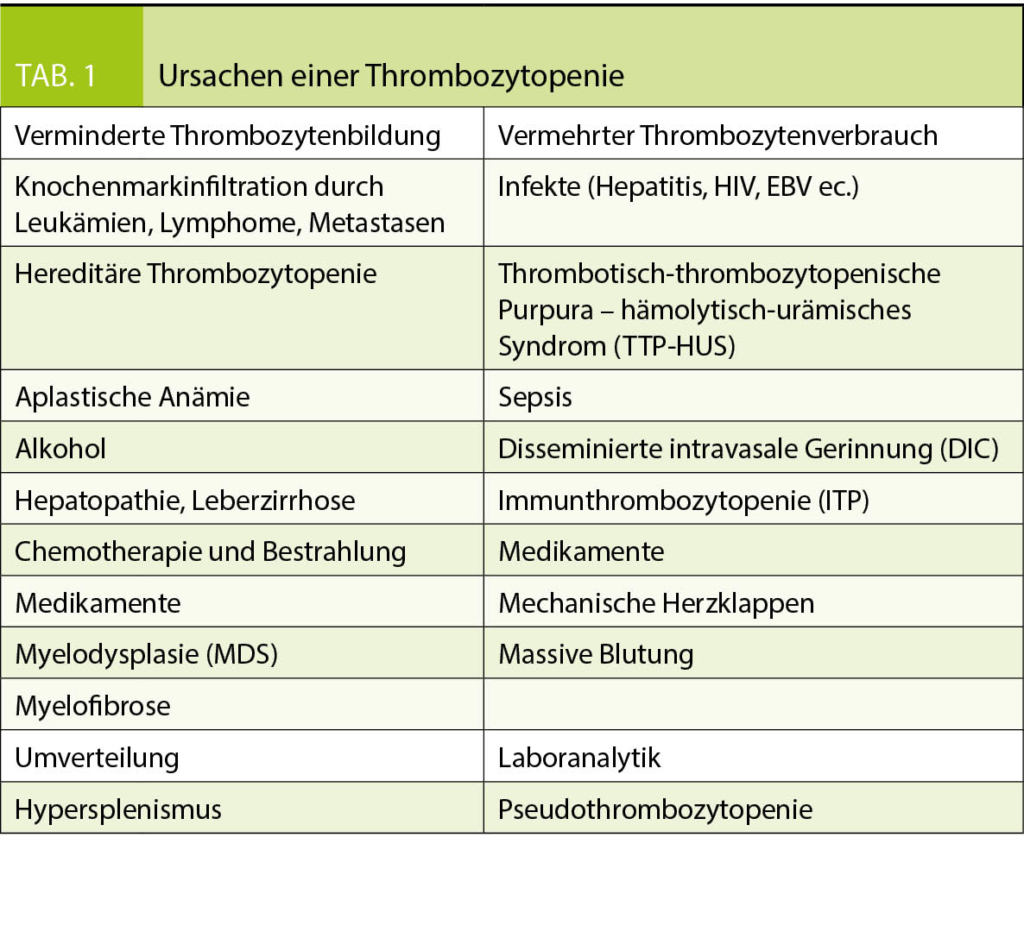
Die häufigsten reaktiven Ursachen sind (4-7): Gewebetrauma inkl. vorausgehende Operationen, Infekte und (chronische) Entzündungen, Neoplasien, Eisenmangel und Hypo-/Asplenismus (siehe auch Tab. 1).
Bei den meisten Patienten sind klinische Zeichen einer der Thrombozytose zugrundeliegenden systemischen Erkrankung vorhanden. Jedoch können auch subklinische Erkrankungen eine reaktive Thrombozytose triggern, wobei an dieser Stelle insbesondere auf okkulte solide Neoplasien hingewiesen werden soll.
In einer gross angelegten prospektiven Kohortenstudie (Patienten der Grundversorgung > 40Jahre) musste bei 11.6% resp. 6.2% der Männer und Frauen mit Thrombozytose im nachfolgenden Jahr die Diagnose eines soliden Tumors gestellt werden (was einem positiv prädiktiven Wert vergleichbar demjenigen einer Hyperkalzämie entspricht). Insbesondere Lungen- und kolorektale Karzinome wurden bei Patienten mit Thrombozytose überproportional häufig diagnostiziert, wobei über ein Drittel dieser Fälle nebst der Thrombozytose keine anderweitig relevanten Symptome aufwies. Auch weitere Daten (10) legen nahe, dass die Thrombozytose ein nicht zu unterschätzender Risikomarker für eine (okkulte) Neoplasie darstellt. Darüber hinaus wird postuliert, dass die Thrombozytose nicht nur als reines Epiphenomen zu betrachten ist, sondern das Tumorwachstum per se fördert und z.B. beim Ovarialkarzinom einen prognostisch ungünstigen Risikofaktor darstellt (12).
Primäre Thrombozytose
Die häufigste Ursache einer primären Thrombozytose ist die Essentielle Thrombozythämie (ET), welche sich häufig als isolierte Thrombozytose manifestiert. Die ET gehört zu den myeloproliferativen Neoplasien (MPN), einer Gruppe von hämatologischen Stammzellerkrankungen, welche durch eine vermehrte Produktion reifer Blutzellen charakterisiert wird. Aus dieser Gruppe kann sowohl die Polyzythämia vera (PV, charakterisiert durch eine Polyglobulie), die rimäre Myelofibrose (PMF, charakterisiert durch Anämie, Splenomegalie und Nachweis unreifer Vorstufen im peripheren Blut [leukoerythroblastäres Blutbild]) wie auch die chronische myeloische Leukämie (CML, charakterisiert durch eine Leukozytose mit Linksverschiebung bis zum Blasten) ebenfalls mit einer Thrombozytose vergesellschaftet sein, meist liegen aber die zusätzlich charakteristischen diagnostischen Befunde der jeweiligen Erkrankung vor. Insbesondere bei älteren Patienten ist bei Nachweis einer Thrombozytose und gleichzeitiger Anämie (häufig makrozytär) differentialdiagnostisch an ein myelodysplastisches Syndrom (MDS) oder aber ein overlap aus myelodysplastischem Syndrom und myeloproliferativer Neoplasie (ein sogenanntes MDS/MPN) zu denken, wobei der Blutausstrich wichtige diesbezügliche Hinweise liefert (dysplastische Veränderungen einer oder mehrerer Blutreihen sind häufig bereits im Blutausstrich zu sehen). Selten kann auch eine akute myeloische Leukämie mit einer Thrombozytose einhergehen. Die Ursachen der primären Thrombozytose sind in Tabelle 1 zusammengefasst.
Die familiären Thrombozytosen sind sehr seltene, hereditäre Erkrankungen, welche bei auffälliger Familienanamnese in Betracht gezogen werden.
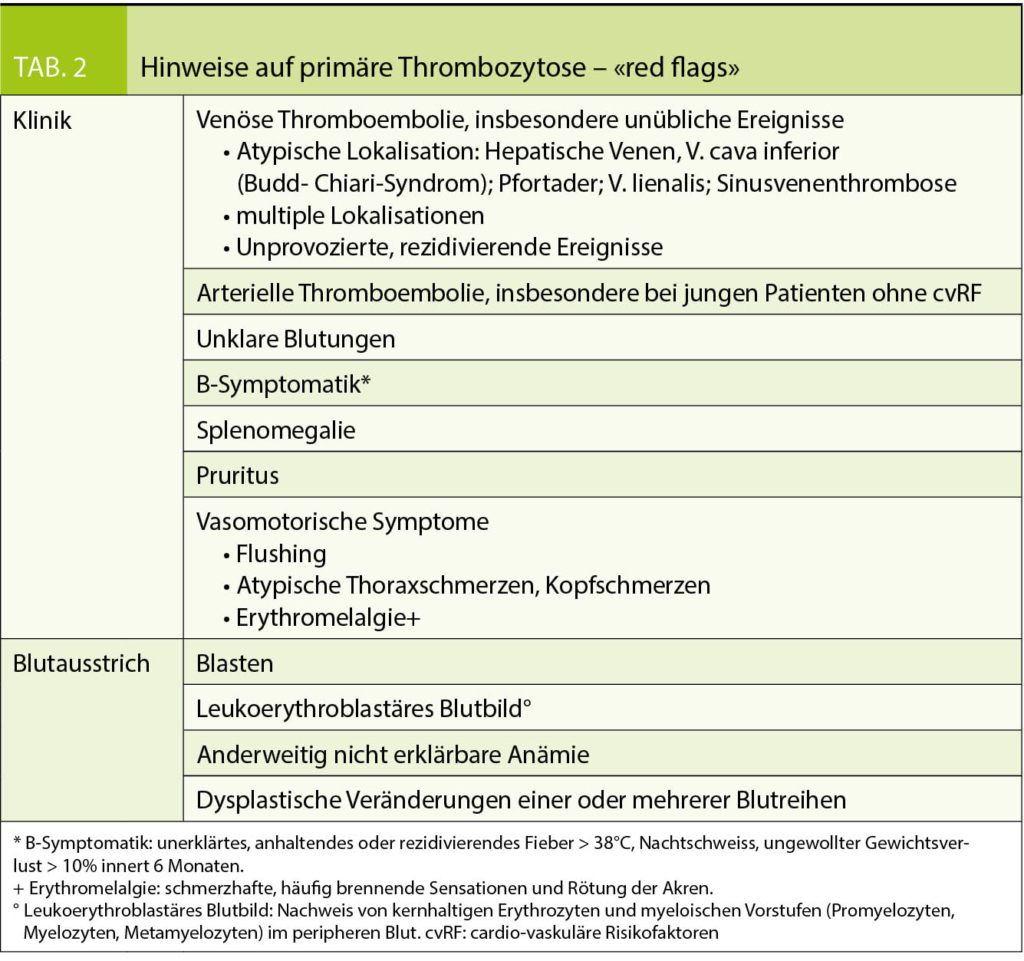
Hinweise auf eine primäre Thrombozytose – «red flags»
Sowohl anhand des klinischen Kontexts wie auch begleitender Blutbildveränderungen lassen sich wichtige Hinweise auf eine primäre Thrombozytose identifizieren (hier «red flags» genannt, siehe Tab. 2). Diese werden im Folgenden etwas genauer beleuchtet:
Ein äusserst bedeutsamer klinischer Hinweis sind thromboembolische und hämorrhagische Ereignisse. Patienten mit einer MPN zeigen paradoxerweise sowohl ein deutlich erhöhtes Thrombose- wie auch Blutungsrisiko. Gemäss verschiedenen Studien liegt bei Erst-diagnose bei 19-39% der PV-, bei 7-26% der ET- und bei 7-22% der PMF-Patienten ein thromboembolisches Ereignis vor. Mit einem Anteil von ca. 2/3 überwiegen die arteriellen gegenüber den venösen Ereignissen, wobei überwiegend die grossen Gefässe betroffen sind (zerebrale, koronare und periphere Gefässe, Häufigkeit in absteigender Reihenfolge) (14). Auf der venösen Seite ist die atypische Lokalisation (abdominal [Budd-Chiari-Syndrom, Pfortaderthrombosen, Mesenterialvenenthrombosen], Sinusvenen) charakteristisch, so lassen sich ca. 40% aller abdominalen Thrombosen auf eine MPN zurückführen (15). Ebenfalls ist multiplen simultanen sowie rezidivierenden und unprovozierten thromboembolischen Ereignissen eine erhöhte Aufmerksamkeit zu schenken.
Das erhöhte Risiko für Hämorrhagien (Gesamt-inzidenz schwerer Blutungen gut 5%) (14) wird zumindest teilweise auf ein erworbenes von Willebrand Syndrom zurückgeführt, wobei von einem Thrombozytose-bedingten selektiven Verlust hämostatisch sehr aktiver hochmolekularer von Willebrand Moleküle ausgegangen wird (9, 15). Obwohl die Laborkonstellation eines erworbenen von Willebrand Syndromes ebenfalls bei reaktiver Thrombozytose verzeichnet werden kann, sind spontane Blutungen in diesem Kontext äusserst selten (9).
Im Weiteren stellen B-Symptomatik, vasomotorische Symptome wie flushing, Kopf- oder atypische Thoraxschmerzen, Erythromelalgie (schmerzhafte, häufig brennende Sensationen und Rötung der Akren), Pruritus sowie eine Splenomegalie (kann sich klinisch als abdominaler Dyskomfort manifestieren) weitere klinische «red flags» dar.
Zu den laboranalytischen Hinweisen zählen: Nachweis von Blasten, ein leukoerythroblastäres Blutbild (kernhaltige Erythrozyten und myeloische Vorstufen im peripheren Blut) sowie der Nachweis dysplastischer Veränderungen im Blutausstrich.
Diagnostisches Vorgehen in der hausärztlichen Praxis
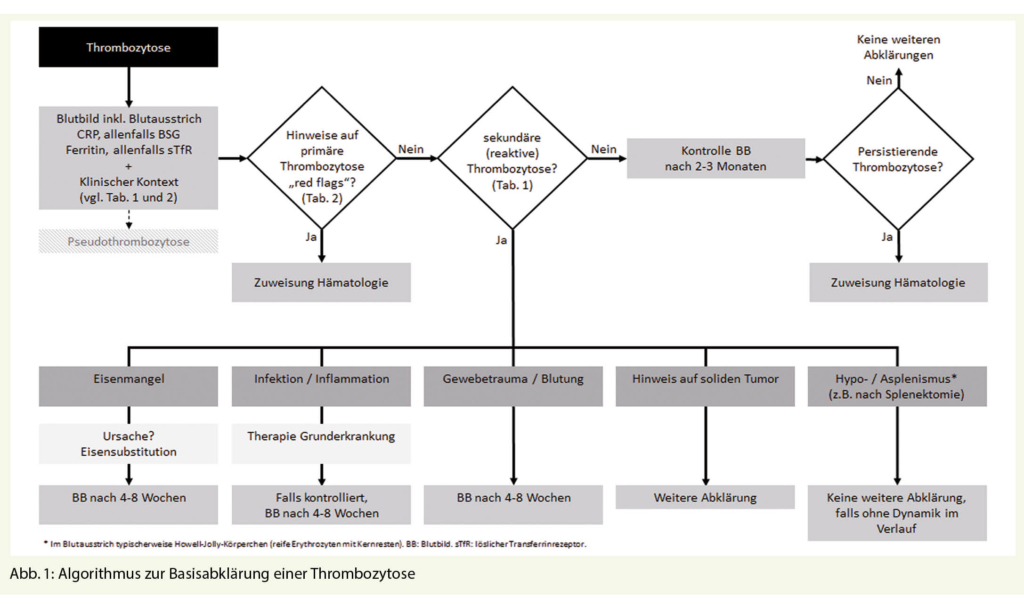
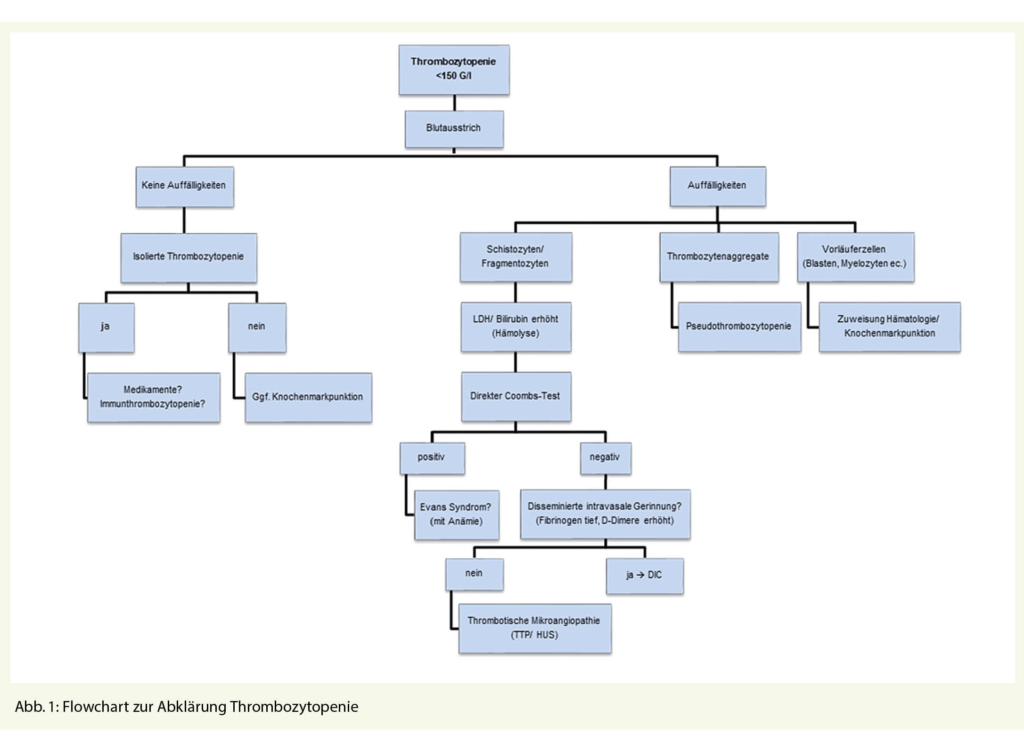
Ein einfacher, auf die Grundversorgung ausgelegter Algorithmus zur laboranalytischen Basisabklärung einer Thrombozytose ist in Abbildung 1 dargestellt. In einem ersten Schritt soll zum einen ein Blutbild mit manueller Blutbilddifferenzierung und laboranalytischen Basisabklärungen (CRP, allenfalls BSG; Ferritin und allenfalls löslicher Transferrinrezeptor) veranlasst werden und zum anderen eine Erörterung des klinischen Kontextes (siehe Tab. 1 und 2) erfolgen. Aufgrund der Möglichkeit einer paraneoplastischen Genese sollte insbesondere bei älteren Patienten Wert auf eine sorgfältige Anamnese hinsichtlich gastrointestinaler oder pulmonaler Beschwerden, Noxen und eine Familienanamnese erfolgen. Zudem ist eine klinische Untersuchung unerlässlich (Splenomegalie? Erythromelalgie?). Bei Rauchern empfehlen wir in diesem setting überdies niederschwellig eine pulmonale Bildgebung und bei Patienten > 50 Jahre eine Screening-Kolonoskopie.
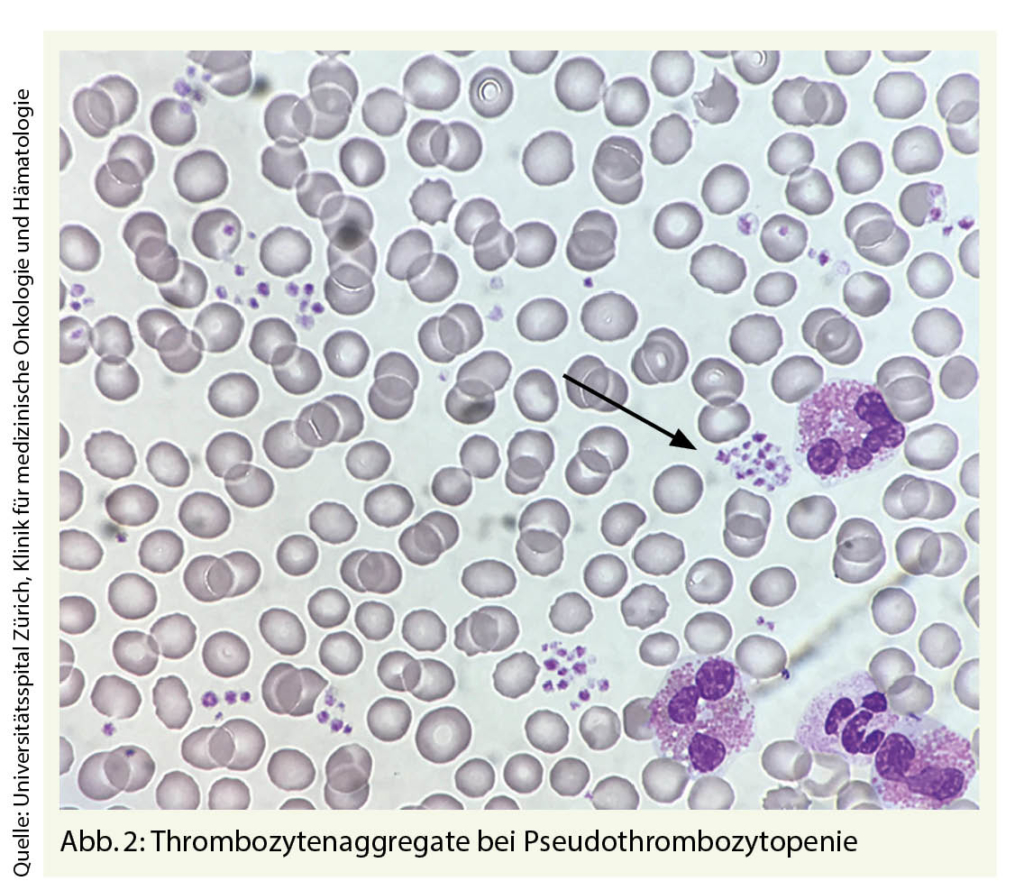
Nach Ausschluss einer Pseudothrombozytose (durch das Analysegerät fälschlicherweise als Thrombozyten erkannte Zellfragmente) erlauben diese einfachen Massnahmen auf der einen Seite die «red flags» zu erkennen und auf der anderen Seite ein breites Spektrum an Ursachen einer reaktiven Thrombozytose zu identifizieren.
Bei Vorliegen von «red flags» ist eine weiterführende hämatologische Abklärung an-gezeigt. Im Falle eines Blastennachweises im Blutbild sollte diese bald erfolgen.
Bei reaktiver Thrombozytose mit transientem Stimulus ist eine Blutbildverlaufskontrolle zur Bestätigung der Normalisierung der Thrombozytenzahl empfohlen.
Ergeben die Abklärungen weder einen Hinweis auf eine reaktive Thrombozytose noch liegen «red flags» vor, empfehlen wir eine Verlaufskontrolle nach 2-3 Monaten und bei Thrombozytosepersistenz ebenfalls eine hämatologische Abklärung.
Therapeutisches Management bei reaktiver Thrombozytose
Die Therapie einer reaktiven Thrombozytose besteht in erster Linie in der Behandlung der Grunderkrankung.
Im Gegensatz zur breiten Anwendung bei Patienten mit MPN ist der Einsatz von Aspirin bei reaktiver Thrombozytose sehr umstritten. Es gibt weder kontrollierte klinische Studien noch Beobachtungsstudien, welche den Nutzen von Aspirin in diesem Kontext belegen. Die Thrombozytose per se scheint das Thromboserisiko nicht relevant zu erhöhen, gleichzeitig vorhandene prothrombogene Faktoren beeinflussen das Thromboserisiko jedoch durchaus (8, 9).
In diesem Spannungsfeld empfehlen wir klar, von einem generellen Einsatz von Aspirin bei reaktiver Thrombozytose abzusehen. Ein allfälliger Behandlungsentscheid soll nur individualisiert unter Abwägung von Blutungs- und Thromboserisiko erfolgen.
Abteilung für Hämatologie
Luzerner Kantonsspital Luzern
6000 Luzern 16
sabine.ruosch@luks.ch
Abteilung für Hämatologie
Luzerner Kantonsspital Luzern
6000 Luzern 16
Es bestehen keine Interessenskonflikte im Zusammenhang mit diesem Beitrag.
1. Banach M, et al. Etiology and clinical relevance of elevated platelet count in ICU patients: A retrospective analysis. Med Klin Intensivmed Notfmed. 2018 Mar;113(2):101-107
2. Valade N, et al. Thrombocytosis after Trauma: incidence, aetiology, and clinical significance. Br J Anaesth. 2005 Jan;94(1):18-23.
3. Bailey SE, et al. Clinical relevance of thrombocytosis in primary care: a prospective cohort stud of cancer incidence using English electronic medical records and cancer registry data. Br J Gen Pract. 2017 Jun;67(659):e405-e413.
4. Griesshammer M, et al. Aetiology and clinical significance of thrombocytosis: analysis of 732 patients with an elevated platelet count. J Intern Med. 1999 Mar;245(3):295-300
5. Schafer AI. Thrombocytosis. N Engl J Med 2004 Mar 18; 350(12):1211-1219
6. Harrison CN, et al. Guidelines for investigation and management of adults and children presenting with a thrombocytosis. Br J Haematol. 2010 May;149(3):352-75.
7. Tefferi A, et al. Plasma Interluekin-6 and C-reactive protein levels in reactive versus clonal thrombocytosis. Am J Med 1994; 97:374-378.
8. Alberio L. Do we need antiplatelet therapy in thrombocytosis? Pro. Diagnostic and pathophysiologic considerations for a treatment choice. Hamostaseologie. 2016 Nov 7;36(4):227-240
9. Scharf RE. Do we need antiplatelet therapy in thrombocytosis? Contra. Proposal for an individualized risk-adapted treatment. Hamostaseologie. 2016 Nov 7;36(4):241-260
10. Bailey SE, et al. How useful is thrombocytosis in predicting an underlying cancer in primary care? a systematic review. Fam Pract. 2017 Feb;34(1):4-10
11. Buss DH, et al. Occurrence, etiology, and clinical significance of extreme Thrombocytosis: a study of 280 cases. Am J Med 1994 Mar;96(3):247-253
12. Stone RL, et al. Paraneoplastic thrombocytosis in ovarian cancer. N Engl J Med. 2012 Feb 16;366(7):610-8
13. Arber DA, et al. The 2016 revision tot he World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016 May 19;127(20):2391-405.
14. Casini A, et al. Thrombotic complications of myeloproliferative neoplasms: risk assessment and risk-guided management. J Thromb Haemost. 2013 Jul;11(7):1215-27.
15. Kreher S, et al. Prophylaxis and management of venous thromboembolism in patients with myeloproliferative neoplasms: consensus statement of the Haemostasis Working Party of the German Society of Hematology and Oncology (DGHO), the Austrian Society of Hematology and Oncology (ÖGHO) and Society of Thrombosis and Haemostasis Research (GTH e.V.). Ann Hematol (2014) 93:1953–1963.