Europäischer Hämatologie-Kongress:
«Hochinteressante Perspektiven für die Zukunft»
Die Kollegen von den Universitätsspitälern Zürich, Basel und vom Kantonsspital Winterthur haben für info@onkologie den EHA besucht und berichten über die Highlights:
Myeloische Neoplasien
PTX-2 bei Myelofibrose
Die therapeutische Landschaft bei Myelofibrose unterscheidet sich bezüglich JAK-Inhibitoren und Therapien, welche unabhängig von der JAK-STAT-Signalübertragung wirken. In dieser Phase-II-Studie wird die Wirkung von rekombinantem Pentraxin-2 (PTX-2, PRM-151) untersucht bei Patienten, welche auf den zugelassenen JAK-Inhibitor Ruxolitinib nicht mehr ansprechen oder bei Patienten, welche für eine solche Therapie nicht Frage kommen.
PTX-2 hemmt die Differenzierung von Monozyten in sogenannte Fibrozyten, welche zur Myelofibrose beitragen. Bei Patienten mit Myelofibrose ist die Serum-Konzentration von PTX-2 tief. In einem Mausmodell für Myelofibrose wurde gezeigt, dass die Zugabe von PTX-2 zu einem Rückgang der Myelofibrose und verbessertem Überleben führen kann.
In dieser Dosisfindungsstudie wurde die Wirkung 3 verschiedener PTX-2 Dosierungen bei 97 Patienten untersucht. Der primäre Endpunkt war der Rückgang der Knochenmarkfibrose. Insgesamt konnte bei knapp 30% aller untersuchten Patienten eine Reduktion der Fibrose dokumentiert werden, wobei die höchste Dosis nicht wirksamer war als die anderen Dosierungen. Bei ca. 40% der Patienten konnte eine 50-prozentige Reduktion der Erythrozytentransfusionen erreicht werden und 16% wurden transfusionsunabhängig. Interessanterweise korrelierte ein Hämoglobin-Anstieg mit einer Reduktion der Fibrose. Bei ca. 60% der Patienten konnte eine 50-prozentige Reduktion der Thrombozytentransfusionen erreicht werden. Dabei wurden knapp 50% der Patienten transfusionsunabhängig. Im Gegensatz zur Erythropoiese korrelierte ein Anstieg der Thrombozyten nicht mit einer Reduktion des Fibrosegrades. Ähnlich wie unter JAK-Inhibitoren konnte eine Verbesserung der MF-assoziierten Symptome, sowie eine Reduktion der Milzgrösse festgestellt werden.
Aufgrund dieser Daten ist gut vorstellbar, dass PRM-151 als Monotherapie oder in Kombination mit einem JAK-Inhibitor bei Patienten mit Myelofibrose in Zukunft eingesetzt werden wird.
Quelle: Verstovsek S et al. A randomized, double blind phase 2 study of 3 different doses of PRM-151 in patients with myelofibrosis who were previously treated with or ineligible for Ruxolitinib. EHA Congress 2019, Abstract S828, 24th EHA Congress, 2019, Amsterdam, NL
Gilteritinib bei refraktärer AML
Die ADMIRAL-Studie untersucht die Wirkung eines FLT3-Inhhibitors der neuen Generation (Gilteritinib) bei Patienten mit rezidivierter oder refraktärer akuter myeloischer Leukämie (AML). Gilteritinib, im Vergleich zum zugelassenen Midostaurin, ist spezifischer für die FLT3-Kinase und wirkt auch bei AML mit FLT3-Mutationen in der Tyrosinkinasedomäne.
In dieser Phase-3-Studie wurde die Wirkung von Gilteritinib gegenüber einer Salvage-Chemotherapie in einer 2:1-Randomisierung verglichen. Die Salvage-Chemotherapie war in ca. 2/3 der Fälle eine intensive Therapie (MEC, Mitoxantron, Etoposid, Cytarabin oder FLAG-IDA, Fludarabin, Cytarabin, Idarubicin). Auch eine hypomethylierende Therapie war aber möglich (ca. 1/3 der Patienten). Patienten konnten nach der Gilteritinib oder Salvage-Chemotherapie einer konsolidierenden allogenen hämatopoietischen Stammzelltransplantation (allo-HSZT) zugeführt werden. Eine Erhaltungstherapie mit Gilteritinib nach allo-HSZT war ebenfalls möglich. Die primären Endpunkte waren das Gesamtüberleben (OS) und die Rate kompletter Remissionen (CR).
Entsprechend der Randomisierung erhielten 247 Patienten Gilteritinib und 124 eine Salvage-Chemotherapie. Zum Zeitpunkt der Präsentation waren 38 Patienten im Gilteritinib-Arm und keine Patienten im Salvage-Chemotherapie-Arm noch in der Studie. Dabei war die Rate kompletter Remissionen im Gilteritinib-Arm doppelt so hoch wie im Chemotherapie-Arm (21% vs. 11%). Das widerspiegelte sich auch in einer deutlich höheren Zahl an mit allo-HSZT behandelten Patienten im Gilteritinib-Arm (26% vs. 15%). Das OS war mit Gilteritinib fast doppelt so lange wie mit Chemotherapie (9.3 Monate vs. 5.6 Monate, p=0.0007). Bemerkenswert ist auch, dass die Erhaltungstherapie nach allo-HSZT mit Gilteritinib das OS signifikant (p=0.024) verlängerte. Die häufigsten Nebenwirkungen in der gesamten Kohorte waren febrile Neutropenie, Anämie und Pyrexie. Grad ≥3 Nebenwirkungen unter Gilteritinib waren v.a. Anämie, febrile Neutropenie und Thrombozytopenie.
Diese Studie zeigt, dass in Zukunft Gilteritinib eine attraktive Alternative zur Salvage-Chemotherapie bei AML mit FLT3-Mutation sein wird. Hinzu kommt, dass Gilteritinib eine orale Therapie ist, welche eine ambulante Betreuung der Patienten ermöglicht.
PD Dr. med.Alexandre Theocharides
Klinik für medizinische Onkologie und Hämatologie, Universitätsspital Zürich
Quelle: Perl A et al. Gilteritinib significantly prolongs overall survival in patients with FLT3-mutated (FLT-MUT+) relapsed/refractory (R/R) acute myeloid leukemia (AML): Results from the phase 3 ADMIRAL Trial.EHA Congress 2019, abstract S876, 24th EHA Congress, 2019, Amsterdam, NL
HD16-Studie: PET-basierte Therapie-Stratifizierung im Frühstadium des Hodgkin Lymphoms
Die HD16-Studie untersuchte eine PET-basierte Therapie-Stratifizierung im Frühstadium des HL (Stadium IA ausser LPHD, IB, IIA, IIB ohne einen der folgenden Risikofaktoren: grosser Mediastinaltumor; Extranodalbefall; hohe BSG; >/= 3 befallene Lymphknotenareale). Die Patienten erhielten 2 Zyklen ABVD, anschliessend erfolgte eine FDG-PET/CT-Untersuchung. Im Standardarm erhielten Alle eine 20Gy IF-Bestrahlung (IF-RT). Im experimentellen Arm erhielten nur die PET-positiven Patienten, definiert durch einen Deauville score (DS) ≥3, eine Bestrahlung. Die Ergebnisse, die am ASH 2018 präsentiert wurden, zeigten eine Überlegenheit des Standardarmes in Bezug auf das PFS. Die konsolidierende Bestrahlung gehört also auch im Frühstadium des HL weiterhin zum Therapiestandard.
Am EHA wurden die Ergebnisse der Subanalyse gezeigt. Diese untersuchte, ob mittels Interim PET unter den Patienten, die mit Radiochemotherapie (RCT) behandelt werden (alle Patienten aus dem Standardarm und PET-positive im experimentellen Arm) ein Risikokollektiv identifizierbar ist und ob sich eine Assoziation zwischen Interim DS und Baseline Charakteristika herstellen lässt. Zudem wurde das Outcome mit unterschiedlichen DS-Cut-offs untersucht.
Von den 1007 randomisierten Patienten hatten im Interim PET 667 (66%), 218 (22%) bzw. 122 (12%) einen DS von 1-2, 3 und 4. Von den 693 Patienten, die eine RCT erhielten, hatten 353, 218 bzw. 122 einen DS von 1-2, 3 bzw. 4. Ein Stadium II und ein Tumorbulk waren mit einem ungünstigen DS im Interim PET assoziiert. Eine CT-basierte CR nach der IF-RT fand sich bei 344/348 (99%) der Patienten mit einem Interim DS von 1-2, bei 209/214 (98%) mit DS3, und bei 108/117 (92%) mit DS4 (p=0.016 für DS1-2 vs. 3-4; p=0.0012 für DS1-3 vs. 4). Bei einem medianen FU von 46 Monaten betrug das geschätzte 5-Jahres-PFS 93.2% (90.2–96.2) bei Patienten mit DS1-2, 92.8% (88.8–96.9) bei solchen mit DS3 und nur 80.9% (72.2–89.7) in der Gruppe mit DS4. Bei einem DS ≥3 als Cut-off war die Differenz des PFS nicht signifikant (HR 1.73 [0.99–3.02], p=0.055). Bei einem DS4 als Cut-off wird die Differenz deutlicher mit einem 3-fachen Risiko für ein Therapieversagen bei Patienten mit einem DS4 nach RCT (HR 2.94 [1.63–5.31], p=0.0004). Bezüglich OS zeigten sich keine Differenzen zwischen den Subgruppen (5-Jahres OS 98.2% [96.7–99.8] bei DS1-2, 98.6% [96.0–100] für DS3, 96.5% [92.3–100] für DS4.
Zusammenfassend ist ein positives PET nach 2xABVD bei HL im Frühstadium mit einem grösseren Tumorvolumen assoziiert und stellt für Patienten, die mit Standard-RCT behandelt werden einen Risikofaktor für das PFS dar, dies insbesondere bei einem DS von 4 als Cut-off für die PET-Positivität. Basierend auf diesen Daten sollte der Nutzen einer PET-basierten Therapieintensivierung in dieser Hochrisiko-Subgruppe untersucht werden.
Dr. med. Anouk Widmer,
USZ, Klinik für medizinische Onkologie und Hämatologie
Quelle: Fuchs M et al. (S819) PET after 2 cycles of ABVD in patients with early-stage favorable Hodgkin Lymphoma treated within the phase 3 GHSG HD16 study. Abstract S819:24th EHA Congress, 2019, Amsterdam, NL
CAR T cell Therapie
Therapien mit CAR T Zellen haben in einigen klinischen Anwendungen grosse Therapieerfolge erzielt. Die Therapie kann aber mit schweren Nebenwirkungen wie Cytokine release Syndrome (CRS) und Neurotoxizität verbunden sein. Über andere Nebenwirkungen wie z. Bsp. Infektkomplikationen ist wenig bekannt.
In einer Studie wurden 19-28Z/4-1BBL CAR T Zellen verwendet. Dabei handelt es sich um eine neuere Generation der CAR T Zellen, von der eine bessere Expansion und ein längeres Überleben erwartet wird. Patienten mit rezidivierten/therapierefraktären Non Hodgkin Lymphomen (DLBCL, Follikuläres Lymphom, M. Waldenström, CLL inkl. Richter Transformation) und B-ALL konnten eingeschlossen werden. Die Konditionierung setzte sich aus Cyclophosphamid mit oder ohne Fludarabin zusammen, gefolgt von eskalierenden Dosen von CAR T Zellen. Insgesamt konnten 28 Patienten eingeschlossen werden, nur einer dieser Patienten hatte eine B-ALL. 11 Patienten entwickelten ein CRS, maximal Grad 2. 3 Patienten zeigten schwerwiegende neurologische Komplikationen. Gut die Hälfte der Patienten erreichten eine komplette Remission (57%). Am besten sprachen die Patienten mit DLBCL (CR in 78%) an, am schlechtesten die Patienten mit einer CLL (30%). Mit einem kurzen medianen Follow-up von 169 Tagen sind noch 29% der Patienten in einer CR. Diese Daten zeigen, dass die Therapie mit CAR T Zellen mehrheitlich gut vertragen wird und dass Patienten mit einem DLBCL am besten, und Patienten mit einer CLL am schlechtesten auf die Therapie ansprechen. Eventuell benötigen CLL-Patienten höhere CAR T Zelldosen. Aufgrund der geringen Patientenzahl und kurzen Beobachtungszeit sind die Daten aber mit Vorsicht zu bewerten.
Quelle: Palomba L et al A phase I first-in-human clinical trial of CD19-targeted 19-28Z/4-1BBL «armored» CAR T cells in patiens with relapsed of refractory NHL and CLL including Richter transformation, 24th EHA Congress 2019, Abstract S1634, Amsterdam, NL
Bekannte Nebenwirkungen der CAR T Zelltherapie sind das Cytokine release Syndrom (CRS) und neurologische Komplikationen. Zudem kann es zu Zytopenien, Hypogammaglobulinämie und einer B-Zell-Aplasie kommen. Differentialdiagnostisch ist es bei Fieber nicht einfach, zwischen einem CRS und einer infektiösen Komplikation zu unterscheiden.
Es wurde eine retrospektive Analyse der Fieberepisoden und Infektkomplikationen innerhalb der ersten 30 Tage nach CAR T Zellgabe gezeigt. 29 schwer vorbehandelte Patienten wurden in die Studie eingeschlossen. 69% hatten ein DLBCL. 45 % der Patienten erhielten Tisagenlecleucel, 55% Axicabtagen-Ciloleucel. Das mediane Alter betrug 50 Jahre (23-77). Fast alle Patienten erhielten eine Pneumocystis- und antivirale Prophylaxe. 83% der Patienten entwickelten Fieber, die mediane Zeit bis zum Auftreten des Fiebers war Tag 3 (0-13). 90% Patienten entwickelten innerhalb dieser 30 Tage eine Neutropenie. Die mediane Neutropeniedauer betrug 6 Tage. Ein Keimnachweis gelang in 8 Fieberepisoden bei 4 Patienten. Dabei handelte es sich um 2 Bakteriämien, einmal mit E. faecalis und S. epidermidis bei einer Cholangitis und einmal mit S. epidermidis bei Katheterinfekt. Ein Patient hatte eine Pneumonie mit Nachweis von E. coli, ein weiterer Patient entwickelte eine C. difficile Enteritits. 4 virale Infektionen wurden beobachtet (je eine mit Rhinovirus, Norovirus, CMV Reaktivierung und BK-Zystitis). Es wurden keine Pilzinfektionen dokumentiert.
Zusammenfassend treten febrile Neutropenien häufig auf nach CAR T Zelltherapie. Es ist wichtig, sich bei Fieber an die üblichen diagnostischen und therapeutischen Massnahmen zu halten.
Dr.med. Gayathri Nair
Klinik für medizinische Onkologie und Hämatologie, Universitätsspital Zürich
Quelle: Di Blasi R et al. Infectious complications in patients receiving anti-CD 19 chimeric antigen receptors T cells (CAR T) for diffuse large B cell lymphoma (DLBCL). A monocentric preliminary experience. 24th EHA Congress 2019, Abstract S1641, Amsterdam, NL
Erstlinientherapie des follikulären Lymphoms
Spagat zwischen wissenschaftlicher Evidenz und Patientenpräferenz
An die Erstlinientherapie eines follikulären Lymphoms stellen der behandelnde Arzt und die betroffenen Patienten oft unterschiedliche Ansprüche. Wodurch diese beeinflusst werden und wie passende Lösungen aussehen könnten, wurde von einer Expertengruppe, bestehend aus Dr. med. Miguel Canales (Madrid/S), Prof. Dr. med. Martin Dreyling (München/D), Dr. med. Wendy Osborne (Newcastle upon Tyne/GB) und Prof. Dr. med. Judith Trotman (Auckland/AUS) diskutiert.
Der erste Teil der Diskussion drehte sich um die Gruppe der jungen, neudiagnostizierten Patienten. Dr. Canales stellte dazu den Fall einer 56-jährigen Patientin mit einem follikulären Lymphom (FL) Grad 1 bis 2, Ann Arbor Stadium IV (Knochenmarkbefall, Befall von zervikalen, axillären und inguinalen Lymphknoten sowie abdominaler Tumorbulk) und einem Hb von 11,8g/dl vor. «Unabhängig davon, welchen prognostischen Score wir bei dieser Patientin anwenden, ob FLIPI, FLIPI-2 oder PRIMA-PI, haben wir es hier mit einer Hochrisikopatientin zu tun», erklärte Dr. Canales.
Hohes Risiko, schlechter Verlauf
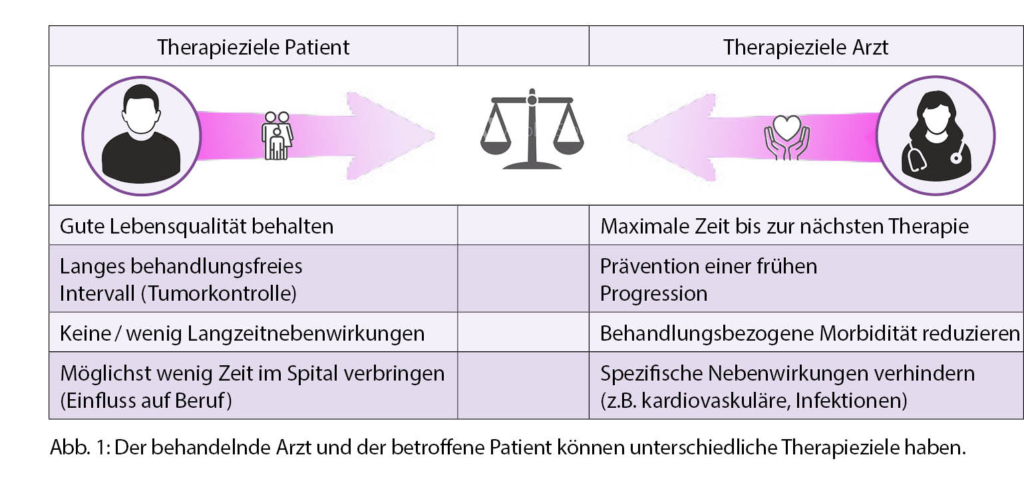
Wie Dr. Canales weiter erläuterte, zeigte eine Arbeit aus Frankreich, dass FL-Patienten, trotz einer Verbesserung im Gesamtüberleben (OS) seit der Einführung von Rituximab, nach wie vor an ihrer Erkrankung sterben und dass Hochrisikopatienten (FLIPI-Score 3 bis 5) eine höhere Lymphom-assoziierte Mortalität aufweisen als Patienten mit einem niedrigen Risiko (FLIPI-Score 0-1) (1). Eine weitere Arbeit ergab, dass das Outcome von Hochrisikopatienten unabhängig davon, welcher Chemotherapie-Partner zusammen mit Rituximab eingesetzt wurde, schlechter war als das von Patienten mit intermediärem oder niedrigem Risiko (2). «Mein Ziel im Management solcher Patienten ist es daher, eine möglichst lange Zeit bis zur nächsten Therapie zu erreichen, eine frühe Progression zu verhindern und die behandlungsbezogene Morbidität möglichst zu minimieren», erklärte Dr. Canales an diesem Punkt der Diskussion (Abb. 1). Für die Patientin sei dagegen nicht nur eine langfristige Tumorkontrolle entscheidend gewesen, sondern auch eine gute Lebensqualität, z.B. durch das Fehlen von Langzeitnebenwirkungen einer Behandlung.
Verschiedene Faktoren beeinflussen Wahl der ersten Therapielinie
Bei der Wahl einer Erstlinientherapie für FL-Patienten gilt es nicht nur, sich zwischen einem der beiden Anti-CD20-Antikörpern – Obinutuzumab oder Rituximab – zu entscheiden, sondern auch den am besten zu einem Patienten passenden Chemotherapiepartner zu wählen. «Dabei spielen Faktoren wie Alter, Tumorbulk, Komorbiditäten, Risiken und die Patientenpräferenz eine Rolle», gab Dr. Canales zu bedenken. Das Langzeitfollow-up der FOLL05 Studie bestätigte bei Patienten mit einem fortgeschrittenen FL mit einer 8-Jahres-OS-Rate von 83% den positiven Effekt einer Immunchemotherapie mit R-CHOP, R-CVP oder R-FM (3). Patienten, die mit R-CVP behandelt worden waren, wiesen ein höheres Risiko für eine Progression auf, verglichen mit den mit R-CHOP behandelten Patienten, sowie ein höheres Risiko dafür, eine weitere Therapie zu benötigen.
In der STiL-Studie wurde die Behandlung mit R-CHOP und R-Bendamustin (B-R) miteinander verglichen (4). Sie zeigte eine signifikant längere Zeit bis zur nächsten Therapie (TTNT) mit B-R im Vergleich zu R-CHOP. Eine Subgruppenanalyse ergab jedoch, dass B-R bei Patienten mit einem Hochrisiko-FLIPI-Score im Vergleich zu R-CHOP zu keinem signifikant besseren progressionsfreien Überleben (PFS) führte.
Frühe Progression verhindern
Eine gepoolte Analyse von über 5 000 FL-Patienten bestätigte, dass eine frühe Krankheitsprogression (progression of disease, POD) bei mit einer Chemoimmuntherapie behandelten Patienten – innerhalb von 24 Monaten nach Diagnose (POD24) – ein robuster Indikator für ein schlechtes OS darstellt (5). Als Faktoren, die eine POD24 begünstigen, wurden dabei das männliche Geschlecht, ein schlechter Performance-Status (> 2), ein hoher FLIPI-Score (3 bis 5) und ein erhöhter β2-Mikroglobulin-Ausgangswert ermittelt. Der Einsatz von Rituximab und Anthrazyklinen war dagegen mit einer späteren Progression assoziiert. «Dies wäre ein Argument dafür, bei meiner Patientin aufgrund ihres höheren Risikos R-CHOP als Erstlinientherapie zu wählen», meinte Dr. Canales. Die GALLIUM Studie jedoch zeigte, dass Obinutuzumab (G) kombiniert mit einer Chemotherapie zu einem signifikant besseren PFS und einer ebenfalls signifikant verbesserten TTNT führte als R-Chemo (6). Der Vorteil von Obinutuzumab blieb dabei unabhängig vom verwendeten Chemotherapieregime (Bendamustin, CHOP, CVP) erhalten (7). Auch bestätigte GALLIUM den negativen Einfluss einer frühen Progression auf das OS (8). Das Risiko für eine POD24 wurde dabei durch G-Chemo im Vergleich zu R-Chemo um 46% reduziert. «Dies ist vielleicht eines der überzeugendsten Argumente, um in der Erstlinientherapie eines follikulären Lymphoms Obinutuzumab statt Rituximab zu wählen. Ich habe mich bei der von mir vorgestellten Patientin denn auch für eine Behandlung mit G-CHOP entschieden», so Dr. Canales. Die Patientin erhielt eine Induktionstherapie mit 6 Zyklen G-CHOP. Das anschliessende PET zeigte ein komplettes Ansprechen (CR). Seither erhält sie eine Obinutuzumab-Erhaltungstherapie.
Behandlung älterer, komorbider Patienten
Als nächstes wurde das Thema der älteren, komorbiden Patienten mit einem intermediären Risiko anhand eines Fallbeispiels von Dr. Wendy Osborne diskutiert. Es handelte sich dabei um einen 72-jährigen Mann mit einem metabolischen Syndrom und Status nach Myokardinfarkt. 2011 trat eine axilläre Lymphadenopathie auf und es wurde ein FL Grad 1 bis 2, Stadium III diagnostiziert. «Der Patient arbeitete zu dieser Zeit nach wie vor als selbständiger Taxifahrer und er wollte das auch so beibehalten, weil er seine Familie dadurch ernährte. Dieser Punkt spielte daher bei der Wahl der Therapie eine grosse Rolle», erläutere Dr. Osborne. Da der Patient asymptomatisch war, entschied sich Dr. Osborne für ein Watch-and-Wait. 2015 wurde der Patient, der inzwischen einen weiteren Myokardinfarkt erlitten hatte, mit einem geschwollenen linken Bein vorstellig. Das CT zeigte eine inguinale Lymphadenopathie. «Für diesen Patienten wollte ich eine Therapie mit einer möglichst geringen Toxizität, vor allem einer möglichst geringen kardiovaskulären Toxizität. Und ich machte mir Sorgen bezüglich Infektionen. Für den Patienten selbst stand im Vordergrund, dass er möglichst wenig Zeit im Spital verbringen musste sowie eine möglichst lange Zeit bis zur nächsten Therapie», beschrieb Dr. Osborne die Situation (Abb. 1). Aufgrund der PFS-Daten der FOLL05 Studie hätte sie sich, trotz seiner guten Verträglichkeit, gegen CVP als Chemotherapie-Backbone entschieden (3). «Auch CHOP kam nicht in Frage, da ich bei diesem Patienten kein Anthrazyklin einsetzen wollte», erläuterte sie weiter. Basierend auf den Resultaten der STiL-Studie entschied sie sich schliesslich für B-R.4 Rituximab wählte sie, da 2015 Obinutuzumab noch nicht als Alternative zur Verfügung stand. Prof. Trotman warf hier ein, dass sie bei diesem Patienten aufgrund seines Alters und seines metabolischen Syndroms kein Bendamustin gewählt hätte. Prof. Dreyling meinte daraufhin, dass es für ihn weniger um die Frage «Bedamustin ja oder nein» gehe, sondern vielmehr um die verwendete Dosierung. Er sprach sich für eine Dosis von 70 mg / m2 an den Tagen 1 und 2 aus, sowie für 4 anstelle von 6 Zyklen. Dr. Osborne meinte dazu: «Das zeigt auf, wie wichtig eine individualisierte Therapie ist.» Wie sie weiter erklärte, zeigte der Patient nach Abschluss der Induktionstherapie eine komplette Remission. Basierend auf dem in der PRIMA-Studie gezeigten PFS-Vorteil startet sie anschliessend eine Rituximab-Erhaltungstherapie (9). Aufgrund einer persistierenden Neutropenie und zwei Hospitalisierungen mit febriler Neutropenie musste sie diese jedoch nach 5 Monaten stoppen.
Einige Monate später wurde der Patient mit einer schweren Dyspnoe notfallmässig hospitalisiert. Wie es sich herausstellte, litt er unter einer Pneumocystis jirovecii Pneumonie (PJP). Dr. Osborne sagte dazu: «Ich führe dies auf die Bendamustin-haltige Induktionstherapie zurück. Aus der Gallium Studie wissen wir, dass etwa 5% der Patienten in den ersten zwei Jahren nach einer Bendamustin-haltigen Induktionstherapie starben. Diese Mortalität wurde auf die anhaltende Depletion der T-Zellen nach einer solchen Therapie zurückgeführt. Aufgrund dieser Daten erhalten nun alle meine Patienten, die mit Bendamustin behandelt werden, für zwei Jahre nach Abschluss der Behandlung eine PJP-Prophylaxe. Dies unabhängig davon, ob sie eine Erhaltungstherapie bekommen oder nicht.» Zum heutigen Zeitpunkt hätte sie bei diesem Patienten eine Behandlung mit Obinutuzumab in Betracht ziehen können, um eine möglichst lange TTNT zu erreichen. «Allenfalls hätte er die Behandlung jedoch abgelehnt, weil er dann für die Infusionen mehr Zeit im Spital hätte verbringen müssen», schloss sie.
Dr. Therese Schwender
Literatur:
1. Sarkozy C et al. Cause of Death in Follicular Lymphoma in the First Decade of the Rituximab Era: A Pooled Analysis of French and US Cohorts. J Clin Oncol. 2019;37:144-152.
2. Nooka AK et al. Examination of the follicular lymphoma international prognostic index (FLIPI) in the National LymphoCare study (NLCS). Ann Oncol. 2013;24(2):441-8.
3. Luminari S et al. Long-Term Results of the FOLL05 Trial Comparing R-CVP Versus R-CHOP Versus R-FM for the Initial Treatment of Patients With Advanced-Stage Symptomatic Follicular Lymphoma. J Clin Oncol. 2018;36:689-696.
4. Rummel MJ et al. Bendamustine plus rituximab (B-R) versus CHOP plus rituximab (CHOP-R) as first-line treatment in patients with indolent lymphomas: Nine-year updated results from the StiL NHL1 study. J Clin Oncol 2017;35 (Suppl): 7501.
5. Casulo C et al. Validation of POD24 As a Robust Early Clinical Endpoint of Poor Survival in Follicular Lymphoma: Results from the Follicular
Lymphoma Analysis of Surrogacy Hypothesis (FLASH) Investigation. Blood 2017;130:412.
6. Townsend W et al. Obinutuzumab-Based Immunochemotherapy Prolongs Progression-Free Survival and Time to Next Anti-Lymphoma Treatment in Patients with Previously Untreated Follicular Lymphoma: Four-Year Results from the Phase III GALLIUM Study. Blood 2018;132:1597.
7. Hiddemann W et al. Immunochemotherapy With Obinutuzumab or Rituximab for Previously Untreated Follicular Lymphoma in the GALLIUM Study: Influence of Chemotherapy on Efficacy and Safety. J Clin Oncol 2018;36:2395-2404.
8. Seymour JF et al. Association of early disease progression and very poor survival in the GALLIUM study in follicular lymphoma: benefit of
obinutuzumab in reducing the rate of early progression. Haematologica 2019;104:1202-1208.
9. Salles GA et al. Long Term Follow-up of the PRIMA Study: Half of Patients Receiving Rituximab Maintenance Remain Progression Free at 10 Years. Blood 2017, 130:486.
Aggressive Lymphome: Car-T-Cells und weitere…?
Daten zur Erstlinientherapie wie die ROBUST-Studie und die ECOG-ACRIN1412-Studie zum Vergleich Lenalidomid plus/minus R-CHOP wurden auf dem wenige Tage nach dem EHA folgenden 15. ICML Meeting in Lugano präsentiert. So gab es aus Amsterdam im Wesentlichen Daten zur Rezidiv-Situation zu berichten. Auch hier war die Rolle der CAR-T-Zell-Therapie für die diffus-grosszelligen B-Zell-Lymphome ein dominierendes Thema.
Interessante Real-Life-Daten konnte Prof. Dr. med Catherine Thieblemont vom Hôpital Saint Louis, Paris in diesem Zusammenhang präsentieren. In Frankreich erlaubt der Einschluss in ein Patienten-Programm die Therapie mit CAR-T-Zellen, sowohl mit den Produkten Axicabtagen-Ciloleucel (YESCARTA) und Tisagenlecleucel (KYMRIAH). Insgesamt wurden in den fünf teilnehmenden Zentren 60 Patienten ausgewählt, darunter waren 68% primär refraktär auf die vorangegangene Therapie. Ein wesentlicher Punkt, auf den während der Präsentation eingegangen wurde, war hier die mittlere Dauer zwischen Einschluss der Patienten und Zeitpunkt der Zell-Re-Transfusion von 47.5 Tagen, mit einem Range von 30 bis 190 Tagen. Dies machte bei annähernd allen Patienten eine Bridging-Therapie notwendig, 5 Patienten starben in der Zeit, 3 an einem Progress, zwei an Infektionen. Dieser Zeitverzug bleibt aktuell in Europa noch ein wesentliches Problem, vor allem vor dem Hintergrund, dass zum Beispiel aus China von einer mittleren Dauer von mitunter bei 8 Tagen berichtet wird, ein Umstand, der auch nach den Sessions intensiv zwischen den Teilnehmern diskutiert wurde.
Quelle: Thieblemont C et al: Real-world results on CD19 CAR T-cell for 60 French patients with relapsed/refractory diffuse large B- cell lymphoma included in a temporary authorization for use (ATU) program.. EHA Congress 2019, Abstract S1600, 24th EHA Congress, 2019, Amsterdam, NL
Im Bereich der zielgerichteten Therapien wurden die Interims-Daten zum first-in-class anti CD47-Antikörper Hu5F9-G4 in Kombination mit Rituximab bei refraktärem/rezidiviertem Non-Hodgkin-Lymphom vorgestellt. Hierzu waren die Daten der 1b-Phase bereits im November 2018 hochrangig im NEJM publiziert worden (Advani, R. Et al CD47 Blockade by Hu5F9-G4 and Rituximab in Non-Hodgkin’s Lymphoma, N Engl J Med 2018; 379:1711-1721). Dr. med. Mark Roschewski, USA präsentierte für die Studiengruppe nun Phase-2-Daten von 115 Patienten, darunter 59 mit einem DLBCL, insgesamt eine schwer vorbehandelte Population: 59% der Patienten mit einem primär refraktären DLBCL, 85% waren refraktär auf die letzte Therapie mit Rituximab und 89% der Patienten nicht fähig für eine CAR-T-Zell-Therapie.
Die mediane Nachbeobachtungszeit von 3.7 Monaten ist sicher noch kurz, aber es zeigte sich bei akzeptabler Toxizität (im wesentlichen Infusionsreaktionen und Anämie, der Anteil der Grad 3/4 Toxizitäten lag insgesamt bei 7%, für Anämie bei 15%, in 4/100 Fällen musste die Therapie auf Grund von Nebenwirkungen abgebrochen werden) bei dieser Hochrisikogruppe immerhin ein Overall Response von 36%. Diese etwas niedrigere Rate als in der Phase 1b der Studie trägt wohl dem Umstand Rechnung, dass überwiegend nicht CAR-T-Zell-fähige Patienten eingeschlossen worden waren. Insgesamt scheint der Mechanismus aber auch bei intensiv vortherapierten Patienten ein dauerhaftes Ansprechen zu erreichen, wie die Daten aus der 1b-Phase zeigen. Die Dauer des Ansprechens liegt zwischen 2.4 und über 20 Monaten für die DLBCL-Patienten, wobei der Median noch nicht erreicht wurde. Wichtig in diesem Zusammenhang ist sicher auch, dass das Ansprechen mit median 1.8 Monaten schnell erreicht wurde. Die Studie rekrutiert aktuell in der Phase 2 weiter.
Quelle: Ranjana A et al: The first-in-class anti-CD47 antibody HU5F9-G4 with rituximab induces durable repsonses in relapsed/refractory DLBCL and indolent lymphoma: Interim phase 1B/2 results. EHA Congress 2019, abstract S867, 24th EHA Congress, 2019, Amsterdam, NL
Auch der bispezifische Anti-CD 20 und AntiCD3 IgG4 Antikörper REGN1979 kann möglicherweise eine Option bei intensiv vortherapierten DLBCL-Patienten darstellen. Dr. Rajat Bannerji vom Rutgers Cancer Institute in New Jersey stellte Phase-1-Daten vor. Bisher konnten 39 DLBCL-Patienten eingeschlossen werden, der Behandlungsplan sah die Gabe des Medikamentes als Monotherapie wöchentlich über 12 Wochen, im Anschluss daran alle 2 Wochen über insgesamt weitere 12 Wochen vor. Die Verträglichkeit war gut, hauptsächlich traten Fieber, Schüttelfrost und ein Zytokin-Release-Syndrom auf. Diesen Nebenwirkungen konnte durch eine entsprechende Prämedikation im Verlauf gut begegnet werden. Insgesamt zeigt die Substanz vor allem in einer höheren Dosierung von mindestens 80 mg eine Effektivität, in 4 von 7 so behandelnden Patienten konnte sogar eine CR erreicht werden. Basierend auf diesen positiven Daten ist eine Phase-2-Studie in Planung, wie auch in der vorgehenden Studie werden nicht nur diffus-grosszellige B-Zell-Lymphome eingeschlossen, sondern auch follikuläre Lymphome und Mantelzell-Lymphome, so dass auch für diese Entitäten hoffentlich die therapeutischen Möglichkeiten zahlreicher werden.
Quelle: Bannerji R. Emerging clinical activity of REGN1979, an anti CD 20x Anti CD3 bispecific antibody (AB) in Patients (Pts) with relapsed/refractory (R/R) B-Cell- Non-Hodgkin Lymphoma (B-NHL) EHA Congress 2019, Abstract S868, 24th EHA Congress, 2019, Amsterdam,NL
Für die peripheren T-Zell-Lymphome (PTLD) wurden Daten zu Tipifarnib, einen CXCL12/CXCR4 Signalweg-Inhibitor präsentiert. Das Chemokin CXCL12 wird von 50% der AITL und von etwa einem Drittel aller übrigen peripheren T-Zell-Lymphome stark exprimiert und ist unter anderem essentiell für das Homing der T-Zelle in das lymphatische System und das Knochenmark, Tipifarnib inhibiert das Enzym Farnesyltransferase (FT), in vivo konnte dementsprechend über diesen Mechanismus eine Down-Regulation der CXCL12-Sekretion gezeigt werden. In einer Phase-II-Studie, die Thomas Witzig, Rochester, präsentierte, wurden deshalb Patienten mit rezidiviertem oder refraktärem histologisch nachgewiesenem AITL oder einem anderen CXCL12-exprimierenden T- Zell-Lymphom eingeschlossen. Die Patienten erhielten 300 mg Tipifarnib 2x täglich an Tag 1 bis Tag 21 eines 28-Tage-Zyklus bis zum Progress. Bei 41 von initial 50 eingeschlossenen Patienten konnten nun die Daten ausgewertet werden. Die Patienten hatten im Mittel drei Vortherapien erhalten. Das Nebenwirkungsprofil lag im erwarteten Bereich mit hauptsächlich hämatologischen Nebenwirkungen (Neutropenie 44%, Thrombozytopenie 37%, Leukopenie 28%, Anämie 22% und febrile Neutropenie 21%). In der AITL-Kohorte konnte eine ORR von 45% beobachtet werden, sicher ein hoffnungsvoller Ansatz einer Monosubstanz in dieser intensiv vorbehandelten Patientenpopulation. In der PTLD-CXCL12+ Gruppe waren 3 Patienten auswertbar (1 PR, 2 SD). Eine hohe CXCL12-Expression korrelierte mit einem besseren Ansprechen auf die Tipifarnib-Therapie, wobei 50% der AITL und 35% der Nicht-AITL-Proben CXCL12 überexprimierten. Die Studie konnte damit bei Patienten mit peripheren T-Zell-Lymphomen, vor allem vom AITL-Typ und bei einer CXCL12-Überexpression eine Aktivität der Substanz nachweisen, für die CXCL12-positive Gruppe rekrutiert die Studie aktuell noch weiter, so dass wir für diese schwierig zu behandelnde Patientengruppe interessante weitere Daten erwarten dürfen.
Dr. med. Wiebke Rösler
Universitätsspital Zürich, Klinik für medizinische Onkologie und Hämatologie
Quelle: Witzig T et al. Tipifarinib in relapsed or refractory angioimmunoblastic T cell lymphoma (AITL) and CXCL12+ peripheral T-cell lymphoma (PTCL): Preliminary results from an open label, phase 2 study. EHA Congress 2019, Abstract S869, 24th EHA Congress, 2019, Amsterdam, NL
Chronische Lymphatische Leukämie (CLL)
Die viel beachtete Zwischenanalyse der CLL12-Studie wurde von P. Langerbeins et al. präsentiert. Dabei wurden asymptomatische CLL-Patienten mit einem erhöhten Progressionsrisiko (German CLL risk score >3) randomisiert und doppelblind mit Placebo oder Ibrutinib (420mg täglich) bis zu einem symptomatischen CLL-Progress behandelt. Zwischen April 2014 und Februar 2019 wurden 363 Patienten eingeschlossen. Der primäre Endpunkt war die Zeit von der Randomisierung bis zum symptomatischen CLL-Progress. Als sekundärer Endpunkt wurde unter anderem das Gesamtüberleben gewählt. Die beiden Patientengruppen (Ibrutinib 182 Patienten, Placebo 181 Patienten) waren bezüglich der demographischen und CLL-spezifischen Eigenschaften sehr gut vergleichbar. Die mediane Therapiedauer im Ibrutinib-Arm betrug 21 und im Placebo-Arm 18 Behandlungszyklen à 28 Tage. Als Resultat war das progressionsfreie Überleben (median 14,8 Monate im Placebo-Arm: p<0.0001, HR 0.176) und die Zeit bis zur nächsten Therapie (p<0.0001, HR 0.205) im Ibrutinib-Arm signifikant besser. Interessanterweise ergaben sich bei den meisten unerwünschten Ereignissen keine Unterschiede zwischen den beiden Studienarmen. Nur Vorhofflimmern (alle: 17,8% vs. 7,3%; ≥ Grad 3: 6,5 % vs 1.7 %), Blutungen (alle: 27,6% vs. 9,6%; ≥ Grad 3: 3,1 % vs 1.2 %) und hypertensive Veränderungen (alle: 9,7% vs. 3,9%; ≥ Grad 3: 1,6 % vs 1.7 %) waren unter Ibrutinib signifikant häufiger als unter Placebo und waren zugleich die Hauptursachen für einen Behandlungsstopp von Ibrutinib (34.1%). Zusammenfassend muss die Verträglichkeit von Ibrutinib als sehr gut beurteilt werden. Solange jedoch noch keine signifikant besseren OS-Daten im Ibrutinib-Arm präsentiert werden können, muss weiterhin bei allen asymptomatischen CLL-Patienten eine «watch and wait»-Strategie empfohlen werden.
Quelle: Langerbeins P et al. Ibrutinib versus placebo in patients with asymptomatic, treatment-naïve early stage chronic lymphocytic leukemia (CLL): Primary endpoint results oft he pahse 3 double blind randomized CLL12 trial. EHA 2019, Abstract LB2602, 24th EHA Congress, 2019, Amsterdam, NL
Von A.P. Kater et. al. wurden erste Daten der VISION / HOVON 141 Phase-2-Studie zur MRD-gesteuerten zeitlich limitierten Therapie von Patienten mit refraktärer/rezidivierter CLL mit Ibrutinib und Venetoclax vorgestellt. Dieses rein orale Therapieregime ohne klassisches Chemotherapeutikum erfolgte ab der zweiten Therapielinie unabhängig von der Anzahl an Komorbiditäten bei einer Kreatinin-Clearance von ≥ 30 ml/min. Eine frühere Therapie mit Ibrutinib und/oder Venetoclax war ausgeschlossen. Die Induktions-Behandlung besteht aus einer alleinigen Vorbehandlung mit Ibrutinib 420mg täglich für 2 Therapiezyklen, gefolgt von 15 Zyklen Kombinationstherapie von Ibrutinib (420mg täglich) und Venetoclax (Ramp-up über 4 Wochen bis 400mg täglich) bei einer Zyklusdauer von 28 Tagen. Bei Patienten ohne detektierbare Resterkrankung (flowzytometrisch <10-4 in Blut und Knochenmark zentral analysiert) erfolgt randomisiert entweder eine Erhaltungstherapie mit Ibrutinib oder der Therapieabschluss. Der primäre Endpunkt ist das PFS 12 Monate nach Abschluss der Induktionstherapie. Das mediane Alter der eingeschlossenen Patienten liegt bei 67 Jahren (40-83) wobei ein Drittel dieser Patienten bei Therapiebeginn ein Stadium Binet C aufwies und der überwiegende Anteil männlich ist (71%). In der vorliegenden Zwischenanalyse wurden die Resultate der ersten 51 Patienten gezeigt (Ziel: 207 eingeschlossene Patienten). 29% davon waren am Ende des 9. und 47% am Ende des 12. Therapiezyklus MRD-negativ. Die Verträglichkeit dieser Therapie war gut, mit Feststellung eines laboranalytischen Tumorlyse-Syndroms (TLS) bei 10% der Patienten (keine klinischen TLS). Der mediane Follow-up beträgt 13,5 Monate. Die häufigsten Grad-3-Nebenwirkungen waren Neutropenie (36%) und Infektionen (20%). In dieser Zeit traten bei je 8% der Patienten Blutungen (Grad 2) und Vorhofflimmern (Grad 2) auf. Zusammenfassend zeigen sich auch bei vortherapierten CLL-Patienten mit einer zeitlich limitierten Kombinationstherapie von Ibrutinib und Venetoclax hohe Raten an sehr gutem Therapieansprechen bei insgesamt sehr guter Verträglichkeit.
Dr. med. Jeroen Goede
Medizinische Onkologie und Hämatologie, Kantonsspital Winterthur
Quelle: Kater AP, et al. Safety analysis of venetoclax and ibrutinib for patients with relapsed/refractory chronic lymphocytic leukemia (r/r cll): second interim analysis from the phase II VISION HO141 trial. Abstract S108: 24th EHA Congress, 2019, Amsterdam, NL
Fortschritte in der Behandlung der akuten lymphatischen Leukämie (ALL)
Erstmalige chemotherapiefreie Behandlung der Philadelphia positiven ALL des Erwachsenen: Präliminäre Resultate der GIMEMA LAL2116 D-ALBA Studie.
Seit der Einführung von Tyrosin-Kinase-Hemmern (TKI) und der Anwendung des bispezifischen Antikörpers Blinatumomab hat sich die Behandlung der bcr-abl1 positiven ALL wesentlich gewandelt. Die Autoren zeigen erstmalig die präliminären Resultate einer chemotherapiefreien Induktionstherapie mit Dasatinib und Blinatumomab.
Eingeschlossen werden konnten alle Patienten > 18 Jahre. Nach einer 7-tägigen Steroid-Vorphase wurden für weitere 24 Tage (bis Tag 31) Steroide zusammen mit Dasatinib (140mg/d) verabreicht, welches dann bis Tag 85 fortgesetzt wurde. Anschliessend wurden Patienten mit einer kompletten hämatologischen Remission (CHR, 96.8%) mit mindestens 2 (bis maximal 5, abhängig vom Ansprechen) Zyklen Blinatumomab (28µg/d) behandelt, Dasatinib wurde während dieser Phase unverändert weitergegeben. Eine nicht näher bezeichnete ZNS-Prophylaxe wurde ab Diagnosestellung durchgeführt.
Zwischen Mai 2017 und Januar 2019 konnten 63 Patienten mit einem medianen Alter von 54.5 Jahren (24.1-81.7) in diese Phase-II-Studie eingeschlossen werden. 61/63 konnten die Induktion (Tag 85) abschliessen. 55 erhielten mindestens 1, 17 total 5 Zyklen Blinatumomab.
Den primären Studienendpunkt die MRD-Negativität (CMR oder PNQ (positive non-quantifiable)) erreichten 56.2%. Bei einer noch sehr kurzen medianen Beobachtungszeit von 10 (0.9-21.5) Monaten betrug der OS bzw. DFS nach 12 Monaten 94.8% bzw. 87.8%.
2 Todesfälle (1 in Induktion, 1 in CHR) und 5 Rezidive wurden beobachtet. Überraschend zeigte sich eine hohe Rate an CMV-Reaktivierungen.
Ob diese Patienten zur weiteren Konsolidation einer allogenen Stammzelltransplantation bedürfen, ist momentan nicht klar.
Quelle: Chiaretti S et al. A dasatinib-blinatumomab combination for the front-line treatment of adult PH+ ALL patients. Preliminary results of the GIMEMA LAL2116 D-ALBA trial; on behalf oft he GIMEMA ACUTE LEUKEMIA WORKING PARTY. EHA Congress 2019, Abstract S1617, 24th EHA Congress, 2019, Amsterdam, NL
Nelarabin als Salvage- und Bridging-Therapie zur allogenen Stammzelltransplantation bei rezidivierter/refraktärer T-ALL. Eine real world Observations Phase 4 Studie.
Die resistente oder rezidivierte akute T-lymphoblastische Leukämie (T-ALL) des Erwachsenen hat eine schlechte Prognose mit einem 5-Jahres-OS von unter 10%. Erstmalig berichteten N. Gökbuget et al. 2011 (Blood 118:3504) über den erfolgreichen Einsatz des Purin Analogs Nelarabin in dieser Situation. Ziel der aktuellen Studie war es, zusätzliche und reproduzierbare Evidenz der Wirksamkeit und Sicherheit von Nelarabin zu erbringen und die Machbarkeit einer anschliessenden Stammzelltransplantation zu belegen.
Eingeschlossen wurden Patienten > 18 Jahre mit einer refraktären/rezidivierenden T-ALL, die mindestens einen Zyklus Nelarabin erhalten hatten. Primäre Endpunkte waren die overall response rate (OOR) und das Überleben (OS). Zwischen Mai 2007 und November 2018 konnten in 27 italienischen Zentren 118 Patienten (65% T-ALL, 35% T-LBL) im medianen Alter von 38 (18-81), 73% Männer, 57% rezidivierend, 43% refraktär, eingeschlossen werden. 55% hatten 2 oder mehr Vortherapien. Im Median wurden 2 (1-4) Zyklen Nelarabin verabreicht.
43/118 (36%) erreichten eine CR, 16/118 (14%) eine PR und 59/118 (50%) zeigten kein Ansprechen (NR). 47/118 (CR 28, PR 4, NR 15) erhielten im Anschluss eine allogene Stammzelltransplantation. Das Gesamtüberleben der ganzen Gruppe (N=118) betrug 38% nach 1 und 18% nach 5 Jahren bei einem medianen Überleben von 8 Monaten. Das mediane Überleben der Rezidivierenden war mit 11.5 Monaten gegenüber den resistenten Patienten mit 4.8 Monaten signifikant besser (p=0.0039). Das 1 Jahres OS nach Stammzelltransplantation war mit 54% gegenüber ohne mit 22% signifikant besser (P<0.0001), ebenso wie das mediane Überleben von 14.5 gegenüber 4.8 Monaten. Von den 32/118 auf Nelarabin ansprechenden und anschliessend transplantierten Patienten betrug das mediane OS 22.5 Monate bzw. der 5 Jahres OS 40%. Die neurologische Toxizität Grad 3/4 betrug 9% (10/118).
Nelarabin und eine anschliessende Stammzelltransplantation ist eine wichtige therapeutische Option bei der rezidivierten/resistenten T-ALL des Erwachsenen mit einer akzeptablen (neurologischen) Toxizität.
PD Dr. med. Urs Schanz
Klinik für medizinische Onkologie und Hämatologie, Universitätsspital Zürich
Quelle: Candoni A et al. Nelarabine as salvage therapy and bridge to allogenic stem cells transplantation in 118 adult patients with relapsed/refractory T cell acute lymphoblastic leukemia/lymphoma. A campus ALL, phase 4 study. Abstract S1620, 24th EHA Congress, 2019, Amsterdam, NL
Myelom
CASSIOPEIA-Studie
Beim diesjährigen EHA-Kongress in Amsterdam wurden die ersten Ergebnisse der CASSIOPEIA-Studie präsentiert, einer randomisierten Phase-III-Studie, die die Wirksamkeit einer 4-fach Kombination mit Daratumumab, Bortezomib, Thalidomid und Dexamethason (D-VTd) in der Induktions- und Konsolidierungstherapie bei Patienten untersucht, die sich für eine autologe Stammzelltransplantation qualifizieren. Präsentiert wurde die Auswertung des ersten Teils der Studie, der den Effekt der 4-fach Kombination nach Induktion- und Konsolidierungsphase beschreibt, Resultate des 2. Teils, der randomisiert eine Erhaltungstherapie mit Daratumumab vs Bobachtung vergleicht, sind ausstehend. Eingeschlossen wurden 1085 Patienten in 111 beteiligten Zentren der HOVON- und IFM-Studiengruppen. Die Patienten erhielten eine Induktionstherapie mit 4 Zyklen VTd +/- Daratumumab und nach erfolgter Hochdosistherapie und autologer Stammzelltransplantation 2 weitere Zyklen VTd +/- Daratumumab zur Konsolidierung. Im Studienarm mit Daratumumab-VTd konnte eine signifikante Verbesserung der stringenten kompletten Remission (sCR) als primärer Endpunkt und damit eine verbesserte Remissionstiefe zum Zeitpunkt nach Konsolidierung erreicht werden (Dara-VTd 29%, VTd 20%, OR 1.6; 95% CI, 1.21-2.12; P=0.0010). Auch die als sekundäre Endpunkte definierte Rate an MRD-Negativität (64% vs 44% mittels Durchflusszytometrie, P<0.0001), Ansprechen >= CR, PFS ab Zeitpunkt der 1. Randomisation (HR 0.47 (0.33-0.67), P<0.0001) zeigten eine Überlegenheit des Studienarmes, das Gesamtüberleben war zum Zeitpunkt der Analyse bei einem medianen Follow-up von 18.8 Monaten noch nicht auswertbar. Zusammenfassend konnte diese Studie einen klinisch bedeutenden Benefit der 4-fach-Kombination durch Hinzunahme von Daratumumab mit Verbesserung der Remissionstiefe und einer Reduktion des Progressionsrisikos von 53% aufzeigen.
Quelle: Moreau P et al. Phase 3 randomized study of daratumumab + bortezomib/Thalidomide/dexamethasone (D-VTD) versus VTD in ptransplant-eligible newly diagnosed multiple myeloma: Part 1 CASSIOPEIA results. 24th EHA Congress 2019, Abstract S145, Amsterdam, NL
COLUMBA-Studie
Im Kontext der immer häufigeren Verwendung von Daratumumab in unterschiedlichen Behandlungsphasen ist darüber hinaus die am EHA-Kongress vorgestellte Phase-3-COLUMBA Studie erwähnenswert.
Hierbei handelt es sich um eine non-inferiority-Studie, die Daratumumab in einer subkutanen Darreichungsform gegen das etablierte i.v.-Regime untersucht. Die Daratumumab-Infusionszeiten betragen bei Erstinfusion 7 Stunden, bei Zweitapplikation 4.3 Stunden und aber der dritten Infusion 3 Stunden im Median. Eine subkutane Darreichungsform von Daratumumab unter Verwendung rekombinanter humaner Hyaluronidase erlaubt eine deutliche Verkürzung der Applikationsdauer auf 5 Minuten und basierend auf der Phase-1b PAVO-Studie wurde eine Einheitsdosis von 1800mg s.c. gegen das etablierte i.v. Regime getestet. Hierbei waren die getesteten primären Endpunkte Gesamtansprechrate (ORR), minimaler Talspiegel (Ctrough) in beiden Armen vergleichbar und auch die sekundären Endpunkte Progressions-freies Überleben (PFS) und Gesamtüberleben (OS) zeigten keine Unterschiede. Im Hinblick auf unerwünschte Wirkungen war insgesamt ein vergleichbares Sicherheitsprofil festzustellen, die Rate an infusionsbedingten Reaktion im s.c.-Arm war geringer, so dass zusammenfassend von einer vergleichbaren Wirksamkeit bei deutlich komfortablerer Applikationsform ausgegangen werden kann.
Quelle: Mateos MV et al. Randomized, 0pen-label, non-inferiority , phase 3 study of subcutaneous (SC) versus intravenous (IV) daratumumab (DARA) administration in patients with relapsed or refractory multiple myeloma: COLUMBA. 24th EHA Congress 2019, Abstract S823, Amsterdam, NL
FORTE-Studie
Eine weitere interessante Präsentation beinhaltete ein Update zur FORTE-Studie, die den Stellenwert der autologen Stammzelltransplantation im Kontext einer Induktion und Konsolidierung mit Carfilzomib-Lenalidomid-Dexamethason (KRd) oder Carfilzomib-Cyclophosphamid-Dexamethason (KCd) untersucht (KRd4/autologe Stammzelltransplantation (ASCT)/KRd4 vs KCd4/ASCT/KCd4 vs alleinige KRd-Therapie über 12 Zyklen (KRd12)). Bereits beim ASH-Kongress 2018 wurde die Überlegenheit beider lenalidomidhaltiger Regime über KCd/ASCT/KCd gezeigt (Gay et al., ASH 2018). In der aktualisierten Subgruppenanalyse zeigte sich ein signifikant niedriger Anteil an frühen Rückfällen im KRd/ASCT/KRd-Arm im Vergleich zur alleinigen KRd-Therapie (KRd12) in der High-risk-Population, so dass zusammenfassend festgehalten werden kann, dass trotz des Erreichens vergleichbarer Remissionstiefen in den beiden lenalidomid-haltigen Armen aufgrund der hohen Rate an frühen Rückfällen in der Hochrisikosituation die Hochdosistherapie mit autologem Stammzellersatz in diesem Kontext ihren Stellenwert beibehalten wird.
Dr. med. Rouven Müller
USZ, Klinik für medizinische Onkologie und Hämatologie
Quelle: Kumar S et al. A phase 3 study of venetoclax or placebo in combination with relapsed/refractory multiple myeloma. 24th EHA Congress 2019, Abstract LB 2801 Amsterdam, NL
Post EHA Stammzelltransplantation
Bezüglich der allogenen hämatopoetischen Stammzelltransplantation (HCT) war der EHA 2019 Kongress nicht so ertragreich wie bei anderen zellulären Therapien. Einige Arbeiten sind aber erwähnenswert, hier seien 3 ausgewählt: zuallererst das Abstract, welches im Presidential Symposium vorgestellt wurde (1). Es geht um Patienten mit akuter myeloischer Leukämie (AML), welche bei erhöhtem Rückfallrisiko in erster Remission allogen stammzelltransplantiert wurden. Hier ist die Frage offen, ob die immuntherapeutische Komponente der HCT oder aber die prätransplantäre Chemotherapie eine grössere Rolle in der Heilung spielen. Zu diesem Zweck wurden 218 Patienten randomisiert (BMT CTN 0901 [NCT NCT01339910]) in eine Gruppe mit intensiver Therapie (Myeloablative Konditionierung, MAC) und in eine Gruppe mit wenig intensiver Therapie (Reduziert intensive Konditionierung RIC). Das Rückfallrisiko wurde näher charakterisiert über eine Bestimmung der minimalen Resterkrankung (MRD) über eine Next Generation Sequencing Analyse der 13 am häufigsten mutierten Gene mit einer ultradeep Sequenziermethode, welche Allelhäufigkeiten von 0.001 detektieren konnte. Wie Abb. 1 zeigt, war das 3-Jahres-Gesamtüberleben bei Patienten ohne detektierbare Resterkrankung mit RIC oder MAC gleich. Hingegen war bei Patienten mit detektierbarer Resterkrankung das 3-Jahres-Gesamtüberleben 61% vs. 44%, p: 0.02 mit MAC vs RIC. Bei Patienten mit detektierbarer Resterkrankung war in der Multivarianzanalyse korrigiert für den Einfluss anderer Faktoren das Rückfallrisiko mit RIC erhöht (HR: 5.98 [3.19-11.26], p: <0.001), das leukämiefreie (HR: 2.80 [1.76-4.44], p<0.001) und das Gesamtüberleben vermindert (HR: 2.16 [1.30-3.60], p: 0.003] im Vergleich zu MAC. Die Interpretation dieser Daten ist dahingehend, dass sowohl die Intensität der prätransplantären Chemotherapie als auch die immunologischen Effekte zur Heilung beitragen und dass insbesondere Patienten zwar in Remission, aber mit tiefensequenzierungsdetektabler Resterkrankung von einer intensiveren prätransplantären Chemotherapie profitieren können.
In der zweiten Arbeit (2) wurden Patienten mit akuter lymphoblastärer Leukämie (ALL) untersucht, welche mit einer haploidenten HCT in CR1 oder CR2 behandelt worden waren. Die HCT von HLA-identischen Geschwistern gehört zur Standardbehandlung, ebenso wenn der Spender ein HLA-identischer unverwandter Spender ist. In den letzten Jahren hat die Verwendung haploidenter Stammzellspender massiv zugenommen, haploident heisst, dass Spender und Empfänger einen HLA-Satz teilen, den zweiten aber nicht, d.h. halbidentisch sind. Da Eltern und Kinder per Definition halbidentisch zum Patienten sind und auch die Hälfte der Geschwister, erhöht die Verwendung von halbidentischen Spendern die Spenderverfügbarkeit ungemein. Haploidente HCT sind aber mit einem erhöhten Graft versus Host Krankheits (GvHD) Risiko behaftet, deshalb werden in der GvHD-Prophylaxe neue Wege beschritten. Einer dieser Wege ist die Verwendung hoher Dosen von Cyclophosphamid posttransplantär (2x50mg/kg; ptCy) nach der HCT, um alloreaktive T-Zellen zu eliminieren, andere Strategien verwenden polyklonale Antikörper, ATG = Antithymozytenglobulin. In dieser observationellen Studie wurden 434 Patienten untersucht, 336 mit ptCY, 98 mit ATG behandelt. In beiden Gruppen waren das Angehen des Transplantates und die Rate an akuter und chronischer GvHD vergleichbar. Die Häufigkeit von Todesfällen an Infektionen betrug vergleichbar 32% und 30% Rückfälle waren unter ptCy seltener: 33.8% vs 43%; [HR] 0.61 [95% CI: 0.39-0.94], p = 0.03), die behandlungsassoziierte Mortalität (TRM) war etwas tiefer mit ptCy (26.7% vs 32.9%; HR 0.68 [0.42-1.11], p = 0.12). Das leukämiefreie und das Gesamtüberleben waren besser mit ptCy (40.3% vs 24.1%; HR 0.67 [0.46-0.96], p=0.03, und 48.4% vs 27.4%; HR 0.60 [0.42-0.84], p=0.003) im Vergleich zu ATG. Die Schlussfolgerung ist, dass hohe Dosen von Cyclophosphamid nach der HCT gegeben zu weniger Rückfällen führen und bezüglich der Kontrolle der GvHD gleichwertig sind wie andere Methoden der GvHD-Prophylaxe.
In der dritten Arbeit (3) geht es um die Bedeutung von anti-HLA Antikörpern, welche beim Patienten vorhanden sein können, auf Grund früher erfolgter Sensibilisierungen (Schwangerschaften, Transfusionen). Diese können heutzutage gut gemessen werden mit der Luminex-Technologie, in welcher Beads mit HLA-Molekülen beschichtet und mit unterschiedlicher Fluoreszenz erlauben, präzise die Spezifität der anti-HLA Antikörper zu charakterisieren und zu bestimmen, ob bei HCT mit HLA «mismatches» zwischen Spender und Empfänger die anti-HLA Antikörper eine Spenderspezifität haben oder nicht (donor specific antibodies, DAS). In dieser Studie wurden 343 Empfänger von Nabelschnurblut-HCT untersucht; Empfänger von Stammzellen aus dem Nabelschnurblut weisen häufig HLA «mismatches» gegen den Spender auf, Nabelschnurblut-HCTs werden ja unternommen, um die HLA-Barriere bei immunologischer Unreife der Spender besser unterlaufen zu können. Auch ist bei Nabelschnurblut-HCT das Risiko einer Transplantatabstossung höher als bei anderen Stammzellquellen, dafür das GvHD-Risiko kleiner. Bei 25 Patienten wurden spenderspezifische Antikörper mit einer Fluoreszenzintensität von > 1000 gefunden. Ein Angehen des Transplantates wurde bei 75.7% (95% CI, 70.6–80.1) der DSA-negativen Patienten aber in 56.0% (95% CI, 34.1–73.1) der DAS-positiven Patienten (P = 0.03) beschrieben. Diese Studie zeigt, dass präexistierende anti-HLA Antikörper eine Rolle im Transplantatversagen spielen können. Ob Strategien zur Eliminierung dieser Antikörper eine Rolle spielen können, ist nicht klar. Bei Nabelschnurtransplantaten ist es wohl angezeigt einen Spender zu wählen, gegen den der Patient keine präexistenten Antikörper hat.
Insgesamt bleibt die allogene und autologe HCT eine Standardbehandlung für zahlreiche verschiedene Pathologien mit über 45 000 Patienten, die jährlich europaweit so behandelt werden. Sie tritt, mit weiteren zu erwartenden Fortschritten, heutzutage in Konkurrenz mit anderen zellulären Therapien.
Prof. Dr. med. Jakob Passweg
Klinik für Hämatologie, Universitätsspital Basel
Quellen:
1. Hourigan C et al. Impact of conditioning intensity of allogenic transplantation for acute myeloid leukemia with genomic evidence of residual diseae. EHA Library . June 14, 2019, 273253; LB2600
2. Nagler A et al. Post-transplant cyclophosphamide vs ATG for graft-versus-host disease prophylaxis in T replete haploidentical transplantation for acute lymphoblastic leukemia: A report of the ALWP/EBMT EHA Library June 14, 2019; 267315; S114
3. Fuji S et al. Impact of pre-transplant donor specific anti-HLA antibodies in cord blood transplantation on behalf of the transplant complications working group of JSHCT. EHA Library. Jun 14, 2019; 267319; S118