Heutzutage reisen auch Patienten mit Herzerkrankungen in grosser Zahl in hochgelegene Regionen. Nicht zuletzt aufgrund der eingeschränkten Datenlage besteht dabei aber nach wie vor eine gewisse Unsicherheit. Im Folgenden soll daher ein kurzer Überblick über kardiale Reaktionen auf Hypoxie und die aktuelle Datenlage zu Höhenaufenthalten bei Herzpatienten gegeben werden, sowie darauf basierend Empfehlungen für einen sicheren Höhenaufenthalt dieser Patienten.
Reisen in hochgelegene Regionen werden immer beliebter. Dank moderner Infrastruktur ist dies heute auch problemlos und ohne grosse Anstrengung möglich. Schätzungen zufolge suchen jährlich etwa 100 Millionen Menschen Höhenregionen über 2500 m auf. Darunter befinden sich zahlreiche Personen mit bekannten oder auch unbekannten Herzerkrankungen.
Während Höhenaufenthalte beim Gesunden in aller Regel gut toleriert werden, kann die in der Höhe durch Hypoxie gesteigerte kardiale Beanspruchung beim Herzpatienten aber zu Problemen führen. Um Zwischenfälle zu vermeiden ist es zum einen notwendig, die physiologischen Prozesse bei Aufenthalten in der Höhe zu verstehen und zum anderen auch die Besonderheiten kardialer Erkrankungen unter diesen Bedingungen zu kennen.
Physiologische Reaktionen auf Hypoxie
Mit steigender Höhe sinkt der Barometerdruck, damit auch der Sauerstoff-Partialdruck (PO2) in der Einatemluft und folglich alveolärer und arterieller PO2. Aufgrund der Sauerstoffbindungskurve des Hämoglobins tritt ein relevanter arterieller Sättigungsabfall ab einer Höhe von etwa 3000 m auf. Unter Belastung kann dies aber schon auf niedrigeren Höhen eintreten (1). Durch eine Reihe physiologischer Vorgänge versucht der Organismus, den PO2 im Gewebe möglichst aufrecht zu erhalten. Neben ventilatorischer und hämatologischer Akklimatisation spielt das kardiovaskuläre System hier eine wesentliche Rolle (2). Da der Sauerstoffbedarf für eine gegebene Belastung unabhängig vom Umgebungs-PO2 konstant ist, muss bei niedrigerem arteriellem PO2 das Herzzeitvolumen steigen, um die gleiche Menge Sauerstoff zu transportieren (3). Im Vergleich zum Flachland bedeutet dies also einen erhöhten myokardialen Sauerstoffbedarf bei vermindertem Sauerstoffangebot. Weiter gesteigert wird der myokardiale Sauerstoffbedarf durch erhöhte Nachlast: linksventrikulär durch gesteigerte sympathische Aktivierung und rechtsventrikulär durch die hypoxische pulmonalarterielle Vasokonstriktion (4).
Die sympathische Aktivierung steigert zudem die Ruhe-Herzfrequenz. Diese bleibt trotz vollständiger Akklimatisation bei Höhenaufenthalten erhöht, was auch auf die Herzfrequenz bei submaximaler Belastung zutrifft (4,5). Die maximale Herzfrequenz nimmt dagegen mit zunehmender Höhe ab (5), die Herzfrequenz-Reserve wird daher geringer. Die maximale Sauerstoffaufnahme als Mass für die Leistungsfähigkeit geht ab einer Höhe von 1000 – 1500 m ebenfalls zurück, durchschnittlich um etwa 1% pro 100 m Höhengewinn (6).
Häufige Herzerkrankungen und Höhenexposition
Arterielle Hypertonie
Akute Hypoxie-Exposition wirkt peripher vasodilatatorisch. Dieser Effekt steht aber nur für kurze Zeit im Vordergrund. Bereits nach wenigen Stunden überwiegt die systemische, sympathisch vermittelte Vasokonstriktion und der Blutdruck steigt an und bleibt dann in der Regel für einige Tage konstant. Auf 5400 m ist bei über 50-jährigen mit einem Anstieg des Blutdrucks um gut 20 mmHg zu rechnen (7).
Koronare Herzkrankheit (KHK)
Die Sauerstoffausschöpfung am Herzen ist bereits im Flachland sehr hoch, weswegen bei vermindertem arteriellem PO2 der zusätzliche Bedarf nur durch eine Zunahme der myokardialen Perfusion gedeckt werden kann. Bei gesunden Koronarien erfolgt dies in der Höhe durch eine hypoxisch bedingte Vasodilatation (8). Bis auf Höhen von 8000 m sind im EKG bei gesunden keine Zeichen einer myokardialen Minderperfusion zu sehen (9). Atherosklerotisch veränderte Koronarien weisen aber eine endotheliale Dysfunktion auf, weshalb die hypoxische Vasodilatation hier ausbleibt oder es gar paradoxerweise zu einer Vasokonstriktion kommen kann (9). Ein erhöhtes Risiko für eine myokardiale Minderperfusion und den damit einher gehenden Komplikationen wäre daher plausibel. Auf der anderen Seite zeigt die Datenlage selbst bei akuter Exposition auf Höhen bis 3500 – 4200 m bei Patienten mit stabiler KHK wenig Evidenz für klinisch relevante höhenbedingte myokardiale Ischämien (5, 6, 10). Levine et al. (11) zeigten aber bei akuter Höhenexposition auf 2500 m eine etwas geringere Belastungstoleranz als im Flachland, die aber bereits nach 5 Tagen Akklimatisation in der Höhe wieder auf das Flachland-Niveau anstieg.
Zur Häufigkeit kardialer Ereignisse in der Höhe bei KHK-Patienten gibt es kaum belastbare Daten. Eine Studie zum plötzlichen Herztod bei Wanderern und Skifahrern ergab ein erhöhtes Risiko nur bei Männern, die Belastung nicht gewohnt waren, einer Patientengruppe die bereits im Flachland ein deutlich erhöhtes Risiko für kardiale Zwischenfälle aufweist (12). Ob die höhenbedingte Hypoxie per se hierzu beiträgt und wenn ja, welchen Anteil sie daran hat, kann aber auch in dieser Studie nicht ausreichend beurteilt werden. Die Häufigkeit akuter myokardialer Ischämien zeigte in einem Kollektiv von durchschnittlich 70-jährigen (KHK Prävalenz 20%) keine klinisch relevanten Ereignisse (13). Bei guter oder nur leicht eingeschränkter linksventrikulärer Pumpfunktion nach Revaskularisierung traten auch bei maximaler Belastung auf 3454 m Höhe keine kardialen Ereignisse auf (6).
Herzinsuffizienz
Zu Patienten mit Herzinsuffizienz in der Höhe ist die Datenlage noch dünner. Patienten mit Herzinsuffizienz weisen primär schon eine erhöhte sympathische Aktivität auf, die bei Höhenaufenthalten noch weiter gesteigert wird. Die erhöhte Herzfrequenz macht die Herzarbeit ineffektiver, die Wahrscheinlichkeit für Arrhythmien und Ischämien steigt. Auf der anderen Seite zeigen kurzzeitige Aufenthalte auf 3000-3500 m eine erstaunlich gute Höhentoleranz solcher Patienten (klinisch NYHA Klasse II-III). Zwar war der höhenbedingte Rückgang der maximalen Sauerstoffaufnahme umso grösser, je stärker schon die Einschränkung im Flachland war (Flachland vs. 3000 m –10% (EF 39±6%, normale VO2,max) vs. –30% (EF 39±6%, reduzierte VO2,max)), dennoch zeigte sich klinisch keine Angina pectoris Symptomatik und im EKG traten keine Arrhythmien oder Ischämiezeichen auf (14). In einer anderen Studie konnte zudem bei NYHA II Patienten auf 3454 m keine echokardiographisch fassbare Einschränkung der linksventrikulären Pumpfunktion gesehen werden (15).
Empfehlungen
Allgemeine Empfehlungen
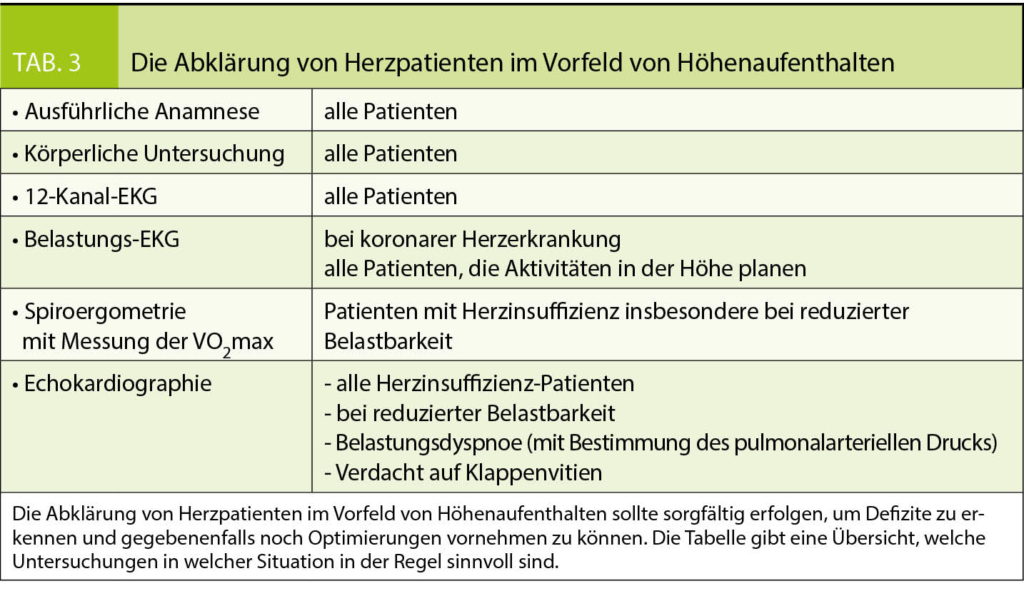
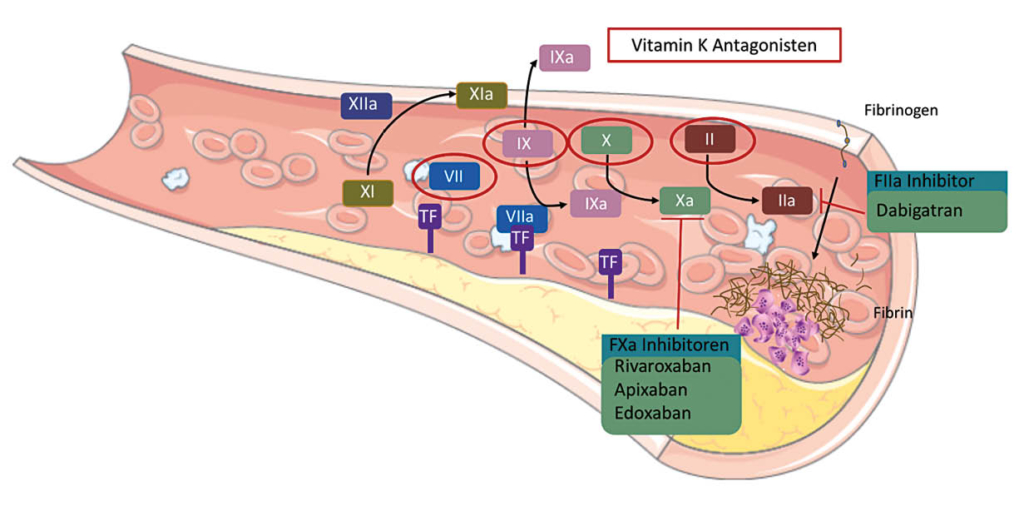
Hochgebirgsregionen bieten neben der Hypoxie eine Reihe weiterer Besonderheiten, die in Tabelle 1 dargestellt sind. Wenn Patienten dorthin reisen, sollten sie gut über Erkrankung und Therapie informiert sein, damit sie im Notfall erforderliche Therapieanpassungen selbst vornehmen können. Grundsätzlich gilt für alle kardialen Patienten, dass die medikamentöse Einstellung vor einem Höhenaufenthalt bereits im Flachland optimiert werden sollte. Ist dies nicht der Fall oder befindet sich der Patient in einer instabilen Krankheitsphase, ist von Höhenaufenthalten abzuraten (weitere Restriktionen sind in Tab. 2 zusammengefasst). Zur Medikation kardialer Patienten ist anzumerken, dass kardioselektive ß-Blocker vorgezogen werden sollten. Denn nicht-kardioselektive ß-Blocker vermindern die Ventilation unter Belastung, was in der Höhe zu einem verstärkten Sättigungsabfall führen kann (16). Möglicherweise ist hier ein grosszügigerer Einsatz von Acetazolamid (Diamox®) von Vorteil (14), ein schwaches Diuretikum (Carboanhydrasehemmer), das wegen seiner ventilationssteigernden Wirkung von vielen Bergsteigern zur Prophylaxe der Bergkrankheit eingenommen wird. Grundsätzlich sollten Herzpatienten immer die allgemeinen Aufstiegsprinzipien beachten, insbesondere eine Aufstiegsgeschwindigkeit von 300-350 m pro Tag nicht überschreiten (17). Sinnvolle Voruntersuchungen im Rahmen von geplanten Höhenaufenthalten bei Herzpatienten sind in Tabelle 3 dargestellt.
Körperliche Belastung in der Höhe
Körperliche Belastungen werden in der Höhe normalerweise gut toleriert. Personen, die im Flachland nicht schon regelmässig körperlich aktiv sind, sollten damit aber nicht in der Höhe beginnen. Sind körperliche Aktivitäten in der Höhe geplant, kann die Leistungsfähigkeit in der Höhe durch einen Belastungstest im Flachland recht gut abgeschätzt werden (2). Bei Herzinsuffizienz mit eingeschränkter maximaler Sauerstoffaufnahme ist dabei der überproportionale Rückgang der Leistungsfähigkeit mit einzukalkulieren (14). Gegebenenfalls ist ein entsprechendes Training im Vorfeld ratsam. Zur Belastungssteuerung eignet sich auch in der Höhe sehr gut die Herzfrequenz, die aus dem Belastungs-EKG im Flachland ermittelt werden kann.
Arterielle Hypertonie
Patienten welche ausschliesslich eine arterielle Hypertonie haben, die im Flachland gut eingestellt ist, brauchen bei normalen Ferienaufenthalten keine besonderen Massnahmen einzuhalten. Der Blutdruck wird etwas ansteigen (7), was aber für einen kurzzeitigen Aufenthalt in aller Regel unproblematisch ist. Bei längeren Aufenthalten kann dagegen eine Anpassung der Blutdrucktherapie erforderlich und sinnvoll sein. Ein besonderes Augenmerk gilt den Diuretika. In grosser Höhe aufgrund erhöhter körperlicher Aktivität, niedriger Luftfeuchtigkeit und gesteigerter Atmung ist das Risiko einer Dehydrierung erhöht. Diuretika können diesen Zustand weiter verschlimmern und das Risiko einer Hypokaliämie erhöhen und sollten daher nicht Bestandteil der Bedarfsmedikation für Höhenaufenthalte bei Hypertonikern sein.
Koronare Herzerkrankung
Bei koronarer Herzerkrankung sollte eine direkte Anreise auf Höhen von 3000 m oder höher möglichst vermieden werden. In den ersten Tagen eines Höhenaufenthaltes sollten zudem körperliche Anstrengungen unterbleiben, da in der Akklimatisationsphase die Ischämieschwelle etwas gesenkt, das Risiko also umgekehrt erhöht ist. Personen mit niedrigem Risiko (CCS 0-I) können so relativ sicher bis 4200 m aufsteigen und dort auch leichte bis mittlere Aktivitäten ausüben. Intensive körperliche Anstrengungen sollten unterbleiben (5). Bei moderatem Risiko (CCS II-III) scheinen Höhen bis 2500 m ebenfalls sicher, wenn dort nur leichte körperliche Aktivitäten unternommen werden (11). Höhen über 4500 m sind schon in Ruhe mit einer ausgeprägten Hypoxämie verbunden und sollten bei KHK daher grundsätzlich gemieden werden.
Herzinsuffizienz
Herzinsuffizienz-Patienten im klinischen Stadium NYHA I-II können ohne grosses Risiko bis 3500 m aufsteigen, sollten aber hier auch nur leichte bis moderate Aktivitäten ausüben (14). Im klinischen Stadium NYHA III sind Höhen bis 3000 m bei leichter körperlicher Aktivität möglich (15).
Arrhythmien
Arrhythmien in Form von singulären ventrikulären oder supraventrikulären Extrasystolen sind vor allem in der Akklimatisationsphase in der Höhe deutlich häufiger als im Flachland. Dieses Phänomen scheint aber benigner Natur zu sein (18). Patienten, die aber bereits im Flachland komplexe oder höhergradige Rhythmusstörungen aufweisen, haben aus physiologischer Überlegung durchaus ein Risiko für Rhythmusereignisse und sollten daher nicht in die Höhe gehen. Daten hierzu gibt es allerdings nicht. Anhaltspunkte für Schrittmacher- oder ICD-Fehlfunktionen allein bedingt durch Höhe gibt es nicht (19).
Pulmonale Hypertonie und Klappenvitien
Bei Patienten mit pulmonaler Hypertonie können schon Höhen ab etwa 1500 m zu einer Verschlechterung der Symptomatik führen. Patienten mit pulmonaler Hypertonie sollten daher vom Spezialisten im Vorfeld eines gewünschten Höhenaufenthalts beurteilt werden. Im Einzelfall kann eine Bestimmung des pulmonalarteriellen Drucks unter (simulierten) Höhenbedingungen (z. B. echokardiographisch) sinnvoll sein.
Ein direkter Einfluss der höhenbedingten Hypoxie auf Klappenvitien besteht nicht, bei «Klappenpatienten» ist daher immer die allgemeine kardiale Funktion für die Höhentauglichkeit entscheidend. In der Regel haben leicht- bis mittelgradige Klappenvitien daher keinen Einfluss auf die Höhentauglichkeit. Eine höhergradige Aortenstenose kann aber bei höhenbedingter Dehydratation durchaus zu einer Verschlechterung der Symptomatik aufgrund der reduzierten Nachlast führen.
Abschliessend sollte noch erwähnt werden, dass neben den kardiologischen Problemen immer auch akute höhenbedingte Erkrankungen (akute Bergkrankheit, Höhenlungen- und Höhenhirnödem) auftreten können, deren Symptome und Therapie daher bekannt sein sollten. Einen sehr guten Überblick hierüber gibt der Übersichtsartikel von Luks et al. (17).
Allgemeine Innere Medizin und Kardiologie (FMH)
Medbase Sports Medical Center
Löwenstrasse 29,
8001 Zürich
christoph.dehnert@medbase.ch
Der Autor hat in Zusammenhang mit diesem Artikel keine Interessenskonflikt deklariert.
1. Burtscher M, Bachmann O, Hatzl T, Hotter B, Likar R, Philadelphy M, Nachbauer W. Cardiopulmonary and metabolic responses in healthy elderly humans during a 1-week hiking programme at high altitude. Eur J Appl Physiol. 2001;84(5):379-386.
2. Bärtsch P, Gibbs JS. Effects of altitude on the heart and the lungs. Circulation 2007;116:2191–2202.
3. Lundby C, Calbet JA, Sander M, van Hall G, Mazzeo RS, Stray-Gundersen J, Stager JM, Chapman RF, Saltin B, Levine BD. Exercise economy does not change after acclimatization to moderate to very high altitude. Scand J Med Sci Sports. 2007 Jun;17(3):281-291.
4. Hansen J, Sander M. Sympathetic neural overactivity in healthy humans after prolonged exposure to hypobaric hypoxia. J Physiol. 2003;546:921-929.
5. De Vries ST, Komdeur P, Aalbersberg S, van Enst GC, Breeman A, van’t Hof AW. Effects of altitude on exercise level and heart rate in patients with coronary artery disease and healthy controls. Neth Heart J 2010;18:118–121.
6. Schmid J-P, Noveanu M, Gaillet R, Hellige G, Wahl A, Saner H. Safety and exercise tolerance of acute high altitude exposure (3454 m) among patients with coronary artery disease. Heart 2006;92:921–925.
7. Parati G, Bilo G, Faini A, Bilo B, Revera M, Giuliano A, Lombardi C, Caldara G, Gregorini F, Styczkiewicz K, Zambon A, Piperno A, Modesti PA, Agostoni P, Mancia G. Changes in 24 h ambulatory blood pressure and effects of angiotensin II receptor blockade during acute and prolonged high-altitude exposure: a randomized clinical trial. Eur Heart J 2014;35:3113–3122.
8. Kaufmann PA, Schirlo C, Pavlicek V, Berthold T, Burger C, von Schulthess GK, Koller EA, Buck A. Increased myocardial blood flow during acute exposure to simulated altitudes. J Nucl Cardiol. 2001 Mar-Apr;8(2):158-164.
9. Wyss CA, Koepfli P, Fretz G, Seebauer M, Schirlo C, Kaufman PA. Influence of altitude exposure on coronary flow reserve. Circulation 2003;108:1202–1207.
10. de Vries ST, Kleijn SA, van’t Hof AWJ, Snaak H, van Enst GC, Kamp O, Breeman A. Impact of high altitude on echocardiographically determined cardiac morphology and function in patients with coronary artery disease and healthy controls. Eur J Echocardiogr 2010;11:446–450.
11. Levine BD, Zuckerman JH, deFilippi CR. Effect of high-altitude exposure in the elderly: the Tenth Mountain Division study. Circulation. 1997;96(4):1224-1232.
12. Burtscher M, Philadelphy M, Likar R. Sudden cardiac death during mountain hiking and downhill skiing. N Engl J Med. 1993;329(23):1738-1739.
13. Roach RC, Houston CS, Honigman B, Nicholas RA, Yaron M, Grissom CK, Alexander JK, Hultgren HN. How well do older persons tolerate moderate altitude? West J Med. 1995;162(1):32-36.
14. Agostoni P, Cattadori G, Guazzi M, Bussotti M, Conca C, Lomanto M, Marenzi G, Guazzi MD. Effects of simulated altitude-induced hypoxia on exercise capacity in patients with chronic heart failure. Am J Med 2000;109:450–455.
15. Schmid J, Nobel D, Brugger N, Novak J, Palau P, Trepp A, Wilhelm M, Saner H. Short-term high altitude exposure at 3454 m is well tolerated in patients with stable heart failure. Eur J Heart Fail 2015;17:182–186.
16. Valentini M, Revera M, Bilo G, Caldara G, Savia G, Styczkiewicz K, Parati S, Gregorini F, Faini A, Branzi G, Malfatto G, Magrì D, Agostoni P, Parati G. Effects of beta-blockade on exercise performance at high altitude: a randomized, placebo-controlled trial comparing the efficacy of nebivolol versus carvedilol in healthy subjects. Cardiovasc Ther 2012;30:240–248.
17. Luks AM, Swenson ER, Bärtsch P. Acute high-altitude sickness. Eur Respir Rev. 2017;26(143).
18. Kujaník S, Snincák M, Vokál J, Podracký J, Koval J. Periodicity of arrhythmias in healthy elderly men at the moderate altitude. Physiol Res 2000;49:285–287.
19. Weilenmann D, Duru F, Schönbeck M, Schenk B, Zwicky P, Russi EW, Candinas R. Influence of acute exposure to high altitude and hypoxemia on ventricular stimulation thresholds in pacemaker patients. Pacing Clin Electrophysiol 2000;23:512–515.